Для самостоятельного изучения «Биохимия как наука. Этапы развития биохимии. Методы биохимических исследований» (Скоробогатова З. М.)
| Вид материала | Методические рекомендации |
- Для самостоятельного изучения Биохимия как наука. Этапы развития биохимии, 2094.45kb.
- Основы биохимии спорта, 1521.5kb.
- Председатель цикловой методической комиссии, 42.51kb.
- Тема строение белков и ферментативный катализ вопросы лекции, 137.02kb.
- Лекция №6. Структура биологии как науки. Ранние этапы эволюции жизни, 433.89kb.
- Планирование будущего развития с использованием техники сценариев, 15.36kb.
- Тематический план лекций по общей биохимии для студентов 2-го курса лечебного, педиатрического, 1643.39kb.
- Резюмируя можно сказать, что объектом ее изучения являются химические элементы, 71.81kb.
- Курс (8 семестр) 2010/2011уч год специальность «Стоматология» Календарно-тематический, 183.27kb.
- 1. История как наука: этапы становления, предмет, методы исследования, функции исторического, 609.65kb.
Граф логической структуры
ТЕМА 1.18. СПЕЦИАЛИЗИРОВАННЫЕ ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ. БИОСИНТЕЗ КРЕАТИНА. НАРУШЕНИЯ ОБМЕНА АМИНОКИСЛОТ
Актуальность темы
Биологическое значение аминокислот определяется не только их участием в синтезе белка. Свободные аминокислоты используются в образовании многих веществ, которые выполняют специфические функции коферментов, нуклеиновых кислот, гормонов, нейромедиаторов и других регуляторных и структурных молекул.
В связи с этим возникает значительный интерес в изучении аминокислот как источников физиологически активных соединений, имеющих медико-биологическое значение.
Теперь ознакомьтесь с целями занятия.
Общая цель
Уметь анализировать значение образования из аминокислот биологически активных соединений, а также механизм нарушения обмена веществ.
Конкретные цели: Цели исходного уровня:
Уметь:
| 1.Интерпретировать особенности метаболизма циклических аминокислот и его возможные нарушения. | 1.Интерпретировать структуру и свойства аминокислот (кафедра медицинской и фармацевтической химии) |
| 2.Интерпретировать особенности метаболизма глицина и серина | |
| 3.Интерпретировать роль креатина в энергообеспечивающей функции мышечной ткани. | |
| 4.Интерпретировать особенности метаболизма серусодержащих аминокислот и его возможные нарушения. | |
Для проверки исходного уровня Вам предлагается выполнить ряд заданий.
Задания для самопроверки и самокоррекции исходного уровня
Задание 1. Аминокислоты по своему химическому строению разделяются на циклические и ациклические. Какая из перечисленных аминокислот относится к циклическим?
А. Аланин
В. Фенилаланин
С. Валин
D. Метионин
Е. Глутамат
Задание 2
Некоторые аминокислоты содержат в своем составе серу. Выберите эту аминокислоту.
А. Серин
В. Валин
С. Цистеин
D. Аргинин
Е. Тирозин
Задание 3
Аминокислота глицин является важнейшим участником многих биохимических процессов. Выберите его формулу из перечисленных:
А. СН2 – СН – СООН
І І
ОН NH2
В. СН3 – СН – СООН
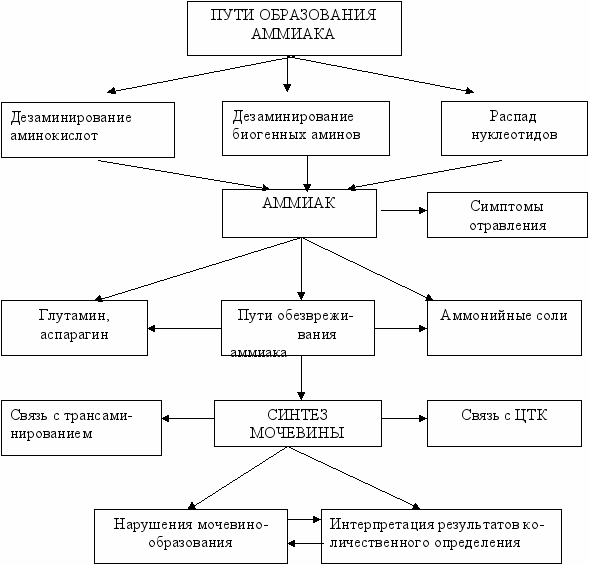
І
NH2
С. СН2 – СН – СООН
І І
SН NH2
D. СН2 – СООН
І
NH2
Е. СООН-СН2 – СН – СООН
І
NH2
Задание 4
Одна из аминокислот является участником внутриклеточного метаболизма и донором метильной группы. Выберите эту аминокислоту.
А. Глутамат
В. Лизин
С. Валин
D. Тирозин
Е. Метионин
Правильность решений проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению заданий для самопроверки и самоконтроля исходного уровня:
1 - В; 2 - С; 4 - Е.
Информацию для восполнеия исходного уровня можно найти в следующей литературе:
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. - М.: Медицина, 1985. - С. 297 -309; 312 - 320.
2. Лекции по биоорганической химии.
Содержание обучения
Содержание обучения должно обеспечивать достижения целей обучения, чему способствует граф логической структуры изучаемой темы (Приложения 1, 2).
Основные теоретические вопросы, позволяющие восполнить целевые виды деятельности
- Пути метаболизма безазотистого скелета аминокислот. Гликогенные и кетогенные аминокислоты.
- Специализированные пути обмена ациклических аминокислот:
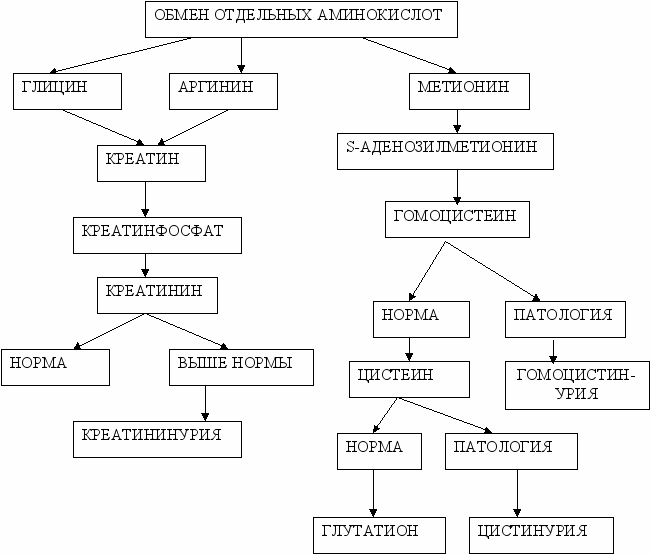
а) обмен глицина и серина;
б) обмен серусодержащих аминокислот и его наследственные нарушения (гомоцистинурия).
- Биологическая роль и синтез креатина.
- Биологическая роль и синтез глутатиона.
- Болезнь кленового сиропа как нарушение обмена аминокислот с разветвленными цепями.
- Обмен аргинина.
- Специализированнные пути обмена циклических аминокислот:
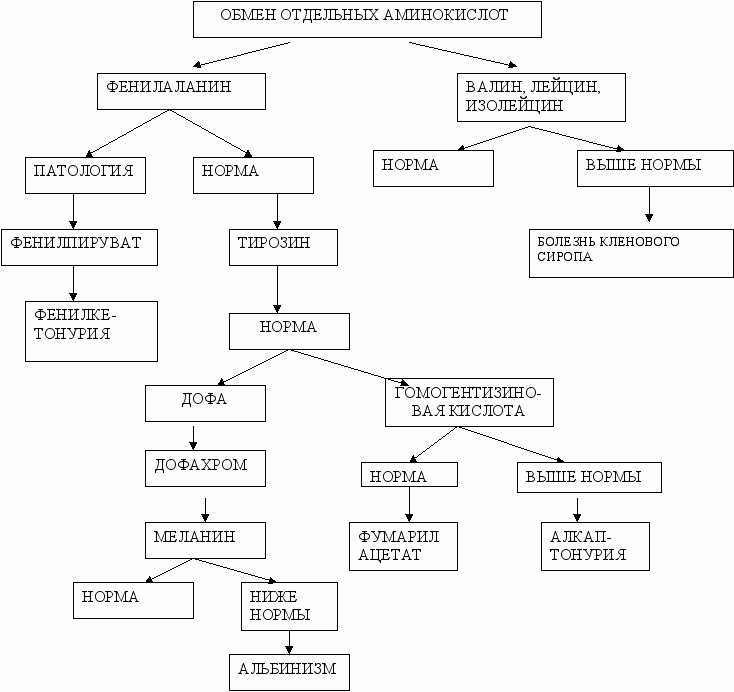
а) обмен фенилаланина, тирозина и его наследственные нарушения (фенилкетонурия, алкаптонурия, альбинизм);
б) пути обмена триптофана.
Найти материал для освоения этих вопросов можно в одном из следующих источников.
Обязательная литература
- Губський Ю.Г., Біологічна хімія. - Київ.-Тернопіль, Укрмедкнига, 2000.-С.250-263
- Тестовые задания по биологической химии. Под редакцией Б.Г. Борзенко.- Донецк. 2000.-С.148-202
- Лекции по биохимии
- Графы логической структуры (Приложения 1, 2)
- Инструкция к лабораторной работе.
Дополнительная литература
1. Биохимия. Краткий курс с упражнениями и задачами / Под ред. Е.С.Северина,
А.Я.Николаева. - М.: ГЭОТАР – МЕД, 2001.- С.243-252; 414-416.
- Березов Т.Г., Коровкин Б.Ф. Биологическая химия. - М.: Медицина, 1998. - С. 451 – 468
- Березов Т.Г., Коровкин Б.Ф. Биологическая химия. - М.: Медицина, 1990. - С. 354 – 364
- Николаев А.Я. Биологическая химия.- М.: ООО «Медицинское информационное агентство», 1998. - С. 323 - 339
- Кушманова О.Д., Ивченко Г.М. Руководство к лабораторным занятиям по биологической химии. – М. : Медицина, 1983. – С. 7 - 15
После изучения вышеперечисленных вопросов для самопроверки усвоения материала по изучаемой теме Вам предлагается выполнить целевые обучающие задачи. Правильность решения задач можно проверить, сопоставив их с эталонами ответов.
Целевые обучающие задачи:
Тест 1
Экспериментальному животному введен глицин, меченный по углероду, с целью выяснения его участия в метаболических процессах. Назовите аминокислоту, которая может непосредственно образоваться из глицина.
А. Глутамат
В. Треонин
С. Триптофан
D. Цистеин
Е. Метионин
Тест 2
Экспериментальному животному введен глицин, меченный по углероду, с целью выяснения его участия в метаболических процессах. Выберите синтез, в котором непосредственное участие принимает глицин.
А. Синтез кетоновых тел
В. Синтез холестерина
С. Синтез креатина
D. Синтез меланина
Е. Синтез желчных кислот
Тест 3
В экспериментах по изучению обмена аминокислот подопытному животному был введен радиоизотоп углерода в составе аминокислоты тирозина.
Выберите соединение, которое может синтезироваться из тирозина.
А. Гем
В. Метионин
С. Креатин
D. Норадреналин
Е. Глутатион
Тест 4
Экспериментальным животным была введена радиоизотопная метка по углероду фенилаланина с целью изучения участия этой аминокислоты в метаболических процессах. Выберите соединение, которое может синтезироваться из фенилаланина.
А. Гем
В. Пантотеновая кислота
С. Креатин
D. Адреналин
Е. Никотинамид
Тест 5
С целью изучения участия цистеина в биохимических процессах подопытным крысам была введена эта аминокислота с радиоизотопной меткой по углероду. Через некоторое время метка была обнаружена в ряде метаболитов. Выберите соединение, которое может синтезироваться из цистеина.
А. Таурин
В. Рибофлавин
С. Креатин
D. Никотинамид
Е. Гем
Тест 6
У экспериментального животного, находящегося на безбелковом рационе, развилась жировая инфильтрация печени, в частности, вследствие дефицита метилирующих агентов. Назовите аминокислоту, которая является донором метильных радикалов.
А. Цистеин
В. Метионин
С. Триптофан
D. Глутаминовая кислота
Е. Тирозин
Правильность решения проверьте, сопоставив их с эталонами ответов.
Эталоны ответов к решению целевых обучающих задач: 1 - В; 4 - D; 5 - А.
Краткие методические рекомендации к проведению занятия
В начале занятия проводятся тестовый контроль исходного уровня знаний студентов и его коррекция. Затем студенты приступают к выполнению лабораторной работы, используя при этом инструкцию.
После выполнения лабораторной работы необходимо оформить протокол, сделать выводы к работе, которые проверяет и контролирует преподаватель. Проводится анализ самостоятельной работы студентов и коррекция.
В конце занятия проходит итоговый контроль, подводятся итоги занятия.
Инструкция к лабораторной работе
Работа І. Ксантопротеиновая реакция на ароматические аминокислоты.
Принцип метода: при взаимодействии с концентрированной азотной кислотой происходит нитрирование бензольного кольца циклических аминокислот. Образуется нитросоединение желтого цвета – динитротирозин, при подщелачивании которого образуется натриевая соль динитротирозина оранжевого цвета.
Материальное обеспечение: 1% раствор яичного белка, концентрированная азотная кислота, 10% раствор едкого натра, штатив с пробирками, пипетки.
Ход работы: к 5 каплям раствора белка добавьте 3 капли концентрированной НNО3 и осторожно прокипятите. В пробирке появится осадок желтого цвета. После охлаждения пробирки необходимо добавить к исследуемому раствору белкового гидролизата по каплям 10% раствор NаОН до появления оранжевого цвета (10 – 15 капель), что свидетельствует об образовании натриевой соли динитротирозина.
Работа ІІ. Реакция Миллона на тирозин.
Принцип метода: При добавлении к раствору белка реактива Миллона (раствор ртути в азотной кислоте с небольшим количеством NaNO2) и при кипячении образуется кроваво-красный осадок ртутной соли динитротирозина благодаря наличию в тирозине фенольного ядра.
Материальное обеспечение: 1% раствор белка, реактив Миллона , 0,1% раствор фенола, штатив с пробирками, пипетки.
Ход работы:
Возьмите две пробирки.
Налейте в 1-ю пробирку 5 капель 1% раствора яичного белка, во 2-ю – 5 капель 0,1%
раствора фенола.
В каждую пробирку добавьте по 3 капли реактива Миллона и осторожно нагрейте.
В пробирке с яичным белком появится кроваво-красное окрашивание, с фенолом –
розовато-красное.
Работа ІІІ. Реакция на аминокислоты, содержащие слабосвязанную серу (реакция Фоля)
Принцип метода: Сульфгидрильные группы белков подвергаются щелочному гидролизу, в результате чего происходит отщепление серы в виде сульфида, который с плюмбитом дает черный (или бурый) осадок сульфида свинца.
Метионин, в отличие от цистеина, этой реакции не дает, так как сера в нем связана прочно.
Материальное обеспечение: 1% раствор яичного белка, реактив Фоля, штатив с пробирками, пипетки.
Ход работы: к 5 каплям белка добавьте 5 капель реактива Фоля. Прокипятите. Через 1-2 минуты после кипячения появляется черный (бурый) осадок сульфида свинца.
Работа ІУ. Качественное определение креатинина в моче.
Принцип метода: В щелочной среде моча при добавлении нитропруссида натрия приобретает красную окраску, которая переходит в желтую. Это объясняется образованием изонитрозокреатинина.
Материальное обеспечение: 10% раствор едкого натра, 5% раствор нитропруссида натрия, штатив с пробирками, колбочки, пипетки.
Ход работы: к 10 каплям мочи прибавить 1 каплю 5% раствора нитропруссида натрия, подщелочить 1-2 каплями 10% раствора NaOH. Моча приобретает красную окраску, переходящую в желтую.
ВЫВОДЫ:
Подпись преподавателя:
Приложение 1
Граф логической структуры
Приложение 2
Граф логической структуры
ЗАДАНИЯ ДЛЯ САМОПРОВЕРКИ И САМОКОРРЕКЦИИ СОДЕРЖАТЕЛЬНОГО МОДУЛЯ «МЕТАБОЛИЗМ АМИНОКИСЛОТ. ЭНЗИМОПАТИИ АМИНОКИСЛОТНОГО ОБМЕНА»
Задание 1. Простые белки состоят из аминокислот. Выберите из перечисленных ниже химических групп те, за счет которых аминокислоты связываются между собой в белках.
А. Аминогруппа и сульфгидрильная группа
В. Сульфгидрильная и карбоксильная группы
C. Формильная и гидроксильная группы
D. Карбоксильная и аминогруппы
Е. Кетогруппа и метильная группы
Задание 2. Молекула белка имеет определенный заряд за счет аминокислот, входящих в ее состав. Какая из перечисленных аминокислот придает ему отрицательный заряд?
А. Аланин
В. Валин
С. Глутамат
D. Тирозин
Е. Метионин
Задание 3. При лабораторном исследовании желудочного сока в нем была обнаружена молочная кислота. О преобладании какого метаболического процесса свидетельствует этот показатель?
А. Анаэробного гликолиза
B. Аэробного гликолиза
C. Глюконеогенеза
D. Синтеза гликогена
Е. Катаболизма гликогена
Задание 4. У пациентки вследствие кровоизлияния в желудочно-кишечный тракт белки крови оказались доступными для микроорганизмов кишечника. Концентрация какого вещества будет увеличена у этой пациентки?
А. Креатина
B. Тиамина
C. Скатола
D. Гомогентизиновой кислоты
E. Цистеина
Задание 5. Пациенту назначен препарат – ингибитор моноаминооксидазы. На какой процесс он влияет?
А. На синтез мочевины
B. На образование биогенных аминов
C. На инактивацию биогенных аминов
D. На образование амидов дикарбоновых аминокислот
E. На трансаминирование
Задание 6. У пациента, проходящего курс лечебного голодания, нормальный уровень глюкозы в крови поддерживается за счет глюконеогенеза. Из какого из нижеперечисленных веществ может синтезироваться глюкоза?
А. Из мочевой кислоты
B. Из мочевины
C. Из серина
D. Из лейцина
E. Из никотинамида
Задание 7. У ребенка после перенесенной вирусной инфекции наблюдаются признаки гипераммониемии: головокружение, рвота, судороги. Нарушение какой реакции имеет место в данном случае?
А. Тирозин → Диоксифенилаланин
B. Орнитин + Карбамоилфосфат → Цитруллин
C. Фенилаланин → Тирозин
D. Аргинин + Глицин → Гуанидинацетат
E. Гомогентизиновая кислота → Фумарилацетоацетат
Задание 8. Группа подопытных животных находилась на длительной безбелковой диете, вследствие чего у них нарушились многие метаболические процессы, связанные с использованием незаменимых аминокислот. Какая из них используется в качестве метилирующего агента в биосинтезе креатина?
А. Валин
B. Треонин
C. Фенилаланин
D. Метионин
E. Глицин
Задание 9. В работах Г.Кребса было установлено, что цикл трикарбоновых кислот и орнитиновый цикл тесно связаны. Какое вещество участвует в обоих циклах?
А. Оксалоацетат
B. Цитруллин
C. Фумарат
D. Цитрат
E. Аргинин
Задание 10. Новорожденному был сделан анализ мочи с хлорным железом. Тест оказался положительным, что свидетельствует о фенилкетонурии. Какая реакция обмена фенилаланина нарушена в данном случае?
А. Гидроксилирование
B. Гидролиз
C. Гликозилирование
D. Трансаминирование
E. Декарбоксилирование
Эталоны ответов: 4 - С; 7 - В; 10 – А.
ПЕРЕЧЕНЬ ОСНОВНЫХ ТЕОРЕТИЧЕСКИХ ВОПРОСОВ ДЛЯ ИТОГОВОГО КОНТРОЛЯ МОДУЛЯ І «ОБЩИЕ ЗАКОНОМЕРНОСТИ МЕТАБОЛИЗМА. МЕТАБОЛИЗМ УГЛЕВОДОВ, ЛИПИДОВ, БЕЛКОВ И ЕГО РЕГУЛЯЦИЯ»
1. Ферменты. Химическая структура ферментов:
а) доказательства белковой природы ферментов;
б) простые и сложные ферменты, кофакторы и коферменты, примеры;
в) проферменты, примеры, биологическое значение;
г) изоферменты, характеричтика, примеры, применение в медицине;
д) мультиферментные комплексы, примеры.
2. Классификация ферментов:
а) принцип классификации;
б) краткая характеристика основных классов ферментов, примеры.
3. Свойства ферментов как биологических катализаторов:
а) отличия ферментов от неорганических катализаторов;
б) термолабильность, примеры, применение в медицине;
в) влияние рН среды на активность ферментов;
г) специфичность, виды специфичности, примеры.
4. Механизм действия ферментов:
а) понятие об энергии активации ферментативных и некаталитических реакций;
б) представление об активном центре ферментов;
в) основные положения современной теории ферментативного катализа;
г) кинетика ферментативных реакций.
5. Регуляция активности ферментов:
а) понятие об аллостерическом центре, его регуляторной роли;
б) активаторы ферментов;
в) виды активации ферментов;
г) ингибиторы ферментов;
д) типы ингибирования ферментов (обратимое и необратимое, конкурентное и неконкурентное);
е) регуляция активности ферментов по принципу прямой и обратной связи;
ж) применение активаторов и ингибиторов ферментов в медицине.
6. Биохимия витаминов:
а) классификация и номенклатура витаминов;
б) причины и проявления гипо-, гипер- и авитаминозом;
в) провитамины, антивитамины: характеристика, примеры;
г) структура, биологическая роль, коферментная форма водорастворимых витаминов группы В, С, Р, пантотеновой кислоты, фолиевой кислоты, биотина.
7. Клинические аспекты ферментологии и витаминологии:
а) энзимодиагностика;
б) энзимотерапия;
в) энзомопатология.
8. Общие и специфические пути катаболизма, взаимосвязь анаболизма и катаболизма.
9. Современные представления о механизме биологического окисления:
а) экзергонические и эндергонические реакции;
б) энергетическое сопряжение в биологических системах.
10. Типы реакций биологического окисления.
11. Активные формы кислорода:
а) механизмы образования в организме, причины токсичности;
б) физиологическая роль.
12. Макроэргические соединения:
а) типы высокоэнергетических связей;
б) АТФ как основная форма сохранения химической энергии в клетке;
в) типы реакций фосфорилирования.
13. Цепь переноса электронов митохондрий:
а) структура и функции компонентов дыхательной цепи;
б) схема и локализация в клетке цепи тканевого дыхания;
в) сопряжение тканевого дыхания и окислительного фосфорилирования.
14. Механизм окислительного фосфорилирования:
а) хемиоосмотическая теория Митчела;
б) коэффициент фосфорилирования, энергетическая ценность субстратов;
в) регуляция окислительного фосфорилирования, дыхательный контроль.
15. Ингибиторы дыхательной цепи, механизм их действия, влияние на организм.
16. Понятие о разобщителях., примеры различных механизмов разобщения. Свободное нефосфорилирующее окисление, его биологическая роль.
17. Окислительное декарбоксилирование пирувата как первое общее звено катаболизма белков, жиров и углеводов.
18. Цикл трикарбоновых кислот как центральный метаболический путь:
а) локализация, химизм реакций;
б) дегидрогеназные реакции ЦТК как источник водорода для системы тканевого
дыхания;
в) декарбоксилирование в цикле Кребса как механизм образования в клетках СО2
как конечного продукта катаболизма углеводородов;
г) биологическая роль ЦТК;
д) регуляция цикла Кребса.
19. Структура и функции моно-, олиго-, гетеро-, гомо- и полисахаридов.
20. Механизмы переваривания и всасывания углеводов.
21. Взаимопревращения моносахаридов.
22. Общие схемы путей использования глюкозы и пирувата в организме.
23. Механизм, регуляция синтеза и мобилизации гликогена. Гликогенная функция печени.
24. Основные этапы, биологическая роль аэробного и анаэробного гликолиза. Подсчет энергии окисления глюкозы в этих условиях.
25. Связь тканевого дыхания и окислительного фосфорилирования с аэробным окислением углеводов.
26. Биосинтез глюкозы (глюконеогенез). Регуляция гликолиза и глюконеогенеза.
27. Сущность и регуляторная функция в окислении углеводов эффектов Пастера и Кребтри.
28. Биологическая роль пентозофосфатного пути окисления глюкозы, его общая характеристика.
29. Реакции окислительной стадии пентозофосфатного пути окисления глюкозы. Его связь с гликолизом.
30. Нарушения углеводного обмена:
а) галактоземия, фруктозурия, наследственная непереносимость фруктозы;
б) гликогенозы и агликогенозы;
в) нарушение толерантности к молоку;
г) синдром смерти младенцев в колыбели
31. Классификация, структура, свойства и биологическая роль липидов.
32. Структура и функции клеточных мембран. Характеристика липидов и белков клеточных мембран. Транспорт веществ через клеточные мембраны.
33. Механизм переваривания и всасывания липидов. Желчные кислоты, их структура и роль.
34. Механизм биосинтеза жирных кислот, триглицеридов и фосфатидов.
35. Механизм мобилизации жира из жировых депо. Бета-окисление жирных кислот. Подсчет энергии бета-окисления жирных кислот. Окисление глицерина.
36. Синтез холестерина, его регуляция и транспорт. Гиперхолестеринемия.
37. Синтез и использование кетоновых тел. Кетонемия. Кетонурия.
38. Липопротеины сыворотки крови, их состав, структура, образование и биологическая роль.
39. Нарушения липидного обмена:
а) нарушение переваривания и всасывания липидов;
б) ожирение;
в) жировое перерождение печени;
г) атеросклероз;
д) желчнокаменная болезнь.
40. Виды азотистого баланса. Полноценность белкового питания. Биологическая ценность
белков. Синдром квашиоркора. Незаменимые аминокислоты.
41. Переваривание белков. Виды кислотности желудочного сока. Ахлоргидрия,
гипохлоргидрия, гиперхлоргидрия, ахилия. Гниение белков в кишечнике.
42. Транспорт аминокислот. Пути использования аминокислот в организме.
43. Прямое и непрямое дезаминирование аминокислот.
44. Трансаминирование, его значение для обмена аминокислот. Глюкозо-аланиновый
цикл.
45. Декарбоксилирование аминокислот. Образование и роль ГАМК, гистамина,
серотонина, дофамина.
46. Пути обмена безазотистых остатков аминокислот. Глюкогенные и кетогенные
аминокислоты.
47. Источники образования аммиака. Причины токсичности аммиака. Понятие
гипераммониемии.
48. Пути обезвреживания аммиака. Их особенности в почках, печени, нервной ткани.
49. Орнитиновый цикл: биологическая роль, уравнения реакций, связь с циклом
трикарбоновых кислот. Нарушения орнитинового цикла.
50. Обмен отдельных аминокислот (глицина, серина, серусодержащих аминокислот,
фенилаланина, тирозина).
- Биологическая роль и биосинтез креатина.
- Энзимопатии аминокислотного обмена: цистинурия, гомоцистинурия, фенилкетонурия, алкаптонурия, альбинизм, болезнь кленового сиропа. Метаболические блоки.
