Изучение эффектов мексидола и его комбинации с гимантаном при экспериментальном паркинсоническом синдроме 14. 00. 25 фармакология, клиническая фармакология
| Вид материала | Автореферат |
- Исследование эфективности направленного транспорта нимодипина в магнитоуправляемых, 359.89kb.
- Прогнозирование и лечение ототоксических эффектов аминогликозидных антибиотиков. 14., 615.63kb.
- Клиническая эффективность и фармакоэпидемиология лекарственных средств у детей с аллергическим, 462.25kb.
- Типовые учебный план и программа для клинических ординаторов по специальности «клиническая, 656.73kb.
- «Клиническая фармакология» Специальность: 111201 Ветеринария Пояснительная записка, 94.74kb.
- «Экспериментальная и клиническая фармакология» журнал к сведению, 84.61kb.
- Программа вступительных испытаний для специальности магистратуры 1-79 80 10 Фармакология,, 197.39kb.
- Антиметастатическая активность препаратов природного происхождения 14. 00. 25 фармакология,, 1023.15kb.
- Оптимизация фармакотерапии плоского лишая 14. 00. 25. фармакология, клиническая фармакология, 214.56kb.
- Лекарственные растительные средства в профилактике респираторных заболеваний у детей, 439.68kb.
1 2
Рисунок 6. Влияние мексидола на экстрапирамидные нарушения у крыс при
МФП+-вызванном ПС. *, # - P<0,05 достоверность различий относительно МФП+
в 1-е и на 7-е сутки после введения нейротоксина, соответственно.
МФП+ МФП++Мексидол 150
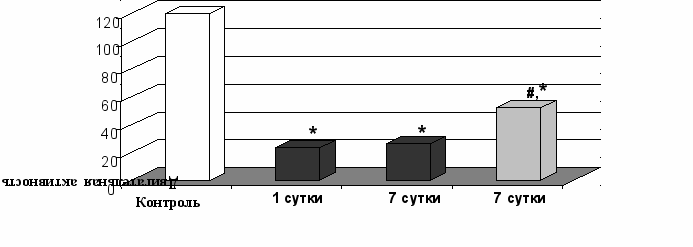
Рисунок 7. Влияние мексидола на олигокинезию у крыс с ПС. *, # - P<0,05 достоверность различий относительно интактного контроля и МФП+, соответственно.
Таким образом, 7-и дневное введение мексидола в дозе 150 мг/кг крысам эффективно устраняло проявления ПС, вызванного интранигральным введением МФП+, что выразилось в уменьшении степени олигокинезии, значительной редукции тремора и ригидности по сравнению с группой животных, получавших только нейротоксин.
5. Анализ биоэлектрической активности мозга крыс через 24 часа после интранигрального введения МФП+ показал наличие в электрограммах всех исследуемых структур дизритмичной активности с присутствием дельта- и тета-волн, амплитудой биопотенциалов 70-100 мкВ. В электрограммах черной субстанции (ЧС) и хвостатых ядер (ХЯ) обоих полушарий отмечались синхронные разряды высокоамплитудных медленных волн с заостренными вершинами в диапазоне тета- и дельта-частот амплитудой 150-200 мкВ. Сходный паттерн биоэлектрической активности мозга крыс сохранялся и через 7 суток после введения МФП+, отмечалось лишь незначительное снижение амплитуды пароксизмальных разрядов, однако, они становились более генерализованными и регистрировалась во всех исследованных структурах. При этом несколько изменялся характер пароксизмальной активности - разряды состояли из групп высокоамплитудных тета-волн (Рис. 8А).
При проведении сравнительного визуального анализа электрограмм крысы опытной группы, зарегистрированных через 24 часа после введения МФП+ и через 1 час после инъекции мексидола, отмечено значительное снижение числа и амплитуды пароксизмальных разрядов высокоамплитудных острых и медленных волн, наиболее заметное в электрограммах ХЯ и сенсо-моторной коры (СМК) правого полушария. Также, на фоне однократного введения мексидола в электрограммах всех исследуемых структур отмечалось усиление активности в альфа- и бета-диапазонах.
Через 1 час после последнего введения мексидола во всех исследованных структурах отмечалось уменьшение амплитуды и числа разрядов пароксизмальной активности (Рис. 8Б). Кроме того, отмечалось уменьшение медленной активности и усиление альфа-активности в электрограммах ЧС и СМК.
А 7 дней после введения МФП+ Мексидол (7 дней) на фоне МФП+ Б
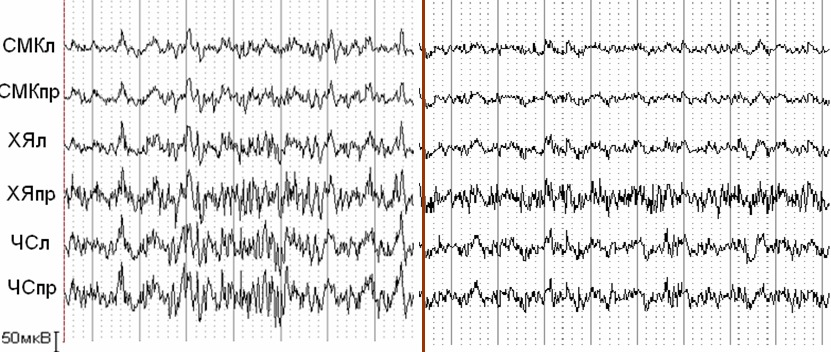
Рисунок 8. Влияние субхронического введения мексидола на биоэлектрическую активность мозга крыс с ПС вызванным МФП+.
Статистический анализ изменения мощности спектра биоэлектрической активности мозга крыс после однократного приема мексидола выявил тенденцию к её снижению в диапазоне дельта- и тета-частот и усилению в диапазоне альфа- и бета-частот. Данные изменения были наиболее выраженными в спектрограммах ХЯ и ЧС.
Статистический анализ спектрограмм группы крыс получавших мексидол в течение 7 дней выявил достоверное увеличение мощности спектра в диапазоне тета-активности в СМК правого полушария и ЧС левого полушария и снижение мощности спектра в диапазоне дельта-активности в электрограммах всех исследованных структур (Рис. 9).
Одновременно отмечалось статистически значимое увеличение мощности спектра в бета1-диапазоне в спектрограммах всех структур и в диапазоне бета2-частот в электрограмме ХЯ левого полушария (Рис. 9).
Таким образом, эффекты мексидола при однократном и семидневном введении однонаправлены, и проявляются уменьшением пароксизмальной активности и нормализацией биоэлектрической активности.
На фоне субхронического введения препарата биоэлектрическая активность становится более регулярной, отмечается появление тета-ритма частотой 7-8 Гц. Следует отметить, что усиление бета-активности в электрограммах крыс на фоне лечения мексидолом сопоставимо с эффектами амантадина и гимантана (Неробкова и соавт., 2007), однако усиление альфа активности наблюдается лишь на фоне приема мексидола.
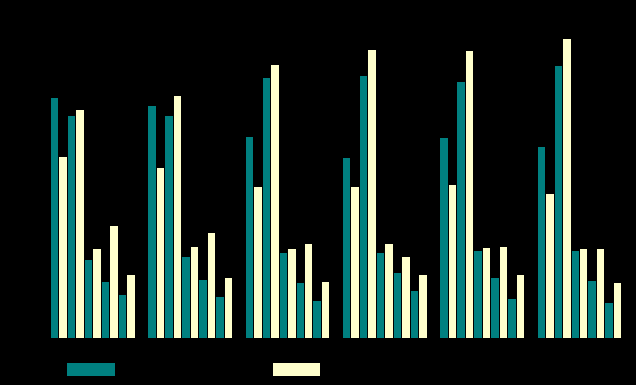
Рисунок 9. Спектральный анализ влияния мексидола на биоэлектрическую активность мозга крыс с МФП+-вызванным ПС. *- P<0,05 достоверность различий по сравнению с МФП+.
Анализ пароксизмальной активности показал, что однократное введение мексидола приводило к значительному уменьшению числа пароксизмальных разрядов во всех исследованных структурах (кроме СМК пр.п.) (Рис. 10).
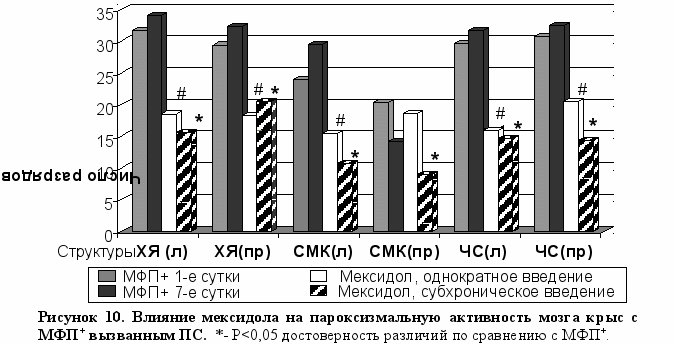
Отмеченные изменения пароксизмальной активности усиливались при 7-и дневном введении препарата (Рис. 10).
В результате проведенного исследования было показано, что мексидол в дозе 150 мг/кг в условиях экспериментального ПС у крыс, вызванного интранигральным введением МФП+, ослаблял проявления ПС: препарат уменьшал число и длительность пароксизмальных разрядов. Мексидол нормализовал характеристики ЭЭГ, увеличивал спектр мощности в диапазоне альфа- и бета-активности в электрограммах хвостатых ядер. Этот эффект усиливался при субхроническом введении мексидола и сопровождался уменьшением двигательных нарушений. Настоящие данные позволяют предположить наличие антипаркинсонической активности у мексидола, что возможно связано с его нейропротекторыми эффектами. Полученные результаты согласуются с результатами Катуниной (2005), где получено морфологическое подтверждение уменьшения выраженности нейродегенеративных изменений при предварительном введении мексидола (накануне дня эксперимента) на модели ПС у крыс, индуцированного МФТП.
6. Изучение влияния мексидола на содержание моноаминов и их метаболитов в структурах головного мозга крыс с ПС, вызванным системным введением МФТП
Известно, что МФТП вызывает как поведенческие расстройства, сходные с симптоматикой БП, так и биохимические изменения, для которых характерно селективное и необратимое снижение содержания дофамина (ДА) и его метаболитов, и снижение активности тирозингидроксилазы в стриатуме, прилежащем ядре и черной субстанции мозга (Przedborski, Vila, 2003; Sedelis et al, 2001). Кроме того, в патофизиологический процесс вовлекаются и другие нейротрансмиттерные системы – норадренергическая, холинергическая, серотонинергическая. (Scholtissen et al, 2006).
Оценку изменений содержания моноаминов головного мозга под влиянием мексидола проводили под контролем поведенческих проявлений ПС, вызванного введением МФТП (30 мг/кг). Установлено, что субхроническое применение мексидола в течение 7 дней (150 мг/кг) до введения нейротоксина вызывает существенное уменьшение основной симптоматики ПС. На фоне мексидола двигательная активность крыс в актометре в 3,31 раза превышала соответствующий показатель группы животных, получавших только МФТП. Под действием мексидола отмечалось уменьшение (в 2 раза) мелкоамплитудного тремора головы и передних конечностей. Заметно снижалась (в 1,7 раза) ригидность.
Анализ результатов полученных при изучении влияния мексидола на нейромедиаторный баланс в структурах головного мозга интактных крыс выявил наличие разнонаправленных незначительных изменений в содержании нейротрансмиттеров. Субхроническое введение мексидола в течение 7 дней вызвало достоверное увеличение концентрации серотонина (5-ОТ) во фронтальной коре и норадреналина (НА) в стриатуме, и снижение содержания дофамина (ДА) и его метаболита – 3,4-диоксифенилуксусной кислоты (ДОФУК - показатель внутриклеточного метаболизма дофамина) – в гипоталамусе по сравнению с контрольной группой (Табл. 3).
Однократное введение МФТП за 90 минут до декапитации животных вызывало значительные изменения активности катехоламинергических нейротрансмитерных систем. При этом наблюдалось драматическое снижение содержания ДА и ДОФУК во всех ДА-содержащих структурах мозга (за исключением гиппокампа, где напротив, отмечался рост ДОФУК). Изменения концентрации другого метаболита ДА – гомованилиновой кислоты (ГВК) - показатель постсинаптической трансформации дофамина – носили разнонаправленный характер. Если во фронтальной коре этот показатель возрастал, то в стриатуме и прилежащем ядре – снижался (Табл. 3). Разнонаправленным было влияние МФТП и на содержание НА, которое увеличивалось в стриатуме, но снижалось во фронтальной коре, гипоталамусе и гиппокампе. Уровень серотонина (5-ОТ) был достоверно ниже во фронтальной коре и гиппокампе мозга крыс. Концентрация его метаболита 5-оксииндолуксусной кислоты (5-ОИУК) во всех изученных структурах мозга также была меньше аналогичных значений контрольной группы, что может объясняться неспецифическими эффектами МФТП, и согласуется с данными ряда исследователей (Chen et al, 1998; Scholtissen et al, 2006; Ansah и соавт. 2007). Соотношение ДОФУК/ДА, характеризующее скорость кругооборота ДА, достоверно снижалось во всех структурах мозга (где определяли содержание ДОФУК), кроме гиппокампа, где отмечался рост этого
Таблица 3. Влияние мексидола на содержание моноаминов и их метаболитов в структурах головного мозга крыс в условиях моделирования дофаминергической нейротоксичности, вызванной введением МФТП
| Группа | НА | ДА | ДОФУК | ГВК | 5-ОТ | 5-0ИУК | ДОФУК/ДА | ГВК/ДА | 5-0ИУК/5-ОТ |
| Фронтальная кора | |||||||||
| Контроль | 0,5790,065 | 0,710,02 | - | 0,3220,08 | 6,4690,26 | 3,570,08 | - | 0,5360,14 | 0,5630,03 |
| Мексидол | 0,5860,04 | 0,6250,06 | - | 0,180,02 | 7,50,24* | 3,970,24 | - | 0,330,06 | 0,5510,06 |
| МФТП | 0,0480,02* | 0,4190,04* | - | 0,7750,12* | 4,940,15* | 2,450,09* | - | 1,8890,39* | 0,5570,06 |
| Мексидол+ МФТП | 0,0670,02* | 0,4190,02* | - | 1,0230,24* | 4,8340,2* | 2,540,08* | - | 2,7860,82* | 0,5730,04 |
| Гипоталамус | |||||||||
| Контроль | 8,9750,37 | 2,1690,09 | 0,4710,09 | 0,4850,14 | 6,00,28 | 3,4590,24 | 0,2270,04 | 0,210,06 | 0,5870,04 |
| Мексидол | 8,4570,47 | 1,6470,1* | 0,2110,03* | 0,3710,1 | 5,6030,14 | 3,1440,16 | 0,1280,02 | 0,2410,06 | 0,5350,04 |
| МФТП | 5,4010,48* | 1,2830,13* | 0,1330,04* | 0,4650,07 | 6,090,33 | 2,4740,26* | 0,1250,04* | 0,3810,06 | 0,4030,03* |
| Мексидол+ МФТП | 5,4850,21 | 1,1370,13 | 0,1540,02 | 1,120,29 | 5,5690,21 | 2,2720,14* | 0,1210,02 | 1,1120,33* | 0,40,03 |
| Прилежащее ядро | |||||||||
| Контроль | 4,530,58 | 56,1052,72 | 8,1360,47 | 2,6440,14 | 7,0180,4 | 6,250,21 | 0,1470,01 | 0,050,001 | 0,910,04 |
| Мексидол | 4,4080,21 | 56,9132,76 | 8,6490,44 | 2,3560,28 | 6,1480,41 | 5,940,36 | 0,1540,01 | 0,0420,005 | 0,9740,04 |
| МФТП | 5,5530,47 | 38,6741,86* | 1,5480,05* | 1,110,16* | 6,640,23 | 4,010,31* | 0,0380,003* | 0,030,01* | 0,590,03* |
| Мексидол+ МФТП | 5,9460,689 | 38,7891,98 | 1,6840,14 | 1,2310,17 | 5,9870,38 | 3,4570,17 | 0,0450,003* | 0,0340,01 | 0,590,03* |
| Гиппокамп | |||||||||
| Контроль | 2,4280,21 | 0,1140,02 | 0,1040,05 | 0,3790,1 | 2,7930,25 | 3,8390,13 | 0,460,2 | 3,731,03 | 1,4760,132 |
| Мексидол | 2,6390,15 | 0,1360,02 | 0,2580,09 | 0,5120,15 | 2,9420,13 | 4,3010,19 | 3,2851,65 | 1,6630,83 | 1,5150,25 |
| МФТП | 1,0690,23* | 0,0590,01* | 0,190,05 | 0,6590,37 | 2,060,19* | 2,3950,25* | 3,8551,34* | 7,8522,97 | 1,2740,18 |
| Мексидол+ МФТП | 1,0440,27* | 0,10,01# | 0,1340,03 | 0,6480,07 | 2,5990,34 | 3,1960,14*# | 1,4290,26# | 8,01,83 | 1,6040,12# |
| Стриатум | |||||||||
| Контроль | 0,3970,02 | 86,1681,43 | 8,1440,21 | 3,7240,22 | 3,8710,09 | 5,750,19 | 0,0940,005 | 0,0430,003 | 1,4850,03 |
| Мексидол | 0,5230,04* | 90,5162,47 | 8,7940,48 | 3,9790,26 | 3,9910,14 | 6,3140,23 | 0,090,005 | 0,0440,004 | 1,5870,05 |
| МФТП | 0,7960,04* | 63,8071,95* | 1,8620,11* | 1,7140,07* | 3,6810,18 | 4,0610,18* | 0,0310,002* | 0,0290,003* | 1,120,065* |
| Мексидол+ МФТП | 0,810,05* | 59,5591,58* | 1,7120,14* | 1,9240,13* | 3,9220,16 | 4,5060,08* | 0,0290,003* | 0,0320,002* | 1,170,06* |
Данные представлены в нмоль/г ткани, (Мm).* и #– р<0,05 - достоверность различий по сравнению с контролем и с МФТП, соответственно.
показателя в 8,38 раза по сравнению с контролем. В то же время показатель ГВК/ДА достоверно уменьшался в стриатуме и прилежащем ядре, тогда как во фронтальной коре он возрастал на 150%. Следует отметить, что соотношение 5-ОИУК/5-ОТ, свидетельствующее о скорости биодеградации 5-ОТ, снижалось в гипоталамусе, стриатуме и прилежащем ядре (Табл. 3). Таким образом, однократное введение МФТП вызывало значительные изменения активности катехоламинергических нейротрансмиттерных систем.
Одной из структур мозга, поражающейся на ранних стадиях паркинсонизма является гиппокамп (Shan, Chi, Bishop, 2006). Установлено, что МФТП вызывает достоверное снижение в гиппокампе уровня ДА – патогенетического нейромедиатора при ПС; увеличение показателя ДОФУК/ДА, снижение содержания 5-ОИУК/5-ОТ (Рис. 11 А, Б).
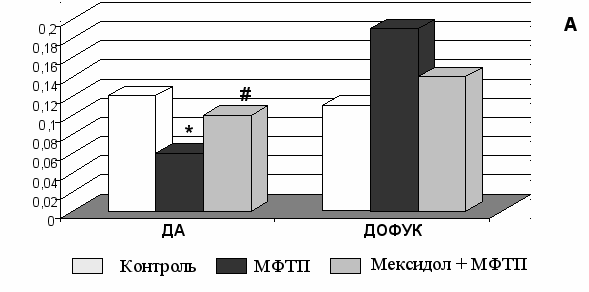
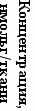

Рисунок 11. Влияние мексидола на содержание моноаминов и их метаболитов в гипокампе крыс в условиях моделирования ПС, вызванного МФТП.
*, # - P<0,05 достоверность различий по сравнению с интактным контролем
и группой МФТП, соответственно.
Субхроническое введение мексидола крысам устраняло депримирующее влияние МФТП на уровень ДА, 5-ОТ и их метаболитов – ДОФУК и 5-ОИУК в гиппокампе. Под влиянием препарата в 1,7 раза повышался уровень ДА (Рис. 11А). Позитивное влияние мексидола отмечалось в нормализации кругооборота ДА, о чем свидетельствовало снижение в 2,7 раза соотношения ДОФУК/ДА относительно показателя в группе «МФТП». Кроме того, влияние мексидола сказалось в повышении в 1,3 раза уровня 5-ОИУК и соотношения 5-ОИУК/5-ОТ (Рис. 11Б).
При суммарной оценке результатов, полученных на основании исследований других структур мозга, выраженных эффектов мексидола на изменения нейрохимических показателей, вызванных введением МФТП, не наблюдалось.
Эффекты МФТП обусловлены токсическим действием его метаболита – МФП+, который вызывает энергетическую недостаточность, усиление процессов свободнорадикального окисления, ведущих к структурно-пластической недостаточности нейронов и их гибели (Przedborski et al, 2000, 2001; Watanabe et al, 2005). Корректирующий эффект мексидола может быть связан с тем что, обладая антиоксидантными свойствами, он активизирует энергосинтезирующую функцию митохондрий и улучшает энергетический обмен в клетках, делая их менее чувствительными к действию нейротоксина. Наличие нейропротекторной и мембранопротекторной активности в спектре действия мексидола (Воронина и соавт., 2002) способствует уменьшению выраженности нейродегенеративных изменений под действием нейротоксина МФТП, и, следовательно, увеличивает число сохранных и слабоизмененных нейронов, обеспечивая нейропротекторный эффект, что согласуется с данными Катуниной (2005).
Таким образом, мексидол значительно ослабляет моторные и вегетативные проявления ПС, вызванного введением МФТП. Восстанавливающий эффект мексидола на моторные показатели сопровождается нормализацией нейромедиаторного баланса мозга, наиболее выраженной в гиппокампе, что проявляется восстановлением уровня ДА и соотношения ДА и 5-OT.
7. Определение продуктов перекисного окисления липидов (ПОЛ) в гомогенатах мозга мышей. Одним из механизмов антипаркинсонического влияния мексидола в условиях моделирования ПС может быть его антиоксидантное действие, которое подтверждено в опытах in vivo и in vitro (Клебанов и соавт., 2001; Матюшин и соавт., 2001; Нечипуренко и соавт., 2006; Новиков и соавт., 2004; Смирнов, 2003). О состоянии процессов ПОЛ в тканях мозга мышей с МФТП-индуцированным ПС судили по содержанию промежуточных и конечных продуктов липопероксидации – диеновых конъюгатов и малонового диальдегида (Щербань и соавт., 2004). Увеличение концентрации продуктов ПОЛ свидетельствует об усилении липопероксидации и срыва антиоксидантной защиты организма.
На фоне введения нейротоксина МФТП возникала выраженная активация процессов липопероксидации, о чем свидетельствовало увеличение содержания диеновых конъюгатов на 134% и малонового диальдегида на 88% в гомогенатах мозга мышей по сравнению с контролем (Табл. 4). Предварительное введение мексидола (200 мг/кг) и гимантана (10 мг/кг) уменьшало интенсивность процессов липопероксидации индуцированных применением МФТП, снижая концентрацию продуктов ПОЛ в мозге мышей. Так, содержание диеновых коньюгатов уменьшилось в среднем в 1,46 раза, а малонового диальдегида в 1,38 раза относительно показателей в группе животных получавших только нейротоксин. Наиболее значимый антиоксидантный эффект фиксировался при использовании комбинации мексидола и гимантана. На фоне препаратов отмечалось снижение содержания малонового диальдегида в мозге мышей до уровня нормы.
Таблица 4. Влияние веществ на содержание ПОЛ в гомогенатах мозга мышей.
| Группа | Диеновые конъюгаты (мкмоль/мг ткани) | Степ. отлич., % | Малоновый диальдегид (мкмоль/мгткани) | Степ. отлич., % |
| Контроль | 2,45±0,62 | - | 15,39±1,14 | - |
| МФТП (30 мг/кг) | 5,72±0,28 # | 134% | 28,97±1,45## | 88% |
| Мексидол (200)+МФТП | 3,91±0,19* | 59% | 21,04±1,0*& | 37% |
| Гимантан (10)+МФТП | 3,90±0,15* | 59% | 20,85±1,0*& | 36% |
| Мексидол+Гимантан+ МФТП | 3,93±0,18* | 60% | 17,91±0,7** | 16% |
#, *, (**) - р<0,05 (р<0,01) достоверность различий относительно контрольной и МФТП
групп, соответственно; & - P<0,05 достоверность различий по сравнению с группой Гимантан + Мексидол.
Таким образом, при ПС, вызванном введением МФТП мышам С57Bl/6, происходит увеличение интенсивности ПОЛ в головном мозге, характерное для синдрома мембранной патологии по оксидативному типу. Применение антиоксиданта мексидола, гимантана, обладающего антирадикальной активностью, и особенно комбинации гимантана и мексидола нормализовало ПОЛ в головном мозге мышей. Антиоксидантное действие мексидола обусловлено его химической структурой – наличием в составе производного гидроксипиридина (витамина В6 (пиридоксол) и придания ему антиоксидантных свойств за счет экранирования алкильными группами фенольного гидроксила (Новиков и соавт., 2004). Протективное действие мексидола можно объяснить его мембраностабилизирующим действием, которое проявляется угнетением ПОЛ мембран и изменением их фосфолипидного состава, а также нормализацией функционирования мембраносвязанных ферментов (Дюмаев, Воронина, Смирнов, 1995). Наряду с этим сукцинат мексидола легко проникает в клетки и окисляется в цикле трикарбиновых кислот, что способствует поддержанию уровня макроэргов при стрессорной гипоксии (Тилекеева и соавт., 1987; Лукьянова и соавт., 1993).
Умеренная антиоксидантная активность гимантана была установлена ранее. В бесклеточной системе пероксидиза – пероксид водорода было показано, что гимантан в концентрации 3*10-4М вызывает тушение хемилюминесценции за счет взаимодействия со свободными радикалами. (Золотов и соавт. 2001; Вальдман, 2001). Антиоксидантная активность гимантана была также оценена на модели аскорбат-зависимого перекисного окисления липидов в гомогенате печени крысы по концентрации малонового диальдегида. Достоверность различий была зарегистрирована только при применении гимантана в высокой концентрации 1мМ (Вальдман, 2001). Полученные данные на модели МФТП-индуцированного ПС подтверждают правильность ранее сделанных заключений о антирадикальной активности гимантана. Усиление этой активности при совместном применении с мексидолом свидетельствует в пользу целесообразности использования мексидола в комплексном лечении болезни Паркинсона с целью повышения эффективности симтоматической терапии и замедления прогрессирования заболевания.
Выводы:
- Мексидол в дозе 200 мг/кг проявляет положительный эффект в условиях трех моделей двигательных нарушений при паркинсонизме: снижает выраженность каталепсии, вызванной галоперидолом, и ареколинового тремора; уменьшает олигокинезию и ригидность при МФТП – индуцированном ПС.
- По антикаталептической активности и по эффективности на модели МФТП-индуцированного паркинсонизма мексидол в дозе 100-200 мг/кг уступает препаратам сравнения – леводопе (100 мг/кг), мидантану (20 мг/кг) и гимантану (10 мг/кг), а в тесте ареколинового тремора – гимантану (10 мг/кг).
3. Комбинация мексидола с гимантаном приводит к усилению противопаркинсонической активности последнего, что выражается в значительном снижении тяжести паркинсонических симптомов – тремора, ригидности, повышении двигательной активность животных.
4. Мексидол в дозе 150 мг/кг корректирует нарушения биоэлектрической активности головного мозга крыс с МФП+-индуцированным паркинсоническим синдромом, что проявляется в уменьшении числа и длительности пароксизмальных разрядов на ЭЭГ. Мексидол увеличивает спектр мощности в диапазоне альфа- и бета-активностей в электрограммах хвостатых ядер. Эффекты мексидола усиливаются при субхроническом введении препарата и сопровождаются уменьшением двигательных нарушений.
5. Предварительное субхроническое введение мексидола в дозе 150 мг/кг снижает выраженность нейрохимических изменений в гиппокампе, вызываемых нейротоксином МФТП, что выражается в уменьшении падения уровня дофамина и нормализации кругооборота дофамина и серотонина.
6. Мексидол (200 мг/кг), гимантан (10 мг/кг) и в большей степени их комбинация снижают содержание продуктов перекисного окисления липидов - диеновых конъюгатов и малонового диальдегида в гомогенатах мозга мышей С57Bl/6 с МФТП-индуцированным паркинсоническим синдромом.
Список работ, опубликованных по теме диссертации:
1. Воронина Т.А. Применение Мексидола в качестве противопаркинсонического средства [Текст] / Т.А. Воронина, О.А. Попова, Л.Н. Неробкова // XIII Международная конференция «Новые информационные технологии в медицине, биологии и фармакологии». - М., 2005. - С. 367-369.
2. Воронина Т.А. Оценка клинической эффективности Мексидола и его комбинации с паркинсоническими препаратами при болезни Паркинсона [Текст] / Т.А. Воронина, О.А. Попова, Е.А. Катунина, Г.Н. Авакян //Сборник материалов конгресса (тезисы докладов) XIV Российский национальный конгресс «Человек и лекарство», Москва 2006. - М. 2006. -С. 127.
3.Попова О.А. Электрофизиологические механизмы противопаркинсонического действия Мексидола на модели паркинсонического синдрома, вызванного нейротоксином МФП+ [Текст] / О.А. Попова, Т.А.Воронина, Л.Н. Неробкова // Сборник материалов конгресса (тезисы докладов) XIV Российский национальный конгресс «Человек и лекарство» Москва 2006. - М. 2006.- С. 441.
4. Воронина Т.А. Особенности противопаркинсонического действия Мексидола в эксперименте при моделировании паркинсонического синдрома и в клинике у пациентов БП [Текст] / Т.А.Воронина, Г.Н. Авакян, О.А. Попова, Е.В. Катунина, Л.Н. Неробкова, И.Г. Капица // Неврология и нейрохирургия Казахстана. - 2006. - № 4. - С. 12-19.
5. Попова О.А. Влияние Мексидола на локомоторные нарушения у крыс с МФП+ паркинсоническим синдромом [Текст] / О.А. Попова, Т.А. Воронина, Е.А. Вальдман, Л.Н. Неробкова // XV Российский национальный конгресс «Человек и лекарство».- М., 2007.- С. 865.
6. Попова О.А. Влияние мексидола на нейрохимические изменения в структурах мозга крыс при моделировании паркинсонического синдрома [Текст] / О.А. Попова, В.С. Кудрин, П.М. Клодт, В.Б. Наркевич, Л.Н. Неробкова, И.Г. Капица, Т.А. Воронина, Е.А. Вальдман // Вестник РГМУ. - 2008 - №1 (60). - С. 54-58.
7. Попова О.А. Антиоксидантная активность комбинации гимантана и мексидола при экспериментальном паркинсоническом синдроме у мышей С57BL/6 [Текст] / О.А. Попова, Н.Н. Золотов, И.Г. Капица, Л.Н. Неробкова, Е.А. Вальдман, Т.А. Воронина // Материалы научно-практической конференции «Медико-биологические науки для теоретической и клинической медицины». Москва, 28 ноября 2008.- М.: Российский государственный медицинский университет, 2008. - С. 83.
