Обоснование выбора метода реконструкции молочной железы
| Вид материала | Документы |
- Иммунодиагностика и иммунотерапия рака молочной железы, 241.98kb.
- Иммунодиагностика и иммунотерапия рака молочной железы, 212.29kb.
- Роль тиреоидной патологии в развитии дисгормональных заболеваний молочной железы, 224.5kb.
- Рак молочной железы: вопросы-ответы, 70.08kb.
- Реконструктивно-пластическая хирургия при раке молочной железы Р. Ш. Байбулатов, 66.9kb.
- Когда предотвратить легче, чем лечить тревожная статистика каждую минуту только в России, 136.97kb.
- Темы дня молочные железы и гинекологические болезни • Пластическая хирургия молочных, 514.96kb.
- Рак молочной железы и беременность, 90.57kb.
- Локальная, системная и сочетанная лучевая терапия костных метастазов, 150.74kb.
- 20 октября в Украине ежегодно проводиться День борьбы с раком молочной железы. Внашей, 156.69kb.
1 2
ОБОСНОВАНИЕ ВЫБОРА МЕТОДА РЕКОНСТРУКЦИИ МОЛОЧНОЙ ЖЕЛЕЗЫ
Современный подход к реабилитации больных состоит не только в том, чтобы устранить соматические проявления постмастэктомического синдрома, но и помочь женщине справиться с психосоциальными последствиями радикального лечения. Потребность в пластике МЖ испытывают 7 % женщин пожилого и 38 % женщин молодого возраста от числа лиц, подвергшихся мастэктомии.
Пластика молочной железы может выполняться в отсроченном варианте после окончания радикального лечения РМЖ, а может выполняться и одномоментно после мастэктомии. Преимуществами последнего варианта являются отсутствие рубцов после хирургического вмешательства и лучевой терапии, сохранность сосудов подмышечной области, возможность сохранить больше собственной кожи железы и несравненно лучший эстетический результат. Кроме этого, больная не подвергается «психологическому коллапсу», связанному с утратой молочной железы.
Возможность выполнения одномоментной пластики молочной железы изменила требования к классической технике выполнения мастэктомии. Многие хирурги при ранних стадиях опухолевого процесса стали применять так называемую кожесберегающую мастэктомию, сохраняя большую часть кожи при удалении паренхимы молочной железы с последующим восстановлением ее объема тем или иным способом.
Существует три основных способа ПМЖ:
- Восстановление при помощи силиконовых имплантатов или тканевых экспандеров;
- Пластика нижне-поперечным кожно-мышечным лоскутом передней брюшной стенки на основе прямой мышцы живота (Transvers Rectus Abdominis Myocutaneous flap – ТRАМ-лоскут в английской аббревиатуре);
- Пластика торакодорзальным лоскутом (ТДЛ) со спины.
В арсенале онкологов имеется еще одна методика, в которой объединены техники редукционной маммопластики и консервативной хирургии МЖ. Мы дали название этой методике – онкопластическая редукция молочной железы. Многие авторы отмечают, что сочетание этих техник при раке молочной железы, является, по сути, методом выбора в тех случаях, когда методы органосохраняющей хирургии дают неудовлетворительные результаты. Такие результаты чаще получаются у пациенток с большими и птозными молочными железами и локализацией опухоли в нижних или центральном квадрантах.
Топографо-анатомическое обоснование использования модифицированного торакодорзального лоскута
С учетом того, что наиболее применяемыми для полной или частичной реконструкции молочной железы являются ТДЛ и TRAM-лоскут, нами проведено исследование по определению полезного объема этих лоскутов. Топографо-анатомическая часть исследования выполнена на 13 нефиксированных трупах женщин, умерших в возрасте от 35 до 68 лет в результате травм и заболеваний, не связанных с поражением сосудов и нервов изучавшихся областей, в пределах которых производится формирование лоскутов. Всего в трех сериях исследований было изучено после различных инъекций артериального русла 23 препарата указанных областей (12 правых и 11 левых). Необходимо отметить, что подавляющее большинство исследованных препаратов – 16 из 23 – было получено от трупов женщин, умерших в возрасте от 40 до 59 лет. Следует отметить, что для проведения топографо-анатомических исследований отбирали препараты, не имевшие повреждений, деформаций или других видимых патологических изменений.
Объем комплексов тканей определялся по методу Архимеда путем определения объема вытесненной воды.
Было получено, что объем ТДЛ в среднем составляет 365 [230–440] мл. Объем TRAM-лоскута – 870 [745–1100] мл. Таким образом, стандартные лоскуты (ТДЛ и TRAM) не пригодны для восполнения восполнения дефицита тканей объемом от 440 до 745 мл. Для восполнения таких объемов нужно либо увеличивать объем ТДЛ искусственным наполнителем (силиконовым имплантатом), или уменьшать объем TRAM-лоскута. Кроме того, применение TRAM-лоскута сопряжено с большой травматичностью и длительностью реконструкции, а также нестабильностью конечного результата.
Поэтому на следующем этапе нашего исследования мы оценили возможность увеличения объема ТДЛ за счет окружающих мягких тканей спины.
В основу нашего исследования легло топографо-анатомическое изучение наличия анастомозов, связывающих сосудистую систему широчайшей мышцы спины (ШМС) с артериями, питающими трапециевидную мышцу и фрагмент лопаточного апоневроза с покрывающей его подкожной жировой клетчаткой.
Выявлено, что дистальная часть трапециевидной мышцы и участок лопаточного апоневроза с жировой клетчаткой, располагающийся от верхнего края ШМС до лопаточной ости, могут быть использованы для пластики молочной железы в составе модифицированного торакодорзального лоскута (мТДЛ). Нами проведено измерение объемов различных составных частей мТДЛ, изучены особенности их сосудистого снабжения и возможности использования для пластики молочной железы.
Мы предлагаем использовать мТДЛ, который состоит из пяти составных частей: фрагмента кожи спины, участка подкожной жировой клетчатки, располагающейся над широчайшей мышцей спины, лоскута из широчайшей мышцы спины, части лопаточного апоневроза с покрывающей его подкожной жировой клетчаткой и дистального фрагмента трапециевидной мышцы, поскольку весь комплекс тканей получает кровоснабжение из одного источника – торакодорзального сосудистого пучка.
На 23 модифицированных торакодорзальных лоскутах, сформированных в ходе всех трех серий топографо-анатомических исследований, после разделения фрагментов объем каждой из этих частей был измерен методом Архимеда. Результаты измерений суммированы в таблице 1.
Таблица 1
Таблица средних объемов анатомических составляющих мТДЛ
| мТДЛ, мл (n = 23) | КЛ, мл | ПЖК, мл | ШМС, мл | ТМ, мл | ЛА, мл |
| 590,9 ± 32,1 | 31,7 ± 1,7 | 243,3 ± 21,4 | 237,6 ± 12,7 | 45,4 ± 2,5 | 32,8 ± 1,6 |
Примечание: мТДЛ – модифицированный торакодорзальный лоскут; КЛ – кожный лоскут; ПЖК – подкожная жировая клетчатка; ШМС – широчайшая мышца спины; ТМ – трапециевидная мышца; ЛА – лопаточный апоневроз.
Выполненные измерения и сравнительный анализ их результатов позволили выяснить, что модифицированный торакодорзальный лоскут может быть больше по объему в среднем на 119,4 %, чем традиционный кожно-мышечный лоскут на основе широчайшей мышцы спины, использующийся для пластики молочной железы. Такое желательное увеличение объема (в среднем на 321,5 мл) может быть достигнуто за счет включения в мТДЛ дополнительного участка лопаточного апоневроза с подкожной жировой клетчаткой, выделяемого на протяжении от верхнего края ШМС до лопаточной ости, подкожно-жировой клетчатки над широчайшей мышцей спины, а также дистального фрагмента трапециевидной мышцы, формируемого на уровне V–XII грудных позвонков.
Возможность включения указанных участков мягких тканей спины в состав мТДЛ зависят, в первую очередь, от наличия связей между их кровеносными сосудами и артериями, а также сопутствующими им венами широчайшей мышцы спины. Именно сосудистые связи будут обеспечивать кровоснабжение всех частей модифицированного торакодорзального лоскута после его перемещения в реципиентную область на постоянной сосудистой ножке – грудоспинном сосудистом пучке. Поэтому на следующем этапе исследования нами проведено изучение таких сосудистых анастомозов.
Проведенные прикладные топографо-анатомические исследования позволили выяснить некоторые закономерности сосудистого снабжения мягких тканей спины применительно к возможностям формирования модифицированного торакодорзального лоскута. В частности, было установлено, что внутри широчайшей мышцы спины грудоспинная артерия обычно делится на три внутримышечные ветви, направляющиеся кзади и вниз по ходу волокон этой мышцы. Указанные артериальные ветви прослеживались в ходе препарирования, а также на рентгенограммах до лопаточной линии. Далее они распадались на конечные веточки и образовывали множественные анастомозы с многочисленными (от 5 до 9) ветвями межреберных артерий, проникавших в медиальные отделы широчайшей мышцы спины кнутри от лопаточной линии (рис.1).
Р
 ис. 1. Рентгенограмма комплекса мягких тканей правой области широчайшей мышцы спины после инъекции артериального русла рентгеноконтрастной затвердевающей массой. III серия (протокол № 20): 1 – грудоспинная артерия (ГА); 2 – ветвь ГА внутри широчайшей мышцы спины (ШМС); 3 – мышечная ветвь межреберной артерии (МА); 4 – кожная ветвь артерии, огибающей лопатку (АОЛ); 5 – анастомоз между мышечными ветвями ГА и МА внутри ШМС; 6 – анастомоз между мышечной ветвью ГА и кожной ветвью АОЛ.
ис. 1. Рентгенограмма комплекса мягких тканей правой области широчайшей мышцы спины после инъекции артериального русла рентгеноконтрастной затвердевающей массой. III серия (протокол № 20): 1 – грудоспинная артерия (ГА); 2 – ветвь ГА внутри широчайшей мышцы спины (ШМС); 3 – мышечная ветвь межреберной артерии (МА); 4 – кожная ветвь артерии, огибающей лопатку (АОЛ); 5 – анастомоз между мышечными ветвями ГА и МА внутри ШМС; 6 – анастомоз между мышечной ветвью ГА и кожной ветвью АОЛ.Помимо указанных внутримышечных артериальных соустий, кожные веточки артерий, проходящих в толще широчайшей мышцы спины, прободали собственную фасцию груди над указанной мышцей, разветвлялись в подкожной жировой клетчатке и формировали анастомозы с другими кожными артериями. Наиболее постоянные и крупные из таких анастомозов были отмечены между мышечно-кожными артериями, выходившими из широчайшей мышцы спины и крупными кожными ветвями артерии, огибающей лопатку. Они хорошо видны, как на представленной рентгенограмме (рис.1), так и на фотографии препарата после инъекции артериального русла латексом и выполненного микропрепарирования артериальных сосудов (рис.2).
Р
 ис. 2. Результат микропрепарирования артериальных анастомозов в правой области формирования модифицированного торакодорзального лоскута. Инъекция артерий латексом (протокол № 16): 1 – широчайшая мышцы спины (ШМС); 2 – трапециевидная мышца (ТМ); 3 – нижний угол лопатки; 4 – крупная ветвь V межреберной артерии; 5 – артерия, огибающая лопатку (АОЛ); 6 – анастомоз между артериями ШМC и ТМ в V межреберье; 7 – анастомоз между артериями ШМC и ТМ в VI межреберье; 8 – анастомоз между артериями ШМC и ветвью АОЛ; 9 – анастомоз между артериями ТМ и ветвью АОЛ.
ис. 2. Результат микропрепарирования артериальных анастомозов в правой области формирования модифицированного торакодорзального лоскута. Инъекция артерий латексом (протокол № 16): 1 – широчайшая мышцы спины (ШМС); 2 – трапециевидная мышца (ТМ); 3 – нижний угол лопатки; 4 – крупная ветвь V межреберной артерии; 5 – артерия, огибающая лопатку (АОЛ); 6 – анастомоз между артериями ШМC и ТМ в V межреберье; 7 – анастомоз между артериями ШМC и ТМ в VI межреберье; 8 – анастомоз между артериями ШМC и ветвью АОЛ; 9 – анастомоз между артериями ТМ и ветвью АОЛ.Следует отметить, что именно эти постоянные сосудистые анастомозы обеспечивают питание дополнительной порции модифицированного торакодорзального лоскута, включающей часть лопаточного апоневроза с покрывающей его подкожной жировой клетчаткой.
Особое внимание в ходе проведенных топографо-анатомических исследований уделяли артериальным анастомозам, соединяющим сосудистые системы широчайшей мышцы спины и трапециевидной мышцы. Ведь от наличия, частоты встречаемости, количества и диаметров указанных соустий зависит возможность адекватного кровоснабжения дистальной части трапециевидной мышцы, которую было предложено включать в состав модифицированного торакодорзального лоскута. Необходимо отметить, что такие артериальные анастомозы в количестве от 4 до 8 были найдены на всех изученных препаратах. Они прослеживаются и на приведенной иллюстрации из II серии экспериментов (рис.2), и на фотографии препарата из I серии (рис.3).
Р
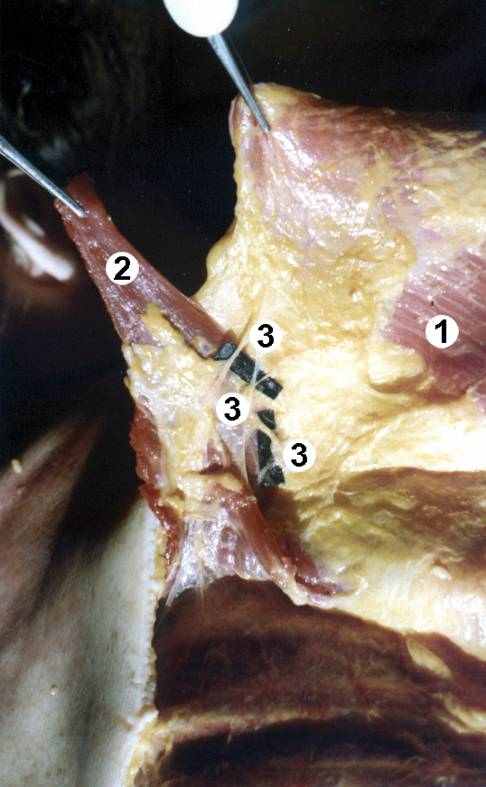 ис. 3. Результат препарирования сосудистых анастомозов между широчайшей мышцей спины и трапециевидной мышцей слева. I серия опытов (протокол № 11): 1 – широчайшая мышца спины (ШМС); 2 – трапециевидная мышца (ТМ); 3 – сосудистые анастомозы между ШМС и ТМ.
ис. 3. Результат препарирования сосудистых анастомозов между широчайшей мышцей спины и трапециевидной мышцей слева. I серия опытов (протокол № 11): 1 – широчайшая мышца спины (ШМС); 2 – трапециевидная мышца (ТМ); 3 – сосудистые анастомозы между ШМС и ТМ.Cоустья между артериальными системами широчайшей мышцы спины и трапециевидной мышцы чаще всего располагались в V и VI межреберьях или вблизи от места пересечения верхнего края ШМС и наружного края ТМ. На участке от нижнего края V ребра до верхнего края VII ребра такие соединительные артерии в количестве от одной до четырех были отмечены на каждом изученном препарате. Общее же число анастомозов между артериями широчайшей мышцы спины и трапециевидной мышцы колебалось на различных препаратах от четырех до восьми.
Прицельное микропрепарирование источников артериальных соустий в толще широчайшей мышцы спины и трапециевидной мышцы позволило установить, что они, как правило, формируются за счет крупных (диаметром 1,3–2 мм) мышечных ветвей межреберных артерий. Эти артерии анастомозируют, с одной стороны, с ветвями грудоспинной артерии в толще широчайшей мышцы спины, а, с другой стороны, с нисходящей ветвью поперечной артерии шеи – основным источником артериального снабжения трапециевидной мышцы. Указанные анастомозы хорошо видны на представленной ранее фотографии препарата (рис.2), на котором крупная мышечная ветвь V межреберной артерии (4) формирует веточки как к ШМС, так и к ТМ в V и VI межреберьях (6, 7).
На этом же препарате (рис. 2) видны связи двух крупных кожных ветвей артерии, огибающей лопатку (5), с мышечными артериями широчайшей мышцы спины (8) и трапециевидной мышцы (9). Таким образом, поступление артериальной крови в дистальную порцию трапециевидной мышцы из системы грудоспинной артерии, очевидно, может осуществляться не только по прямым анастомотическим связям между артериями ШМС и ТМ, но и по ветвям артерии, огибающей лопатку. Поэтому представляется весьма целесообразным включать в состав модифицированного торакодорзального лоскута не только дистальную часть трапециевидной мышцы, но и участок лопаточного апоневроза с подкожной жировой клетчаткой на участке ниже лопаточной ости, где как раз и разветвляются кожные ветви артерии, огибающей лопатку.
В ходе выполненных топографо-анатомических исследований наличие анастомозов между ветвями грудоспинной артерии, артериальными сосудами трапециевидной мышцы и артерией, огибающей лопатку, было проверено также путем экспериментального формирования модифицированного торакодорзального лоскута после инъекции артериального русла затвердевающей рентгеноконтрастной массой (рис. 4 а). На представленной рентгенограмме такого лоскута (рис. 4 б) ясно видны указанные артериальные соустья (9, 10, 11).
Таким образом, наличие рассматриваемых артериальных соустий было доказано не только посредством препарирования, но также и с помощью посмертной ангиографии, произведенной на различных этапах экспериментального формирования модифицированного торакодорзального лоскута.
Р


а
б
ис. 4. Результат экспериментального формирования модифицированного торако-дорзального лоскута (мТДЛ) после инъекции артерий рентгеноконтрастной затвердевающей массой (протокол № 17). а) сформированный мТДЛ; б) рентгенограмма сформированного мТДЛ: 1 – широчайшая мышцы спины (ШМС); 2 – трапециевидная мышца (ТМ); 3 – кожный фрагмент лоскута; 4 – участок лопаточного апоневроза; 5 – ветвь ГА внутри ШМС; 6 – кожная ветвь артерии, огибающей лопатку (АОЛ); 7 – мышечная ветвь межреберной артерии (МА) внутри ШМС; 8 – мышечная ветвь МА внутри трапециевидной мышцы (ТМ); 9 – анастомоз между артериальными системами ШМС и ТМ; 10 – анастомоз между мышечной ветвью ГА и кожной ветвью АОЛ; 11 – анастомоз между мышечной ветвью МА внутри ТМ и кожной ветвью АОЛ.
Необходимо отметить, что каждый из описанных выше артериальных анастомозов обязательно сопровождался соединительными венозными сосудами примерно равного с артериями диаметра. И хотя венозное русло в нашей работе не заполнялось специальными инъекционными массами, венозные соустья, располагающиеся рядом с артериальными, встречались в ходе препарирования с закономерным постоянством.
Подводя итоги результатам проведенных топографо-анатомических исследований, следует отметить, что удалось выявить анатомически постоянные артериальные и венозные анастомозы между сосудистыми системами широчайшей мышцы спины и дистальной части трапециевидной мышцы, а также их связи с ветвями артерии и вены, огибающих лопатку. Были изучены количество, локализация и диаметры этих сосудистых соустий. Установленные особенности сосудистого снабжения мягких тканей спины позволили обосновать с анатомических позиций возможности включения в состав модифицированного торакодорзального лоскута трех дополнительных фрагментов – подкожной жировой клетчатки, дистальной части брюшка трапециевидной мышцы и участка лопаточного апоневроза, выделенного на протяжении от верхнего края широчайшей мышцы спины до лопаточной ости.
Полученные новые сведения о деталях строения артериального русла изученной области обусловили также вывод о том, что дополнительное выделение всех перечисленных выше частей в составе модифицированного торакодорзального лоскута обеспечивает более надежное сосудистое снабжение всего тканевого комплекса, чем включение в такой лоскут лишь одной из них.
Проведенные топографо-анатомические исследования позволили рекомендовать модифицированный торакодорзальный лоскут для использования в клинической практике. Этот комплекс тканей позволяет заполнить пробел между объемами ТДЛ и TRAM-лоскутов, поскольку его объем составил 630 мл [470–710].
Такой тканевой комплекс пригоден для выделения единым блоком на единственной сосудистой ножке – грудоспинном сосудистом пучке и последующего перемещения на указанных питающих сосудах в реципиентную область с целью несвободной пластики молочной железы.
Выполненные прикладные топографо-анатомические исследования обеспечили обоснование с анатомических позиций возможностей формирования модифицированного торакодорзального лоскута (мТДЛ), включающего помимо собственно широчайшей мышцы спины и кожно-жировой порции еще три дополнительные составные части – дистальный фрагмент брюшка трапециевидной мышцы, участок лопаточного апоневроза и подкожную жировую клетчатку. Было установлено, что дополнительное выделение этих частей в составе мТДЛ позволяет увеличить его объем по сравнению с традиционным торакодорзальным лоскутом в среднем на 119,4 %, при достаточно надежном сосудистом снабжении всего тканевого комплекса.
Такой прирост объема тканей, пересаживаемых в составе единого лоскута, является, на наш взгляд, весьма существенным для пластики молочной железы, так как позволяет отказаться от использования имплантов. При этом замещение раневого дефекта или восполнение тканевого дефицита в реципиентной области осуществляется здоровыми и хорошо кровоснабжаемыми собственными тканями.
Формирование модифицированного торакодорзального лоскута на анатомическом материале позволило прийти к заключению, что его выделение технически не сложнее, чем обычного тканевого комплекса на основе ШМС. Дополнительные тканевые компоненты, включаемые в мТДЛ, находятся рядом с ШМС и вполне доступны для мобилизации из обычного для таких операций доступа. Поэтому операционное время, необходимое для выполнения этого этапа пластики молочной железы, увеличивается не существенно.
Необходимо также отметить, что проведенные топографо-анатомические исследования были направлены, в первую очередь, на обоснование возможностей использования модифицированного торакодорзального лоскута для несвободной пластики молочной железы и обеспечили положительное решение этого вопроса. Однако выявленные анатомические особенности сосудистого снабжения мягких тканей спины принципиально позволяют обосновать также возможность свободной пересадки мТДЛ на грудоспинном сосудистом пучке с его пересечением и последующим микроанастомозированием питающих лоскут сосудов с артерией и веной в реципиентной области.
Такая операция, безусловно, потребует от хирургов дополнительной подготовки в области микрососудистой хирургии, а также использования специальных средств оптического увеличения, особого инструментария и шовного материала. Для пластики молочной железы нет необходимости в производстве такой – гораздо более сложной, чем несвободная пересадка модифицированного торакодорзального лоскута, микрохирургической операции. Однако для реконструкции в отдаленных от места формирования мТДЛ областях микрохирургическая аутотрансплантация описанного лоскута может быть вполне реальной, о чем свидетельствуют данные, полученные в ходе проведенных исследований.
В целом же следует отметить, что обоснованные анатомическими исследованиями возможности клинического применения модифицированного торакодорзального лоскута, выявленные его преимущества и особенности, изложенные в настоящем разделе, позволили успешно использовать мТДЛ в клинике для пластики молочной железы.
Предложенная методика реконструкции молочной железы
модифицированным торакодорзальным лоскутом
Предоперационная маркировка выполняется в вертикальном положении пациентки. Наносятся стандартные ориентиры: позвоночной (средней) линии, проекции лопатки, широчайшей и трапециевидной мышц, задней ости подвздошной кости. Линия кожного фрагмента размечается на заднебоковой области спины в форме полумесяца, открытого кверху, либо в виде веретена. Задняя верхушка его располагается в 3 см от средней линии, передняя – на передней аксиллярной линии и может на несколько сантиметров выходить за передний край широчайшей мышцы спины. Длина кожного фрагмента обычно между 22 и 25 см. Ширина фрагмента обычно составляет 7–9 см и планируется таким образом, чтобы оставшимися тканями можно было без труда закрыть послеоперационную рану (рис. 5 а, б).
Проводится это следующим образом: кожа спины с подлежащими тканями берется в складку так, чтобы длинные пальцы кисти исследователя находились на нижней границе фрагмента, а большой палец оттягивал ткани спины снизу. Если верхняя граница находится над кончиками длинных пальцев, то ширина кожного фрагмента считается адекватной. Это необходимо для того, чтобы избежать осложнений со стороны донорской раны. Увеличение кожного фрагмента дает небольшой прирост объема всего лоскута, но может привести к вторичному заживлению раны на спине, как следствие чрезмерного натяжения тканей при ее ушивании.
Р


а
б
ис. 5 (а, б). Планирование модифицированного торакодорзального лоскута для одномоментной пластики молочной железы.
Техника операции
Операция состоит из нескольких этапов:
1. Онкологический этап.
Поворот на бок в торакотомную позицию.
2. Мобилизация лоскута и проведение его в подкожном тоннеле к дефекту на месте мастэктомии. Дренирование и ушивание донорской раны.
Поворот на спину и «присаживание» пациентки под углом 45°.
3. Формирование из лоскута образа молочной железы. Дренирование подмышечной области и ушивание раны.
После того как пациентка вводится в наркоз, выполняется поворот ее в торакотомную позицию (латеральную супинацию) (рис.6) и спина обрабатывается раствором антисептика. Затем делается поворот в исходное положение на стерильную простынь и обрабатывается передняя грудная стенка. Во время этих поворотов при первых операциях отрабатывается согласованность действий операционной бригады.
После выполнения мастэктомии, пациентка вновь возвращается в торакотомную позицию. Подъем торакодорзального лоскута осуществляется по стандартной методике, отличие составляют несколько важных моментов.
Р
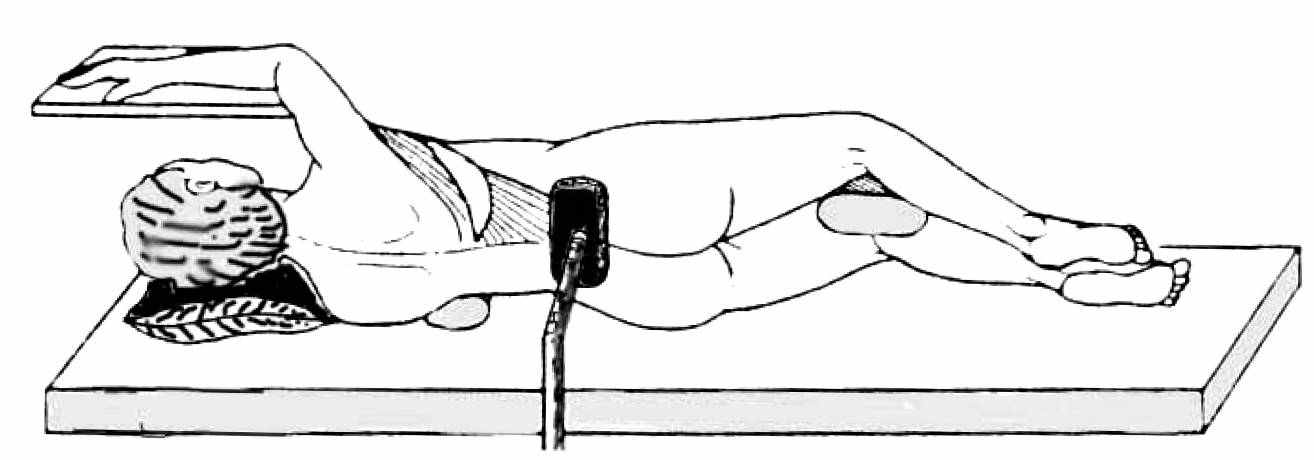 ис. 6. Положение пациентки на операционном столе при мобилизации модифицированного торакодорзального лоскута.
ис. 6. Положение пациентки на операционном столе при мобилизации модифицированного торакодорзального лоскута.Перед выполнением разрезов на коже подкожная жировая клетчатка спины в границах размеченного лоскута инфильтрируются следующим составом:
- 0,1% раствор адреналина гидрохлорида – 0,5 мл,
- 10% раствор лидокаина гидрохлорида – 2 мл,
- 0,25% раствор новокаина – 500 мл.
Этим достигаются две цели: уменьшается кровоточивость тканей за счет спазма периферических сосудов и выполняется гидропрепаровка зоны оперативного вмешательства.
После рассечения кожи по намеченным границам кожного фрагмента мобилизация тканей далее выполняется электроножом для профилактики послеоперационного кровотечения из спазмированных во время инфильтрации сосудов. Хорошим ориентиром служит поверхностная фасция. Мобилизация в слое сразу ниже ее позволяет сохранить равномерную толщину клетчатки на остающихся кожных лоскутах спины. Жировая клетчатка, остающаяся на поверхности широчайшей мышцы спины, кровоснабжается за счет ее перфорантов. Этот этап мобилизации относительно длительный по сравнению с классическим методом подъема лоскута на уровне мышечной фасции. Объем жира, остающегося на мышце, варьирует от конституции и толщины подкожной клетчатки пациентки. Вверх мобилизация продолжается до ости лопатки (spina scapulae), вниз – до ости подвздошной кости (crista iliaca). При этом подкожная клетчатка, включаемая в лоскут ниже кожного фрагмента, ограничивается уровнем 11–12 ребер, поясничная клетчатка в лоскут не входила (рис. 7). Латеральная граница мобилизации тканей – это край широчайшей мышцы спины, медиальная – позвоночная линия. Кровоснабжение лоскутов кожи, остающихся на спине, после разделения перфорантов от широчайшей мышцы спины осуществляется за счет субдермального сплетения.
После окончания мобилизации лоскута по передней поверхности начинается отделение его от грудной стенки, которое удобнее начинать с латерального края его ниже угла лопатки, где широчайшая мышца легко отделяется от подлежащих тканей. По возможности вдоль латерального края мышцы оставляется полоса подкожной клетчатки шириной до 2 см. Выделение лоскута со стороны его нижней поверхности продолжается в периферическом направлении, перевязываются вступающие в нее перфорантные сосуды и разделяются все более прочные связи мышцы и ее апоневроза с поясничной фасцией. Сохранение фасции необходимо для предотвращения образования поясничных грыж.
Р
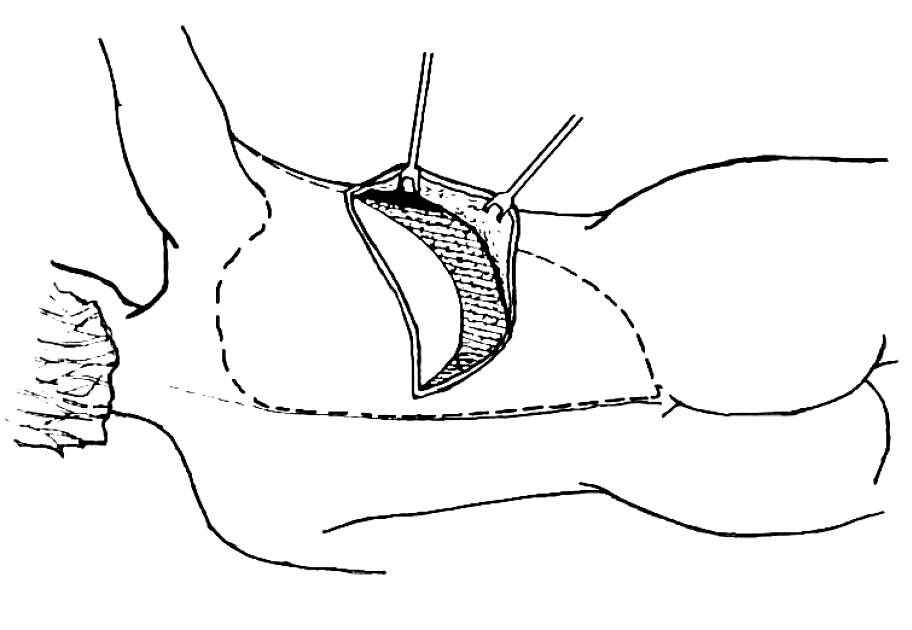 ис. 7. Границы мобилизации модифицированного торакодорзального лоскута (показаны пунктирной линией).
ис. 7. Границы мобилизации модифицированного торакодорзального лоскута (показаны пунктирной линией).Жировую клетчатку поясничной области в лоскут мы не включали, поскольку именно этот фрагмент чаще некротизируется и приводит к необходимости повторных операций. Кроме того, именно это место имеет название «ручки любви». И изменение конфигурации этой области может привести к определенному дискомфорту в интимной жизни пациентки.
Затем мобилизация проходит в проксимальном направлении, широчайшая мышца отделяется от 9–12 ребер и остистых отростков 1–2 поясничных и 7–12 грудных позвонков. Начиная от 12 грудного позвонка, вместе с широчайшей мышцей спины от остистых отростков отделяется и трапециевидная мышца. На уровне 5–6 грудных позвонков эта мышца пересекается в поперечном направлении и далее происходит отделение так называемой лопаточной и окололопаточной «жировой фасции», составляющую основу лопаточных лоскутов, от подлежащих мышц (большой ромбовидной, подостной, большой и малой круглых мышц). На уровне угла лопатки становятся видны просвечивающие через рыхлую соединительную ткань сосуды, переходящие в торакодорзальный сосудисто-нервный пучок. Ветвь к передней зубчатой мышце сохраняется, это не влияет на мобильность лоскута. В одном случае сохранение этой ветви позволило нам провести повторную операцию у пациентки с жировым некрозом ТRАМ-лоскута. Ей была выполнена пластика ТДЛ на ретроградном кровотоке через этот сосуд, поскольку микроанастомозы на первой операции накладывались с торакодорзальными сосудами выше отхождения ветви к передней зубчатой мышце.
Также мы не считаем необходимым пересечение торакодорзального нерва, поскольку это повлечет за собой атрофию мышечной массы лоскута. Только у 3-х пациенток мы наблюдали сокращаемость перемещенной ШМС, которая ослабевала со временем. В связи с тем, что толщина широчайшей мышцы спины значительна у места ее прикрепления к плечевой кости, то для уменьшения контурируемости ножки лоскута под кожей подмышечной ямки выполняли иссечение мышечного фрагмента над сосудистой ножкой на протяжении, оставляя полоску мышцы 1,0–0,5 см над сосудами для профилактики перекрута или натяжения их. Лоскут в подкожном тоннеле, сформированном в подмышечной области, переводится на переднюю поверхность грудной клетки.
Далее после установки активного дренажа в донорскую зону выполняется послойное закрытие раны на спине. Пациентка переводится в полусидячее положение (рис. 5).
Р
 ис. 8. Положение пациентки на операционном столе при формировании из лоскута подобия молочной железы.
ис. 8. Положение пациентки на операционном столе при формировании из лоскута подобия молочной железы.Следующий этап – формирование из лоскута подобия молочной железы. Он может выполняться двояко в зависимости от оставшегося количества кожи молочной железы. В том случае, когда иссекался большой фрагмент кожи над опухолью или вокруг послеоперационного рубца и (или) удалялся сосково-ареолярный комплекс, лоскут размещается на грудной стенки кожным фрагментом наружу. Вначале для профилактики натяжения сосудистой ножки накладываются швы 2/0 из рассасывающегося материала между проксимальной частью широчайшей мышцы спины и большой грудной мышцей. Затем лоскут подшивается по периферии области, мобилизованной после удаления ткани молочной железы. Нижняя часть лоскута подворачивается для создания объема. Ткани лоскута сшиваются между собой и фиксируются к тканям грудной стенки. Накладываются временные фиксирующие швы на оставшуюся кожу молочной железы. На коже лоскута маркируется участок, соответствующий дефициту кожи молочной железы. Для этих же целей применяется трафарет из полиэтиленовой пленки, соответствующий размерам иссеченной кожи молочной железы. Временные швы удаляются, и выполняется деэпидермизация остальной кожи лоскута. При этом необходимо следить за тем, чтобы не было резких переходов между фрагментами лоскута, которые могут контурироваться под кожей железы. Это достигается удалением тканей фрагментов по их границе под углом примерно в 60°. Затем в подмышечную область помещается активный дренаж. Накладываются послойные швы.
Если удаляемый фрагмент кожи небольшой, возникший дефект может быть устранен обычным сшиванием краев раны. В случае сохранения сосково-ареолярного комплекса, сформированный лоскут полностью погружается под оставшуюся кожу молочной железы. Для этого выполняется деэпидермизация всего кожного фрагмента лоскута, и он заворачивается в остальные ткани лоскута таким образом, что наружной поверхностью становится поверхность широчайшей мышцы спины, прилегающей к грудной стенке. Этот прием обеспечивает отсутствие неровностей, контурирующихся под кожей железы. Такой вариант пластики приводит к получению наиболее эстетичных результатов. В остальном и фиксация лоскута, и дренирование раны выполняются так же как в предыдущем варианте.
Оценивается симметрия и форма созданного органа. Лоскут, имитирующий молочную железу, должен располагаться на грудной клетке несколько выше (на 2 см), чем другая железа, и должен превышать ее объем примерно на 15-30 %. Это выполняется в расчете на последующий птоз и атрофию мышечной части лоскута.
Наблюдение за состоянием лоскута проводится через «окно» в повязке. В течение первых суток пациентке разрешается сгибать ноги в коленных и тазобедренных суставах, слегка поворачиваться с боку на бок. На следующий день пациентке разрешается вставать, немного ходить, сидеть в кресле. В течение первой недели ограничиваются движения в плечевом суставе на стороне операции, затем назначаются лечебная физкультура для разработки движений в этом суставе. Дренажи удаляются после того, как количество отделяемого по ним не превышает 30 мл в сутки. Если дренажи удаляются раньше, например, по причине инфильтрации мягких тканей вокруг них, то дальнейшее удаление жидкости производится путем ежедневных пункций. С учетом сложной конфигурации тканей в зоне локализации трансплантата иногда целесообразно для поиска участков скопления жидкости прибегнуть к ультразвуковому исследованию. Узловые швы удаляются на 8–10 день, внутрикожные – на 10–12 день после операции.
Окончательный результат реконструкции обычно оценивается на 5–6 месяц после операции.
Тактика выбора метода реконструкции
при злокачественных новообразованиях молочной железы
При проведении топографо-анатомического этапа исследований было установлено, что объем ТДЛ в среднем составляет 365 [230–440] мл. Объем TRAM-лоскута – 870 [745–1100] мл. Средний объем мТДЛ составил 630 мл [470–710].
С
 учетом того, что в поздний послеоперационный период объем пересаженного лоскута изменяется (в частности, объем ТДЛ уменьшается со временем на 15–30 % из-за атрофии мышечного компонента), это необходимо учитывать при планировании реконструкции МЖ. Поэтому реальные объемы молочных желез, которые можно заместить ТДЛ, составляют по расчетным данным 245 [150–290] мл, мТДЛ – 420 [310–470] мл. Поскольку TRAM-лоскут состоит большей частью из жировой клетчатки, поэтому его объем не подвергается атрофии и зависит от только общей массы пациентки.
учетом того, что в поздний послеоперационный период объем пересаженного лоскута изменяется (в частности, объем ТДЛ уменьшается со временем на 15–30 % из-за атрофии мышечного компонента), это необходимо учитывать при планировании реконструкции МЖ. Поэтому реальные объемы молочных желез, которые можно заместить ТДЛ, составляют по расчетным данным 245 [150–290] мл, мТДЛ – 420 [310–470] мл. Поскольку TRAM-лоскут состоит большей частью из жировой клетчатки, поэтому его объем не подвергается атрофии и зависит от только общей массы пациентки. Реконструктивные операции по времени проведения делятся на одномоментные и отсроченные. Это так же имеет значение при выборе метода реконструкции, поскольку исходные условия для проведения восстановительной операции разные. При одномоментной реконструкции у хирурга имеется исходный образ железы, условия для сохранения ткани, кожи и САК молочной железы. При отсроченной реконструкции железа, как правило, удалена полностью, дефицит кожи более значительный, САК отсутствует, и образ удаленной железы можно представить только по сохранившейся молочной железе.
В нашем исследовании одномоментная реконструкция проведена в 78 случаях. Реконструкция лоскутами тканей проведена у 66 пациенток. 10 пациенток при одномоментной пластике нуждались в замещении объема 200–250 мл, им выполнялась реконструкция с использованием сТДЛ. У 45 пациенток замещаемый объем составил около 400 мл, им выполнялась реконструкция с использованием мТДЛ. И 11 женщинам требовались лоскуты большего объема, поэтому для реконструкции им применялся TRAM лоскут (табл. 5.3).
Таблица 5.3
Одномоментные реконструктивные операции
| Метод реконструкции | n | % |
| сТДЛ | 10 | 12,8 |
| мТДЛ | 45 | 57,7 |
| TRAM | 11 | 14,1 |
| PP+PM | 8 | 10,3 |
| Силикон | 4 | 5,1 |
| Всего | 78 | 100 |
В нашем опыте при одномоментных операциях был более востребован именно модифицированный вариант торакодорзального лоскута – 57,7 % – как комплекс тканей наиболее вариабельный по объему и стабильный по кровоснабжению. Стандартный вариант ТДЛ и TRAM-лоскут применялись примерно в равных пропорциях 12,8 и 14,1 % соответственно.
У 8 пациенток (10,3 %) была возможность использовать онкопластическую редукцию молочной железы. И в 4 случаях (5,1 %) при одномоментной реконструкции устанавливались силиконовые имплантаты.
Клинический пример № 7. Использование сТДЛ.
Пациентка Л., 39 лет, лечилась в отделении маммологии Иркутского областного онкологического диспансера с диагнозом: рак левой молочной железы pT2N1M0, 2b ст., 3 кл. гр. (см. гл. 4, клинический пример № 4).
Объем железы – 920 см3. Объем опухоли – 2,34 см3. Объем удаляемых тканей – 94,4 см3. Отношение объема удаляемого фрагмента к объему молочной железы 10,3 %, что является показанием для радикальной резекции. Пациентке проведена радикальная секторальная резекция правой молочной железы.
Для замещения дефекта с расчетным объемом 94,4 см3 достаточно было объема стандартного ТДЛ. В его состав вошли только фрагмент кожи спины и широчайшая мышца. Лоскут проведен на дефект через подкожный тоннель в подмышечной области и адаптирован к оставшимся тканям молочной железы.
Послеоперационный период протекал без осложнений.
ПГЗ № 20826-34 – в секторе правой молочной железы обнаружена опухоль 2 × 1,5 × 1,5 см, в которой микроскопически выявлено строение инфильтративного протокового рака, 1 ст. злокачественности. В краях препарата роста опухоли не обнаружено. В двух лимфоузлах подмышечной области обнаружены метастазы рака молочной железы.
Пациентка прошла послеоперационную лучевую терапию и адъювантную ПХТ 6 курсов по FAC.
Пациентка наблюдается на протяжении 7,5 лет. Признаков местного рецидивирования и отдаленного метастазирования нет (рис. 5.9).
Таким образом, в этом случае для замещения дефекта ткани молочной железы большого размера после выполнения радикальной секторальной резекции достаточно было использовать стандартный вариант ТДЛ.
Р

а
б
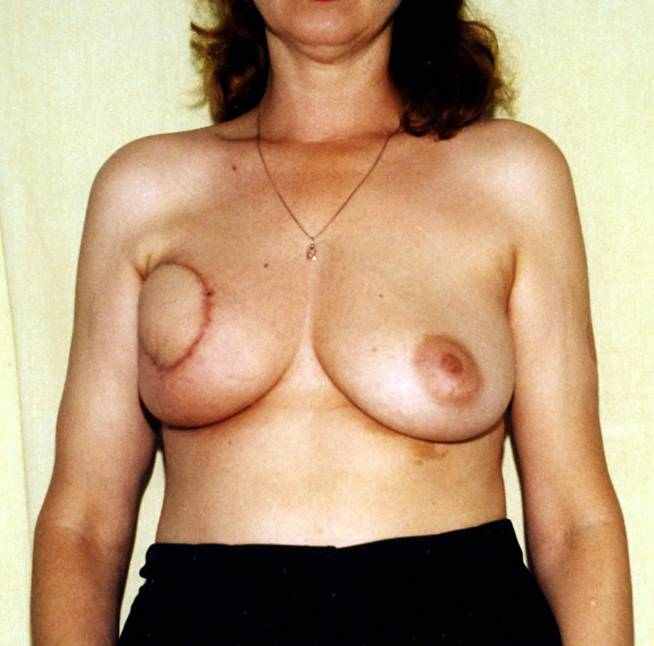
в
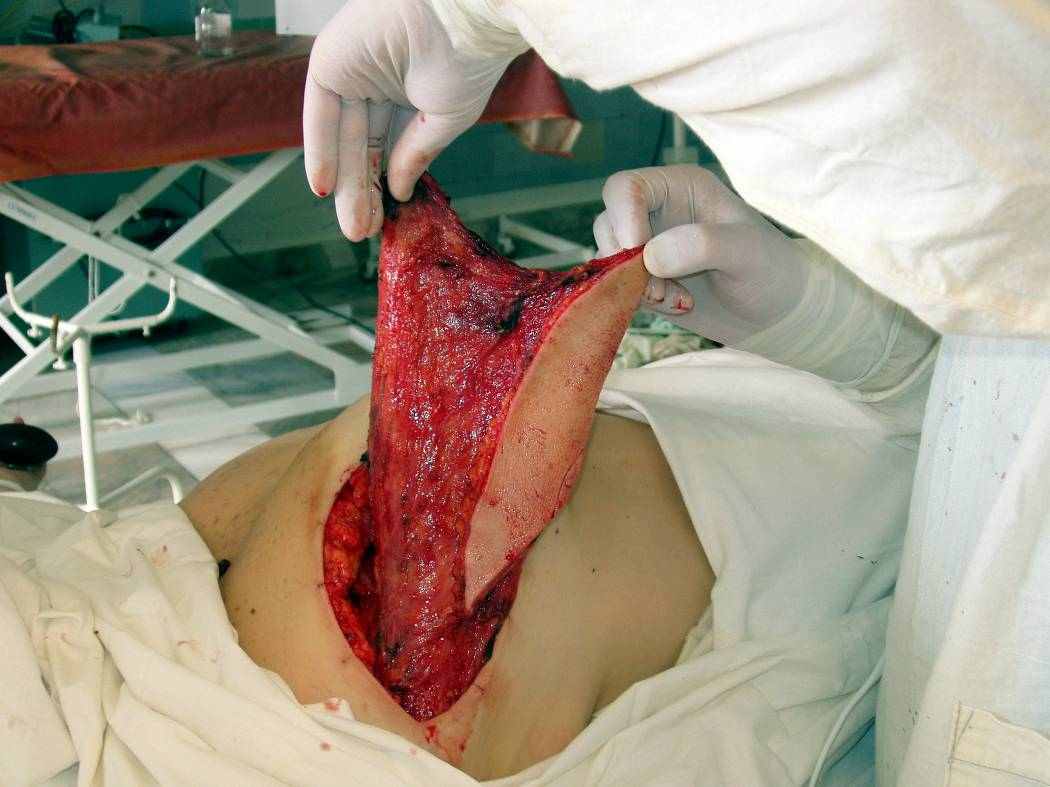
ис. 5.9. Пациентка Л., 39 лет, рак левой молочной железы pT2N1M0, 2b ст.: а – мобилизованный сТДЛ проведен в подкожном тоннеле через подмышечную область в рану молочной железы; б, в – вид пациентки через 1,5 мес. после операции.
Р


г
д
ис. 5.9. (продолжение). Пациентка Л., 39 лет, рак левой молочной железы pT2N1M0, 2b ст.: г – вид пациентки через 1,5 мес. после операции; д – вид донорского места.
Клинический пример № 8. Использование TRAM-лоскута.
Пациентка C., 37 лет, поступила в отделение маммологии Иркутского областного онкологического диспансера с жалобами на опухоль левой молочной железы. Выставлен диагноз: рак левой молочной железы T2N0M0, 2а ст., 3 кл. гр. (см. главу 4, клинический пример № 5). Объем молочной железы – 650 см3. Объем опухоли – 12,5 см3. Расчетный объем удаляемого фрагмента – 686,4 см3. Отношение объема удаляемого фрагмента к объему молочной железы 105,6 %, что является показанием к мастэктомии.
Для выполнения объема железы в 650 см3 решено использовать TRAM-лоскут. После проведения двух курсов ПХТ по CMF ей выполнена операция: подкожная мастэктомия слева без сохранения САК с одномоментной пластикой TRAM-лоскутом. Лоскут мобилизован в свободном варианте. Размещен на грудной клетке и отформирован.
Р
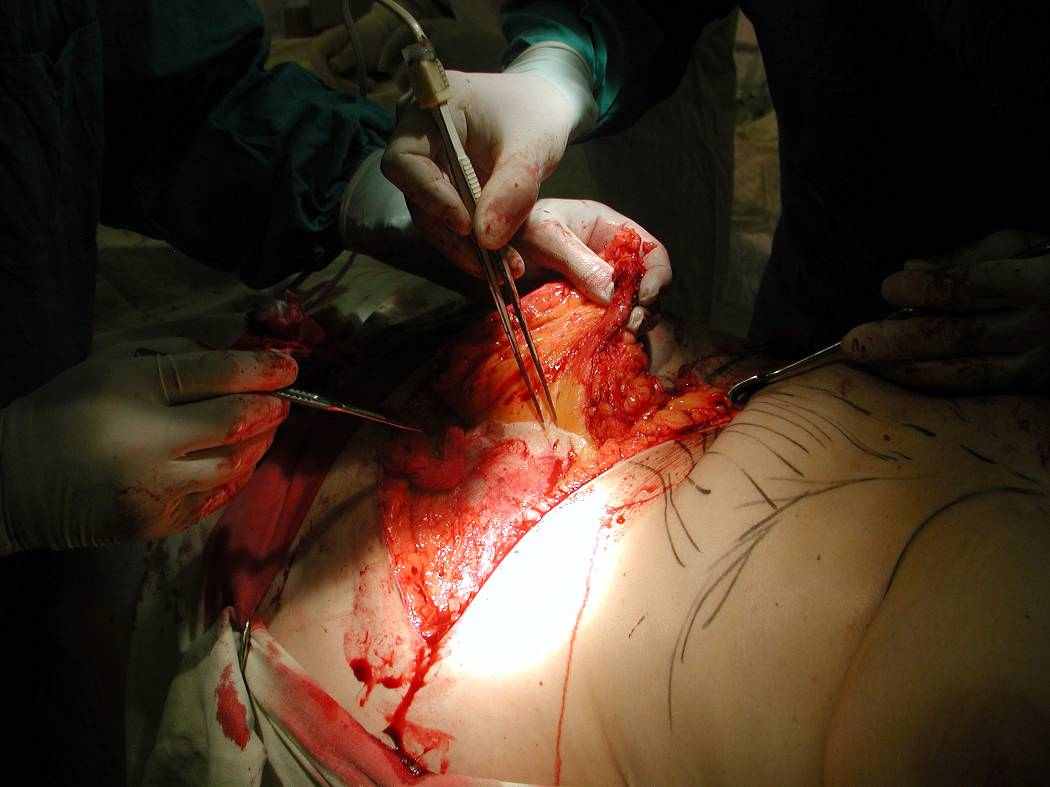 ис. 5.10. Этап мобилизации TRAM-лоскута.
ис. 5.10. Этап мобилизации TRAM-лоскута.Между питающими сосудами TRAM- лоскута (нижние эпигастральные) и сосудами подмышечной области (торакодорзальные) наложены анастомозы.
В послеоперационном периоде без особенностей.
Пациентка наблюдается 96 мес. Данных за прогрессирование заболевания нет (см. рис. 4.20 а, б, в).
В этом клиническом примере объем молочной железы среднего размера после мастэктомии был восполнен TRAM-лоскутом.
Клинический пример № 9. Использование м ТДЛ.
Пациентка Р., 56 лет (см. главу 4, клинический пример № 6).
Диагноз: рак правой молочной железы T2N0M0, 2а ст.
Объем молочной железы на момент обследования – 560 см3. Объем опухоли – 16,4 см3. Расчетный объем удаляемого фрагмента – 546 см3. Отношение объема удаляемого фрагмента к объему молочной железы 97,5 %, что является показанием к мастэктомии. Для реконструкции молочной железы в данном случае был выбран мТДЛ.
Пациентке выполнена подкожная мастэктомия слева с сохранением САК.
В состав лоскута вошли все перечисленные ранее компоненты: фрагмент кожи спины (выполнена его деэпителизация); широчайшая мышца спины; участок подкожной жировой клетчатки, располагающейся над широчайшей мышцей спины; часть лопаточного апоневроза с покрывающей его подкожной жировой клетчаткой; дистальный фрагмент трапециевидной мышцы (рис. 5.11 а). Донорская рана на спине ушита послойно без натяжения. Сформированный комплекс тканей проведен в подкожном тоннеле через подмышечную область в рану после мастэктомии. И затем было выполнено формирование из лоскута подобия молочной железы (рис. 5.11 б).
Р


а
б
ис. 5.11. а – вид мТДЛ перемещенного в ложе железы. Кожный фрагмент деэпителизирован. б – формирование из мТДЛ подобия молочной железы.
В послеоперационном периоде без особенностей. После операции проведено 4 курса по ПХТ по CAF. Пациентка наблюдается более 6 лет. Признаки болезни отсутствуют (см. рис. 4.21 а, б, в).
У этой пациентки дефицит тканей, образовавшийся после удаления молочной железы среднего размера, был одномоментно заполнен мТДЛ.
Отсроченная пластика проведена у 30 пациенток. У 11 из них проведение дооперационной химиолучевой терапии не позволило выполнить одномоментную реконструкцию железы. Остальные пациентки отказались от одномоментной пластики при выполнении онкологической операции на молочной железе. У всех пациенток данной группы с учетом объема опухоли и объема железы была выполнена мастэктомия. Поэтому при отсроченной пластике в нашем исследовании наиболее востребованным был TRAM лоскут как самый объемный (в 25 случаях из 30). В четырех случаях использовался мТДЛ, в одном случае использовался экспандер/имплантат молочной железы типа Becker (табл. 5.4).
Таблица 5.4
Отсроченные реконструктивные операции
| Метод реконструкции | n | % |
| мТДЛ | 4 | 13,3 |
| TRAM | 25 | 83,4 |
| Силикон | 1 | 3,3 |
| Всего | 30 | 100 |
Дополнительные операции для улучшения эстетического результата часто являются необходимой составляющей любого реконструктивного вмешательства. В нашем опыте их потребовалось 29, т.е. практически у каждой четвертой пациентки (табл. 5.5). Большая часть подобных операций выполнена после отсроченного варианта – у 70 % пациенток. И только в 10,3 % случаях коррекция эстетического результата потребовалась при одномоментном варианте реконструкции.
Таким образом, применение отсроченной пластики сопряжено с достоверно большей частотой применения дополнительных операций для улучшения эстетического результата по сравнению с одномоментной пластикой (χ2 = 39,4, p < 0,0001).
Таблица 5.5
Дополнительные операции для улучшения эстетического результата
у больных РМЖ
| Операции | Варианты операций по времени проведения | Всего n = 108 | ||
| Одномоментно n = 78 | Отсроченно n = 30 | n | % | |
Пластика соска | 2 | 5 | 7 | 6.5 |
| Мастопексия противоположной железы | 1 | 3 | 4 | 3.3 |
| Редукционная маммопластика | 1 | 4 | 5 | 4.6 |
| Коррекция послеоперационного рубца | 2 | 4 | 6 | 5.5 |
| Липосакция лоскута | 1 | 3 | 4 | 3.3 |
| Формирование субмаммарной складки | - | 2 | 2 | 1.8 |
| Удаление жирового некроза TRAM-лоскута. Пластика мТДЛ | 1 | - | 1 | 0.9 |
| Итого | 8 (10,3 %) | 21 (70 %) | 29 | 26.9 |
На семи реконструированных железах выполнена пластика соска. В 6 случаях проводилась коррекция послеоперационного рубца. Вмешательство на противоположной железе выполнялось у 9 пациенток (в 4 случаях мастопексия и в 5 – редукционная маммопластика), проведена липосакция четырех лоскутов. В одном случае проведено удаление жирового некроза TRAM-лоскута с пластикой мТДЛ. В двух случаях по специально разработанной нами методике выполнено формирование субмаммарной складки.
Один из недостатков отсроченного варианта реконструкции заключается в сглаженности нижнего контура созданной молочной железы.
Нами предложен оригинальный способ формирования субмаммарной складки («Способ формирования субмаммарной складки» патент РФ № 2355331), который осуществляется следующим образом: до операции производят разметку будущей субмаммарной складки при вертикальном положении пациентки, при этом разметка выполняется на 1,5–2 см выше, чем противоположная. На 2 см выше и ниже разметки размечается зона липосакции. Затем на операционном столе выполняют агрессивную липосакцию от кожи до глубокой фасции в области разметки изогнутой канюлей 3–4 мм. После этого в проекции субмаммарной складки из нескольких доступов длиной не более 2 см обнажают плотные подлежащие ткани (фасцию, надкостницу) и фиксируют кожу к этим тканям погружными швами нерассасывающимся шовным материалом (пролен 2-3/0). Завершают формирование субмаммарной складки послойным ушиванием доступов (викрил, монокрил 4/0) (рис. 5.12).
Р
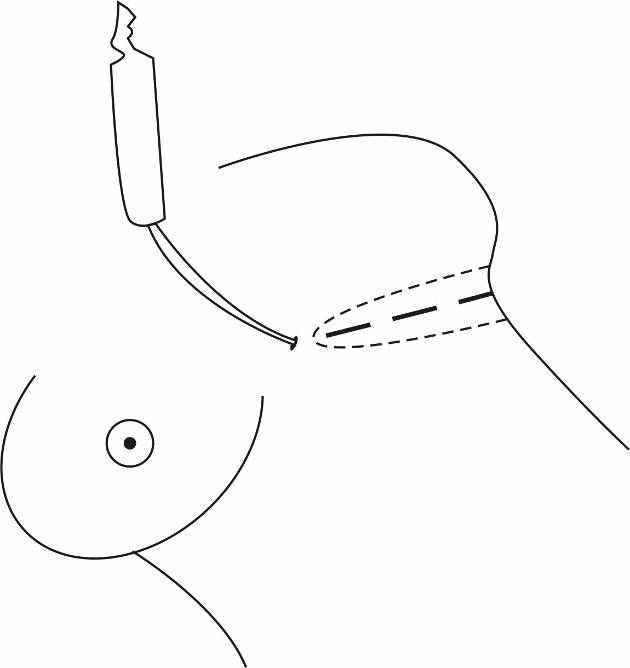 ис. 5.12. Схема формирования субмаммарной складки.
ис. 5.12. Схема формирования субмаммарной складки.Клинический пример № 10. Формирование субмаммарной складки.
Пациентка М., 50 лет, поступила с жалобами на отсутствие левой молочной железы. Из анамнеза: пациентке была выполнена мастэктомия 3 года назад по поводу рака левой молочной железы, 2 ст., T2N0M0.
Объем молочной железы – 560 см3. Объем опухоли – 16,4 см3. Расчетный объем удаляемого фрагмента – 546 см3. Отношение объема удаляемого фрагмента к объему молочной железы 97,5 %, что явилось показанием к мастэктомии. От выполнения одномоментной пластики молочной железы пациентка отказалась. После операции проведено 4 курса адъювантной ПХТ по FAC.
ПГЗ 8056-59/02 опухоль 3,5 × 3 × 3 см протоковый инфильтративный рак, 2 ст. злокачественности, метастазов опухоли в региональные лимфатические узлы нет.
После комплексного обследования, которое показало отсутствие генерализации процесса, пациентке выполнена отсроченная пластика левой молочной железы ротационным ТRАМ-лоскутом.
Послеоперационный период протекал без осложнений.
Далее для улучшения эстетического результата выполнялась коррекция послеоперационного рубца и формирование субмаммарной складки по разработанной методике. Затем через 3 месяца – мастопексия справа по Лежур и пластика САК слева по Литлю (рис. 5.13).
После отсроченной пластики TRAM-лоскутом у этой пациентки потребовался целых ряд дополнительных операций, среди которых выполнялось формирование субмаммарной складки (рис. 5.13 г,д).
Р
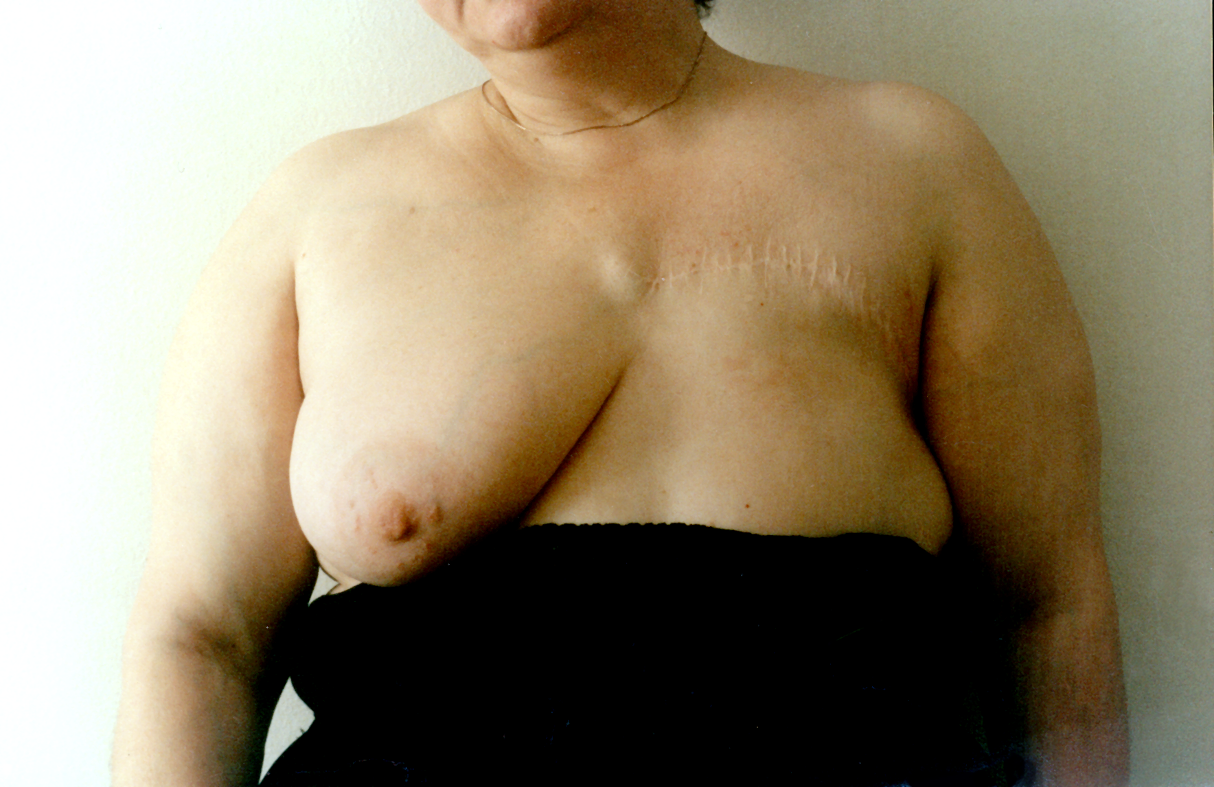
а
ис. 5.13. Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: а – вид до операции.
Р
б
в

 ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: б – вид во время операции после иссечения рубца и мобилизации TRAM-лоскута в ротационном варианте; в – вид пациентки в конце операции.
ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: б – вид во время операции после иссечения рубца и мобилизации TRAM-лоскута в ротационном варианте; в – вид пациентки в конце операции. Р
г
д

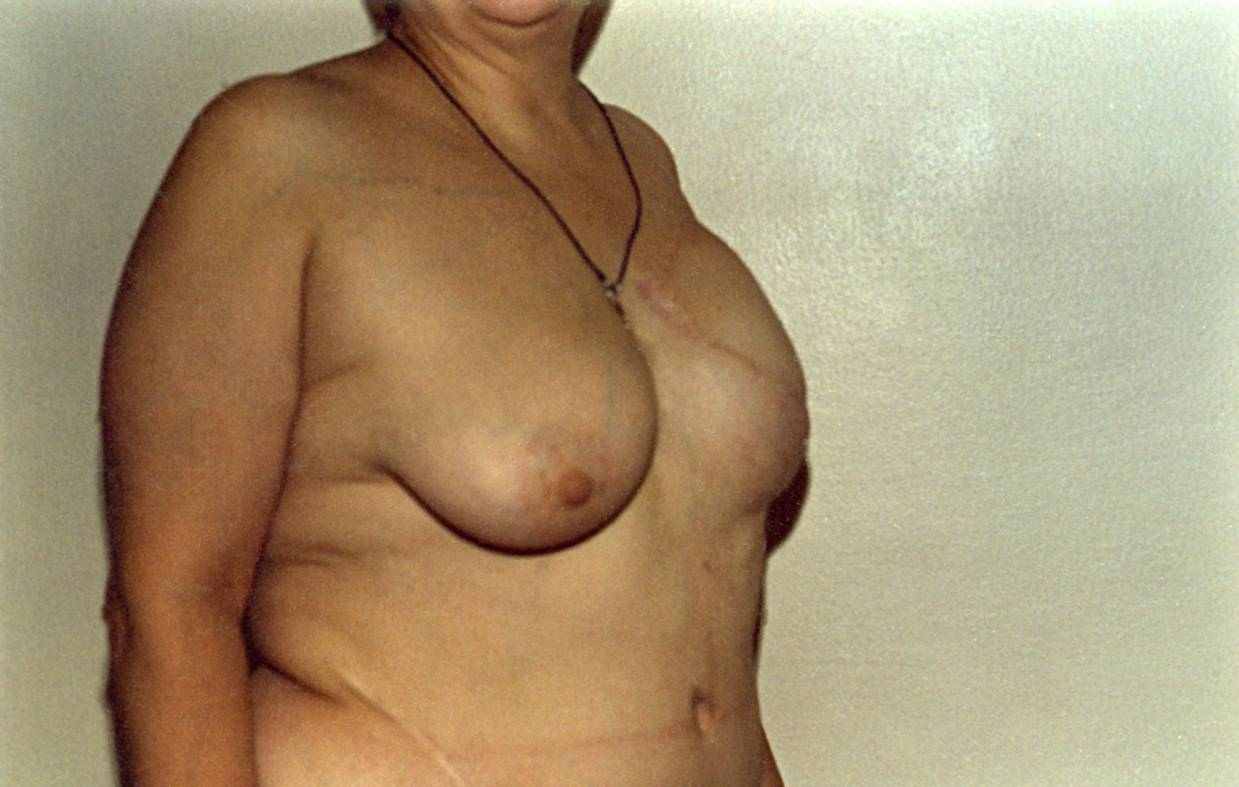 ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: г – пациентка до формирования субмаммарной складки; д – пациентка после формирования субмаммарной складки.
ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: г – пациентка до формирования субмаммарной складки; д – пациентка после формирования субмаммарной складки. Р
е
ж

 ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: е, ж – вид после окончания реконструкции через 2 года 2 месяца.
ис. 5.13. (продолжение). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: е, ж – вид после окончания реконструкции через 2 года 2 месяца. Р
з
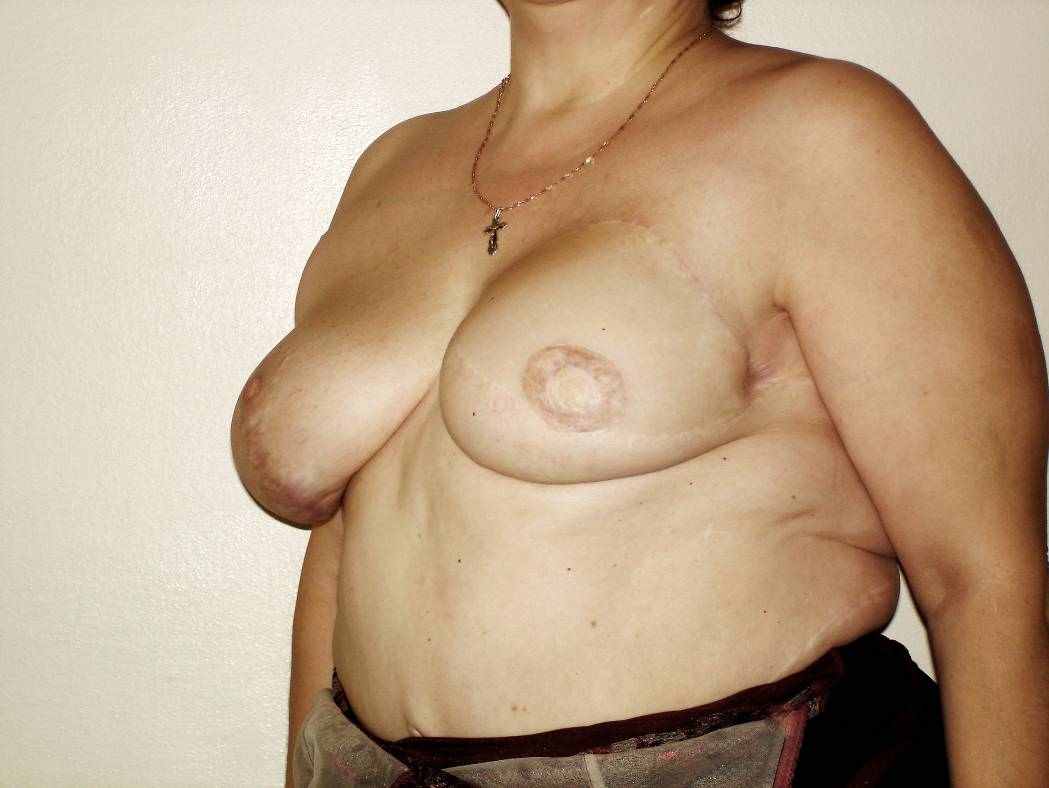 ис. 5.13. (окончание). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: з – вид после окончания реконструкции через 2 года 2 месяца.
ис. 5.13. (окончание). Пациентка М., 50 лет. Рак левой молочной железы, T2N0M0, 2 ст.: з – вид после окончания реконструкции через 2 года 2 месяца. Нами проведен анализ послеоперационных осложнений при использовании различных способов пластики МЖ. Значимые осложнения при пластике молочной железы, потребовавшие повторного оперативного вмешательства, возникли в 14 случаях (табл. 5.6).
Наибольшая частота осложнений отмечена у пациенток при применении пластики с использованием силиконовых изделий (40,0 %) и TRAM-лоскута – 25 % в данной группе. Осложнения после применения мТДЛ встретились в 3 случаях (6,1 %), что в 4 раза реже, чем при использовании TRAM – лоскута и более, чем в 6 раз реже, чем при использовании силиконовых изделий.
Выявлено, что при применении мТДЛ частота осложнений, потребовавших применения повторных операций, значимо не отличается от частоты осложнений при применении сТДЛ (2 = 0, p > 0,05), при этом она значительно ниже, чем при использовании ТRАМ лоскута (2 = 4,64, p = 0,03).
Таблица 5.6
Осложнения при пластике молочной железы, потребовавшие повторных операций
| Виды осложнений | Варианты операций по времени проведения | Количество осложнений | |||||
| мТДЛ (n = 49) | сТДЛ (n = 10) | TRAM (n = 36) | ОПР (n = 8) | Силикон (n = 5) | Всего (n = 108 ) | ||
| Полный некроз лоскута | Одномоментно | 1 | – | 1 | – | – | 2 |
| Отсроченно | – | – | 4 | – | – | 4 | |
| Крово-течение | Одномоментно | 1 | – | – | – | – | 1 |
| Отсроченно | – | – | 1 | – | – | 1 | |
| Нагноение | Одномоментно | 1 | – | – | – | 2 | 3 |
| Отсроченно | – | – | 1 | – | – | 1 | |
| Тромбоз микроанастомозов | Одномоментно | – | – | – | – | – | – |
| Отсроченно | – | – | 2 | – | – | 2 | |
| Итого | 3 (6,1 %) | – | 9 (25,0 %) | – | 2 (40,0 %) | 14 (13,0 %) | |
