Книга первая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского
| Вид материала | Книга |
- Книга вторая Дж. Эдвард Морган-мл. Мэгид С. Михаил Перевод с английского, 11784.54kb.
- А. Конан-Дойль новоеоткровени е перевод с английского Йога Рàманантáты, 2314.23kb.
- Copyright Сергей Александровский, перевод с английского Email: navegante[a]rambler, 619.61kb.
- "книга непрестанности осириса " 177, 7373.41kb.
- Н. М. Макарова Перевод с английского и редакция, 4147.65kb.
- Трудового Красного Знамени гупп детская книга, 2911.61kb.
- Трудового Красного Знамени гупп детская книга, 2911.77kb.
- Перевод с английского: Ф. Веревин, А. и Г. Беляевы, Л. Морозова, 12365.61kb.
- Уайнхолд Б., Уайнхолд Дж. У 67 Освобождение от созависимости / Перевод с английского, 11462.2kb.
- Малиновской Софьи Борисовны Специальность: журналистика Специализация: художественный, 969.08kb.
Блокада поясничного отдела симпатического ствола
А. Показания. Блокада показана при тазовых болях и болях в нижней конечности, а также в некоторых случаях при заболевании периферических артерий.
Б. Анатомия. Поясничный отдел симпатического ствола состоит из 3-5 пар узлов, является продолжением грудного отдела, а также отдает ветви к тазовому сплетению и его узлам. По сравнению с грудными симпатическими узлами, поясничные узлы занимают более переднемедиальное положение по отношению к телам позвонков и располагаются спереди от большой поясничной мышцы и ее фасции. Сзади справа от поясничных узлов располагается нижняя полая вена, а слева — край аорты.
В. Методика выполнения блокады. Наиболее распространенной является двухигольная методика, выполняемая на уровне позвонков lII и lIV в положении больного на боку или на животе (рис. 18-15). Иглу вводят на уровне верхнего края остистого отростка и направляют выше или сразу латеральнее поперечного отростка (в зависимости
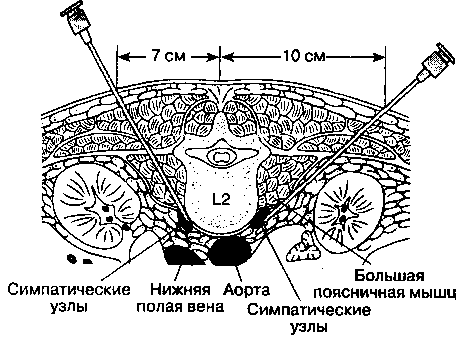
Рис. 18-15. Поясничная симпатическая блокада
от расстояния от срединной линии). Рентгеноскопический контроль с использованием рентгено-контрастного препарата повышает вероятность успешной блокады и снижает риск развития осложнений.
Г. Осложнения. Осложнения включают непреднамеренную инъекцию в сосуд (в нижнюю полую вену, аорту, поясничные сосуды) и блокаду соматических нервов поясничного сплетения.
Блокада подчревного сплетения
А. Показания. Блокада подчревного сплетения показана для лечения тазовой боли, резистентной к эпидуральной анестезии на поясничном уровне, а также к каудальной анестезии. Подчревное сплетение содержит не только эфферентные, но и афферентные вегетативные волокна. Эту блокаду обычно выполняют при раке шейки и тела матки, мочевого пузыря, предстательной железы и прямой кишки. Кроме того, блокада может быть эффективна у женщин, страдающих от хронических тазовых болей неопухолевой природы.
Б. Анатомия. Подчревное сплетение содержит не только постганглионарные волокна, происходящие из поясничных симпатических узлов, но также и висцеральные чувствительные волокна из шейки и тела матки, мочевого пузыря, предстательной железы и прямой кишки. Верхнее подчревное сплетение расположено слева от срединной линии на уровне тела пятого поясничного позвонка ниже бифуркации аорты. Волокна верхнего подчревного сплетения формируют левую и правую ветви и спускаются к тазовым органам как правое и левое нижнее подчревное сплетение (тазовое сплетение). Нижнее подчревное сплетение дополнительно получает преганглионарные парасимпатические волокна от корешков спинномозговых нервов S2-S4.
В. Методика выполнения блокады. Больной лежит на животе, иглу длиной 15 см вводят в 7 см латеральнее межостистого промежутка LIV-LV. Иглу продвигают медиально и каудально под углом 45°, так чтобы при рентгенологическом контроле она располагалась непосредственно над поперечным отростком позвонка LV. Окончательное положение иглы — над межпозвонковым диском между LV и SI, в пределах 1 см от тела позвонка при рентгеноскопии в переднезадней проекции. Введение рентгеноконтрастного препарата подтверждает правильное положение иглы в забрюшинном пространстве; вводят 8-10 мл раствора анестетика.
Г. Осложнения. К осложнениям относятся непреднамеренное внутрисосудистое введение анестетика, а также преходящая дисфункция кишечника и мочевого пузыря.
Внутривенная регионарная симпатическая блокада
Применение гуанетидина (20-40 мг) при выполнении блокады по Биру (см. гл. 17) позволяет проводить избирательную симпатическую блокаду конечности. Чтобы предотвратить ощущение жжения, вводят 10 мл 0,5 % раствора лидокаина. Турникет накладывают на проксимальные отделы конечности и оставляют в заполненном состоянии не менее чем на 20 мин. Гуанетидин вызывает истощение запасов норадреналина и ингибирует его обратный нейрональный захват в терминалях постганг-лионарных нейронов. Селективная симпатическая блокада сохраняется 3-7 дней. Преждевременное снятие турникета влечет за собой гипотонию, бра-дикардию, отеки, диарею и тошноту. Вместо гуанетидина можно использовать резерпин (1-1,5 мг) и бретилиум (5 мг/кг). При нарушениях гемостаза внутривенная регионарная симпатическая блокада является безопасной альтернативой стандартным методикам симпатической блокады.
Дифференциальная центральная блокада и блокада плечевого сплетения
Дифференциальная фармакологическая блокада предназначена для разграничения соматической, симпатической и психогенной боли. Методика основана на различной чувствительности нервных волокон к местным анестетикам (см. гл. 14). Самыми чувствительными к анестетикам являются преганглионарные симпатические волокна (типа В), затем следуют волокна болевой чувствительности (типа С и А5), соматосенсорные (Аβ) и, наконец, наиболее резистентные к действию анестетиков двигательные волокна (Aα). Применение анестетиков в различных концентрациях позволяет обеспечить селективную блокаду одних типов волокон при сохранении проведения по другим. Вместе с тем существуют доводы против дифференциальной блокады: во-первых, критическая концентрация, при которой происходит блокада симпатических волокон, значительно варьируется у разных больных, а во-вторых, блокада зависит не только от размера волокон, но и от продолжительности контакта нерва с анестетиком, а также от частоты проведения импульсов по нерву. Поэтому большинство врачей не применяют дифференциальную блокаду, хотя некоторые продолжают ее использовать в диагностике болевых синдромов. Спинномозговую и эпидуральную анестезию (см. гл. 16) применяют для оценки боли в животе и нижних конечностях, а блокаду плечевого сплетения (см. гл. 17) — для оценки боли в верхней конечности.
Дифференциальная центральная (нейроакси-альная) блокада состоит в последовательном введении четырех растворов, причем концентрация анестетика в каждом последующем выше, чем в предыдущем (табл. 18-8). После инъекции каждого раствора оценивают динамику интенсивности боли, симптомы симпатической блокады (снижение артериального давления), чувствительность к болевым раздражителям (уколы иглой) и легким прикосновениям, а также двигательную функцию. Если боль исчезает после введения солевого раствора, то она либо является психогенной (если развивается длительный аналитический эффект), либо налицо эффект плацебо (если возникает лишь кратковременная аналгезия). Если боль исчезает при избирательной симпатической блокаде, то она опосредована симпатическими волокнами. Если боль исчезает только при соматосенсорной блокаде, то она опосредована соматическими волокнами. И наконец, если боль сохраняется и после наступления двигательной блокады, то она имеет центральное (супраспинальное) происхождение или является психогенной.
Стандартная дифференциальная блокада, особенно эпидуральная, требует значительных затрат времени, что является существенным недостатком. В этой связи многие врачи модифицируют методику, ограничиваясь двумя инъекциями: вначале вводят раствор плацебо, а затем анестетик в максимальной концентрации (5 % гипербарический раствор прокаина интратекально; 2 % раствор хло-ропрокаина или 2 % раствор лидокаина эпидуралъно). Больного также обследуют после каждой инъекции, но при этой модификации определяют корреляцию боли с восстановлением двигательной, сенсорной или симпатической функции.
ТАБЛИЦА 18-8. Растворы для дифференциальной центральной (нейроаксиальной) блокады
| Характеристика раствора | Спинномозговая блокада | Эпидуральная блокада1 |
| Плацебо Блокада симпатических волокон Блокада соматических волокон Блокада всех типов волокон | Физиологический раствор 0,25 % раствор прокаина 0,5 % раствор прокаина 1 % раствор прокаина | Физиологический раствор 0,5 % раствор лидокаина 1 % раствор лидокаина 2 % раствор лидокаина |
1 Вместо лидокаина можно использовать хлоропрокаин.
Нейролитическая блокада
Нейролитические блокады показаны при сильной, неустранимой боли, обусловленной злокачественной опухолью. Иногда их выполняют при рефрактерной невралгии и, значительно реже,— при заболеваниях периферических артерий. Нейролитические блокады влекут за собой значительный риск развития осложнений, поэтому отбор больных должен быть особенно строгим. Более того, эффект блокады временный: спустя недели или месяцы рецидивирует первоначальная боль или возникает новая (центрального происхождения). Временную деструкцию нервного волокна или узла можно обеспечить с помощью инъекции этанола или фенола. Эти химические соединения не обладают избирательностью и в равной мере воздействуют на висцеральные, чувствительные и двигательные волокна. Этанол (50-100 %) вызывает экстракцию фосфолипидов из мембраны и преципитацию липопротеинов в аксонах и шванновских клетках, в то время как фенол (6-12 %) приводит к коагуляции белков. Во время введения этанол вызывает сильную боль. Для блокады периферических нервов этанол можно использовать неразведенным, тогда как для симпатической блокады, когда необходимы большие объемы, его вводят в сочетании с бупивакаином в соотношении 1: 1. Во время введения ни водный раствор фенола (6-8 %), ни его раствор в глицерине не вызывают боли. Используют 12 % раствор фенола в рентгено-контрастном препарате. Криоаналгезия — еще одна методика временной нейролитической блокады (см. гл. 24). В некоторых центрах применяют чрес-кожную радиочастотную коагуляцию нервов.
Любой нейролитической блокаде должна предшествовать диагностическая блокада с применением местных анестетиков. Диагностическая блокада позволяет выявить механизм боли и прогностически оценить эффективность нейролитической блокады. Непосредственно перед введением нейролитического препарата следует снова ввести местный анестетик. Целесообразно использовать рентгеноскопию или компьютерную томографию с применением рентгеноконтрастных препаратов. После введения нейролитического препарата иглу вначале нужно промыть физиологическим раствором или продуть воздухом, а только потом извлечь: этот прием позволяет предупредить повреждение поверхностных тканей.
Нейролитические методики чаще всего используют для блокады чревного сплетения, поясничного отдела симпатического ствола и надчревного сплетения при злокачественных опухолях, но могут применять и для блокады соматических и черепных нервов, и даже для центральной блокады. Большинство специалистов предпочитает применять этанол для блокады чревного сплетения, а фенол — для блокады поясничного отдела симпатического ствола. При субарахноидальной нейролитической блокаде вводят очень малые объемы препарата (0,1 мл). Больному придают такое положение, чтобы в спинномозговом канале препарат оставался на уровне введения, а его воздействие ограничивалось зоной задних рогов спинного мозга. Следует учитывать, что этанол является гипо-барическим раствором, а раствор фенола в глицерине — гипербарическим.
Фармакотерапия
Для устранения болевого синдрома используют такие лекарственные препараты, как ингибиторы циклооксигеназы, опиоиды, антидепрессанты, нейролептики, кортикостероиды и противосудо-рожные. Следует также отметить системное применение местных анестетиков. Ингибиторы циклооксигеназы рассматриваются ниже — в разделе, посвященном послеоперационной боли. Опиоиды используют главным образом для лечения острой среднеинтенсивной и сильной боли, а также при боли, обусловленной злокачественными новообразованиями; эта группа препаратов рассматривается в гл. 8 и в настоящей главе.
Антидепрессанты
Дозы этих препаратов, применяемые для аналгезии, ниже, чем дозы, дающие антидепрессивный эффект. Оба эффекта обусловлены блокадой пресинапти-ческого захвата серотонина, норадреналина или обоих нейромедиаторов (см. также гл. 27). Препараты, которые эффективно блокируют обратный захват серотонина, обладают наиболее выраженной аналитической активностью. Антидепрессанты показаны главным образом при нейропатической боли, например при постгерпетической невралгии и диабетической нейропатии. Они потенцируют действие опиоидов и нормализуют сон.
Препараты отличаются главным образом своими побочными эффектами (табл. 18-9), которые обусловлены следующими механизмами: 1) блокада м-холинорецепторов вызывает сухость во рту (ксеростомию), нарушения аккомодации, задерж-
ТАБЛИЦА 18-9. Антидепрессанты
| Препарат | Блокада обратного захвата норадреналина | Блокада обратного захвата серотонина | Седатив-ный эффект | Антихолин- ергическое действие | Ортостати- ческая гипо- тония (выра- женность) | Период полу- жизни (ч) | Суточная доза (мг) |
| | | | | ||||
| Дезипрамин (норпрамин) | ++++ | +++ | Слабый | Слабое | Слабая | 12-50 | 50-300 |
| Нортриптилин (памелор) | ++ | +++ | Умеренный | Умеренное | Слабая | 15-90 | 40-150 |
| Имипрамин (тофранил) | ++ | ++++ | Умеренный | Умеренное | Высокая | 6-20 | 75-400 |
| Амитриптилин (эливел) | ++ | ++++ | Сильный | Сильное | Умеренная | 30-40 | 25-300 |
| Тразодон (дезирел) | + | +++ | Умеренный | Слабое | Умеренная | 3-9 | 150-400 |
| Флуоксетин (прозак) | + | ++++ | Слабый | Умеренное | Слабая | 160-200 | 20-80 |
| Доксепин (синекван) | + | ++ | Сильный | Умеренное | Умеренная | 8-24 | 75-400 |
ку мочи и запоры; 2) блокада гистаминовых рецепторов (H1 и H2) дает седативный эффект и вызывает повышение рН в желудке; 3) блокада α-адрено-рецепторов проявляется ортостатической гипотонией; 4) хинидиноподобный эффект (особенно у амитриптилина).
Все антидепрессанты подвергаются интенсивному метаболизму в печени (так называемый эффект первого прохождения) и в значительной степени связываются белками. Препараты в большинстве своем липофильны и имеют большой объем распределения. Период полусуществования в фазе элиминации варьируется от 1 до 4 дней. Многие антидепрессанты имеют активные метаболиты.
Нейролептики
Некоторые врачи считают, что нейролептики позволяют устранить рефрактерную нейропатичес-кую боль. Препараты особенно эффективны при выраженном возбуждении и психозе. Наиболее часто используются флюфеназин, галоперидол, хлор-промазин и перфеназин. Механизм действия обусловлен блокадой дофаминергических рецепторов в мезолимбической области. К сожалению, блокада дофаминергических рецепторов нигростриарной системы служит причиной экстрапирамидных расстройств, которые проявляются маскообразным выражением лица, семенящей походкой, симптомом "зубчатого колеса" и брадикинезией. У некоторых больных развиваются острые дистонические реакции в виде окулогирного криза и кривошеи. К медленно развивающимся побочным эффектам относят акатизию (двигательное беспокойство) и позднюю дискинезию (непроизвольные хореоа-тетоидные движения языка, сосательные движения, дистонические движения туловища). Подобно антидепрессантам, большинство нейролептиков оказывают антигистаминное, антихолинергичес-кое (блокада м-холинорецепторов) и антиадренер-гическое (блокада α-адренорецепторов) действие.
Противосудорожные препараты
Противосудорожные препараты показаны при нейропатической боли, особенно при невралгии тройничного нерва. Они способны подавлять спонтанную нейрональную импульсацию, которая играет главную роль в генезе нейропатических расстройств. Наиболее часто используются фенитоин, карбамазепин, вальпроевая кислота и клоназепам (табл. 18-10, а также гл. 27). Все препараты в значительной степени связываются белками и имеют относительно продолжительный период полусуществования. Карбамазепину свойственна медленная и непредсказуемая абсорбция, что требует мониторинга его концентрации в крови. Побочные эффекты рассмотрены в гл. 27.
Кортикостероиды
Кортикостероиды широко применяются при лечении боли, потому что они дают противовоспалительный и, возможно, аналитический эффект. Путь введения — местно, внутрь или парентерально (внутривенно, подкожно, интрабурсально, внутрисуставно, эпидурально). В табл. 18-11 представлены наиболее часто употребляемые кортикостероиды, которые различаются по мощности основного эффекта, относительной глюко-кортикоидной и минералокортикоидной активности, а также по продолжительности действия. Увеличение дозы и удлинение курса лечения усугубляют выраженность побочных эффектов. Чрезмерная глюкокортикоидная активность проявляется артериальной гипертонией, гипергликемией, повышенной восприимчивостью к инфекциям, пептическими язвами, остеопорозом, асептическим некрозом головки бедра, прокси-мальной миопатией, катарактой и, редко,— психозом. Больной может также приобретать характерную для синдрома Кушинга внешность (см. гл. 36). Чрезмерная минералокортикоидная активность проявляется задержкой натрия, гипокалиемией, а также может провоцировать развитие сердечной недостаточности.
ТАБЛИЦА 18-10. Противосудорожные препараты, применяемые для лечения боли
| Противосудорожный препарат | Период полужизни (ч) | Суточная доза (мг) | Терапевтическая концентрация (мкг/мл) |
| Фенитоин (дилантин) Карбамазепин (тегретол) Клоназепам (клонапин) Габапентин (нейронтин) Вальпроевая кислота (депакин) | 22 10-20 18-30 5-7 6-16 | 200-600 200-1200 1-18 900-1800 750-1250 | 10-20 4-12 0,01-0,08 Неизвестна 50-100 |
Системное применение местных анестетиков
При нейропатической боли местные анестетики (см. гл. 14) иногда вводят внутривенно. Они вызывают седацию и центральную аналгезию; аналитический эффект часто превышает по времени "фар-макокинетический профиль" местного анестетика и прерывает "болевой цикл". Чаще всего применяют лидокаин, прокаин и хлоропрокаин. Эти препараты вводят либо в/в струйно медленно, либо в виде длительной инфузии. Лидокаин вводят в/в в течение 5-30 мин, общая доза составляет 1-5 мг/кг. Прокаин в дозе 200-400 мг вводят в/в в течение 1 -2 ч. Хлоропрокаин (1 % раствор) вводят в виде длительной инфузии в дозе 1 мг/(кг X мин), общая доза составляет 10-20 мг/кг. Необходимый объем мониторинга: ЭКГ, артериальное давление, частота и глубина дыхания, уровень сознания; необходимо иметь рядом с больным готовое к работе реанимационное оборудование. Возникновение таких симптомов интоксикации, как шум в ушах, появление пелены перед глазами, выраженная седация или нистагм, требует уменьшения скорости инфузии или ее полного прекращения.
Если при боли неэффективны противосудо-рожные препараты, но она может быть устранена при системном введении местных анестетиков, то высока вероятность успеха при длительном лечении пероральными антиаритмическими препаратами. Используют токаинид и мексилетин; их применение сочетано с риском развития опасных для жизни осложнений и потому требует тщательного мониторинга концентрации в крови.
Вспомогательные методы лечения боли
Психотерапия
Лучше прочих специалистов психотерапевтическими методиками владеют психологи и психиатры. Выделяют когнитивную психотерапию, поведенческую психотерапию, методику биологической обратной связи, методику психической релаксации и гипноз. Когнитивная психотерапия основана на допущении, что отношение больного к боли может оказывать влияние на ее восприятие. Неадекватное отношение способствует усугублению страдания и инвалидизации. Навыками преодоления боли больные овладевают при индивидуальной или групповой психотерапии. Чаще всего используют методики отвлечения внимания и формирования образов. Поведенченская психотерапия основана на предположении, что поведение больного при хронической боли описывается бихевиористи-ческими концепциями. Положительное подкрепление (например, внимание супруга) приводит к аггравации боли, тогда как отрицательное подкрепление, наоборот, делает отношение к боли более адекватным. Врач выявляет особенности неадекватного поведения и пытается манипулировать подкрепляющими факторами. Методы подкрепления требуют сотрудничества со стороны медицинского персонала и семьи больного.
ТАБЛИЦА 18-11. Кортикостероиды1
| Препарат | Путь введения активность | Относительная глюкокортикоидная | Относительная минералокортикоидная активность | Эквивалентная доза (мг) жизни (ч) | Период полу |
| Гидрокортизон | В,П, M | 1 | 1 | 20 | 08-12 |
| Преднизон | в | 4 | 0,8 | 5 | 12-36 |
| Преднизолон | в, п | 4 | 0,8 | 5 | 12-36 |
| Метилпреднизолон (депо-медрол, солю-медрол) | в.п.м | 5 | 0,5 | 4 | 12-36 |
| Триамцинолон (аристокорт) | в.п.м | 5 | О | 4 | 12-36 |
| Бетаметазон (целестон) | В,П, M | 25 | О | 0,75 | 36-72 |
| Дексаметазон (декадрон) | в, п,м | 25 | о | 0,75 | 36-72 |
Примечание. В — Внутрь.
П — Парентерально (инъекции).
M — Местно. 1 Воспроизведено с изменениями. Из: Goodman and Gilman: The Pharmacologic Basis of Therapeutic, 8th ed., Pergamon, 1990.
Методика психической релаксации позволяет больному самостоятельно влиять на реакцию поведенческой и симпатической активации, обусловленной болевым стимулом. Чтобы добиться психической релаксации, чаще всего применяют последовательное расслабление мышц тела. Много общего в методике биологической обратной связи и гипнозе. Методика биологической обратной связи основана на предположении, что больные могут научиться управлять теми физиологическими параметрами, которые обычно не зависят от желания человека. Обучившись методике, больной может влиять на физиологические факторы, которые усугубляют боль (например, напряжение мышцы), а также вызывать реакцию расслабления и более эффективно применять навыки борьбы с болью. Чаще всего больных обучают управлять мышечным напряжением (электромиографическая биологическая обратная связь) и температурой (термическая биологическая обратная связь). Эффективность гипноза значительно варьируется. Гипноз (самогипноз) позволяет изменить восприятие боли с помощью концентрации внимания на других ощущениях, "перенесения" боли на иные участки тела, а также отвлечения от боли, сосредотачиваясь на постороннем предмете. У больных с хронической головной болью и заболеваниями опорно-двигательной системы наиболее эффективны методики психической релаксации.
Физиотерапия
Тепло и холод, устраняя мышечный спазм, могут давать аналгетический эффект. Кроме того, тепло уменьшает тугоподвижность суставов и увеличивает кровоток, тогда как холод вызывает вазокон-стрикцию и способствует уменьшению отека тканей. Аналгетический эффект тепла и холода может найти объяснение, по крайней мере частичное, в рамках шлюзовой теории проведения ноцицеп-тивного импульса (о ней говорилось ранее).
Поверхностное согревание может быть обеспечено контактным способом (горячее влажное обертывание, парафиновые ванны), конвекцией (гидротерапия) и лучевыми методиками (инфракрасное облучение). К методам глубокого теплового воздействия относят ультразвук, а также коротко- и микроволновую диатермию; они особенно эффективно устраняют боли, исходящие из глубокорасположенных суставов и мышц. Холод показан при боли, связанной с острой травмой и отеком. В отдельных случаях холод может устранить мышечный спазм. Для охлаждения используют холодное обертывание, массаж кусочками льда и охлаждающие аэрозоли (этилхлорид, фтор-метан).
Любая программа реабилитации больных с хронической болью должна включать физические упражнения. Программа ступенчатой нагрузки позволяет предотвратить тугоподвижность суставов, атрофию мышц и контрактуры — те состояния, которые провоцируют боль и вызывают нарушение функции.
Акупунктура
Акупунктура является вспомогательным методом лечения при хронической боли и особенно эффективна при хронических заболеваниях опорно-двигательного аппарата и головной боли. Акупунктура заключается во введении игл в отдельные точки на поверхности тела, которые располагаются вдоль условных линий — меридианов. Стимуляция состоит во вращении иглы или подаче на нее слабого электрического тока. Точки никак не накладываются на общепринятые анатомические ориентиры нервной системы. Хотя научная литература о механизме действия акупунктуры и ее роли в лечении боли противоречива, некоторые данные позволяют предположить, что акупунктурная стимуляция вызывает высвобождение эндогенных опиатов, потому что ее эффект устраняется налоксоном.
Электростимуляция
Электростимуляция нервной системы позволяет устранить острую и хроническую боль. Электрический стимул могут подавать чрескожно, из эпи-дурального пространства или через электроды, имплантированные в ЦНС.
Чрескожная электростимуляция
Чрескожная электростимуляция вызывает аналгезию путем стимуляции толстых афферентных волокон. Показания к чрескожной стимуляции — слабая и среднеинтенсивная острая боль, хроническая боль в пояснице, боль при артрите, нейропатическая боль. Шлюзовая теория проведения боли (см. выше) постулирует, что афферентный импульс, проходящий по толстым волокнам эпикритической чувствительности, конкурирует с импульсом, проходящим по тонким болевым волокнам. Альтернативная теория предполагает, что высокочастотная Чрескожная электростимуляция вызывает блокаду мелких афферентных волокон болевой чувствительности. При стандартной методике электроды накладывают в области тех дерма-томов, где ощущается боль, и периодически подают на них импульсы постоянного тока из генератора. Электростимуляцию назначают по 30 мин несколько раз в день. Применяют ток силой 10-30 мА, продолжительность импульса составляет 50-80 мкс (микросекунд), а частота — 80-100 Гц. Некоторые больные невосприимчивы к стандартной методике чрескожной электростимуляции, но реагируют на низкочастотную стимуляцию, где продолжительность импульса превышает 200 мкс, а частота < 10 Гц (длительность стимуляции — 5-15 мин). В отличие от стандартной методики, анал-гетический эффект низкочастотной электростимуляции устраняется налоксоном, что указывает на участие эндогенных опиатов.
Электростимуляция спинного мозга
Эту методику также называют стимуляцией задних столбов, так как аналгезия достигается путем непосредственной стимуляции толстых Ар-волокон в задних столбах спинного мозга. Вначале в эпидуральное пространство вводят временные электроды и подсоединяют их к внешнему генератору. Проводя электростимуляцию, оценивают ее влияние на боль. Если методика дает аналгетичес-кий эффект, то имплантируют постоянные электроды. Постоянный эпидуральный электрод вводят через подкожный туннель и подсоединяют к генератору, который установлен подкожно. Стимуляция спинного мозга особенно эффективна при ней-ропатических болях. К сожалению, у ряда больных эффективность данной методики со временем уменьшается.
Внутримозговая стимуляция
Стимуляция глубоких структур головного мозга показана при неустранимой боли, обусловленной злокачественными новообразованиями, и — реже — при неустранимой нейропатической боли, обусловленной неопухолевыми механизмами. Используя стереотаксические методики, электроды имплантируют следующим образом: при соматической боли (главным образом боли при злокачественных новообразованиях и боли в пояснице) — в центральное и околожелудочковое серое вещество; при нейропатической боли — в специфические чувствительные ядра таламуса. Наиболее серьезными осложнениями являются внутричерепное кровоизлияние и инфекция.
Послеоперационная боль
В соответствии с концепцией упреждающей анал-гезии (см. выше) лечение послеоперационной боли должно начинаться до операции. Результаты исследований показывают, что характер нейроэндо-кринной стрессовой реакции на хирургическую агрессию и боль зависит от методики анестезии. Так, регионарная анестезия, особенно эпидуральная (изолированная или сочетанная с общей анестезией), позволяет блокировать нейроэндокринную реакцию на хирургическое вмешательство (например, выброс кортизола) — при условии, что уровень сенсорной блокады при эпидуральной анестезии не ниже L1. Длительная регионарная анестезия с использованием катетера также обеспечивает надежную послеоперационную аналгезию. Межреберная и эпидуральная анестезия после торакаль-ных операций и вмешательств на верхнем этаже брюшной полости, кроме того, позволяют сохранить функции дыхания и способствуют ранней активизации. Эпидуральная и, возможно, спинномозговая анестезия снижают риск тромбоэмболии после операций на тазобедренном суставе, а также подавляют активацию свертывающей системы после вмешательств на сосудах. Лучше прочих специалистов с лечением послеоперационной боли справляются анестезиологи, потому что они владеют методиками регионарной анестезии и хорошо разбираются в фармакологии анальгетиков. Мнение о высоких затратах на лечение послеоперационной боли является несостоятельным — наоборот, согласно многим исследованиям, применение этих методов снижает летальность, риск осложнений и больничные издержки. Методы послеоперационной аналгезии включают назначение анальгетиков внутрь и парентерально, блокаду периферических нервов, центральную блокаду с применением местных анестетиков и опи-оидов, а также чрескожную электростимуляцию и физиотерапию. Выбор метода аналгезии определяется такими факторами, как состояние больного, характер операции и порядок ее проведения (т. е. амбулаторные или стационарные условия).
Послеоперационная аналгезия у амбулаторных больных
1. АНАЛЬГЕТИКИ ДЛЯ ПРИЕМА ВНУТРЬ
При слабой и умеренной послеоперационной боли эффективно назначение внутрь ингибиторов цик-лооксигеназы, опиоидов или их сочетания. Больные, не способные принимать лекарство внутрь или испытывающие сильную боль, подлежат госпитализации вне зависимости от характера вмешательства.
Ингибиторы циклооксигеназы
Для приема внутрь используются такие ингибиторы циклооксигеназы, как салицилаты, ацетами-нофен и нестероидные противовоспалительные средства (НПВС) (табл. 18-12). Ингибируя цик-лооксигеназу, эти препараты подавляют синтез простагландинов, что дает аналитический, жаропонижающий и противовоспалительный эффект. Ацетаминофен не обладает выраженной противовоспалительной активностью. Аналитический эффект является следствием блокады синтеза простагландинов, которые вызывают сенситиза-цию и усиление ноцицептивной импульсации (см. ранее). Ингибиторы циклооксигеназы очень эффективно устраняют некоторые виды боли, особенно после ортопедических и гинекологических вмешательств, что указывает на важную роль простагландинов в их генезе. Ингибиторы цикло-
ТАБЛИЦА 18-12. Неопиоидные анальгетики для приема внутрь
| Анальгетик | Период полужизни (ч) | Начало действия (ч) | Разовая доза (мг) | Интервалы между приемом (ч) | Максимальная суточная доза (мг) |
| Салицилаты | | | | | |
| Ацетисалициловая кислота (АСА, аспирин) | 2-3 | 0,5-1 | 500-1000 | 4 | 3600-6000 |
| Дифлунизал (долобид) | 8-12 | 1-2 | 500-1000 | 8-12 | 1500 |
| Трисалицилат холина магния (трилисат) | 8-12 | 1-2 | 500-1000 | 12 | 2000-3000 |
| р-Аминофенолы | | | | | |
| Ацетаминофен (тайленол, др.) | 1-4 | 0,5 | 500-1000 | 4 | 1200-4000 |
| Производные пропионовой кислоты | |||||
| Ибупрофен (мотрин, др.) | 1,8-2,5 | 0,5 | 400 | 4-6 | 3200 |
| Напроксен (напросин) | 12-15 | 1 | 250-500 | 12 | 1500 |
| Напроксен натрия (анапрокс) | 13 | 1-2 | 275-550 | 6-8 | 1375 |
| Индолы | | | | | |
| Индометацин (индоцин) | 4 | 0,5 | 25-50 | 8-12 | 150-200 |
| Кеторолак (торадол) | 4-6 | 0,5-1 | 10 | 4-6 | 40 |
оксигеназы также оказывают важное влияние на периферическую и центральную нервную систему. Их аналгетический эффект несколько ограничивается побочными эффектами и токсичностью при применении в высоких дозах.
Ингибиторы циклооксигеназы хорошо всасываются в желудочно-кишечном тракте. Принятая пища замедляет абсорбцию, но не влияет на биодоступность. В значительной степени связываясь с белками плазмы (> 80 %), они могут вытесняться из этой связи другими препаратами с подобными свойствами, например варфарином. Все препараты подвергаются метаболизму в печени и выводятся через почки, поэтому при заболеваниях печени и почек их дозы следует уменьшать.
Из всех ингибиторов циклооксигеназы самые незначительные побочные эффекты присущи аце-таминофену, но и он гепатотоксичен в высоких дозах. Наиболее часто встречаются такие побочные эффекты аспирина и нестероидных противовоспалительных средств, как расстройство желудка, изжога, тошнота и диспепсия. У некоторых больных возникают язвы слизистой оболочки желудка, что обусловлено ингибированием простагландинзави-симого механизма секреции желудочной слизи и бикарбоната. К прочим побочным эффектам относятся головокружение, головная боль и сонливость. За исключением ацетаминофена, все ингибиторы циклооксигеназы вызывают нарушение агрегации тромбоцитов. Аспирин необратимо ацетилирует тромбоциты, угнетая их адгезию и агрегацию на 1-2 нед, тогда как антиагрегантный эффект НПВС обратим и соответствует приблизительно пяти периодам полусуществования (полувыведения), а именно 24-96 ч. Вместе с тем, этот побочный эффект достоверно не увеличивает риск послеоперационного кровотечения после подавляющего большинства амбулаторных вмешательств. Аспирин и НПВС могут провоцировать бронхоспазм, если у больного полипы в носу сочетаются с ринитом и астмой (так называемая триада). Наконец, НПВС могут провоцировать развитие острой почечной недостаточности и папиллярные некрозы почек, особенно при сопутствующей дисфункции почек.
Опиоиды
При умеренной послеоперационной боли показано назначение опиодов внутрь по мере необходимости или через определенные интервалы времени (табл. 18-13). Часто опиоиды комбинируют с ингибиторами циклооксигеназы, что усиливает аналгетический эффект и уменьшает выраженность побочных эффектов. Наиболее распространенными препаратами являются кодеин, оксикодон и гидроко-дон. Они хорошо абсорбируются, но эффект первого прохождения через печень снижает их биодоступность. Как и все опиоиды (см. гл. 8), они подвергаются биотрансформации и конъюгации в печени, после чего элиминируются почками. В печени кодеин трансформируется в морфин. Побочные эффекты опиоидов одинаковы вне зависимости от пути введения; при приеме через определенные интервалы времени целесообразно назначить слабительные.
