Дальневосточный федеральный университет дальневосточный институт инновационных технологий и качества академия экологии, морской биологии и биотехнологии
| Вид материала | Документы |
- Дальневосточный федеральный университет, 61.97kb.
- А. Н. Малютин Дальневосточный морской биосферный государственный природный заповедник, 110.71kb.
- Положение о магистратуре федерального государственного автономного образовательного, 418.7kb.
- Правлением ОАО «Дальневосточный банк», 78.08kb.
- Совершенствование управления качеством при формировании интегрированных систем менеджмента, 270.66kb.
- Дальневосточный государственный университет восточный институт, 1418.89kb.
- 1. Общие положения, 275.75kb.
- «Менеджмент систем качества», 50.31kb.
- 14. дальневосточный экономический район, 1428.3kb.
- Программа I краевого съезда учителей и преподавателей математики хабаровского края, 344.82kb.
| Глава 4. ПОДХОДЫ К КОМПЬЮТЕРНОМУ МОДЕЛИРОВАНИЮ УГЛЕВОД-БЕЛКОВЫХ ВЗАИМОДЕЙСТВИЙ Углеводы играют очень важную роль в процессах межклеточного распознавания, проникновения в клетку вирусов, лекарcтвенных веществ и т.п. В последнее время все больше внимания уделяется изучению пространственных механизмов биологического взаимодействия углеводов с природными рецепторами. Понимание механизмов физиологического действия углеводов на молекулярном уровне необходимо для направленного дизайна структур с заданной активностью. Такая важная роль углеводов определяется особенностями строения их молекул (Рисунок 4). С одной стороны, они являются конформационно подвижными соединениями засчет наличия гибких мостиков между моносахаридными остатками, которые называются гликозидными связями. С другой стороны, сами моносахаридные кольца имеют, как правило, достаточно жесткую конформацию. Однако, наличие многих вариантов взаимного пространственного расположения заместителей в этих остатках обуславливает большую вариабельность пространственных структур углеводов. Таким образом получается, что молекулы углеводов могут принимать весьма широкий спектр конформаций, в то время как некоторые их фрагменты остаются фиксированными. Это облегчает образование углевод-белкового комплекса и позволяет иногда достичь специфичности определенного углеводного лиганда к определенному белку. Подвижные гликозидные связи Малоподвижные кольца Разнообразие пространственных конфигураций заместителей Р        исунок 4 - Структурные особенности молекул углеводов. исунок 4 - Структурные особенности молекул углеводов.На настоящий момент существуют различные методики теоретического молекулрного моделирования структур комплексов углеводов с белками, являющимися их природными мишенями. Задачу такого моделирования можно разделить на две части: 1) поиск оптимальной с энергетической точки зрения конформации самой молекулы углевода 2) количественная оценка энергии взаимодействия молекулы лиганда с рецептором. Методики, позволяющие решать первую часть задачи, известны достаточно давно. Как правило, это методы молекулярной механики, хотя иногда для конформационного анализа применяются и неэмпирические методы квантовой механики. Для решения второй части существуют так называемые “функции ранжировки” (“scoring functions”), развитие и оптимизация которых и представляет особый интерес. Следует отметить, что не всегда обе части докинга выполняются в одной компьютерной программе. Так, существует ряд программ, позволяющих проводить количественную оценку сродства лиганда к белку, в которых конформации лиганда берутся из сторонних источников, например на основании данных молекулрно-механического расчета или экспериментального конформационного анализа с помощью методов ЯМР. В докладе рассматривается программа XScore [1], в которой реализованы сразу несколько функций ранжировки [2]. Наряду с величинами сродства, вычисленными по каждой из этих функций, программа на выходе предоставляет так их усредненную величину и эмпирически вычисленное значение коэффициента распределения LogP, который так же может оказаться полезным при поиске потенциальных лекарственных веществ. Так же рассматривается использование программы LigBuilder [3], которая не рассчитывает степень сродства заданного лиганда к белку, но по эмпирическим функциями на основе структуры связывающего центра в белке может предложить структурные модификации лиганда, потенциально приводящие к увеличению активности. Кроме того, в докладе упоминается возможность самостоятельного построения функции ранжировки с использованием для этого метода молекулярных дескрипторов. Такими дескрипторами могут быть, например, число атомов определенного элемента, молекулярный вес, молекулярный объем и поверхность, дипольный момент, коэффициент распределения и множество других. Смысл данного подхода состоит в том, что строится математическая модель, коррелирующая все эти параметры с некоторой экспериментальной величиной, характеризующей активность лиганда по отношению к белку. Чаще всего в качестве такой величины используется константа 50%-ого ингибирования, IC50. Для построения такой модели могут быть использованы самые разные математические приемы, в том числе, метод искусственных нейронных сетей [4]. В заключение в докладе рассматривается самый современный на сегодняшний день алгоритм докинга, реализующий одновременно как расчет величины внутримолекулярной конформационной энергии лиганда, так и энергии межмолекулярного взаимодействия лиганда с рецептором. В данном случае, следовательно, константа устойчивости получающегося комплекса может быть рассчитана напрямую, а через нее — и величина IC50. Самая распространенная свободно доступная компьютерная программа, использующая данный подход — Autodock [5]. Эта программа имеет следующие преимущества: 1) Точность расчета энергий связывания составляет 2.1 ккал/моль; 2) Можно учитывать эффекты сольватации-десольватации как особый вид взаимодействий; 3) Позволяет учитывать подвижность рецептора. Так же в докладе отмечено, что с помощью программы Autodock можно проводить анализ вкладов отдельных атомов или других фрагментов молекулы в энергию связывания. Это позволяет предположить исходя из компьютерных расчетов, какие именно из частей лиганда являются существенными для проявления активности. Таким образом, на сегодняшний день существует ряд функций ранжировки («scoring functions»), позволяющих провести количественную оценку стабильности углевод-белковых комплексов. Эти функции могут быть реализованы в программах, осуществляющих только расчет сродства лиганда к рецептору, в этом случае на выходе получаются эмпирические величины, которые могут быть прокоррелированы с величинами IC50. В случае если программа проводит конформационный анализ лиганда и всего комплекса в целом, на выходе получаются величины изменения свободной энергии образования комплекса, из которых его константы устойчивости и величины IC50 могут быть рассчитаны в явном виде. Анализируя вклады различных частей молекулы в связывание, можно делать предположения о возможном упрощении структуры лиганда с синтетической точки зрения, в том числе, с перспективой создания на его основе неуглеводного потенциального лекарственного вещества. Библиографический список 1. [Электронный ресурс]. – Режим доступа: ed.umich.edu/software/xtool/manual/index.html 2. Wang R., Lu Y., Wang S. Comparative Evaluation of 11 Scoring Functions for Molecular Docking. // J. Med. Chem. – 2003. - Vol. 46. – P. 2287-2303. 3. [Электронный ресурс]. – Режим доступа: ku.edu.cn/drug_design/work/ligbuilder.html 4. Fabry-Asztalos L., Andonie R., Collar C. J., Abdul-Wahid S., Salim N. A. Genetic Algorithm Optimized Fuzzy Neural Network Analysis of the Affinity of Inhibitors for HIV-1 Protease. // Bioorg. Med. Chem. – 2008. – Vol. 16. – P. 2903-2911. 5. [Электронный ресурс]. – Режим доступа: scripps.edu С.В. Охотина Глава 5. бактериальные биопленки и ремедиация среды Известно, что микроорганизмы являются наиболее древней формой жизни на Земле. Они же являются и основными преобразователями среды. Если на планете произойдет какая-нибудь глобальная катастрофа, то микроорганизмы – бактерии и вирусы, несомненно, выживут и на основе их генетического материала начнут образовываться новые формы жизни. То, что бактерии способны к самоорганизации и образуют сообщества, было известно еще с середины минувшего столетия. Но активное изучение этой особенности началось в 90-х годах XX-го столетия, а первые публикации, касающиеся такой формы организации, как биопленка, датируются 2002-2003гг. Способность бактерий образовывать биоплёнки интересна ввиду того, что микроорганизмы проявляют устойчивость к действию антимикробных веществ при их росте в биоплёнках. Биоплёнки - высокоупорядоченные бактериальные сообщества, которые позволяют бактериям жить в прикреплённом состоянии. Биоплёнки могут состоять из одного или нескольких видов бактерий. Их пронизывает сеть водных каналов, обеспечивающих доставку питательных веществ членам сообщества и удаляющих продукты метаболизма. В одной биоплёнке можно наблюдать различные образцы генной экспрессии, что говорит о том, что индивидуальные члены сообщества имеют «специфические обязанности», которые, комбинируясь с другими, усиливают жизнеспособность всего консорциума. Микроколонии в зрелой биоплёнке расположены во внеклеточном полисахаридном матриксе. Итак, биопленка – это взаимодействующая общность разных типов микроорганизмов, сгруппированных в микроколонии, окруженные защитным матриксом. Основные свойства бактериальной биопленки:
Бактерии способны образовывать биопленки на любом субстрате – это и поверхности внутренних органов, протезы, зубная эмаль, стенки катетеров и контактных линз. Известно, что именно биопленки являются причиной внутрибольничных инфекций и хронических инфекционных заболеваний. Тем не менее, активно ведутся исследования по использованию способности бактерий к самоорганизации в «мирных» целях. Одним из направлений, где активно ведется исследование по применению бактериальных биопленок, является биоремедиация среды. Биоремедиация – это ряд мероприятий, направленных на оздоровление окружающей среды, путем утилизации поллютантов, осуществляемое с участием живых микроорганизмов. На сегодняшний день существуют различные сооружения для очистки промышленных и бытовых сточных вод, в которых осуществляется биодеградация и трансформация органических и минеральных веществ, содержащихся в стоках, в аэробных или анаэробных условиях. По способу контакта очищаемой сточной воды и колоний микроорганизмов различают сооружения очистки сточных вод с иммобилизованной (прикрепленной) микрофлорой и свободноплавающей (табл.5). В настоящее время известно много модификаций, совмещающих в одном сооружении очистки стоков оба механизма. Базовыми вариантами современных сооружений очистки сточных вод являются классические биофильтры, аэротенки и анаэробные биореакторы. Очистные реакторы на основе биопленок, в основном, используются для больших акваторий в местах индустриальных стоков и способны пропускать большие объемы воды. Аэробная биодеструкция органических загрязняющих веществ сточных вод в биофильтрах осуществляется путем фильтрования сточных вод через загрузочный материал, на нем постепенно адсорбируются органические вещества (поллютанты) и микроорганизмы, находящиеся в сточной воде. Образуется так называемый биоорганоминеральный комплекс - биопленка, используемая в технологии биологической очистки промышленных и бытовых сточных вод. Иммобилизованные (прикрепленные) микроорганизмы адсорбируют субстрат (питательные вещества) из сточной воды, омывающей загрузочный материал. В процессе обмена веществ они с помощью экзоферментов ускоряют процесс гидролиза сложных веществ, содержащихся в сточных водах, до более простых, молекулы которых имеют размеры меньшие, чем размеры бактерий. Продукты гидролиза диффундируют в клетку, где под действием эндоферментов происходит их дальнейшее окисление с целью получения энергии и более простых соединений, используемых в качестве строительных блоков клеточного вещества. Состав продуктов окисления зависят от состава субстрата и видового разнообразия бактерий, образующих биопленку, обязательно присутствуют углекислый газ и вода, в различном количестве могут присутствовать сульфаты, фосфаты, азот аммонийный и нитратный, а также продукты неполного разложения - различные органические кислоты. Биопленка, используемая для участия в биоремедиации должна обладать способностью к биосорбции, биоаккумуляции и биоминерализации загрязняющих веществ, а также сродством бактериальных клеток в составе биопленки к определенному виду поллютанта. Высокая плотность микробных клеток и уникальная архитектура биопленки способствуют поддержанию оптимального pH среды, концентрации питательных веществ в среде и окислительно-восстановительного потенциала в межклеточном пространстве Современные возможности генной инженерии при помощи сочетания нескольких генов или активации одного гена позволяют запустить развитие полезных свойств, имеющихся у бактериальных штаммов. Например, создание штаммов с металлосвязующими способностями возможно путем экспрессии генов металлоспецифичных протеинов и пептидов, что усовершенствует процесс утилизации тяжелых металлов природными штаммами. Таблица 5
Таким образом, сочетание методов генной инженерии микроорганизмов, с оптимальными физико–химическими параметрами и концентрацией субстрата в биореакторах является основным условием развития стратегий биремедиации. Н.Л. Белькова, Е.Б. Матюгина, С.О. Воронова, Н.В. Долгих Глава 6. Современные методы идентификации и детекции физиологического статуса водных микроорганизмов Изучение функционирования пресноводных экосистем в современных условиях является одной из приоритетных научных проблем, так как в настоящее время более половины населения Земного шара вынуждены употреблять для питьевых целей воду, не соответствующую нормам и стандартам. Микробные сообщества – одни из наиболее существенных компонентов живого населения водоемов. Они играют важную роль в процессах круговорота веществ и энергии и в трофической цепи организмов пелагиали. В природной микробной популяции бактериальные клетки находятся в разном физиологическом статусе: живые клетки могут быть метаболически активными и неактивными – покоящимися (резистентными) или спорами, а какую-то часть биомассы составляют мертвые клетки. Способности этих бактерий к культивированию различны, и их доля от общей численности может варьировать от 0.25% (культивирование из пресноводных источников) до 2% (из морской воды) (Amann et al., 1995; Bernard et al., 2000, Белькова, 2004). Сложные органические субстраты успешно применяются для выращивания большого разнообразия бактериальных штаммов и для выделения численно доминирующих, способных к культивированию бактериальных клеток из различных водных экосистем (Pinhassi et al., 1997). Оптимизация методов культивирования гетеротрофных бактерий позволяет проводить культивирование микроорганизмов, находящихся в природной среде в некультивируемом состоянии (Bussmann et al., 2001, Hahn et al., 2004). Успехи молекулярной систематики позволяют микробиологам пользоваться принципиально новыми возможностями решения таксономических проблем. В настоящее время описание и регистрация нового штамма микроорганизма не возможны без определения нуклеотидной последовательности гена малой субъединицы рибосомной РНК (гена 16S рРНК) и установления по этой структуре филогенетических взаимоотношений этого штамма с его ближайшими родственниками. Таким образом, селективная детекция микроорганизмов разного физиологического статуса разными методами: с помощью культивирования и молекулярно-генетическим становится актуальной научной задачей. Основными целями исследования стали: (1) молекулярно-генетический анализ природных микробных сообществ ультраолиготрофных экосистем разного происхождения; (2) поиск новых подходов для анализа некультивируемых микроорганизмов. Мы использовали новый метод фильтрации-акклиматизации для культивирования микроорганизмов, находящихся в природных условиях в некультивируемом состоянии. Обработку водных проб из пресноводных озер Восточной Сибири проводили по следующей схеме: (1) культивирование гетеротрофных микроорганизмов и подсчет их численности; (2) эксперимент по фильтрации-акклиматизации; (3) молекулярно-генетическая идентификация штаммов; (4) концентрирование бактериального материала на бактериальных фильтрах и его молекулярно-генетический анализ. Среди культивируемых гетеротрофных микроорганизмов определены представители следующих родов: Aeromonas, Arthrobacter, Escherichia, Dietzia, Flavobacterium, Microbacterium, Rhodococcus и Serratia. Метод фильтрации-акклиматизации был адаптирован для проведения полевых экспериментальных работ по культивированию микроорганизмов из природных микробных сообществ, находящихся в некультивируемом состоянии. После эксперимента по фильтрации акклиматизации преимущественно получены неспорообразующие бактерии Pseudomonas и Acinetobacter. Молекулярно-генетический анализ природных проб выявил новые кластеры некультивируемых микроорганизмов. Работа выполнена при финансовой поддержке грантом РФФИ №09-04-00977 и в рамках интеграционного проекта №122 (рук. Н.Л. Белькова). И.А. Теркина, Г.А. Федорова, О.П. Глызина, В.В. Парфенова Глава 7. Поиск и исследование новых антимикробных метаболитов, продуцируемых бактериями озера Байкал В настоящее время широкое использование антибиотиков в медицинских и немедицинских (ветеринария, животноводство, растениеводство, пищевая и бродильная промышленность, научные исследования) целях привело к возникновению в окружающей среде антибиотикорезистентных штаммов бактерий. Это бактерии группы кишечной палочки [Srinivasan et al., 2007], энтерококки [Johnston & Jaykus, 2004], некоторые виды рода Bacillus, коринеформные бактерии, Clostridium perfringens, Staphylococcus aureus, Listeria monocytogenes [Gravenitz, 2001] и другие. В последние годы наиболее ярким примером антибиотикорезистентности является возникновение устойчивости к ванкомицину у 12% штаммов Enteroccocus faecalis (с 1988 г.) и некоторых штаммов S. aureus (с 2002 г.) [Appelbaum & Jacobs, 2005]. Одним из основных путей преодоления антибиотикорезистентности является поиск и изучение антибактериальных метаболитов микроорганизмов, обитающих в окружающей среде. Решением этой проблемы в настоящее время занимаются объединенные группы ученых биологов и биохимиков разных стран мира, таких как Япония, Германия, Франция, Россия, Америка, Австралия, Индия, Китай и т.д. Водная среда в течение последних 20 лет является богатой лабораторией для выделения таких продуцентов. Установлено, что антимикробная активность продуктов метаболизма водных штаммов бактерий не уступает активности почвенных штаммов [Sponga et al., 1999]. Большой интерес представляет исследование микробного сообщества озера Байкал - уникального древнего пресноводного водоема, в котором обнаружено большое количество редких и специфичных для озера микроорганизмов [Белькова и др., 2003; Шубенкова и др., 2005]. Особые экологические условия в оз. Байкал, в первую очередь низкое содержание растворенного органического вещества и биогенных элементов, а также постоянные низкие температуры, оказывают значительное влияние на жизнедеятельность микроорганизмов, создают антагонистические взаимоотношения между бактериями, которые могут продуцировать уникальные по своей структуре и свойствам антимикробные метаболиты. Поэтому целью этой работы было выделить и исследовать антибактериальные вторичные метаболиты, продуцируемые бактериями озера Байкал в процессе своей жизнедеятельности.
Выделение микроорганизмов из озера Байкал. Источником выделения бактерий были байкальские губки трех видов - Lubomirskaia baicalensis, Baicalospongia bacillifera и Baicalospongia intermedia и байкальская вода. Образцы губок отбирали при помощи водолазной техники в районе п. Листвянка (Lubomirskia baicalensis) с глубины 6 м и в районе пос. Большие коты с глубины 13 метров (Lubomirskia baicalensis) и 3,6м (Вaicalospongia bacilifera). Пробы воды отбирали асептически с корабля при помощи батометра в Южном Байкале. Методы выделения бактерий были опубликованы ранее (Парфенова и др., 2008). Антимикробную активность чистых культур бактерий определяли двумя способами: методом перпендикулярных штрихов и методом одновременного культивирования продуцента и тест-культуры (Теркина и др., 2006). В качестве тест-культур использовали условно-патогенные штаммы бактерий Pseudomonas aeruginosa, Escherichia coli, Bacillus subtilis, Staphylococcus aureus, Enterococcus faecium и Candida albicans. Ферментативную активность бактерий определяли по качественной реакции (Парфенова и др., 2008). Идентификацию выделенных штаммов бактерий с высокой антимикробной активностью проводили на основании морфологических, культуральных и физиолого-биохимических признаков с помощью определителя бактерий Берги (Определитель бактерий Берджи, 1997). Для получения культуральной жидкости бактерии культивировали в колбах Эрленмейера обьемом 250 см3 со 100 мл среды приведенного состава на установке для выращивания микроорганизмов УВМТ-12-250 (скорость качания 110 об/мин). Время культивирования 5 суток, при комнатной температуре. Культивирование проводили в течение 5 суток при комнатной температуре на следующих средах: среда I - рыбо-пептонный бульон (2 г/л) и среда (II): глицерин – 3 г, рыбо-пептонный бульон – 0.5 г, пептон – 0.5 г, NaCl – 0.45 г, CaCO3 – 0.35 г, H2O - 1л, pH= 7.2. Культуральную жидкость экстрагировали этилацетатом и концентрировали в вакууме для получения сухого остатка. Для определения активности экстрактов готовили этилацетатные и водно-спиртовые (не более 10 % спирта в воде) растворы. Антимикробную активность культуральной жидкости, а затем микробных экстрактов оценивали методом диффузии в агар (Медицинская микробиология, 1999). В качестве тест-культур были использованы штаммы E. coli, S. aureus, E. faecium и C. albicans. Хроматографическое исследование микробных экстрактов. Для исследования микробного экстракта использовали метод высокоэффективной жидкостной хроматографии с ультрафиолетовой детекцией (ВЭЖХ-УФ). Хроматографические исследования были выполнены на микроколоночном жидкостном хроматографе «Милихром А-02» с колонкой 2х75 мм, упакованной сорбентом Silasorb SPH C 18 с одновременной многоволновой ультрафиолетовой детекцией. Упаренный досуха бактериальный экстракт перерастворяли в 60% водном метаноле (10 мг/мл). Для общей характеристики бактериального экстракта записывали обзорную хроматограмму в градиенте от 2 до 100% метанола в воде. Для идентификации соединений, обладающих антимикробной активностью, бактериальный экстракт был разделен на 12 фракций. Каждая из фракций была выделена в полупрепаративном режиме и исследована на антимикробную активность в отношении E. faecium. Результат учитывали по величине диаметра зоны подавления роста вокруг лунки, измеренной в миллиметрах. Масс-спектрометрический анализ соединения 11,5 мин проводили на приборе МХ 5303, оборудованном электрораспылительным источником ионизации с ортогональным вводом ионов и времяпролетным масс-анализатором (TOF) (ESI-o-TOF), разработанном в лаборатории экологической и биомедицинской масс-спектрометрии ИАнП РАН. Спектр получали в режиме съемки положительных ионов. При проведении хромато-масс-спектрометрического анализа в качестве подвижных фаз использовали: А - 0.5% НСООН в воде (pH 2.5), В - 0.5% НСООН в ацетонитриле. Скорость потока 150 мкл/мин. Градиент: линейный, от 2 до 75% Б за 2000 мкл, 75% Б 1000 мкл.
В результате проведенной научно-исследовательской работы из воды озера выделено 98 штаммов бактерий, а из байкальских губок 122 штамма бактерий. Обнаружено, что антимикробной активностью по отношению к условно-патогенным тест-культурам обладали 47% штаммов бактерий, выделенных из губок, и около 70% штаммов, выделенных из воды озера. Практически все бактерии, выделенные из воды, подавляли рост S. aureus и E. faecium. (рис. 5). 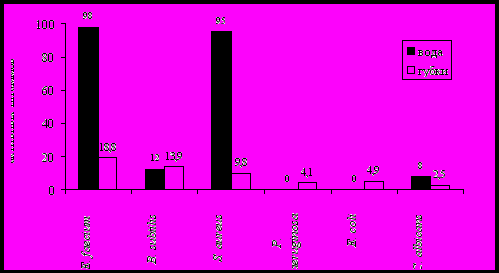 Рисунок 5 - Антимикробная активность бактерий, выделенных из оз. Байкал Ферментативная активность бактерий является одним из показателей их участия в разложении органических веществ (белков, жиров и углеводов). По результатам тестирования установлено, что бактерии, выделенные из воды и губок озера Байкал, обладают высокой гидролитической активностью. Выявлено 63.1% культур, способных пептонизировать молоко, более 60% обладают лецитиназной и липазной активностями, фосфатазную активностью проявляют 55.2% исследованных культур, 53.9% штаммов бактерий способны гидролизовать крахмал, 26.3% разжижают желатину. Больше половины исследованных культур проявляют сразу несколько активностей: фосфатазную, протеазную, лецитиназную и липазную (рис. 6). 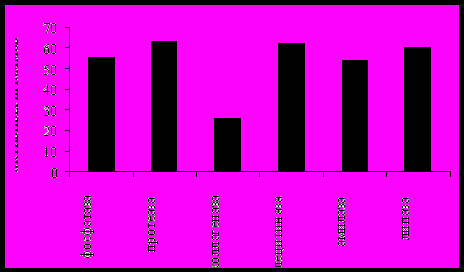 Рисунок 6 - Ферментативная активность бактерий, выделенных из озера Байкал По результатам тестирования для дальнейшей идентификации были выбраны 18 штаммов, обладающих высокой антимикробной и ферментативной активностями. Установлено, что 11 штаммов относятся к роду Pseudomonas, 3 штамма принадлежат к роду Flavobacterium, 2 штамма – к роду Acinetobacter и по 1 штамму к родам Aeromonas и Proteus. Чтобы оценить антимикробную активность бактерий при разных условиях культивирования, были выбраны четыре штамма Pseudomonas sp. 1Lb-06, Pseudomonas sp. 7Lb-06, Flavobacterium sp. 15Bb-06 и Flavobacterium sp.28Bb-06. Штамм Pseudomonas sp.1Lb-06 угнетал рост S. aureus (диаметр зоны подавления роста () составлял 7мм), B. subtilis ( 13мм), C. albicans ( 6мм) и E. faecium ( 14мм), и проявлял протеазную активность (диаметр зоны лизиса () составлял 15мм), лецитиназную ( 10мм) и липазную ( 6мм) активности. Штамм Pseudomonas sp.7Lb-06 был активен в отношении S. aureus ( 18мм), B. Subtilis ( 10мм), и также проявлял протеиназную (15мм), лецитиназную ( 5мм) и липазную ( 12мм) активности. Штамм Flavobacterium sp.15Lb-06 угнетал рост S. aureus ( 15мм), B. subtilis ( 28мм), C. albicans ( 14мм), E. faecium ( 22мм) и P. aeruginosa ( 35мм), обладал протеазной (18мм), коллагеназной ( 2мм), лецитиназной ( 19мм) и липазной ( 12мм) активностями. Штамм Flavobacterium sp.28Bb-06 ингибировал рост S. aureus ( 30 мм), B. subtilis ( 15мм) и E. faecium ( 7мм), и проявлял протеазную (16мм), лецитиназную ( 8мм) и липазную ( 11мм) активности. Тестирование культуральной жидкости, полученной на среде I и среде II, показало, что спектр антимикробного действия этих бактерий зависит от времени культивирования и от состава среды культивирования. Обнаружено, что объем культуральной жидкости, используемой для тестирования, не влиял на антимикробную активность. Штаммы Pseudomonas sp. 1Lb-06, Pseudomonas sp. 7Lb-06, Flavobacterium sp. 15Bb-06 при культивировании на рыбо-пептонном бульоне (среда I) проявляли активность по отношению к E. faecium, S. aureus и C. albicans уже на 3 и 5 сутки, а на среде II выделяли антимикробное вещество только на 7 сутки. В таблице приведены результаты тестирования культуральной жидкости штамма Flavobacterium sp.28Bb-06. Этот штамм был выбран как самый активный для выделения и исследования активного вещества. На среде I эта культура подавляла рост S. aureus и E. faecium (среда I) на третьи сутки культивирования и рост C. albicans – на 7 сутки. На среде II штамм Flavobacterium sp.28Bb-06 уже на 3 сутки культивирования показал активность в отношении S. aureus, B. subtilis и на 7 сутки – к E. faecium. Кроме того, этот штамм обладал протеазной, лецитиназной и липазной ферментативной активностями. Таблица 6 - Антимикробная активность штамма Flavobacterium sp.28Bb- 06 при разных условиях культивирования, (мм) 1
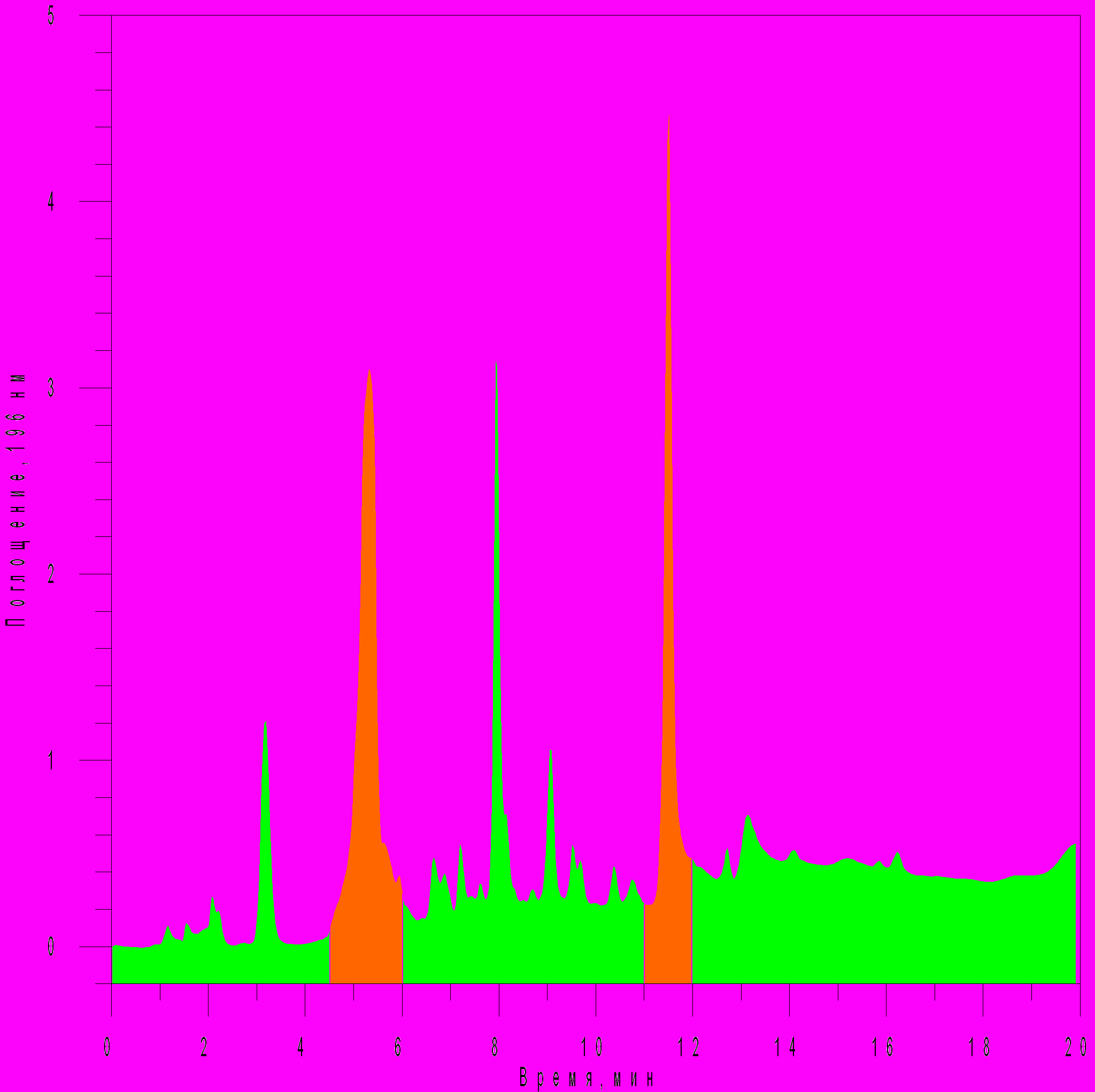
Полученный из культуральной жидкости микробный экстракт протестировали на антимикробную активность по отношению к S. aureus, B. subtilis и E. faecium. Результаты показали, что в микробном экстракте Flavobacterium sp.28 Bb-06 содержится активное вещество, которое подавляло рост этих тест-культур (рис. 7).   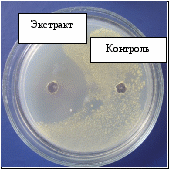 Рисунок 7 - Антимикробная активность суммарного микробного экстракта Flavobacterium sp. 28 Bb-06 (контроль – 10% метанол в воде) Для общей характеристики бактериального экстракта была записана обзорная хроматограмма в градиенте ацетонитрила в воде. Для выявления соединений, обладающих антимикробной активностью, хроматограмма бактериального экстракта была условно разделена на 12 зон различной длительности, каждая из которых была собрана в отдельную пробирку. Фракции были исследованы хроматографически в тех же условиях для оценки качественного и количественного состава и протестированы на антимикробную активность в отношении E. faecium. Обнаружено, что фракция 11,0-12,0 мин практически полностью состоит из соединения со временем удерживания 11,5 мин и обладает значительной антимикробной активностью. Анализ результатов рехроматографии фракций 10,0-11,0 мин; 12,0-13,0 мин и 13,0-14,5 мин показал, что каждая из них содержит в себе соединение со временем удерживания 11,5 мин и их антимикробная активность может быть связана с присутствием этого соединения. По результатам антимикробной активности фракций и повторной хроматографии (рехроматографии) обнаружено 2 зоны, которые обладают высокой антимикробной активностью (рис. 8).
Рисунок 8 - Антибиотическая активность фракций этилацетатного экстракта Flavobacterium sp.28 Bb-06, перерастворенного в 60% растворе МеОН-Н2О Тестируемая культура – E. faecium. По форме и ширине пика можно предполагать, что зона 4,5 - 6 мин состоит из нескольких соединений, а зона 11-12 мин представляет собой гомогенное химическое соединение. Для характеристики соединения 11,5 мин (зона 11,0-12,0 мин) был записан его УФ-спектр в интервале длин волн от 190 до 360 нм с шагом 2 нм методом остановленного потока (рис. 9). Из рисунка 9 видно, что один из максимумов поглощения исследуемого вещества, соответствующий максимальной экстинкции в исследуемом интервале длин волн, равен 270 нм. Это может быть связано с присутствием ароматической системы в этом соединении. 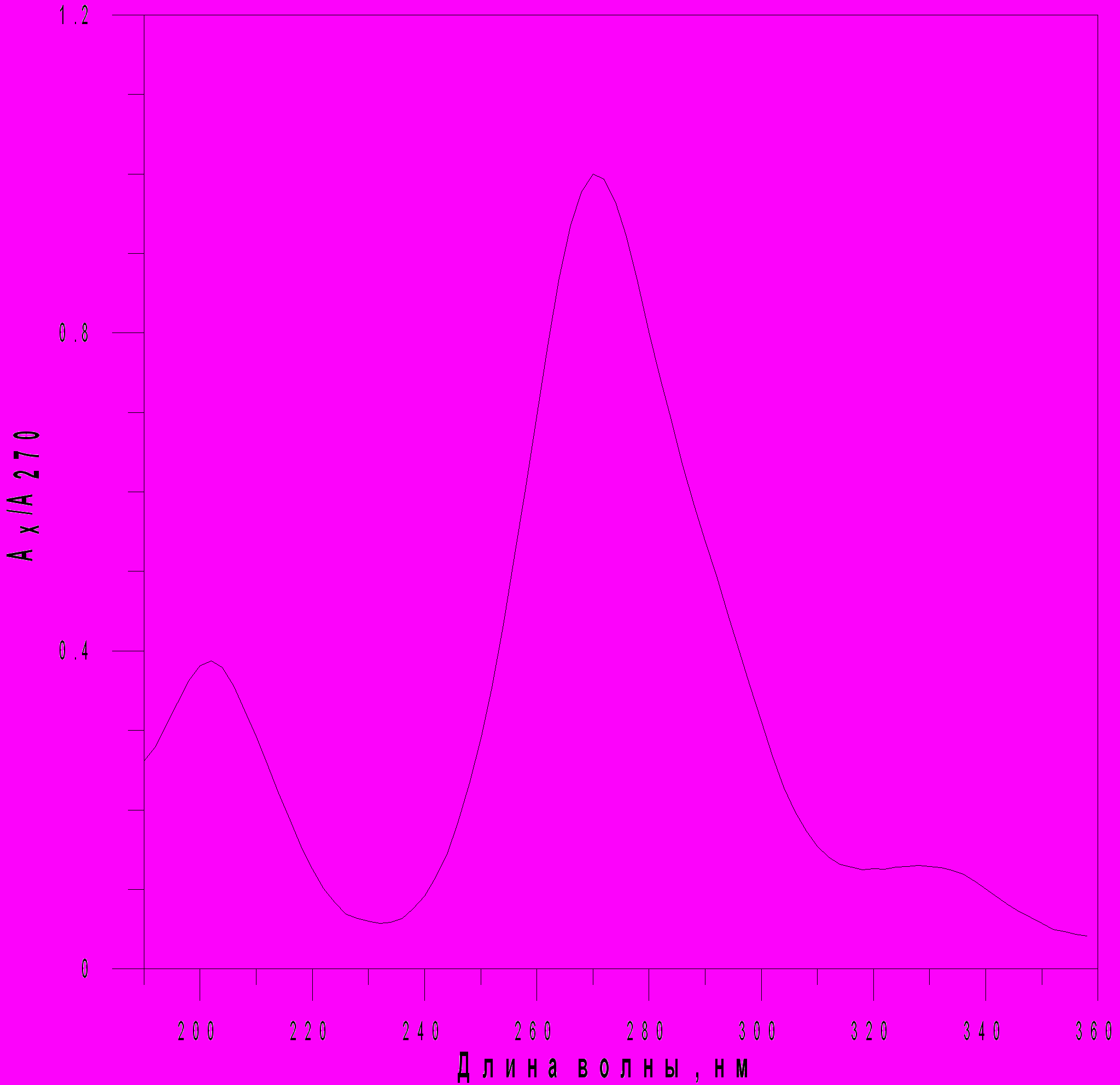 Рисунок 9 - Нормированный УФ-спектр для соединения (11,5 мин), полученного из штамма Flavobacterium sp.28 Bb-06. Растворитель МеCN-Н2О=35:65 Методом масс-спектрометрии была определена масса этого соединения, которая составила 594.179, предложена брутто формула: C30H39N3O3Cl3. Таким образом, среди бактерий, выделенных из озера Байкал, обнаружен штамм Flavobacterium sp.28 Bb-06, обладающий антибактериальной активностью, которая связана с наличием, по меньшей мере, двух соединений. Одно из них выделено в индивидуальном виде и охарактеризовано. Установление структуры этого соединения будет являться предметом наших дальнейших исследований. Работа выполнена при поддержке грантом РФФИ - Байкал № 05-05-97271 и междисциплинарного проекта СО РАН № 96. Библиографический список
Н.Б. Цветкова | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||