Дальневосточный федеральный университет дальневосточный институт инновационных технологий и качества академия экологии, морской биологии и биотехнологии
| Вид материала | Документы |
- Дальневосточный федеральный университет, 61.97kb.
- А. Н. Малютин Дальневосточный морской биосферный государственный природный заповедник, 110.71kb.
- Положение о магистратуре федерального государственного автономного образовательного, 418.7kb.
- Правлением ОАО «Дальневосточный банк», 78.08kb.
- Совершенствование управления качеством при формировании интегрированных систем менеджмента, 270.66kb.
- Дальневосточный государственный университет восточный институт, 1418.89kb.
- 1. Общие положения, 275.75kb.
- «Менеджмент систем качества», 50.31kb.
- 14. дальневосточный экономический район, 1428.3kb.
- Программа I краевого съезда учителей и преподавателей математики хабаровского края, 344.82kb.
Глава 2. БИФИДОСОДЕРЖАЩИЕ ПРОДУКТЫ ФУНКЦИОНАЛЬНОГО ПИТАНИЯ
В последние десятилетия ввиду роста числа хронических заболеваний и установления их причинной связи с несбалансированным питанием, к пищевым продуктам стали относиться как к эффективному средству поддержания физического и психического здоровья и снижения риска возникновения ряда заболеваний. Одним из пионеров, предложивших продукты питания и отдельных их компоненты в качестве фармацевтических препаратов, являлся дважды лауреат Нобелевской премии Лайнус Полинг, обосновавший в 60-80 гг. прошлого века теорию и практику «Ортомолекулярной медицины», согласно которой физическая болезнь и психическое заболевание могут быть излечены не с помощью лекарственных средств, а путем тщательного отбора и применения оптимальных количеств определенных макро- и микронутриентов (например, витамины) или веществ эндогенного происхождения (например, инсулин). В нашей стране в эти же годы активным пропагандистом фармакологических эффектов пищевых продуктов являлся директор Института питания академик А.А. Покровский. Авторитетное мнение Л. Полинга, других ведущих исследователей, нутрициологов и клиницистов стимулировало во всем мире поиск и идентификацию тех пищевых продуктов и специфических нутриентов, которые оказывают благоприятные эффекты на организм человека. В современном терминологическом плане концепция «Функционального питания» как самостоятельного научно-прикладного направления в области здорового питания сложилась в начале 90-х годов. С современных позиций под термином «функциональные пищевые продукты» понимают такие продукты питания, которые предназначены для систематического употребления в составе пищевых рационов всеми возрастными группами здорового населения с целью снижения риска развития заболеваний, связанных с питанием, сохранения и улучшения здоровья за счет наличия в их составе физиологически функциональных пищевых ингредиентов [ГОСТ 52349-2005]. Согласно «Научной концепции Функционального питания в Европе» (Scientific Concepts of Functional Food in Europe), разработанной в 1995-1998гг [20; 29], продукты питания лишь в том случае могут быть отнесены к функциональным, если имеется возможность продемонстрировать их позитивный эффект на ту или иную ключевую функцию (функции) человека (помимо традиционных питательных эффектов) и получить веские объективные доказательства, подтверждающие эти взаимоотношения. Рекомендуется по возможности идентифицировать конкретные маркеры этих функций, чувствительные к модулирующему эффекту пищевых функциональных ингредиентов, если позитивные эффекты на эти функции проявляются при употреблении пищи (или ее действующего начала) в количествах, которые безопасны для организма.
Мы останавливаем внимание на функциональных пищевых продуктах, в состав которых входят про- и пребиотики. С современных позиций микрофлору человека рассматривают как совокупность множества микробиоценозов, занимающих многочисленные экологические ниши на коже и слизистых всех открытых внешней среде полостей макроорганизма, Наиболее сложный по составу микробиоценоз в толстом кишечнике. Условия жизни человека в современном городе, сопровождаемые воздействием целого ряда негативных факторов (неблагоприятная экология, антибиотики, стрессы и пр.) породили «синдром мегаполиса», который проявляется в нарушении обмена веществ, ослаблении иммунитета, нарушении микробной экологии пищеварительного тракта. Одна из его составляющих - снижение уровня бифидо- и лактофлоры и возрастание условно-патогенных микроорганизмов у человека, т.е. дисбактериоз (дисбиоз). Важнейшей составляющей лечебного комплекса дисбактериозов являются пробиотики - живые культуры микроорганизмов, относящихся к нормальным обитателям различных экологических ниш макроорганизма. Они свободны от побочного действия химических соединений. Их использование является наиболее физиологичным по регулирующему влиянию на микрофлору. В настоящее время все больше внимания уделяется разработкам пробиотиков, в состав которых входят несколько микроорганизмов, принадлежащих к различным родам и видам. При этом, прежде всего учитывают взаимодействия микробов в естественной среде обитания, и в первую очередь, симбиоз бифидобактерий с лактобациллами, так как именно они доминируют в микробиоценозе желудочно-кишечного тракта. Так, бифидобактерии создают условия для метаболической деятельности лактобацилл, а лактобациллы способствуют размножению бифидобактерий. Последние колонизируют в основном в толстом кишечнике, а лактобактерии - и в остальных отделах пищеварительного тракта. В настоящее время общепризнанна роль, которую играют бифидобактерии в поддержании здоровья человека. Бифидобактерии составляют основу микрофлоры кишечника (до 90% у взрослых и до 95% у детей). Основные функции бифидобактерий в организме - подавление активности гнилостных и патогенных бактерий и обеспечение защиты от кишечной инфекции; торможение роста клеток опухоли в кишечнике; активизация кишечных функций и участие в синтезе и усвоении питательных веществ, витаминов и микроэлементов; усиление иммунной защиты. Помимо пробиотиков для поддержания нормальной микрофлоры в макроорганизме необходимы также пребиотики. Пребиотики – соединения различного немикробного происхождения, способные стимулировать симбиотную флору кишечника (или способные оказывать позитивный эффект на организм хозяина через селективную стимуляцию роста или активизацию метаболической функции нормальной микрофлоры). Наиболее верная тактика лечения дисбактериоза заключается в применении комбинированных пребиотиков, например сочетание энтеросорбента (для нейтрализации патогенных микроорганизмов) и пребиотика (для стимуляции роста нормальной микрофлоры). Пребиотики обеспечивают функциональное питание облигатных бактерий кишечника, являются источником энергии для них, снижают потенциал роста условно - патогенной и патогенной кишечной флоры, стимулируют и активизируют метаболические реакции полезных представителей микрофлоры, усиливают энергообеспечение и регенерацию эпителия толстой кишки, активируют иммунитет, не подвергаются гидролизу пищеварительными ферментами человека, не абсорбируются в верхних отделах пищеварительного тракта, лишены побочных эффектов при длительном использовании. Исследования показали, что высокий уровень нормальной микрофлоры не служит показателем того, что она в полной мере проявляет свои полезные свойства. Под влиянием неблагоприятных факторов может изменяться не только видовой состав бифидо- и лактобактерий, но и их ферментативная активность. Поэтому становится целесообразным одновременное использование про- и пребиотиков. Такие комбинированные биопрепараты получили название синбиотики (полученные в результате рациональной комбинации про- и пребиотиков препараты). Один из механизмов пробиотического действия следующий: обитающие в кишечнике бифидобактерии вырабатывают ферменты типа гидролаз, эти ферменты расщепляют пребиотики, и полученная таким образом энергия, используется бифидобактериями для роста и размножения. Кроме того, в этом процессе образуются органические кислоты. Именно они понижают кислотность среды и тем самым препятствуют развитию патогенных микроорганизмов, которые не обладают ферментами для переработки пребиотиков. Пробиотики и пребиотики широко применяют в производстве молочных продуктов ежедневного рациона человека. Такая продукция полезна как детям, так и взрослым и способствует профилактике различных заболеваний.
При НИИЭМ СО РАМН уже 17 лет существует производство кисломолочного бифидумбактерина, осуществляемое медицинской фирмой «Дисбактериоз». Кисломолочный бифидумбактерин представляет собой стерильное молоко, сквашенное бифидобактериями, и имеет приятный вкус ряженки. Основные технологические этапы производства осуществляются в соответствии с ТУ 9222-001-01898115-94 и ТИ 1-27033654-94 на производство бифидумбактерина кисломолочного и инструкции МЗ СССР по применению кисломолочного бифидумбактерина № 5/33-101-2; М.:1988, с соблюдением санитарных норм и правил для предприятий молочной промышленности и включают следующие операции: подготовка сырья и материалов (приготовление молока из сухого молока или детских смесей) и расфасовка в стеклянную тару с пробками из алюминиевой фольги; стерилизация молока (в автоклавах); приготовление закваски (в стерильных условиях из лиофильно-высушенной производственных штаммов бифидобактерий В.Iongum B379M или B.bifidum 791 готовят рабочий раствор закваски с концентрацией не менее 109 КОЕ/см3); приготовление продукта кисломолочного (внесение закваски, сквашивание в термостатах при 37 - 40С в течение 24 часов); охлаждение (до температуры 4 ± 2С в холодильных камерах); маркировка (этикетка); хранение; реализация. Хранят и реализуют продукт кисломолочный при температуре от 2°С до 6°С в течение 5 суток с момента окончания технологического процесса, в том числе на предприятии-изготовителе не более 18 часов. На всех стадиях производства продукта кисломолочного производят контроль за соблюдением технологических параметров. Технохимический, микробиологический контроль и контроль качества готовой продукции по показателям безопасности осуществляют в соответствии со стандартами на методы, указанными в ТУ на данный продукт. В целях расширения ассортимента присутствующих на рынке бифидопродуктов, нами разработана технология и получены пробные партии новых пробиотических продуктов, относящихся к категории продуктов функционального питания, а именно бифидумбактерина на молочной и белково-растительной основе, обогащенного БАВ из морских гидробионтов (тинростима, ДНК, моллюскама, фукоидана, каррагинана и сочетания 2-х последних). Перспективными в этом плане являются маристим (уникальный комплекс биологически-активных веществ из икры морских ежей с широким спектром активности), кумазид (БАВ из кукумарии) и другие БАВ. Преимущества новых продуктов. А) Высокая эффективность в нормализации микрофлоры кишечника Одно из главных условий эффективности - высокая концентрация живых бифидобактерий (не менее 109-10 на 1 мл). Установлено, что введение в рацион пробиотиков, кисло-молочных продуктов, биологически активных добавок, содержащих штаммы микроорганизмов в обычных низких (106-7) дозах или в виде сухих препаратов, не способно эффективно подавить рост патогенных видов микроорганизмов в толстой кишке. Попадая в желудочно-кишечный тракт, бифидо- и лактобактерии подвергаются действию соляной кислоты в желудке, а затем оставшиеся жизнеспособные штаммы преодолевают иммунную защиту тонкой кишки и антагонистическое влияние ее собственной микрофлоры, и к месту назначения попадает только малая доля необходимых микроорганизмов. Следующим важным условием эффективности новых продуктов является высокая физиологическая активность бифидобактерий. В отличие от сухих, в жидких пробиотиках, к которым относятся полученные нами новые продукты, бактерии находятся в активном состоянии. Свое благотворное воздействие они оказывают незамедлительно после приема препарата. Что касается сухих препаратов, то большинство штаммов бифидобактерий при сушке значительно теряют свою активность и восстанавливают её только после попадания в благоприятную для размножения среду и проделав цикл делений. Им требуется 8-10 часов для перехода к активному физиологическому состоянию, однако к этому времени большая их часть уже может быть естественным образом элиминирована из кишечника. Таким образом, при комплексной терапии дисбактериоза на порядок должны быть увеличены дозы назначаемых пробиотиков и их активность. Полученные нами новые продукты содержат штаммы бифидобактерий (bifidum, longum), обладающие высокой антагонистической активностью по отношению к патогенной и условно-патогенной флоре (сальмонеллам, стафилококку, протею, патогенной кишечной палочке), а также задерживает размножение хеликобактера (одного из главных факторов, провоцирующих заболевания язвой желудка и двенадцатиперстной кишки). Кроме живых бактерий полученные нами напитки содержат продукты жизнедеятельности бифидобактерий, в частности такие биологически активные вещества, как незаменимые аминокислоты, органические кислоты, витамины, интерфероностимулирующие и иммуномодулирующие вещества. Употребление новых продуктов способствуют росту и развитию других представителей нормальной флоры кишечника (в частности, лактобактерий). Б) Возможность использования разными категориями потребителей, в том числе при лактазной недостаточности (в зависимости от основы продукта (молочная, растительная). Как известно, натуральное коровье молоко содержит в значительном количестве молочный сахар лактозу. Лактоза не усваивается в кишечнике в натуральном виде; для ее усвоения необходимо расщепление на простые сахара - глюкозу и галактозу при помощи фермента бета-D-галоктозидазы, более известного как лактаза. По оценкам специалистов до 70% людей страдают недостаточностью фермента лактазы и плохо переносят употребление молочных продуктов. Кроме того, коровье молоко сильный аллерген, а использование его для питания грудных детей и детей, страдающих желудочно-кишечными заболеваниями, затруднено, вследствие повышенного содержания в нем ионов кальция, что приводит к образованию в желудке ребенка плотного, трудно перевариваемого коагулята белка. Перспективным субстратом для бифидумбактерина является молоко на основе соевых бобов и фруктово-овощные соки. Соевое молоко эквивалентно коровьему по биологической ценности, но не содержит ряда белков-аллергенов и лактозы, холестерина. Главными достоинствами соков являются их пищевая и биологическая ценность, обусловленная присутствием углеводов, витаминов, минеральных солей, клетчатки, пектиновых веществ. Кроме того, перечисленные продукты отличаются низкой калорийностью, что позволяет рекомендовать их для функционального питания. Тыквенный сок и соевое молоко оказались прекрасным субстратом для роста и активизации бифидобактерий, содержание которых при добавлении н-ДНК увеличивалось с 109 до 1010 КОЕ/г. Нами (совместно с ТИБОХ ДВО РАН, ТГЭУ и ТИНРО-центром) разработаны технологические режимы приготовления бифидумбактерина на основе соевого молока и тыквенного сока с добавлением н-ДНК (утверждены ТУ и ТИ на продукт на молочно-растительной основе «Бифидум Дальневосточный» (кисломолочный или на основе сои или тыквенного сока с н-ДНК)). Новые продукты на белково-растительной основе (соевое молоко, тыквенный сок) рекомендованы для лиц с лактазной недостаточностью. Органолептические, физико-химические и другие показатели готовых продуктов не отличались от общепринятых. При переносимости коровьего молока применимы разработанные нами продукт кисломолочный с фукоиданом - «Бифидофукус», каррагинаном - «Бифидокрасный», и с их сочетанием – «Бифидокомплекс». Разработана технология производства (ТУ и ТИ) на эти продукты и подана заявка на патент «Кисломолочный напиток». Новые кисломолочные продукты, характеризуются, прежде всего, хорошей усвояемостью. Эти продукты оказывают стимулирующее действие на секреторную активность пищеварительных желез; способствуют нормализации перистальтики кишечника за счет молочной кислоты; способствуют улучшению всасывания микроэлементов (P, Ca, Fe); оказывают гипохолестеринемический эффект; способствуют сорбции и выведению тяжелых металлов. В) Иммуномодулирующий эффект, обусловленный самим пробиотиком, как природным иммуномодулятором, а также полезные эффекты, обусловленные биологической активностью того или иного БАВ. Помимо того, что восстановление нормальной микрофлоры кишечника приводит к реализации последней (ею) иммуномодулирующего действия, БАВ оказывают свои полезные, в том числе иммуномодулирующие эффекты. Г) Показания (рекомендации) к применению новых продуктов Полученные новые бифидопродукты рекомендованы для систематического применения и могут быть отнесены к категории продуктов функционального питания у взрослых. Спектр показаний к их применению довольно широк: дисбактериозы кишечника, кишечные инфекции, колиты, интоксикации различного происхождения, длительное применение антибиотиков, радиационное облучение, стрессы. Показано применение новых продуктов с профилактической целью при нервно-эмоциональном напряжении, повышенных физических и интеллектуальных нагрузках. Новые продукты перспективны для эффективной профилактики многих заболеваний (ОРЗ, гриппа, кишечных инфекций и др.), для детоксикации организма, для восстановления после стрессовых ситуаций, во время и после курса антибактериальной, гормональной, лучевой терапии. Н.Л. Белькова, Е.В. Суханова, Н.Н. Деникина, О.Т. Русинек, Е.В. Дзюба Глава 3. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ В ИЗУЧЕНИИ КИШЕЧНОЙ МИКРОФЛОРЫ ЛОСОСЕВИДНЫХ РЫБ ОЗЕРА БАЙКАЛ: ПРОБЛЕМЫ И РЕШЕНИЯ Введение В настоящее время технология разведения рыб в аквакультуре во многих странах превратилась в одну из наиболее быстропрогрессирующих отраслей производства продовольствия. Российская Федерация по наличию водоемов, отвечающих требованиям культивирования гидробионтов, занимает первое место в мире (Богерук, 2005). Современное развитие аквакультуры, как и всего агропромышленного комплекса, во многом определяется применением в производстве инноваций, базирующихся на использовании научно-технических разработок (Богерук, 2005). Решение острых проблем, выведение рыбной отрасли из многолетнего системного кризиса и достижение поставленной цели возможно только на основе инновационного пути развития экономики рыбохозяйственного комплекса. В настоящее время в нашей стране в разных секторах аквакультуры появляются эффективно работающие рыбоводные хозяйства, в основе деятельности которых лежат инновационные решения, базирующиеся на применении прогрессивных биотехнологий. При разведении рыб, как в естественных, так и в искусственных водоемах, одной из серьезных проблем является изменение трофности водной среды и образование токсичных соединений, вызванных увеличением продуктов животного метаболизма. В этих условиях преимущество для роста и развития получают сапрофитные микроорганизмы, происходит распространение бактериальных, вирусных и грибковых инфекций, что ведет к повышенной смертности объектов культивирования. В рыбоводных хозяйствах широко распространены бактериальные заболевания, объединенные термином "краснуха" карпов: аэромоноз, псевдомоноз, бактериальная геморрагическая септицемия, смешанные бактериальные инфекции (Грищенко и др., 1999; Buller, 2004). Исследования микрофлоры рыб необходимы для контроля и коррекции их питания, для научного обеспечения контроля показателей качества и безопасности сырья и готовой продукции, а также для изучения патогенных бактерий и факторов, способствующих профилактике инфекционных заболеваний (Абрамова, 2004; Извекова и др., 2007; Кириченко и др., 2004; Кузьмина, 2005; Austin, 2002; Buller, 2004). Использование новых, современных технологий в профилактике и терапии заболеваний рыб позволит существенно снизить экономические потери, вызванные массовой гибелью их от инфекционных заболеваний. Молекулярно-генетические методы становятся надежным и удобным инструментом для решения многих прикладных задач в данной области. Методы диагностики бактериальных инфекций на основе видоспецифичной амплификации (ПЦР-диагностика) – современные наукоемкие технологии – показали свое преимущество перед классическими микробиологическими методами детекции и идентификации бактериальных заболеваний рыб: они требуют меньше времени для получения результата и эффективны для детекции заболеваний, особенно на ранних стадиях. ПЦР-диагностика бактериальных инфекций позволяет корректно идентифицировать возбудителей тех болезней, культивирование и определение которых по классическим биохимическим тестам затруднительно. Этот метод активно используется в странах с развитой аквакультурой (Норвегия, Канада и др.), постоянно совершенствуется и развивается (Buller, 2004; Haygood et al., 1992; Haygood, 1993; Van der Maarel et al., 1999; Spanggaard et al., 2000). В настоящее время подобраны специфичные праймеры на патогенные микроорганизмы таких родов, как Aeromonas, Lactococcus, Flavobacterium и др. (Buller, 2004). Известно, что бактериальные клетки имеют различный физиологический статус: живые; жизнеспособные, но некультивируемые; резистентные – споры; мертвые. Определение жизнеспособности клеток имеет принципиальное значение в таких областях использования ПЦР-методологии, как пищевая микробиология (учет активных бактериальных клеток в продуктах питания), медицинская и ветеринарная микробиология. Для детекции живых клеток применяют ОТ-ПЦР и мРНК (Novak, Juneja, 2001; Bentsink et al., 2002), однако возникают определенные трудности, как с воспроизводимостью результатов такого анализа, так и с корректной дифференцировкой живых и мертвых клеток при использовании мРНК в качестве маркерных молекул (McKillip et al., 1998; Sheridan et al., 1998). Другое направление исследований связано с применением методов микроскопии и проточной цитометрии с красителями, позволяющими различать живые и мертвые клетки, такие как Syto 9 или BacLight (Michel et al., 1999; Burnett, Beuchat, 2002; Rudi et al., 2005). Однако в данном случае чувствительность метода существенно ниже, чем ПЦР или подсчет колониеобразующих единиц (КОЕ) (Rudi et al., 2005). Поэтому разработка методологии, позволяющей использовать ПЦР для дифференциации ДНК из живых и мертвых бактериальных клеток, позволит полностью использовать потенциал ПЦР-методологии в микробной диагностике (Lee, Levin, 2009). В настоящее время в мировой научной литературе обсуждаются результаты лабораторных экспериментов по селективному различению ДНК из живых и мертвых бактериальных клеток с помощью производных этидиумбромида (Flekna et al., 2007; Lee, Levin, 2007, 2009; Nocker et al., 2009). Мы сочли, что использование производных этидиумбромида для ингибирования ДНК из мертвых клеток перед проведением ПЦР является наиболее перспективным методом. Цель работы – разработка эффективной методики, позволяющей быстро и корректно детектировать бактериальные инфекции рыб в условиях искусственного содержания с учетом селективной детекции живых и жизнеспособных бактериальных клеток на основе специфичного ингибирования внеклеточной ДНК. Материалы и методы Пробы биологического материала отбирали в карантинном и экспозиционном аквариумах Байкальского музея ИНЦ СО РАН. Исследования выполнены на следующих видах байкальских рыб: а) черный байкальский хариус ( Thymallus baicalensis): три здоровых особи и рыба со слизистыми обрастаниями на внешних покровах, анализировали образцы соскобов около головы, спинного плавника и по боковой линии; б) ленок ( Brachymystax lenok): две особи с язвами на внешних покровах, анализировали ежедневные образцы соскобов слизи в месте язвенных кровотечений в течение 7 дней; в) байкальский сиг ( Coregonus lavaretus baicalensis): две особи с язвами на внешних покровах, анализировали ежедневные образцы соскобов слизи в месте язвенных кровотечений в течение 7 дней; г) байкальский омуль ( Coregonus migratorius): пять внешне здоровых особей, анализировали образцы переднего, среднего и заднего отделов кишечника, соскобов около головы, спинного плавника, по боковой линии. Все образцы отбирали в двух повторностях и подвергали первичной обработке: либо добавление трис-солевого буфера (ТСБ) и использование сразу же для выделения тотальной ДНК, либо суспендирование биологического материала в ТСБ и обработка моноазидом этидиумбромида. Отбор биологического материала и первичная обработка проб. Образцы тканей рыб собирали стерильным скальпелем в пробирки эппендорф и добавляли от 100 мкл до 1 мл трис-солевого буфера в зависимости от объема биологического материала (ТСБ: 10 мМ трис-HCl, pH 7,5; 0,1 M NaCl; 2 мМ ЭДТА). Проводили серию экспериментов по определению оптимальных условий первичной обработки бактериального материала: 1) суспензию биологического материала использовали без фиксации для выделения тотальной ДНК и фиксировали этанолом до конечной концентрации 70%; 2) лизис биологического материала с добавлением понижающих концентраций анавидина (табл. 3) и 3) обработка биологического материала моноазидом этидиум бромида (ЕМА) для удаления внеклеточной ДНК. Для этого к 100 мкл суспензии добавляли 2 мкл ЕМА (50 мг/мл), инкубировали во льду 1 мин при освещении 650 вт. Выдерживали в темноте 20 мин и использовали для выделения тотальной ДНК. Эксперименты выполнены в трех повторностях. Таблица 3 - Схема эксперимента по возможности использования раствора анавидина в качестве лизирующего агента для разрушения бактериальных клеток и последующего выделения суммарных нуклеиновых кислот, пригодных для амплификации
Примечания: * - Анавидин товарный продукт (бочка) ** - Анавидин с запахом лесных трав (№ партии 16-07 МК-6) Интерпретация результатов амплификации: – ПЦР-продукт не был получен ++ получено два ПЦР-продукта как специфический бактериальный, так и неспецифический с ДНК рыбы + получен только неспецифический ПЦР-продукт с ДНК рыбы Выделение ДНК методом ферментативного лизиса проводили с пробами без предварительной обработки, фиксированными 70% этанолом и после обработки ЕМА. Для выделения тотальной ДНК к 100 мкл пробы с биологическим материалом добавляли 300 мкл ТСБ с лизоцимом (10 мкг/мл), лизис проводили в течение 60 мин при 37°С (Белькова и др., 2008). Затем добавляли 25 мкл протеиназы К (10 мг/мл), инкубировали 30 мин при 60°С. Для денатурации белков добавляли 40 мкл 10% SDS и выдерживали 10 мин при комнатной температуре. Проводили три стадии замораживания-оттаивания. Белки и остатки клеточных стенок удаляли фенол-хлороформной экстракцией. К водной фазе добавляли 1/10 объема 3M ацетата натрия (pH 5,0) и 2 объема абсолютного этанола. ДНК осаждали в течение ночи при –20°С, собирали центрифугированием на настольной центрифуге на максимальных оборотах 30 мин (12000 об/мин). Для удаления солей осадок промывали 400 мкл 70% холодного этанола, затем его подсушивали на воздухе и растворяли в 50 мкл ТЕ-буфера (ТЕ: 10 мМ трис-HCl, pH 7,5; 1 мМ ЭДТА). Выделение ДНК из проб после эксперимента с анавидином проводили с помощью сорбента. Обработку лизирующими растворами проводили, как описано в таблице 3. Пробы прогревали 10 мин при 60°С, центрифугировали 15 мин на настольной центрифуге (12000 об/мин), надосадочную жидкость переносили в новую пробирку. К прозрачному лизату добавляли 25 мкл сорбента. Суспензию тщательно суспендировали на вортексе, выдерживали при комнатной температуре 5 мин, периодически перемешивая. Центрифугировали 30 сек при 12000 об/мин, супернатант удаляли, а осадок промывали 400 мкл 70% этанола и подсушивали 30 мин при 60°С. Нуклеиновые кислоты элюировали в 25 мкл ТЕ буфера. Для этого осадок тщательно суспендировали, прогревали в термостате 5 мин при 60°С и центрифугировали 5 мин на настольной центрифуге на максимальных оборотах (12000 об/мин). Надосадочную жидкость тщательно, без сорбента отбирали в новую пробирку и использовали в качестве матрицы в полимеразной цепной реакции (ПЦР). Полимеразная цепная реакция. Выделенную суммарную ДНК использовали в качестве матрицы в ПЦР и подбирали режим, обеспечивающий высокое качество ПЦР-продукта ожидаемой длины на праймерах, комплементарных участкам гена 16S рРНК бактерий с разным уровнем специфичности (табл. 4). Амплификацию вели в разных условиях, в том числе проверяли температуру отжига в градиенте температур от 44 до 72°С в амплификаторе DNA Engine DYADTM. Анализ продуктов амплификации проводили разделением фрагментов ДНК в 1,5% агарозном геле. Таблица 4 - Структуры праймеров, использованных в работе (Белькова, Андреева, 2009)
Амплификацию с лизатами клонов после клонирования проводили на плазмидных праймерах, рекомендованных фирмой производителем и поставляемых в наборе для клонирования (GeneJETTM PCR Cloning Kit, Fermentas). В амплификацию брали 1 мкл лизата. Режим реакции: 94°С – 5 мин (1 цикл), 92°С – 45 сек, 55°С – 45 сек, 72°С – 45 сек (30 циклов). После амплификации ПЦР-продукты анализировали электрофорезом в 1,5% агарозном геле в ТА буфере (2 мМ трис-ацетат, рН 7,6). Полосы нужной длины вырезали из геля. ПЦР-продукты элюировали замораживанием-оттаиванием и использовали для секвенирования. Лигирование ПЦР-продукта и трансформация клеток Escherichia coli. Для лигирования использовали набор GeneJETTM PCR Cloning Kit (Fermentas). Реакцию проводили по рекомендации фирмы-производителя. Компетентные клетки E. coli (штамм XL-1) для трансформации получали, используя методику трансформации CaCl2-зависимых клеток (Sambrook et al., 1989). Анализировали все выросшие колонии. Для быстрого скрининга большого числа колоний использовали метод «кипячения» клеток. Лизат клеток после центрифугирования (15 мин, 12000 об/мин) использовали в качестве матрицы в ПЦР на плазмидных праймерах. Сравнительный анализ. Анализ полученных последовательностей проводили путем их сравнения с последовательностями, зарегистрированными в международной базе данных с помощью пакета программ FASTA (ссылка скрыта). Наличие химерных структур определяли анализом последовательностей с имеющейся базой данных с помощью пакета программ CHECK CHIMERA (ссылка скрыта). Результаты и обсуждение Для разработки эффективной методики, позволяющей быстро и корректно детектировать бактериальные инфекции рыб, необходимо оценить разные подходы для фиксации бактериального материала и выделения тотальной ДНК. Нами для фиксации и лизиса бактериальных клеток были использованы как классические процедуры: фиксация этанолом и выделение ДНК методом ферментативного лизиса, так и апробирована возможность использования новых химических реагентов, лизирующих клеточные стенки бактерий и денатурирующих внутриклеточные белки. Разработка эффективной методики предполагает поиск оптимальных реагентов и условий лизиса в максимально сжатые сроки. Для этой цели нами впервые эффективный антисептик – анавидин, разработанный на основе производных гуанидина в Иркутском институте химии СО РАН (патент РФ N2144024), был использован в качестве реагента, лизирующего клеточные стенки бактерий. Качество полученной ДНК проверяли ПЦР на консервативных бактериальных праймерах (табл. 4). Положительным считали наличие хотя бы одного ПЦР-продукта. Установлено, что оптимальной для лизиса клеток является концентрация анавидина 0,01% и добавление додецилсульфата натрия до конечной концентрации 1% (рис. 1). Таким образом, нами показано, что при низких концентрациях анавидин является эффективным лизирующим реагентом и на его основе возможно создание нового набора для выделения тотальной ДНК. 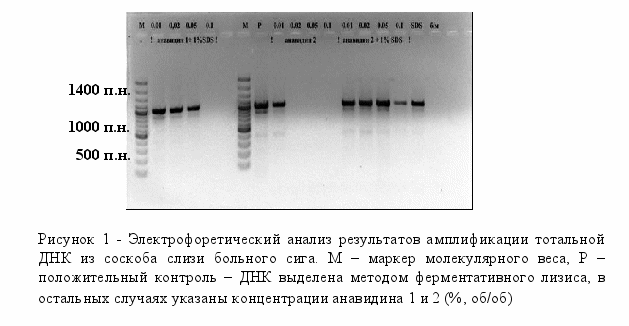 Нами ранее показано, что в результате ПЦР на консервативных праймерах получено два продукта длиной 900 и 1050 пар нуклеотидов (п.н.) (Белькова и др., 2008). Более длинный ПЦР-продукт соответствует фрагменту гена 18S рРНК исследуемого вида рыб. К сожалению, загрязнение ДНК организма-хозяина при проведении видо-специфичной амплификации на бактериальных праймерах приводит к ложно отрицательному результату. Нами использованы праймеры с разным уровнем специфичности для дальнейшей разработки методики (табл. 4). В серии экспериментов показано, что с разных матричных ДНК получается разный спектр целевых ампликонов, неспецифичные полосы могут синтезироваться с ДНК организма-хозяина (рис. 2). На следующем этапе была предпринята попытка селективной амплификации бактериальной ДНК. 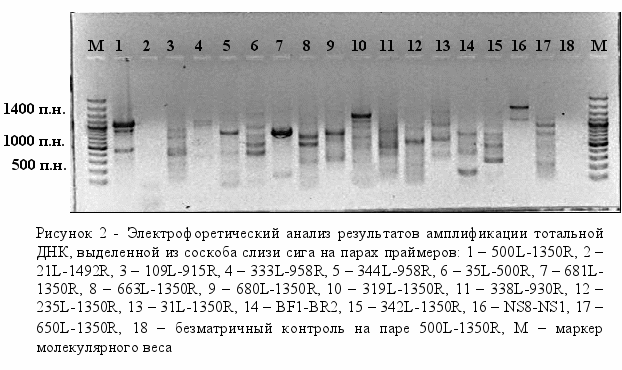 Известно, что этидиумбромид встраивается в двойную цепь ДНК, что способствует ее разрушению при облучении УФ-светом. Установлено, что обработка клеток производным этидиумбромида – моноазидом (ЕМА) с последующим кратковременным освещением светом высокой мощности приводит к селективной инактивации как внеклеточной ДНК, так и ДНК, находящейся в мертвых или частично разрушенных клетках (Nocker, Camper, 2006; Wagner et al., 2008). Механизм этого процесса основан на неспособности этого химического реагента проникать через клеточную стенку жизнеспособных и активных клеток. При мониторинге бактериальных заболеваний существует необходимость получения достоверной информации: из живых или мертвых бактериальных клеток получен ампликон. Актуальность проведения данной диагностики вызвана следующими особенностями: 1) в пробах, взятых с внешних покровов рыб, особенно с травмированных участков тела, присутствуют как бактериальные, так и мертвые (лизированные) клетки эпителия организма-хозяина; 2) специфика профилактики и лечения бактериальных инфекций, заключается в регулярной обработке аквариумов дезинфицирующими средствами, разрушающими клетки микроорганизмов. Мы использовали моноазид этидиумбромида для селективной инактивации внеклеточной ДНК, ДНК отмерших эпителиальных клеток организма-хозяина, а также мертвых бактериальных клеток. Следует отметить, что вся процедура дополнительной обработки занимает несколько минут (обработка светом идет в течение 90 сек). В экспериментах использовали как соскобы с внешних покровов рыб, так и фрагменты кишечника (рис. 3). ПЦР-продукты на некоторых специфичных праймерах, в частности на специфичных праймерах на бактерии рода Bacillus, удалось получить только с тех препаратов ДНК, которые были получены после дополнительной обработки ЕМА. Очевидно, что соотношение ДНК:ЕМА при первичной обработке биологического материала является принципиально важным и должно быть оптимизировано для полного ингибирования ДНК в мертвых клетках. Были проведены предварительные эксперименты по поиску оптимальных концентраций бактериальных клеток для ингибирования ДНК после их разрушения или фиксации на примере культуры грамотрицательных бактерий Escherichia coli. Результаты показали, что фиксация или разрушение клеточной суспензии, титр клеток в которой меньше 1–2×105 кл./мл, и последующая обработка ЕМА приводят к полному ингибированию тотальной ДНК, т.к. не удается получить ПЦР-продукты на праймерах с разным уровнем специфичности. При титре клеток выше 1×106 кл./мл обработка суспензии клеток ЕМА после их лизиса не влияет на получение ПЦР-продукта. 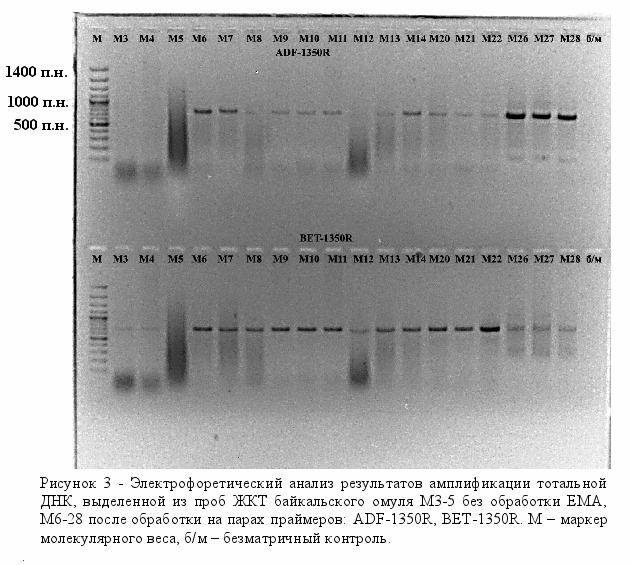 По-видимому, соотношение ДНК:ЕМА в последнем случае не является оптимальным для полного ингибирования ДНК в мертвых клетках. Это соотношение необходимо учитывать при оценке оптимального количества биомассы материала, которое необходимо отбирать при проведении диагностического молекулярно-генетического анализа. Для этого необходимо провести дополнительные эксперименты по определению оптимальных концентрацией ЕМА при обработке микроорганизмов с разным типом клеточной стенки. Однако несомненно, что данный подход является перспективным для дальнейшего исследования и практических рекомендаций. По-видимому, соотношение ДНК:ЕМА в последнем случае не является оптимальным для полного ингибирования ДНК в мертвых клетках. Это соотношение необходимо учитывать при оценке оптимального количества биомассы материала, которое необходимо отбирать при проведении диагностического молекулярно-генетического анализа. Для этого необходимо провести дополнительные эксперименты по определению оптимальных концентрацией ЕМА при обработке микроорганизмов с разным типом клеточной стенки. Однако несомненно, что данный подход является перспективным для дальнейшего исследования и практических рекомендаций.На следующем этапе была проведена диагностика бактериальных инфекций лососевидных рыб, вызываемых Aeromonas hydrophila и Pseudomonas anguilliseptica, в условиях аквариумной экспозиции Байкальского музея ИНЦ СО РАН на основе видо-специфичной амплификации. Эти микроорганизмы широко распространенны в естественных водоемах. В благоприятных условиях рыбы обладают устойчивостью к этим видам и вырабатывают вещества, предупреждающие развитие инфекций. Апробацию метода и подбор условий видо-специфичной амплификации проводили для анализа соскобов с кожных покровов рыб. Положительные ПЦР-продукты были получены только с препаратов ДНК, полученных с внешних покровов рыб с явными проявлениями язвенных заболеваний. Таким образом, разработана эффективная методика, позволяющая корректно детектировать бактериальные инфекции рыб в условиях искусственного содержания с учетом селективной детекции живых и жизнеспособных бактериальных клеток на основе специфичного ингибирования внеклеточной ДНК. Работа поддержана инновационным проектом «Тест-системы для диагностики бактериальных инфекций рыб» 2008 г. ИНЦ СО РАН и выполнена в рамках программы РАН №23, подпрограммы 1, проект 23.13 (2009-2010 гг., рук. Е.В. Дзюба). Библиографический список
А.Г. Гербст | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
