Клинико-генетическое прогнозирование риска развития ишемической болезни сердца 14. 00. 05 внутренние болезни
| Вид материала | Автореферат |
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 127.2kb.
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 118.29kb.
- Стратегия диагностики и лечения ишемической болезни сердца в торако-абдоминальной онкохирургии, 788.25kb.
- Клинико-диагностические критерии супрапищеводных синдромов гастроэзофагеальной рефлюксной, 329.02kb.
- «Ставропольская государственная медицинская академия Федерального агентства по здравоохранению, 889.07kb.
- Клинико-функциональные и метаболические характеристики ишемической болезни сердца, 748.58kb.
- Клинико-неврологические и нейропсихологические особенности ишемической болезни мозга, 367.52kb.
- Лечение и профилактика наиболее распространенных заболеваний кровообращения: гипертонической, 5.54kb.
- Постпрандиальная гиперлипемия и ремоделирование артерий у больных с ишемической болезнью, 420.23kb.
- Расписание лекций по дисциплине «внутренние болезни», 62.03kb.
*Sensitivity – чувствительность, True positive – истинно положительный
**1-Specificity – 1-специфичность, False positive – ложно положительный
Рисунок 4
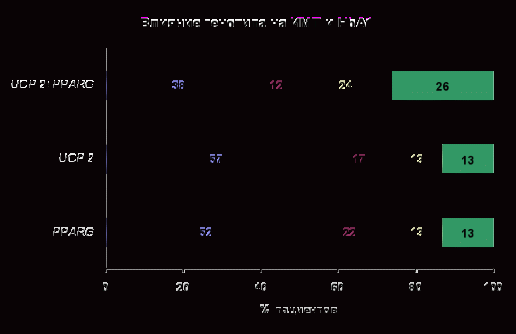
На рисунке 5 представлена частота встречаемости ожирения (ИМТ>30) и повышения гликозилированного гемоглобина (НвА1>6,5) в зависимости от генотипа.


ИМТ<30+HbA1<6.5 ИМТ≥30+HbA1<6.5

 ИМТ<30+HbA1≥6.5 ИМТ≥30+HbA1
ИМТ<30+HbA1≥6.5 ИМТ≥30+HbA1Рисунок 5
Обращает внимание общее возрастание частоты встречаемости фенотипических проявлений при комбинированном генотипе преимущественно за счет увеличения количества пациентов с повышенным уровнем НвА1. Не было выявлено существенных различий показателей инсулина и индекса HOMA в зависимости от генотипа.
Гены PPAR–γ и UCP2 расположены на различных хромосомах, поэтому мы считали их эффект независимым. Для проведения 1 этапа расчета индекса генетического риска (ИГР) по методу, предложенному Horne B. D. с соавт, 2005, в качестве зависимых переменных анализировались глюкоза, НвА1, инсулин, индекс НОМА, ИМТ, ОТ, в качестве независимых переменных – генотипы риска (PP для гена PPAR–γ и A аллель для гена UCP2). Из исследованных показателей только уровень глюкозы натощак и HbA1 независимо ассоциировались с генотипами риска с поправкой на традиционные факторы риска. Учитывая большую информативность HbA1 по сравнению с глюкозой в качестве промежуточного фенотипа был выбран НвА1.
Н
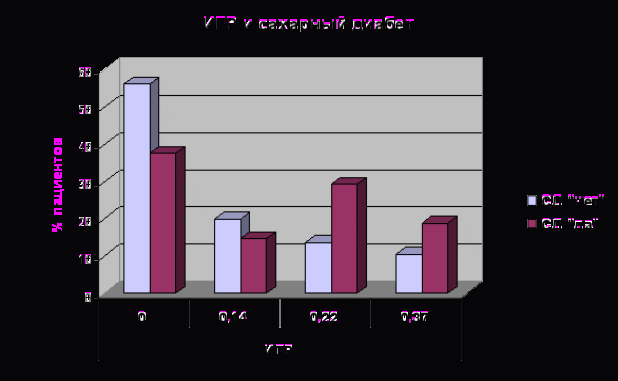 а 2 этапе анализировалась взаимосвязь промежуточного фенотипа (HbA1 – независимая переменная) с клиническими исходами (СД 2 типа, ИБС – зависимые переменные). Анализ с помощью логит-регрессии подтвердил ассоциацию СД с HbA1 (B1 коэффициент-0,458, p<0,0001) и с ИБС (B1 коэффициент-0,375, p<0,036).
а 2 этапе анализировалась взаимосвязь промежуточного фенотипа (HbA1 – независимая переменная) с клиническими исходами (СД 2 типа, ИБС – зависимые переменные). Анализ с помощью логит-регрессии подтвердил ассоциацию СД с HbA1 (B1 коэффициент-0,458, p<0,0001) и с ИБС (B1 коэффициент-0,375, p<0,036).Рисунок 6
Ниже представлены расчеты индекса генетического риска:
ИГРобщ СД = (B I / |Bmax|) β ij S j = (0,458/0,458) x 0,141GG+0,224PP =0,365
На рисунке 6 представлена взаимосвязь между ИГР и частотой встречаемости СД. Возрастание ИГР приводит к увеличению частоты встречаемости СД. Анализ с помощью критерия χ2 (9,59, p<0,002) подтвердил ассоциацию ИГР с СД, подтверждая различия между группами.
Не наблюдалась эта закономерность для ИБС, так как сахарный диабет – один из многих факторов риска заболевания. В нашем исследовании среди изученных аллелей риска генов, участвующих в метаболизме углеводов, только А аллель (UCP2) напрямую ассоциировался с ИБС. Анализ промежуточного фенотипа (HbA1) и изучение генетических ассоциаций с СД 2 типа выявил не менее важную роль второго гена PPAR–γ, метаболически взаимосвязанного с UCP2. Комбинация генотипов риска UCP2 c PPAR–γ также ассоциировалась с ИБС (p<0,03).
Мы продемонстрировали, что комбинация полиморфных вариантов этих генов увеличивает риск развития, как промежуточных фенотипических проявлений, так и клинических исходов. Учет фенотипических проявлений генетического риска – также путь к улучшению стратификации риска исходов. Ограничения изучения ИГР у пациентов с СД: мы изучали ограниченный спектр генов на небольшой группе пациентов. В нашем исследовании использовался один полиморфный вариант для каждого из изученных генов-кандидатов, участвующих в углеводном обмене, предполагая, что данный вариант является лучшим маркером риска.
Для исследования структурных маркеров атеросклероза пациентам проводились дуплексное сканирование брахиоцефальных артерий, эхокардиография и многосрезовая компьютерная томография сердца. Изученная комбинация структурных маркеров атеросклероза имеет очень хорошие аналитические характеристики для прогнозирования коронарного риска (AUC ROC составляет 85 %), по нашим данным. Безусловно, клинические исходы являются наиболее ценным показателем любых исследований, однако их изучение требует много времени и средств. Маркеры атеросклероза предложены в качестве альтернативных конечных точек. Они позволяют сэкономить время и деньги, чтобы внедрить новые профилактические стратегии у пациентов в группе риска.
Построение дерева регрессии (рекурсивное разбиение).
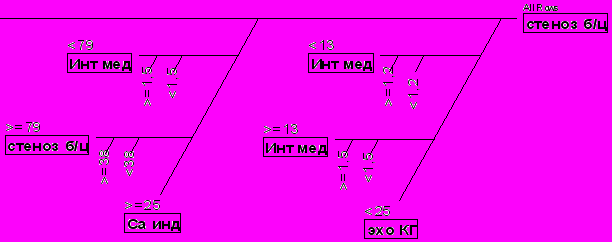
Рисунок 7
С помощью статистической программы SAS JMP7 (построение дерева регрессии) мы приводим алгоритм скрининга ИБС с использованием структурных маркеров атеросклероза, рассчитанный по результатам нашего исследования (рис. 7). Оптимальные точки разделения и порядок проведения исследований оптимизирован с учетом статистической значимости показателей.
Толщина комплекса интима-медиа (КИМ) является промежуточным фенотипическим проявлением раннего атеросклероза. Учитывая простоту и неинвазивность исследования, этот показатель может использоваться в качестве скринингового маркера. На первом этапе проводится УЗДГ брахиоцефальных артерий. При выявлении атеросклеротических бляшек, стенозирующих просвет сосуда >25%, целесообразно выполнение МСКТ, <25% - ЭхоКГ. Оптимальная точка разделения – показатель кальциевого индекса (Са инд) = 79 при МСКТ, при ЭхоКГ – гипертрофия левого желудочка >13 мм.
Генотипы риска развития ИБС, совпадают с полиморфными вариантами генов, ассоциирующимися со структурными маркерами атеросклероза, лишь частично. При анализе результатов генетического обследования только ε4 аллель гена ApoE ассоциируется как с риском развития коронарных событий, так и со структурными маркерами атеросклероза. Полиморфизм гена AGTR2 (3123 C>A) ассоциируется с меньшей толщиной КИМ, выраженностью стеноза брахиоцефальных артерий и гипертрофии левого желудочка, т.е. он обладает защитным действием.
Мы изучили гипотезу о том, что различные морфологические ангиографические признаки ИБС имеют генетическое происхождение. Результаты проведенного исследования демонстрируют ассоциацию ангиографических признаков с полиморфными вариантами различных генов (табл. 4).
Изученные полиморфные варианты генов, участвующих в липидном обмене, ассоциируются с количеством стенозов левой коронарной артерии и протяженными стенозами (PON1), а также с кальцинозом коронарных артерий (ApoСIII). Среди генов, принимающих участие в воспалении, отмечена ассоциация полиморфных вариантов гена TNF α с дистальной локализацией атеросклеротических бляшек и эктазией коронарных артерий, гена UCP2 - с коронарографическим индексом. Кроме того, А аллель гена UCP2 и генотип P12P гена PPAR–γ ассоциируются с кальцинозом коронарных артерий.
Среди генов, принимающих участие в тромбообразовании, А аллель гена FV и С аллель гена GPIIIа ассоциируются с проксимальной локализацией стенозов. Кроме того, Лейденовская мутация гена FV(R506Q) чаще выявляется у пациентов с распространенным поражением коронарного русла (отмечена корреляция с количеством стенозов, диффузным поражением коронарных артерий). Изученный полиморфный вариант гена PLAT ассоциируется с поражением ствола и локализацией стенозов в области бифуркации.
Таблица 4
Ангиографические признаки ИБС и биомаркеры.
| Ангиографические признаки | Биомаркеры | ||
| Распространенность | |||
| Количество сосудов, % | ЛП а (p<0,05), AGTR1(p<0,02) | ||
| Количество стенозов ЛКА* | F V(p<0,05), PON1(p<0,05) | ||
| Количество стенозов ПКА** | F V(p<0,04), BKR2(p<0,05) | ||
| Диффузное поражение ЛКА, % | TNF α(p<0,05), F V(p<0,02) | ||
| Диффузное поражение ПКА, % | гомоцистеин(p<0,03), F V(p<0,02), ACE(p<0,03), BKR2(p<0,004) | ||
| Локализация стенозов | |||
| ЛКА, % | ЛП а (p<0,02), AGTR1 (p<0,04), PLAT(p<0,006), REN(p<0,05) | ||
| Ствол, % | гомоцистеин(p<0,0001), REN(p<0,002), PLAT(p<0,005) | ||
| Проксимальная, % | hs-CRP (p<0,03), F V(p<0,001), GPIIIa(p<0,003), AGT(p<0,003) | ||
| Дистальная, % | hs-CRP(p<0,02), TNF α | ||
| Бифуркационная, % | AGTR2(p<0,02), ApоCIII(p<0,016), PLAT(p<0,04) | ||
| Количественная оценка тяжести | |||
| Коронарографический индекс | НвА1(p<0,05), UCP2(p<0,009) , BKR2(p<0,04) | ||
| Морфология поражений | |||
| Стеноз >10мм, % | TNF α(p<0,03), PON1 (p<0,02) | ||
| Эктазия коронарных артерий,% | TNF α (p<0,04) | ||
| Кальциноз коронарных артерий,% | ОХС (p<0,01), UCP2 (p<0,04), ApоCIII (p<0,03), AGTR2(p<0,04), PPAR–γ(p<0,02) | ||
ЛКА* левая коронарная артерия, ПКА** правая коронарная артерия
Таким образом, прогностически неблагоприятная локализация атеросклеротических бляшек в области ствола и проксимальных отделах левой коронарной артерии также генетически детерминирована. Возможно, это связано с различным онтогенетическим происхождением: проксимальные отделы коронарных артерий развиваются из стенок артериального ствола, а дистальные – из субэпикардиальных ветвей коронарных артерий.
Полиморфные варианты генов ренин-ангиотензиновой системы ассоциируются с распространенностью атеросклеротических изменений, выявляемых при коронарографии, проксимальной и бифуркационной локализации стенозов в системе левой коронарной артерии, а также с тяжестью коронарографических изменений (табл. 4).
Большинство генетических ассоциативных исследований используют дихотомический подход: есть или нет ИБС, независимо от морфологических особенностей заболевания. По нашим данным, это одна из немногих попыток сопоставить комплексный фенотип коронарного атеросклероза с результатами генетических и лабораторных исследований в Российской популяции.
Анализ данных методами теории распознавания.
Задача прогноза заключается в распознавании между двумя классами: класс
 образуют признаковые описания пациентов, у которых не было ИБС, класс
образуют признаковые описания пациентов, у которых не было ИБС, класс  - пациенты, страдающие ИБС (в последнем случае признаковые описания формировались до заболевания). Общая схема анализа полученных данных и прогноза состояла в следующем: на первом этапе применялся метод голосования по логическим закономерностям (ЛЗ) для заданной таблицы обучения.
- пациенты, страдающие ИБС (в последнем случае признаковые описания формировались до заболевания). Общая схема анализа полученных данных и прогноза состояла в следующем: на первом этапе применялся метод голосования по логическим закономерностям (ЛЗ) для заданной таблицы обучения. Основная процедура: «Вычисляются ЛЗ классов и оценивается в режиме скользящего контроля точность прогноза методом ЛЗ. Вычисляются оценки информативности всех признаков и исключаются признаки наименее информативные». Основная процедура повторяется до достижения такой подсистемы признаков, сокращение которой ухудшает точность распознавания относительно исходной на заданный порог. Исходно анализировалось 89 показателей.
На первом этапе были выявлены признаки, которые продемонстрировали недостаточную информативность и отсутствие влияния на прогноз. В результате была сформирована таблица обучения, в которую вошли наиболее информативные показатели, представленные в таблице 5.
Таблица 5
Группы признаков и изучаемые показатели
| Группы признаков | Изучаемые показатели |
| Традиционные факторы риска | Возраст, пол, семейный анамнез, курение, ИМТ, гипертония (АД сист, АД диаст), диабет, липидный профиль |
| Лабораторные маркеры | ЛП а, гомоцистеин, hsCRP, фибриноген, Д-димер, HbA1, мочевая кислота |
| Инструментальные маркеры | % стеноза брахиоцефальных артерий, степень гипертрофии левого желудочка при ЭхоКГ, кальциевый индекс при МСКТ |
| Генетические маркеры | ApoE4 ε4 аллель, PAI 4G/4G, GPIIIa T 196C (Т/С+С/С), UCP2 G866A (A аллель), PON1 Gln192Arg (Gln/Arg+Arg/Arg), ApoCIII 3238 (G/G), ecNOS (4/4), ACE D аллель, FV R506Q (G/A+A/A), FII G 20210A (GA+AA), FGB G 455A (AA), MTHFR С 677T (TT), TNFα G 238A (G/A+A/A), PPAR–δ T 294C (T/T+T/C), PPAR–α G 2528C (G/C+C/C), ГИ |
При анализе генетических маркеров с помощью системы «РАСПОЗНАВАНИЕ» удалось выбрать генотип, оптимальный для прогнозирования.
Из дальнейшего рассмотрения исключались генотипы, которые имели близкие к нулевым оценки информативности, по мнению метода «логические закономерности» и не имели содержательного толкования.
На основании проведенного анализа для расчета генетического индекса (ГИ) из 29 полиморфных вариантов изученных генов были отобраны 15.
Для каждого пациента рассчитывался индивидуальный ГИ, представляющий собой суммарное количество имеющихся аллелей риска + семейный анамнез. Показатели индивидуального генетического индекса колебались от 0 (отсутствие аллелей риска ИБС и семейной отягощенности) до 8 полиморфных вариантов изученных генов (рис. 8).
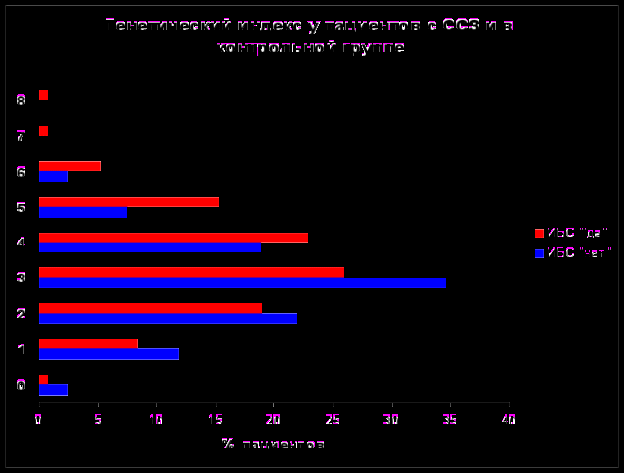
Рисунок 8
Анализ, выполненный с помощью логистической регрессии, выявил независимую ассоциацию ГИ с ИБС с поправкой на традиционные факторы риска (p=0,0002). Отношение шансов составило 2,03, что превышает показатели для большинства отдельных генетических маркеров. Мы проанализировали роль генетических признаков в распознавании ИБС. Распознавание только по генетическим признакам дает в среднем 60% правильных ответов. Это показывает, что генетическая информация влияет на отделимость классов, но в малой степени. Это соответствует результатам, полученным методами традиционной статистики. Площадь под характеристической кривой для ГИ составила 62%. Таким образом, на сегодняшний день изученные генетические маркеры играют вспомогательную роль в прогнозировании коронарного риска.
Мы проанализировали влияние генетических маркеров на стратификацию риска. В результате построения дерева регрессии и рекурсивного разбиения пациентов мы выяснили, что оптимальная точка разделения (порог отсечения) пациентов ИБС и контрольной группы - ГИ ≥ 5.
Мы разделили пациентов на 2 группы в зависимости от значения ГИ: 1 группа – ГИ <5, 2 группа – ГИ ≥5, и проанализировали частоту встречаемости этого показателя у пациентов с различными категориями риска. На рисунке 7 представлено распределение пациентов ИБС и контрольной группы с низким и средним риском, определенным в соответствии с традиционным алгоритмами (именно среди этих пациентов наиболее важно уточнение категории риска), в зависимости от значения ГИ.
Стратификация риска и ГИ
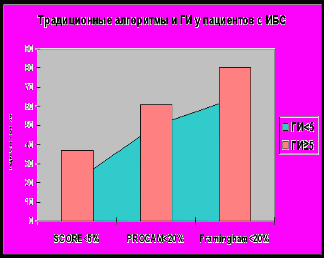
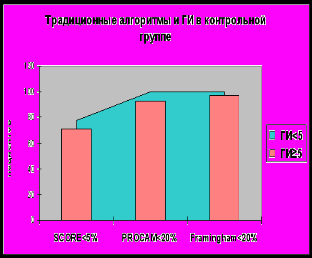
Рисунок 9
Добавление генетических маркеров к традиционным (клиническим) факторам риска приводит к повышению категории риска у пациентов с ИБС в 15,4 %, 10,8% и 15,8% наблюдений по шкалам SCORE, PROCAM и Framingham, соответственно, и не влияет существенно на стратификацию риска в контрольной группе. Добавление генетических маркеров к клиническим данным не только улучшает прогностическую значимость оценки коронарного риска в целом, но и может повышать категорию риска коронарных событий.
С целью оптимизации прогностических маркеров мы проанализировали несколько версий изучаемых показателей (влияние пола, возраста и сахарного диабета на качество прогноза). Мы изучали отдельно выборку, состоящую из мужчин, женщин, пациентов без диабета, и не получили существенных различий в качестве прогноза с использованием различных математических алгоритмов. Отдельно мы проанализировали пациентов молодого возраста (мужчины < 55 лет, женщины < 65 лет), и отметили улучшение качества прогноза в этой группе. Это вполне объяснимо, так как 16 из изучаемых показателей имеет отношение к генетическим маркерам. Изучение наследственной предрасположенности к развитию ИБС более актуально у молодых пациентов. Проанализировав полученные данные, мы пришли к выводу, что большинство ошибок прогноза на нашей выборке связано с тем, что многие пациенты в контрольной группе имели так называемые «эквиваленты ИБС». К которым, в соответствии с последней редакцией руководства АТР III (Grundy S.M., 2004), относятся клинические проявления атеросклероза внекоронарной локализации: атеросклероз артерий нижних конечностей, аневризма брюшного отдела аорты, атеросклероз брахиоцефальных артерий (транзиторные ишемические атаки и/или ишемический инсульт и/или обструкция более 50% просвета сонных артерий), диабет или по крайней мере 2 фактора риска с 10 летним риском коронарных событий > 20%. Для оптимизации процедуры прогнозирования мы переклассифицировали больных с учетом этих критериев, что позволило значительно улучшить качество прогноза.
В таблице 6 представлены результаты анализа с использованием различных систем признаков. В первом столбце представлены результаты оценки точности прогноза по системе из 41 признака (25 «базовых» и 16 «генетических»). Второй столбец соответствует базовым признакам, третий – только генетическим.
Таблица 6
Точность прогноза различных методов распознавания
| Методы распознавания | количество признаков | |||||
| 41 | 25 | 16(ген) | 21 | 17 | 12 | |
| Голосование по тупиковым тестам | 79.0 | 79.7 | 66.2 | 78.3 | 80.3 | 79.0 |
| Бинарное решающее дерево | 75.5 | 75.9 | 63.1 | 76.9 | 71.7 | 70.7 |
| Логические закономерности | 82.1 | 82.8 | 55.2 | 82.8 | 81.7 | 80.0 |
| Линейный дискриминант Фишера | 81.4 | 83.1 | 60 | 82.1 | 82.1 | 80.0 |
| Линейная машина | 85.9 | 89.0 | 65.5 | 84.8 | 82.1 | 78.3 |
| k-ближайших соседей | 78.6 | 80.3 | 53.8 | 80.7 | 73.1 | 78.6 |
| Метод опорных векторов | 83.4 | 84.1 | 57.9 | 82.8 | 83.8 | 79.3 |
| Голосование | 86.9 | 87.9 | 63.1 | 87.2 | 85.5 | 79.3 |
В столбцах 4-6 представлены подсистемы из 21, 17 и 12 признаков, полученные из исходных 41 с использованием первого этапа сокращения признаков. Результаты 3-го столбца показывают, что прогноз по одним генетическим параметрам пациентов фактически невозможен. Распознавание только по генетическим признакам не превышает 66% правильных ответов. Это показывает, что генетическая информация в изолированном виде влияет на отделимость классов, но в малой степени. Однако три генетических признака входят в информативную подсистему из 17 признаков и 2 генетических признака вошли в максимально сокращенный набор признаков (12 признаков), позволяющих разделить классы, причем один из этих признаков ГИ, отражающий суммарное количество имеющихся аллелей риска + семейный анамнез. Это свидетельствует о перспективности исследования влияния генетических маркеров с использованием расширенных и уточненных обучающих выборок.
После использования метода ЛЗ на исходной выборке из 290 объектов, были удалены объекты, на которых были совершены «грубые ошибки» (оценка за ложный класс превосходит оценку за истинный в 5 и более раз), а также объекты, у которых оценка за каждый класс была менее 0,1. Удаленные объекты можно рассматривать как ошибочные для соответствующего класса или нетипичные для обучающей выборки. После удаления 5.5% объектов, сокращенная выборка из 274 объектов представляет более качественное описание выборки, что позволило получить более точные оценки важности признаков методом ЛЗ.
Б
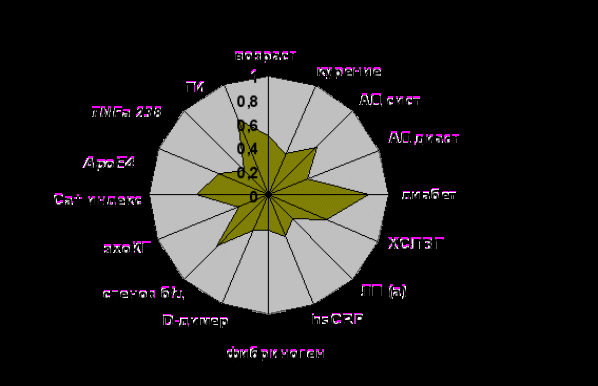 ыло проведено 5 экспериментов при различных значениях управляющих параметров, по результатам которых была сформирована подсистема из 16 признаков. Признак считался информативным, если его вес в каждом эксперименте был не ниже 0.2 (веса признаков представлены графически на рис. 10).
ыло проведено 5 экспериментов при различных значениях управляющих параметров, по результатам которых была сформирована подсистема из 16 признаков. Признак считался информативным, если его вес в каждом эксперименте был не ниже 0.2 (веса признаков представлены графически на рис. 10). 