Клинико-генетическое прогнозирование риска развития ишемической болезни сердца 14. 00. 05 внутренние болезни
| Вид материала | Автореферат |
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 127.2kb.
- Задачи : Формирование 2-х клинических групп обоего пола: 30 пожилого возраста (65-86, 118.29kb.
- Стратегия диагностики и лечения ишемической болезни сердца в торако-абдоминальной онкохирургии, 788.25kb.
- Клинико-диагностические критерии супрапищеводных синдромов гастроэзофагеальной рефлюксной, 329.02kb.
- «Ставропольская государственная медицинская академия Федерального агентства по здравоохранению, 889.07kb.
- Клинико-функциональные и метаболические характеристики ишемической болезни сердца, 748.58kb.
- Клинико-неврологические и нейропсихологические особенности ишемической болезни мозга, 367.52kb.
- Лечение и профилактика наиболее распространенных заболеваний кровообращения: гипертонической, 5.54kb.
- Постпрандиальная гиперлипемия и ремоделирование артерий у больных с ишемической болезнью, 420.23kb.
- Расписание лекций по дисциплине «внутренние болезни», 62.03kb.
* - p<0,05 при сравнении с контрольной группой, p**- сравнение группы ССС (ИМ+НС+ИС) с контрольной группой.
Среди показателей липидного профиля наиболее показательно отношение ОХС/ХС ЛВП. Уровень гомоцистеина был значимо выше среди пациентов с инсультами. Уровень фибриногена был достоверно повышен у всех пациентов с сердечно-сосудистыми заболеваниями.
10-летний риск возникновения ССЗ (по шкале Фрамингем) в группе здоровых составил в среднем 3,4+0,3%, в группе пациентов с сердечно-сосудистыми событиями – 11.6+0,6%. 10-летний риск фатальных сердечно-сосудистых осложнений (по шкале SCORE) в контрольной группе составил 4,69±0,48%, в группе с ССЗ - 11,27±0,79%. Мы сравнили прогностическую значимость общепринятых алгоритмов (Framingham, PROCAM, SCORE) на изучаемой выборке пациентов. Традиционные факторы риска ИБС оценивались ретроспективно по материалам компьютерной базы данных до развития коронарных событий. Среди пациентов с ИБС у 51 % риск заболевания, оцененный с помощью алгоритма PROCAM, оказался > 20 %, в то время как для алгоритма Фрамингем этот показатель составил всего 35%. При оценке фатального риска сердечно-сосудистых событий по таблице SCORE показатели риска ≥ 5% отмечались у 76,2% пациентов, от 1 до 4 % - у 23% и < 1% - у 0,8% (рис.1). Однако все три алгоритма (Framingham, PROCAM, SCORE) недооценили риск у 65%, 49% и 23,8% пациентов, соответственно. По нашим данным, наиболее адекватна оценка фатального риска по шкале SCORE. Анализ традиционных алгоритмов оценки коронарного риска с помощью построения дерева регрессии выявил, что оптимальная точка разделения пациентов с коронарными событиями и контрольной группы для шкалы SCORE составляет 3%, для алгоритма Framingham – 8%, для алгоритма PROCAM - 13%, что свидетельствует о недооценке тяжести заболевания преимущественно среди пациентов в группе среднего риска.
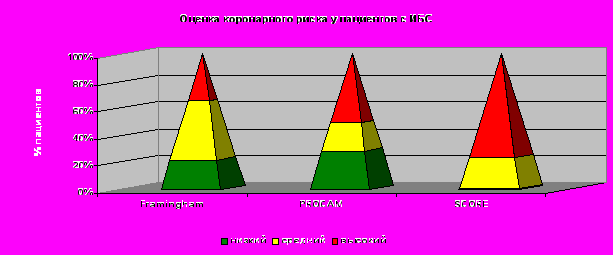
Рисунок 1
При анализе результатов генетического обследования ε4 аллель гена ApoE, 4G/4G генотип гена PAI-1, C аллель гена GPIIIa T196C и А аллель UCP2 G866A статистически значимо ассоциировались с риском развития ИБС с поправкой на традиционные факторы риска. В таблице 2 представлено отношение шансов развития ИБС. Отношение шансов развития ИБС для полиморфных вариантов этих генов колеблется от 1,54 до 1,73, и составило в среднем 1,67, по нашим данным.
Таблица 2
Влияние генотипа на риск ИБС
| ген | генотип | ИБС N=131/% | контроль N=159/% | ОШ*(ДИ*) | χ2* | р |
| ApoE ε2,ε3, ε4 | ε 4 аллель | 30/22,9 | 23/14,5 | 1,76(1,01-3,33) | 4,01 | 0,03 |
| PAI-1 4G/5G | 4G/4G | 44/33,5 | 36/22,6 | 1,73(1,02-2,50) | 4,31 | 0,02 |
| GPIIIa T196C | С аллель | 44/33,5 | 37/23,3 | 1,66(1,00-2,79) | 3,80 | 0,03 |
| UCP2 G866A | А аллель | 40/30,5 | 33/20,8 | 1,53(1,00-2,18) | 3,75 | 0,04 |
χ2***- критерий хи-квадрат (двусторонний тест Фишера).
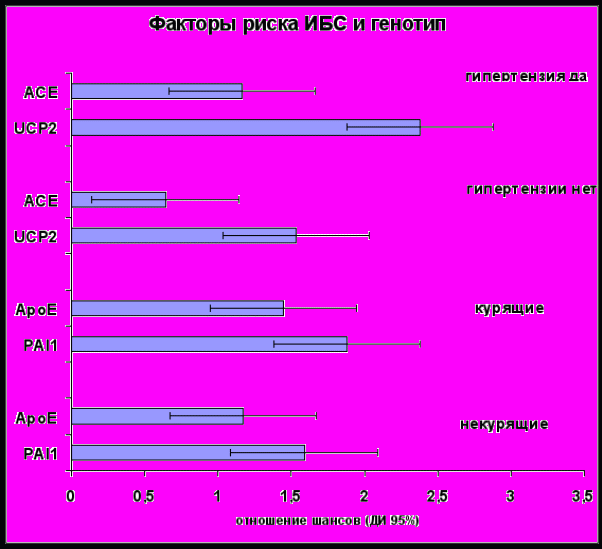
Рисунок 2
Ассоциация генетических маркеров с ИБС различается в зависимости от факторов риска (артериальная гипертензия, сахарный диабет 2 типа, атерогенная дислипидемия, курение сигарет), что является подтверждением участия средовых факторов в фенотипической реализации генетической предрасположенности (рис.2). Необходимым условием интерпретации генетических исследований является изучение их взаимодействия с другими факторами риска. Мы обнаружили возрастание риска ИБС у курящих пациентов с полиморфными вариантами генов ApoE и PAI1 по сравнению с некурящими. Отношение шансов достоверно p<0,05возрастает c 1,17 до 1,45 у носителей ε4 аллеля гена ApoE и с 1,59 до 1,88 у пациентов с 4G/4G генотипом PAI1. Наличие артериальной гипертензии у носителей А-аллеля гена UCP2 и D-аллеля гена ACE также ведет к возрастанию риска заболевания. ОШ развития ИБС у носителей D аллеля гена ACE и А аллеля UCP2 изменялось с 0,64 до 1,16 и с 1,53 до 2,38, соответственно (р<0,05) в зависимости от наличия артериальной гипертензии, что является проявлением «ген-среда» взаимодействия, и необходимо учитывать при стратификации риска.
Мы изучили полиморфные варианты генов, имеющие отношение к различным звеньям патогенеза ИБС. Взаимодействие между генами и факторами риска может играть решающую роль в патогенезе заболевания. Так как вклад отдельных генов в риск развития ИБС невелик, обычно не превышает 2, и в среднем составляет 1,2-1,4 (Arnett D.K. 2007), интерпретация результатов генетических исследований невозможна без учета факторов риска.
Мы изучили также диагностическую значимость генетических маркеров в комбинации с традиционными факторами риска для оценки риска развития сердечно-сосудистых осложнений.
Таблица 3
Генотип и риск сердечно-сосудистых событий
| Ген | Генотип | ССС n=255/(%) | Контроль n=194/(%) | ОШ* | ДИ** 95% |
| MTHFR С677T | С/T | 125 (49%) | 102 (52,5%) | 0,87 | 0,60-1,27 |
| T/T | 26 (10,2%) | 17 (8,8%) | 1,19 | 0,63-2,26 | |
| ACE I/D | I/I | 64 (25,0%) | 44 (22,7%) | 0,78 | 0.50-1,21 |
| D аллель | 191 (74,9%) | 150 (77,3%) | 1,10 | 0,70-1,71 | |
| D/D | 53 (20,8%) | 49 (25,3%) | 0,82 | 0,53-1,28 | |
| ApoE | ε2 аллель | 37 (14,6%) | 24 (12,4%) | 1,21 | 0,69-2,09 |
| ε2+ε4 аллели | 91 (35,8%) | 57 (29,4%) | 1,34 | 0,89-2,00 | |
| ε4 аллель | 66 (25,9%) | 25 (12,9%) | 1,45 | 1,03-2,93 |
ОШ*- отношение шансов, ДИ** - 95% доверительный интервал ОШ
Пациенты с большими сердечно-сосудистыми осложнениями ССО (инфаркт миокарда, нестабильная стенокардия, ишемический инсульт) были объединены в одну группу. Были изучены полиморфные варианты в 3 генах: ApoE (ε2, ε3, ε4), ACE (I/D), MTHFR(677С>T). При анализе результатов генетического обследования среди 3 изученных полиморфизмов только у ε4 аллеля гена ApoE была выявлена независимая статистически значимая ассоциация с риском развития сердечно-сосудистых событий (табл.3).
Среди больных с инсультом не было выявлено статистически значимой ассоциации ни с одним из исследованных генетических маркеров. Однако комбинация ε4 аллеля гена ApoE с гомозиготным полиморфизмом гена MTHFR(677ТT) и комбинация D аллеля гена ACE с гомозиготным полиморфизмом гена MTHFR(677ТT) достоверно ассоциировались с инсультом (p=0,04 и p=0,03, соответственно). Общность патогенеза этих сердечно-сосудистых катастроф определяет высокую перекрестную эффективность стратегий их профилактики.
Существенным аспектом нашего исследования является сопоставление генотипа с фенотипическими лабораторными маркерами, а также сравнительная и комбинированная оценка множественных биомаркеров для прогнозирования ИБС. При анализе влияния генотипа на показатели липидного профиля была выявлена ассоциация носительства ε4 аллеля гена ApoE с ТГ (r=0,164,p<0,005), ХС (r=0,174,p<0,04) и ХС ЛНП (r=0,183,p<0,03). Мы провели анализ взаимосвязи ЛП (а) с семейным анамнезом ИБС и выявили, что среднее значение ЛП (а) составляет 26,24±2,37 мг/дл у пациентов без наследственной отягощенности и 35,44±2,99 мг/дл (p<0,04) у пациентов с наследственной отягощенностью. Кроме того, у пациентов без семейного анамнеза ИБС 81% показателей ЛП (а) было в норме (<40 мг/дл), у пациентов с семейным анамнезом только 60% находились в пределах нормальных значений.
Р
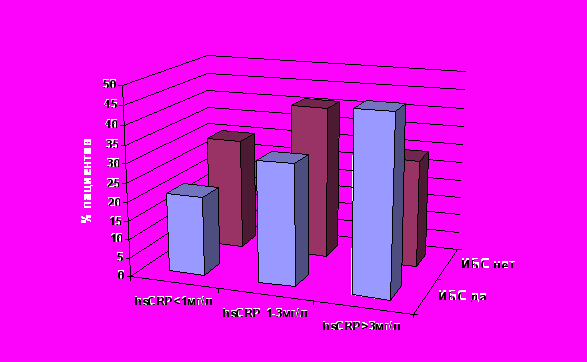 аспределение пациентов в зависимости от уровня hsCRP
аспределение пациентов в зависимости от уровня hsCRPРисунок 3
Среди воспалительных маркеров hs-CRP и D-димер были выше у пациентов с ИБС (p<0,05).
На рисунке 3 представлено распределение пациентов в зависимости от уровня hs-CRP у пациентов с ИБС и в группе контроля. Уровень hsCRP <1 мг/л, от 1 до 3 мг/л и >3 мг/л соотносят с низким, средним и высоким риском ИБС соответственно, согласно рекомендациям экспертной панели AHA/CDC (Pearson T.A., 2003).
Базовый уровень CRP, определяемый высокочувствительным методом (hsCRP), отражает вялотекущее воспаление в интиме сосуда и проспективно определяет риск развития сосудистых осложнений, дополняя прогностическую информацию, которую дают классические факторы риска. Мы не обнаружили корреляции между уровнем фибриногена и полиморфным вариантом гена FGB (455G>A), а также ассоциации А аллеля с ИБС, что в целом сопоставимо с результатами других исследований (Smith G.D., 2005).
Мы проанализировали влияние уровня фолиевой кислоты и витамина В12 в сыворотке на содержание гомоцистеина. Была выявлена слабая корреляция (r=-0,23, p<0,05) между уровнем гомоцистеина и содержанием фолиевой кислоты. Выявлена ассоциация между генотипом MTHFR(677С>T) и содержанием гомоцистеина в сыворотке (r=0,154,p<0,009). При сопоставлении генотипа с уровнем гомоцистеина статистически значимая ассоциация была выявлена у пациентов с гомозиготным полиморфизмом гена MTHFR(677ТT) (p=0,009). Гетерозиготный полиморфизм гена MTHFR(677СT) не ассоциировался с уровнем гомоцистеина (p=0,43). Кроме того выявлена слабая ассоциация уровня гомоцистеина с А аллелем гена UCP2 (G866A) r=0,134, p<0,02 и полиморфным вариантом гена PON1(Gln192Arg) r=0,128, p<0,03.
Среди дополнительных маркеров hs-CRP и D-димер были независимыми предикторами ИБС у обследованных пациентов. Добавление hs-CRP, ЛП (а) и D-димера к традиционным факторам риска значимо улучшает прогностическую значимость скрининга в отличие от фибриногена и гомоцистеина. C-реактивный белок в нашем исследовании оказался более сильным предиктором риска ИБС, чем ХС ЛНП.
Для количественной оценки диагностической ценности исследований рассчитывалась площадь под характеристической кривой (AUC ROC). AUC ROC для hs-CRP составила 62%, для ХС ЛНП – 54 %. Площадь под характеристической кривой (AUC ROC) для модели, включающей традиционные факторы риска и дополнительные лабораторные маркеры, составила 82 %. Добавление генетических маркеров (ApoE ε2, ε3, ε4, PAI-1 4G/5G, GPIIIa T196C и UCP2 G866A) к описанной модели привело к возрастанию AUC ROC до 88 % (рис. 4).
При изучении генетических и лабораторных маркеров у пациентов с сахарным диабетом 2 типа после коррекции на традиционные факторы риска (пол, возраст, курение, АГ, ожирение, дислипидемия) методом логистической регрессии независимая ассоциация с СД 2-го типа отмечалась только для полиморфных вариантов двух генов (UCP2 и PPAR-γ).
Характеристические кривые при различных моделях риска
| Факторы риска+лабораторные маркеры+генетические маркеры | Факторы риска+лабораторные маркеры |
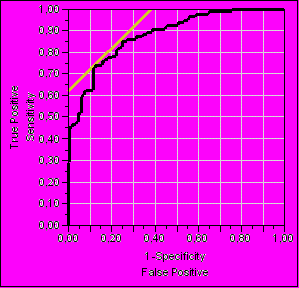 * ** | 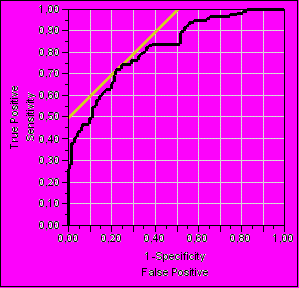 ** * |
| AUC ROC = 0,88 | AUC ROC = 0,82 |
