Элективный курс
| Вид материала | Элективный курс |
- Элективный курс «глобальные проблемы человечества», 121.74kb.
- В. А. Ходаков моу воротынская средняя школа Перемышльского района Калужской области, 76.7kb.
- Элективный курс по астрономии, 93.86kb.
- Пояснительная записка Элективный курс «Природа тел Солнечной системы» предназначен, 50.52kb.
- Ф. В. Чижова методическая разработка элективный курс, 490.04kb.
- Элективный курс «Методы решения задач по физике» 10 11 классы 68 часов, 115.81kb.
- Липецка Учитель Тарасова Светлана Васильевна. Предмет математика. Класс 9 элективный, 242.74kb.
- Багровникова Светлана Владимировна, к ф. н., доцент элективный курс, 110.32kb.
- Джейранов Федор Елефтерович, к ф. н., доцент элективный курс, 116.47kb.
- Р. И. Горелова элективный курс «молекулярные основы наследственности», 116.13kb.
Опыт 1.
Цветная реакция салициловой кислоты с хлоридом железа (III).
В пробирку помещают 5 – 6 капель насыщенного раствора салициловой кислоты и прибавляют 2 капли 1%-ного раствора хлорида железа (III). Раствор окрашивается в тёмно-фиолетовый цвет, что указывает на наличие в салициловой кислоте фенольного гидроксила.
Опыт 2.
Доказательство отсутствия фенольного гидроксила в ацетилсалициловой кислоте (аспирине).
В пробирку помещают 2 – 3 крупинки ацетилсалициловой кислоты, добавляют 1 мл воды и энергично встряхивают. К полученному раствору прибавляют 1 – 2 капли раствора хлорида железа (III). Фиолетовое окрашивание не появляется. Следовательно, в ацетилсалициловой кислоте НООС – С6Н4 – О – СО – СН3 отсутствует свободная фенольная группа, так как это вещество – сложный эфир, образованный уксусной и салициловой кислотами.
Опыт 3.
Гидролиз ацетилсалициловой кислоты.
В пробирку помещают 2 – 3 крупинки ацетилсалициловой кислоты и добавляют 2 мл воды. Доводят содержимое пробирки до кипения и кипятят в течение 0,5 – 1 минуты. Затем к полученному раствору прибавляют 1 – 2 капли раствора хлорида железа (III). Появляется фиолетовое окрашивавшие, что указывает на выделение салициловой кислоты, содержащей свободную фенольную группу. Как сложный эфир ацетилсалициловая кислота легко гидролизуется при кипячении с водой. Составляют уравнение этой реакции. Раствор хлорида железа (III) применяют также для определения чистоты ацетилсалициловой кислоты, которая при неправильном хранении разлагается на салициловую и уксусную кислоты.
Практическая работа
«Изучение свойств антипирина и амидопирина».
Антипирин – один из первых синтетических анальгетиков, применяемый в медицине с 1884 года. Антипирин оказывает болеутоляющее, жаропонижающее и противовоспалительное действие и применяется при невралгиях и простудных заболеваниях. Однако в последнее время, в связи с получением других анальгетиков, он уступает место таким более сильным веществам как амидопирин и анальгин:
Н3С – С = СН
| |
Н3С – N C = O
\ /
N
|
Антипирин
CH3
|
Н3С – С = С – N – CH3
| |
Н3С – N C = O
\ /
N
|

Амидопирин (пирамидон)
В фармацевтической практике антипирин служит основой для получения амидопирина и анальгина, поэтому для оценки чистоты препаратов и для распознавания этих веществ большое значение имеют цветные реакции.
Опыт 1.
Реакция с хлоридом железа (III).
В одну пробирку помещают несколько кристаллов антипирина, а в другую – амидопирина. В каждую из них добавляют по 2 капли воды и 1 – 2 капли 0,03 М раствора хлорида железа (III). В пробирке с антипирином появляется стойкое, интенсивное оранжево-красное окрашивание, которое не исчезает при стоянии. В пробирке с амидопирином реакционная смесь приобретает фиолетовую окраску, которая быстро исчезает. Окраска может появляться вновь при добавлении нескольких капель раствора хлорида железо (III), но затем она бледнеет и снова исчезает. Окрашивание антипирина обусловлено образованием комплексного соединения ферропирина.
Опыт 2.
Реакция антипирина и амидопирина с азотистой кислотой.
В одну пробирку помещают несколько кристаллов антипирина, а в другую – амидопирина. В обе пробирки приливают 2 капли воды, 1 каплю 1М раствора серной кислоты и 1 каплю 0,5М раствора нитрита натрия. В первой пробирке появляется изумрудно-зелёная окраска, которая постепенно исчезает. В пробирке с амидопирином появляется очень нестойкое фиолетовое окрашивание (при быстром исчезновении окраски можно добавить ещё немного амидопирина).
Обе реакции основаны на получении окрашенных продуктов окисления антипирина и амидопирина, поэтому избыток нитрата натрия вредит реакции.
Практическая работа
«Частные реакции на некоторые алкалоиды».
Алкалоидами называют природные азотсодержащие соединения, обладающие основными свойствами и образующиеся преимущественно в растениях. Основные свойства, характерные для этих соединений, обусловили их название: алкалоидный – подобный щёлочи. В растительных клетках алкалоиды находятся в виде солей органических кислот. В настоящее время выделено несколько тысяч алкалоидов с самым разнообразным строением. Большинство из них – гетероциклические соединения (никотин, кофеин, кокаин, кураре и т.д.). О функциях алкалоидов в клетке высказывают различные предположения, которые сводятся к следующим:
а) алкалоиды – запасные вещества;
б) это отбросы жизнедеятельности клетки;
в) защитные вещества;
г) активные и необходимые в биосинтезах вещества.
Среди природных фармакологически активных веществ алкалоиды являются основной группой соединений, из которых получают наиболее эффективные лекарственные средства.
Опыт 1.
Реакция хинина с бромной водой и аммиаком.
В пробирку помещают 1 каплю 1%-ного раствора солянокислого хинина, добавляют 5 капель воды и 2 капли насыщенной бромной воды, а затем одну каплю аммиака. Раствор приобретает характерную изумрудно-зелёную окраску.
Опыт 2.
Получение кофеина и качественна реакция на него.
Кофеин можно получить из листьев чая. Для этого в фарфоровую чашку насыпают 0,5 – 1 г сухого чая, накрывают её воронкой с заткнутым ватным тампоном и нагревают на асбестовой сетке 10 минут. Сначала на внутренней части воронке конденсируются капельки воды, а затем будет возгоняться кофеин, белые тонкие кристаллы которого осаждаются на холодных стенках воронки. Нагревание прекращают и после полного охлаждения фарфоровой чашки кристаллы кофеина счищают со стенок воронки и растворяют в 1 мл воды.
Для проверки наличия кофеина 1 каплю полученного раствора наносят на предметное стекло, добавляют 1 каплю 30%-ного водного раствора пероксида водорода и 1 каплю 10%-ной соляной кислоты. Смесь осторожно выпаривают досуха на газовой горелке. Стекло охлаждают и добавляют 1 каплю концентрированного раствора аммиака, а затем стекло вновь нагревают до полного испарения воды. Пурпурно-красный цвет пятна указывает на наличие кофеина.
Опыт 3.
Цветная реакция на кодеин.
На предметное стекло наносят 1 каплю спиртового раствора кодеина, добавляют 1 каплю формалина и 1 – 2 капли концентрированной серной кислоты. Раствор окрашивается в розово-фиолетовый цвет.
Синтез веществ:
«Получения различных лекарственных препаратов».
Задание 1.
Для местного обезболивания в медицине применяют препарат анестезин (этиловый эфир п-аминобензойной кислоты), получите его из толуола.
Ответ:
H2SO4; HNO3 KMnO4; t0 C2H5OH; H+ [H]
С



 6Н5 – СН3 X1 X2 X3 анестезин
6Н5 – СН3 X1 X2 X3 анестезин п-изомер
СН3
|


X1 –
|
NO2
п-нитротолуол
СООН
|


X2 –
|
NO2
п-нитробензойная кислота
О
||
С – O – C2H5
|


X2 –
|
NO2
этиловый эфир п-нитробензойной кислот
О
||
С – O – C2H5
|


Анестезин
|
NН2
этиловый эфир п-аминобензойной кислоты
Задание 2.
Глюканат кальция часто используют при аллергических осложнениях. Имея в наличии следующие неорганические вещества: Na, CO, H2O, HCl, Cu(OH)2, Ca(OH)2 – получите кальциевую соль глюконовой кислоты
[CH2OH – (CHOH)4 – COO]2Ca
Глюканат кальция
Ответ:
Na → NaOH → HCOONa → HCOOH → H – C = O → C6H12O6 →
|
H
→ CH2OH – (CHOH)4 – COOH → [CH2OH – (CHOH)4 – COO]2Ca
Задание 3.
Дифениловый эфир используют для получения «Ниттифора» (сильное антисептическое средство). Из этанола получите дифениловый эфир.
Ответ:
С2Н5ОН → СН2 = СН2 → BrCH2 – CH2Br → CH ≡ CH →


 Br OH ONa O
Br OH ONa O 









 / / / / \
/ / / / \ → → → → →
Задание 4.
Третбутиловый спирт является основой для синтеза лекарственного препарата «Тимолола», который используется для лечения сердечно-сосудистых заболеваний:
I. получите третбутиловый спирт из метана.
Ответ:
Третбутиловый спирт из метана можно получить следующими способами:
Н СН3
| |
а) СН4 → СН ≡ СН → СН3 – С = О → СН3 – С – СН3 →
|
OMgI
СН3
|
→ СН3 – С – СН3
|
OH
б) СH4 → CH2 = CH2 → CH3 – CH2Br → CH3 – CH2 – CH2 – CH3 →
СН3 CH3
| |
→ СН3 – С – СН3 → CH3 – C – CH3
| |
Br OH
СН3 СН3
| |
в) СН4 → СН ≡ СН → СН3 – С = О → СН3 – С – СН3 → (CH3)3COH
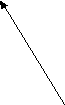
 |
|OMgI

 CH ≡ CNa
CH ≡ CNa CH3 – C ≡ CH
CH3 – C ≡ CH СH3Br
СH3BrII. получите третбутиловый спирт из циклопропана.
Ответ:
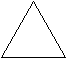
→ С3Н8 → С3Н6 → СН2Br – CHBr – CH3 → CH ≡ C – CH3 →
CH3 CH3
| |
→ СН3 – С = О → СН3 – С – СН3 → (CH3)3C – OH
|
OMgI
III. получите третбутиловый спирт из циклобутана.
Ответ:
а)

→ С4Н10 → СН3 – СООН → (СН3 – СОО)2Са →
CH3 CH3
| |
→ СН3 – С = О → СН3 – С – СН3 → (CH3)3C – OH
|
OMgI
б)
Br OH
 | |
| | → С4Н10 → СН3 – СН – СН3 → СН3 – С – СН3 → СН3 – С – СН3
| | |
CH3 CH3 CH3
Задание 5.
Фенол и его производные входят в состав препаратов антиоксидантов, которые применяются при лечении ожогов, обмороженных участков кожи. Получите из сахарозы фенол и 2,4,6-трибромфенол.
Ответ:
С12Н22О11 → С6Н12О6 → С2Н5ОН → С2Н4 → C2H4Br2 → C2H2 →
OH



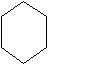 Br OH Br | Br
Br OH Br | Br 


 / / \ /
/ / \ / → → → →
|
Br
Задание 6.
В фармацевтической промышленности часто используют глицерин.
- Предложите схему получения глицерина из пропана двумя способами.
СН2 = СН – С = О → СН2 = СН – СН2ОН → СН2 – СН – СН2
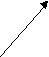 | | | |
| | | |H OH OH OH
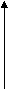
С
 3Н8 → С3Н6
3Н8 → С3Н6 CH2 = CH – CHCl → CH2 = CH – CH2OH → CH2 – CH – CH2
| | |
Cl OH OH
- Предложите схему получения глицерина из метана.
СН4 → Н – С = О → С6Н12О6 → СН2 – СН – СН2
| | | |
H OH OH OH
Задание 7.
Салицилат натрия (2-оксибензоат натрия) – жаропонижающее средство. Предложите схему получения салицилата натрия из метана, используя необходимые реактивы и катализаторы.
Ответ:
С

 Н3Cl CH3 COOH COOH
Н3Cl CH3 COOH COOH

 | | SO3H | SO3H
| | SO3H | SO3H 


 / /
/ / СН4 → СН ≡ СН → → → → →
COOH COONa
| OH | ONa



 / /
/ / → →
Задание 8.
Фениловый эфир уксусной кислоты широко применяют для получения неотропных средств, улучшающих работу ЦНС. Предложите схему получения фенилового эфира уксусной кислоты исходя из уксусной кислоты.
Ответ:
СН3 – СООН → C2H5OH → С2H4 → BrCH2 – CH2Br → CH ≡ CH →
Br OH ONa O – C – CH3











 / / / / ||
/ / / / ||→
 → → → → O
→ → → → OC
 H3 – COOH → CH3 – C = O
H3 – COOH → CH3 – C = O|
Cl
Задание 9.
Анилин является основой лекарственного препарата новокаина (обезболивающее средство). Предложите схему получения анилина и 2,4,6-триброманилин из уксусного альдегида.
Ответ:
СН3 – С = О → C2H5OH → CH2 = CH2 → BrCH2 – CH2Br → CH ≡ CH →
|
H
NH2



 NO2 NH2 Br | Br
NO2 NH2 Br | Br 


 / / \ /
/ / \ / → → → →
|
Br
Задание 10.
Уротропин применяют для лечения менингита и заболеваний глаз. Предложите схему получения уротропина из синтез газа и аммиака.
Ответ:
СО + Н2 → СН3ОН → Н – С = О → (CH2)6N4
|
H
Задание 11.
Третбутилбензол используют для получения соединений группы антиоксидантов (противовоспалительные препараты). Предложите схему получения третбутилбензола из метана наиболее коротким путём.
Ответ:

С
 Н ≡ СNa ← CH ≡ CH ← CH4 → CH ≡ CH → CH3
Н ≡ СNa ← CH ≡ CH ← CH4 → CH ≡ CH → CH3 ↓ |
↓ |CH3Br CH3 – C – CH3
C

 H ≡ C – CH3 ↓ |
H ≡ C – CH3 ↓ |
 CH3MgBr
CH3MgBr ↓
CH3 CH3
| |
CH3 – C – CH3 CH3 – C – OMgBr → CH3 – C – OH
|| | |
O CH3 CH3
II блок.
Макромолекулы жизни.
Лекция на тему:
«Биополимеры».
На протяжении многих веков учёные пытались понять: что есть жизнь? Шло время, одна эпоха сменяла другую, философы и естествоиспытатели ломали копья в спорах. И хотя наши знания о мире существенно расширялись, но этот вопрос по - прежнему остаётся открытым. Сточки зрения химика, всё просто: вещество - и живое, и неживое – состоит из разных по размеру и составу молекул, а молекулы, в свою очередь, - из атомов. Если и то и другое состоит из обыкновенных молекул, почему по строению и свойствам живое и неживое столь не похожи друг на друга? Где же та невидимая грань, что отделяет живое от неживого? Сотни миллионов лет назад природа успешно её преодолела. А человеку ещё предстоит найти ключ к разгадке тайны жизни. Во второй половине 20 века удалось совершить гигантский рывок в этом направлении: были синтезированы сложные молекулы - некоторые белки и даже участки молекул ДНК – гены. Органические соединения, входящие в состав живого, удивительно разнообразны по химической природе. Эти молекулы принято называть биополимеры. Даже в простейших одноклеточных существах – бактериях содержится огромное количество самых разных молекул – простых, таких как вода, более сложных, наподобие глюкозы и, наконец, состоящих из десятков и сотен тысяч атомов Большинство биополимеров можно сгруппировать в несколько классов: белки, нуклеиновые кислоты, углеводы. Одноклеточный организм - кишечная палочка содержит, примерно, 3тыс. видов белков и около 1 тыс. видов нуклеиновых кислот. В организме человека белков около 5млн. Своим бесконечным многообразием всё живое обязано именно уникальным молекулам белка, и иные формы жизни во Вселенной науке пока неизвестно.
Белки или протеины (от греч. «протос» - «первый») – это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. При длительном кипячении белков в присутствии кислот или щелочей белковые цепи распадаются на составляющие их молекулы, называемые аминокислотами. В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них – атом водорода, второй – карбоксильная группа –СООН. Третий заместитель – аминогруппа – NН2, и, наконец, четвёртый заместитель – группа атомов, которую обозначают – R. У всех аминокислот –R группы разные, и каждая из них играет свою, очень важную роль. Природные аминокислоты, входящие в состав белка, называют - аминокислотами. Число - аминокислот, различающихся – R группой, велико, но в белках встречаются всего 20. (Таблица: «Классы аминокислот»). В зависимости от взаимного расположения четырёх заместителей, аминокислота может существовать в двух формах, которые отличаются друг от друга, как предмет от своего зеркального отражения или как правая рука от левой. Такие соединения получили название хиральных (от греч. «хир» - «рука»). Хиральные молекулы открыл французский учёный Луи Пастер. Два типа оптических изомеров получили названия: D – форма (правый) и L – форма (левый) изомер. В состав белков входят только L –аминокислоты, и вся белковая жизнь на Земле – «левая». Полимерная молекула белка образуется при соединении в длинную цепочку - аминокислот, которые соединяются химическими связями. Эти связи образуются благодаря имеющимся у всех аминокислот амино – и карбоксильных групп. ( Таблица: «Образование трипептида из аминокислот»). Образующиеся в результате такой реакции соединения называются пептидами: ( - СО – NН - ) - группировка в них – это пептидная группировка, а связь между углеродом и азотом – пептидная связь. Полипептидное строение белковой молекулы доказал в 1902 году немецкий химик Эмиль Герман Фишер. Общее число аминокислотных остатков в белковой молекуле изменяется в очень широких пределах. Так, человеческий инсулин состоит из 51 аминокислотного остатка, а лизоцим молока кормящей матери – из 130. В гемоглобине человека 4 аминокислотные цепочки, каждая из которых построена из 140 аминокислот. Существуют белки, имеющие почти 3тыс. аминокислотных остатков в единой цепи. Молекулярная масса белков лежит в диапазоне от 11тыс, для малых белков, состоящих из 100 аминокислотных остатков, до 1млн. и более для белков сочень длинными полипептидными цепями.
Возникает вопрос: как же всё огромное многообразие белков с различными функциями и свойствами может быть создано всего из 20 аминокислот? А разгадка этого секрета природы проста - каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка.
В начале 50-х гг. 20в. американские химики Л.К. Полинг и Р. Кори доказали экспериментально, что полипептидные цепи образуют спираль закрученную в правую сторону. Это первый самый низкий уровень пространственной организации белковых цепочек. Такую спираль в целом стабилизируют водородные связи, которые образуются между группами атомов - СО – и – NН – аминокислотных остатков. (Таблица: «Вторичная структура белковой молекулы»).Позднее выяснилось, что - спираль – не единственный способ укладки аминокислотных цепочек. Помимо спирали они образуют ещё и слои. Благодаря всё тем же водородным связям между группами – СО - и - NН - друг с другом могут «слипаться» сразу несколько разных фрагментов одной полипептидной цепи. В результате получается целый слой – его назвали - слоем. Вторичная структура белка представляет собой - спираль и - слои полипептидной цепи. Для того чтобы получить полный «портрет» молекулы белка, знания первичной и вторичной структуры недостаточно. Все спирали и слои каким-то образом размещены в пространстве. Общая пространственная структура полипептидной цепи называется третичной структурой белка. При образовании этой структуры белка проявляют активность R – группы -боковые цепи аминокислот. В живом организме белки всегда находятся в водной среде. А самое большое число основных аминокислот – восемь содержат неполярные R – группы. Белок стремится спрятать внутрь своей молекулы неполярные боковые цепи, чтобы ограничить их контакт с водой. Учёные называют это возникновением гидрофобных взаимодействий. Благодаря гидрофобным взаимодействиям вся полипептидная цепочка принимает определённую форму в пространстве, т.е. образует третичную структуру. Часть боковых цепей заряжены отрицательно, а часть положительно, между этими участками возникают силы электростатического притяжения (возникают солевые мостики). Это ещё одна возможная сила, стабилизирующая третичную структуру. Между двумя аминокислотными остатками цистеина иногда образуются ковалентные связи (-S – S -), которые очень прочно фиксируют расположение разных участков белковой цепи по отношению друг к другу. Такие связи называют дисульфидными мостиками.
Молекула белка может состоять не из одной, а из нескольких полимерных цепей. Каждая такая цепь представляет собой самостоятельную структуру – субъединицу. Например, белок гемоглобин состоит из четырёх субъединиц, которые образуют единую молекулу. Субъединицы притягивают друг друга благодаря гидрофобным взаимодействиям, солевым мостикам и водородным связям. Если белок состоит из нескольких субъединиц, говорят, что он обладает четвертичной структурой. Такая структура представляет высший уровень организации белковой молекулы. Приблизительно половина из известных на сегодняшний день белков четвертичной структуры не имеют.
Биологическая роль белков.
| Класс белков. | Примеры. | Локализация/функция. |
| Структурные | Коллаген Склеротин Кератин Эластин Мукопротеины Белки оболочки вирусов | Соединительная ткань Наружный скелет насекомых Кожа, перья, ногти, рога Связки Слизистые секреты Обертка" нуклеиновой кислоты |
| Ферменты | Трипсин Рибулозодифосфаткарбоксилаза; | Катализ гидролиза белков Участие в фотосинтезе |
| Гормоны | Инсулин | Регуляция обмена глюкозы |
| Защитные белки | Антитела Фибриноген, тромбин | Образование комплексов с инородными белками Свертывание крови |
| Запасные бедки | Яичный альбумин Козеин | Белок яйца Белок молока |
| Сократительные белки | Миозин, актин | Миофибрилл |
| Токсины | Змеиный яд, дифтерийный токсин | |
