Элективный курс
| Вид материала | Элективный курс |
СодержаниеАктивированный уголь Ацетилсалициловая кислота |
- Элективный курс «глобальные проблемы человечества», 121.74kb.
- В. А. Ходаков моу воротынская средняя школа Перемышльского района Калужской области, 76.7kb.
- Элективный курс по астрономии, 93.86kb.
- Пояснительная записка Элективный курс «Природа тел Солнечной системы» предназначен, 50.52kb.
- Ф. В. Чижова методическая разработка элективный курс, 490.04kb.
- Элективный курс «Методы решения задач по физике» 10 11 классы 68 часов, 115.81kb.
- Липецка Учитель Тарасова Светлана Васильевна. Предмет математика. Класс 9 элективный, 242.74kb.
- Багровникова Светлана Владимировна, к ф. н., доцент элективный курс, 110.32kb.
- Джейранов Федор Елефтерович, к ф. н., доцент элективный курс, 116.47kb.
- Р. И. Горелова элективный курс «молекулярные основы наследственности», 116.13kb.
2. Двухосновную адипиновую кислоту НООС - (СН2)4 - СООН в больших количествах используют для получения различных лекарственных препаратов. В пищевой промышленности она может заменять лимонную и винную кислоты. Сейчас адипиновую кислоту получают окислением циклогексана кислородом. Рассчитайте массу адипиновой кислоты, которую можно получить из 336 кг циклогексана, если массовая доля выхода кислоты составляет 75% от теоретически возможного.
Решение.
С6H12 + [O] → HOOC – (CH2)4 – COOH
M(С6Н12) = 84кг/кмоль;
M(адипиновой кислоты) = 146 кг/кмоль;
n = m/M; n(C6H12) = 4кмоль;
m(адипиновая кислота) = 4 ٠ 146 = 584кг.
= m(практ.)/m(теор.)
0,75 = х/584; х = 438кг.
Ответ: m(адипиновой кислоты) = 438кг.
3. Анилин широко применяется в производстве фармацевтических препаратов. В последнее время анилин часто получают из хлорбензола и аммиака
С6Н5Сl + 2NH3 C6H5NH2 + NH4Cl
Определите массу анилина, который можно получить из 450 кг хлорбензола, если массовая доля выхода анилина составляет 94% от теоретически возможного.
Решение.
М(С6Н5Сl) = 112,5 кг/кмоль;
M(C6H5NH2) = 93 кг/кмоль;
n(C6H5Cl) = 4 кмоль; m(С6Н5NH2) = 94 ٠ 93 = 372 кг.
= m(практ.)/m(теор.)
0,94 = х/372; х = 349,7кг.
Ответ: m(C6H5NH2) = 349,7кг.
4. Горькая или английская соль (крисаллогидрат сульфата магния) впервые была выделена из воды минерального источника Эпсоли - при пригороде Лондона. Эта соль применяется в медицине при заболеваниях нервной системе, для снижения артериального давления, а также как слабительное средство. Составьте формулу английской соли, если массовые доли химических элементов в ней составляют 9,86% (Mg); 13,01% (S); 71,4% (O); 5,73% (H).
Решение.
Формулу соли представим как MgxSyOzHk,
x : y : z : k = 0,0986/24 : 0,1301/32 : 0,7140/16 : 0,0573/1 = 1 : 1 : 11 : 14
Следовательно, формула соединения MgSO4 ٠ 7H2O
Ответ: MgSO4 ٠7H2O.
5. Фармацевт получил задание приготовить глазные капли, представляющие собой водный раствор сульфата цинка и борной кислоты (массовая доля сульфата цинка - 0,25%; массовая доля борной кислоты - 2%). Определите массы сульфата цинка и борной кислоты, которые необходимы фармацевту для приготовления капель, если дистиллированной воды он взял 200 мл.
Решение.
х – масса сульфата цинка;
у – масса борной кислоты.
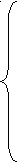
0,25% = х ٠ 100% ;
200 + х + у
2% = у ٠ 100% ;
200 + х + у
х = 0,508г.
у = 4,092г.
Ответ: m(сульфата цинка) = 0,508г; m(борной кислоты) = 4,092г.
6. Порошок «Регидрон» используют при обезвоживании организма. Одна доза порошка содержит 3,5 г хлорида натрия; 2,5 г хлорида калия; 2,9 г цинката натрия и 10 г глюкозы. При употреблением дозу растворяют в 1 литре воды. Определите массовые доли всех компонентов порошка «Регидрон» в полученном растворе.
Решение.
m = ٠V; M(H2O) = 1000мл ٠ 1г/мл = 1000г.
m(раствора) = 1000 + 3,5 + 2,5 + 2,9 + 10 = 1018,9г.
= m (вещества) ٠ 100% ; (NaCl) = 3,5 ٠ 100% = 0,34%
m (раствора) 1018,9
(KCl) = 2,5 ٠ 100% = 0,245%
1018,9
(цитрат натрия) = 2,9 ٠ 100% = 0,28%
1018,9
(глюкозы) = 10 ٠ 100% = 0,98%
1018,9
Ответ: (NaCl) = 0,34%, (KCl) = 0,245%, (цитрат натрия) = 0,28%, (глюкозы) = 0,98%.
7. АЦЦ-средство от кашля. Одна доза АЦЦ массой 3 г содержит 100 мг ацетилцестеина и 2,9 г сахарозы. Перед употреблением АЦЦ растворяют в 100 мл воды. Определите молярную концентрацию сахарозы в полученном растворе, если плотность раствора 1,01 г/мл.
Решение.
M(С12Н22О11) = 342г/моль; n(C12H22O11) = 2,9/342 = 0,00848моль;
m = ٠ V; m(Н2О) = 100мл ٠ 1г/мл = 100г
m(раствора) = 100 + 3 = 103г
V(раствора) = 103г ٠ 1,01г/мл = 104,03мл.
104,03мл – 0,00848моль
1000 мл – х
х = 0,008моль/л
Ответ: молярная концентрация сахарозы в полученном растворе составляет 0,008моль/л.
8. При изжоге и болях в желудке используют средство «Маалокс», содержащее в 100 мл суспензии 3,49 г гидроксида алюминия 3,99 г гидроксида магния. Сколько молей гидроксидов попадает в организм человека при приёме 1 столовой ложки (15 мл) препарата?
Решение.
Суспензия 100мл – 3,49г Al(OH)3
суспензия 15 мл – х г Al(OH)3
х = 0,5235г.
M[Al(OH)3] = 78г/моль; n[Al(OH)3] = 0,00661моль.
суспензия 100мл – 3,99г. Mg(OH)2
суспензия 15мл – х г. Mg(OH)2
х = 0,5985г.
M[Mg(OH)2] = 58г/моль; n[Mg(OH)2] = 0,0103моль
n(гидроксидов) = 0,0103 + 0,0066 = 0,017моль.
Ответ: n(гидроксидов) = 0,017моль.
9. Для обработки ран используют 5%-ный спиртовой раствор йода, содержащий 2% йодида калия. При приготовлении такого препарата используют 95%-ный раствор этанола. Определите массовую долю воды в спиртовом растворе йода.
Решение.
Возьмём 100г раствора.
m(I2) = 5г; m(KI) = 2г.
m(95%-ного раствора этанола) = 100г – 5г – 2г = 93г.
(H2O) = 100% - 95% = 5%
5% = х ٠ 100%
93
х = 4,65г.
(Н2О) = 4,65г ٠ 100%
100г
(Н2О) = 4,65%
Ответ: (Н2О) = 4,65%.
10. При пониженной кислотности желудочного сока больным назначают разбавленную соляную кислоту, в которой массовая доля хлороводорода равна 8,2% ( = 1,04 г/мл). В аптеке её готовят из 37%-ной соляной кислоты ( = 1,19г/мл). Определите объём разбавленной кислоты, которую можно приготовить из 20 мл 37%-ной соляной кислоты (103,27 мл).
Решение.
m = ٠ V; m(раствора) = 20г ٠ 1,19г/мл = 23,8г.
= m (вещества) ٠ 100%
m (раствора)
37% = х ٠ 100% ; х = 8,806г. х – масса соляной кислоты
23,8г.
8,2% = 8,806г ٠ 100% ; у = 107,39г. у – масса раствора 8,2%-ного
у раствора соляной кислоты
V = m/; V(разбавленной кислоты) = 107,39г/1,04г/мл = 103,26мл.
Ответ: V(разбавленной соляной кислоты) = 103,26мл.
11. Больной получил внутривенно в качестве противоаллергического средства 10 мл 30%-ого раствора тиосульфата натрия = 1,2 г/мл. Сколько ионов натрия попало при этом в его организм?
Решение.
m = ٠ V; m(раствора) = 1,2г/мл ٠ 10мл = 12г.
= m (вещества) ٠ 100%; 30% = х ٠ 100%
m (раствора) 12г
х = 3,6г. (Na2S2O3)
M(Na2S2O3) = 158г/моль; n(Na2S2O3) = 3,6/158 = 0,0228моль.
n(Na+) = 0.0228моль ٠ 2 = 0,0456 моль.
NA(Na+) = 0,0456моль ٠ 6,02 ٠ 1023моль-1 = 2,74 ٠ 1022 ионов.
Ответ: NA(Na+) = 2,74 ٠ 1022 ионов.
12. При язвенной болезни пациентом назначают пить 0,05%-ный раствор нитрата серебра. Суточная доза нитрата серебра составляет 0,1 г. На сколько дней больному хватит 2 л 0,05%-ного раствора нитрата серебра? Плотность этого раствора считать равной плотности воды.
Решение.
m(раствора) = 2000мл ٠1г/моль = 2000г.
= m (вещества) ٠ 100%; 0,05% = х ٠ 100%
m (раствора) 2000г
х = 1г. (AgNO3)
AgNO3 0,1г – 1 сутки
AgNO3 1г – х сутки; х = 10 суток.
Ответ: на 10 дней хватит 2л 0,05%-ного раствора нитрата серебра.
13. Шестиводный кристаллогидрат хлорида кальция, поступающий в аптеку не используют для приготовления лекарств, так как он гигроскопичен и имеет непостоянный состав, что может привести к неточной дозировке. Из кристаллогидрата готовят 50%-ный раствор хлорида кальция, который в дальнейшем применяют для приготовления лекарств. Определите массу кристаллогидрата, который потребуется для приготовления 50%-ного раствора, если в распоряжении фармацевта имеется 100 мл дистиллированной воды. Определите массы воды и 50%-ного раствора хлорида кальция необходимых для приготовления 100 г 10%-ного раствора этого вещества.
Решение.
m(H2O) = 100г.
Для получения 50%-ного раствора необходимо взять х моль СaCl2٠6H2O.
M(CaCl2٠6H2O) = 111 + 108 = 219г/моль
= m (вещества) ٠ 100%; 50% = х٠ 111 ٠ 100%
m (раствора) 100 + 219х
х = 33,333моль.
m(CaCl2٠H2O) = 33,333моль ٠ 219г/моль = 7299г. = 7,3кг.
10% = х ٠ 100%; х = 10г (CaCl2)
100г.
50% = 10г ٠ 100%; х = 20г (раствора)
х
m(H2O) = 100 – 20 = 80г.
Ответ: m(CaCl2٠6H2O) = 7,3кг; m(H2O) = 80г; m(50%-ный раствор CaCl2) = 20г.
14. Для рентгеноскопии желудка используют взвесь сульфата бария и воды. Сульфат бария получают из минерала витерита, состоящего, в основном, из карбоната бария. Рассчитайте массу 35%-ного раствора хлороводорода, который потребуется для полного растворения 100 г витерита, содержащего 5% некарбонатных примесей. Определите массу 20%-ного раствора сульфата натрия, необходимого для полного осаждения ионов бария в виде сульфата из полученного раствора хлорида бария.
Решение.
BaCO3 + 2HCl = BaCl2 + H2O + CO2↑
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
(BaCO3) = 100% - 5% = 95%.
95% = х ٠ 100%; х = 95г (BaCO3)
100г
M(BaCO3) = 197г/моль; n(BaCO3) = 95/197 = 0,482моль
n(HCl) = 0,482моль ٠ 2 = 0,964моль.
M(HCl) = 36,5г/моль; m(HCl) = 0,964 ٠ 36,5 = 35,2г
35% = 35,2г ٠ 100%; х = 100г (раствора соляной кислоты)
х
n(Na2SO4) = n(BaCl2) = 0,482моль.
M(Na2SO4) = 142г/моль;
m = M ٠ n; m(Na2SO4) = 0,482 ٠ 142 = 68,44г.
20% = 68,44г ٠ 100%; х = 342,2г (раствора сульфата натрия)
х
Ответ: m(раствора Na2SO4) = 342,2г; m(раствора HCl) = 100г.
Тестовые задания по теме:
«Лекарства и организм человека».
1. Причина вспенивания пероксида водорода, при дезинфекции ранки, это -
а) выделение водорода при его контакте с кровью;
б) выделение углекислого газа и воды при окислении глюкозы;
в) разложение пероксида водорода на воду и кислород под воздействием фермента каталазы;
г) образование озона при взаимодействии пероксида водорода с гемоглобином крови.
2. Активированный уголь (карболен) применяют при химических отравлениях потому, что:
а) химически активен и реагирует с токсическими веществами;
б) благодаря очень большой поверхности адсорбирует токсические вещества;
в) является ингибитором взаимодействия токсических веществ с жидкими средами организма;
г) повышает иммунитет организма.
3. Слабый раствор марганцовки (перманганата калия) обесцвечивается, если добавить к нему:
а) столовый уксус;
б) сок щавеля;
в) сахарный сироп;
г) раствор поваренной соли.
4. Свойства соединения холина [(CH3)3N+ - CH2 - CH2 - OH] OH-, содержащегося в животных тканях, растениях и микроорганизмов:
а) сильной кислоты;
б) сильного основания;
в) амфотерного органического вещества;
г) растворимой в воде соли, неподвергающейся гидролизу.
5. Для лечения синяков и ушибов используют свинцовую примочку, которая представляет собой раствор соли свинца в воде. Если к 1 моль этой соли добавит 1 моль гидроксида натрия образуется ацетат натрия и гидроксид свинца (II).
Соль, входящая в состав свинцовой примочки -
а) ацетат свинца (II);
б) гидроксоацетат свинца (II);
в) ацетат свинца (IV);
г) гидроксоацетат свинца (IV).
6. Вещество, которое не возможно получить брожением глюкозы:
а) этанол;
б) диэтиловый эфир;
в) масляная кислота;
г) молочная кислота.
7. Две молекулы, образующиеся при гидролизе мальтозы:
а) глюкозы;
б) фруктозы;
в) галактозы;
г) рибозы.
8. Причиной того, что сахароза, в отличие от глюкозы, не обладает восстанавливающими свойствами является:
а) отсутствие у сахарозы альдегидной группы;
б) сахароза - дисахарид;
в) наличие у сахарозы гидроксильных групп;
г) глюкоза - многоатомный спирт.
9. Реагент, для доказательства двойной связи в молекуле витамина А:
а) свежеприготовленный гидроксид меди (II);
б) раствор хлорида железа (III);
в) аммиачный раствор оксида серебра;
г) бромная вода.
10. “Лишнее” с точки зрения химического строения вещество в ряду:
а) окситоцин;
б) изолейцин;
в) аспарагин;
г) цистеин.
11. Группа, к которой относится адреналин (биологически активное вещество):
а) витамины;
б) ферменты;
в) аминокислоты;
г) гормоны.
12. “Лишнее”, с точки зрения фармакологического действия, лекарство в ряду:
а) тетрациклин;
б) новокаин;
в) эритромицин;
г) пенициллин.
13. Сильными антисептическими свойствами обладает:
а) этановая кислота;
б) раствор фенола;
в) диметиловый эфир;
б) бензол.
14. Наименее токсичными являются ионы:
а) Pb2+;
б) Hg2+;
в) Na+;
г) Zn2+.
15. Раздражающее действие на организм не оказывает:
а) NO2;
б) N2;
в) Cl2;
г) Br2.
16. Не ядовитым является каждый из трёх газов:
а) NO; NO2; F2.
б) H2S; NH3; O3.
в) СO2; Cl2; SO2.
г) H2; O2; N2.
| Номер задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Ответ | в | б | в | б | б | б | а | а |
| Номер задания | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| Ответ | г | а | г | б | б | в | б | г |
Практические работы на тему:
«Лекарственные препараты».
Практическая работа
«Изучение свойств салициловой и ацетилсалициловой кислот».
Салициловая кислота – 2-гидроксибнзойная кислота.
СООН
| OH

Брутто-формула: С7Н6О3
Фармакологические действия – антисептическое, кератолитическое, отвлекающее. Применяется при обработке ран, ожогов, бородавок, мозолей, жирной себореи, псориаз, дискератоз, ихтиоз. Местно – наносят тонким слоем на ранку и закрывают стерильной салфеткой. Наружно, в виде 2% спиртового раствора. В отоларингологии – закапывают в ухо. В дерматологической практике в качестве антисептического и противовоспалительного средства для протирания поражённых участков.
Ацетилсалициловая кислота – 2-ацетилоксибнзойная кислота.
О
СООН ||
| O – С – СН3


Брутто-формула: С9Н8О4
Фармакологические действия – анальгезирующее, жаропонижающее, противовоспалительное, антиагрегационное. Показания при инфаркте миокарда (для снижения риска повторного инфаркта и смерти после инфаркта миокарда), протезировании клапанов сердца (профилактика и лечение тромбоэмболий), клапанных митральных пороках сердца, ревматизме, мигрени, головной боли, невралгии и др. болевых синдромах слабой и средней интенсивности. Применяется внутрь в виде таблеток (доза зависит от тяжести заболевания и возраста пациента), в качестве ингибитора, через зонд.
