Особенности функционирования серотонинэргических рецепторов в аорте крысы
| Вид материала | Автореферат |
- Крысы неслись через двор, повизгивая от возбуждения, 406.1kb.
- Задачи, функции и структура pr-подразделения в государственных органах 4 Особенности, 468.59kb.
- Задача курса познакомить студентов со спецификой функционирования современных сми;, 269.35kb.
- Особенности функционирования и цели создания экономических информационных систем, 1105.31kb.
- Ассистент кафедры госпитальной терапии, к м. н. Ю. Ю. Кофман Зав кафедрой госпитальной, 321.24kb.
- Институализация и особенности функционирования информационных процессов в российском, 937.16kb.
- Учебное пособие Для всех форм обучения специальности 080507 "Менеджмент организации", 1372kb.
- «Крысы за и против», 102.73kb.
- Учебно-методический комплекс по дисциплине «Финансовые рынки и посредники» Астана,, 1879.15kb.
- 2 этап. Вопросы к интеллектуальному марафону «Мир вокруг нас», 43.32kb.
На правах рукописи
БАБИЧЕВА Александра Геннадьевна
ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ СЕРОТОНИНЭРГИЧЕСКИХ РЕЦЕПТОРОВ В АОРТЕ КРЫСЫ
Специальность 03.03.01 – Физиология
АВТОРЕФЕРАТ
на соискание ученой степени
кандидата биологических наук
Астрахань - 2010
Работа выполнена на кафедре патофизиологии Астраханской государственной медицинской академии.
Научный руководитель: доктор медицинских наук, профессор Тризно Николай Николаевич
Официальные оппоненты: доктор биологических наук, профессор
Кондратенко Елена Игоревна
доктор биологических наук, профессор
Котельников Андрей Вячеславович
Ведущая организация: Волгоградский государственный медицинский университет
Защита диссертации состоится « 24 » « декабря » 2010 года в 12-00 часов на заседании регионального диссертационного совета ДМ 212.009.01 при Астраханском государственном университете по адресу: 414000, г. Астрахань, пл. Шаумяна, 1.
С диссертацией и авторефератом можно ознакомиться в библиотеке Астраханского государственного университета по адресу: 414000, Астрахань, пл. Шаумяна, д.1
Автореферат разослан 23 ноября 2010 года.
Ученый секретарь
диссертационного совета,
доктор биологических наук Ю.В. Нестеров
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Большое количество работ по изучению серотонина направлено на исследование серотонинэргических механизмов в центральной нервной системе человека и млекопитающих. Гораздо меньше сведений имеется по действию серотонина на сосудистый тонус. Артериальный тонус является результатом суммирования сократительных и расслабляющих стимулов в гладкомышечных и эндотелиальных клетках (Гомазков О.А., 2000). Известно, что гормоны и нейротрансмиттеры, оказывающие влияние на тонус сосудов, могут взаимодействовать между собой. Описаны факты межрецепторного взаимодействия на уровне внутриклеточных сигнальных систем и вторичных посредников (Ullian M.E. et al., 1996; Schiffrin E.L. et al., 1995; Murasawa S. et al., 1995). Однако накопленный в настоящее время экспериментальный материал о роли различных типов серотонинэргических рецепторов в регуляции сосудистого тонуса, о запускаемых серотонином механизмах передачи сигнала в клетку и межрецепторных взаимодействиях не всегда имеет однозначную трактовку. Поэтому проблемой современных исследований рецепторов серотонина является более точное определение свойств системы, которая делает это невероятное разнообразие возможным.
Среди моноаминов серотонин является уникальным, потому что его эффекты осуществляются через 15 особых рецепторов. Большинство серотонинэргических рецепторов относятся к суперсемейству семидоменных трансмембранных рецепторов, сопряженных с G-белками (G-protein-coupled receptors – GPCR). Каждый из них представляет отдельную полипептидную цепь из аминокислотных остатков (Kroeze W. et al., 2003; Kristiansen K., 2004). Известно 7 основных типов рецепторов (5НТ1-5НТ7), некоторые из которых подразделяются на подтипы (5-НТ1А, 5-НТ1В, 5-HT1D, 5-HT1E, и 5-HT1F) на основе их структурных и функциональных характеристик (Hoyer D. et al., 2002). В клетках сосудов млекопитающих обнаружены 5-НТ1А, 5-НТ1В, 5-НТ1D, 5-НТ2А, 5-НТ2В, 5-НТ4, 5НТ7-рецепторы (Ullmer M.E. et al, 1995; Nilsson T. et al., 1999; Kato S. et al., 1999; Martin G., 1994).
Несмотря на безусловную значимость серотонина в регуляции сосудистого тонуса, физиологические особенности функционирования вазоконстрикторных и вазодилататорных серотонинэргических рецепторов до конца не изучены. Актуальность этой проблемы подтверждается литературными данными о развитии гиперчувствительности сосудов к воздействию серотонина при ряде патологических состояний, таких как гипертензия, атеросклероз, кровопотеря, травматический шок, астма (Chin H.P. et al., 1990; Watts S.W., 2002; Кожевникова Л.М., Авдонин П.В., 2006; Segura P. et al., 2010). Остается неясным, какие именно рецепторы участвуют в развитии избыточной реакции сосудов на серотонин. Результаты настоящего исследования потенциально могут быть использованы при разработке лекарственных препаратов на основе агонистов и антагонистов серотонина для лечения ряда сердечно-сосудистых заболеваний.
Цель исследования - выявить особенности функционирования серотонинэргических рецепторов в аорте крысы.
Задачи исследования:
- Идентифицировать в аорте крысы рецепторы серотонина, опосредующие констрикцию и дилатацию, с помощью их специфических агонистов и антагонистов.
- Исследовать влияние деполяризации плазматической мембраны гладкомышечных клеток сосудов на функционирование серотонинэргических рецепторов.
- Изучить воздействие вазоактивных агентов (норадреналина и эндотели-на-1) на функциональную активность серотонинэргических рецепторов.
- Выявить особенности функционирования серотонинэргических рецепторов на фоне долгосрочного и краткосрочного воздействия глюкокортикоидов.
- Провести сравнительный анализ факторов, влияющих на функционирование серотонинэргических рецепторов в аорте крысы.
Научная новизна. Впервые проведено комплексное исследование вазоконстрикторного и вазодилататорного эффекта серотонина в аорте крысы. Полученные результаты дополнили современные представления об особенностях действия специфических агонистов и антагонистов на функциональную активность различных типов серотонинэргических рецепторов. В работе изучено влияние деполяризации плазматической мембраны гладкомышечных клеток сосудов, действия эндогенных вазоконстрикторов, а также длительное и краткосрочное применение глюкокортикоидов на реакцию аорты крысы в ответ на введение серотонина. Это позволило сделать вывод об участии отдельных рецепторов в усилении сократительной реакции сосудов на серотонин.
Теоретическая и практическая значимость работы. Результаты настоящего исследования пополнили теоретические сведения о свойствах серотонинэргических рецепторов сосудов млекопитающих и их участии в регуляции тонуса аорты с формированием различных эффектов под влиянием вазоконстрикторных агентов и глюкокортикоидов. Материалы диссертации могут быть использованы при лечении осложнений, наблюдаемых у пациентов в процессе терапии глюкокортикоидами. Лекарственные препараты на основе специфических агонистов и антагонистов серотонина потенциально могут применяться в медицинской практике для поддержания сосудистого тонуса при стероид-индуцированной гипертензии, атеросклерозе, травматическом шоке, астме, мигрени, сопровождающихся избыточной реактивностью сосудов на серотонин.
Основные положения и выводы работы могут быть использованы при чтении лекций на кафедрах медико-биологического профиля Астраханской государственной медицинской академии и Астраханского государственного университета.
Основные положения, выносимые на защиту:
- Основными вазоконстрикторными рецепторами серотонина являются 5НТ2А, которые активируют потенциалуправляемые кальциевые каналы L-типа.
- Рецепторы 5НТ1А, 5НТ1В, 5НТ1D, 5НТ2В и 5НТ4 типа вызывают расслабление аорты крысы независимо от активации мускариновых рецепторов.
- Стимулирование сократительной серотонин-индуцированной реакции аорты на фоне деполяризации плазматической мембраны гладкомышечных клеток осуществляется через 5НТ2А-рецепторы.
- «Молчащие» в покое вазоконстрикторные 5НТ1А-рецепторы опосредуют потенцирующий эффект норадреналина и эндотелина-1 на сосудистую реакцию, вызванную серотонином.
- Усиление прессорной реакции аорты на серотонин при долгосрочном воздействии дексаметазона не зависит от числа 5НТ2А-рецепторов.
Апробация работы. Результаты исследования доложены на V конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины», посвященной 250-летию Московской медицинской академии им. И.М.Сеченова (г.Москва, 2008, доклад отмечен золотой медалью за лучшую научную работу), международном междисциплинарном симпозиуме «От экспериментальной биологии к превентивной и интегральной медицине» (Украина, г.Судак, 2008), XV школе «Актуальные проблемы биологии развития» (г.Звенигород, 2008), Всероссийской конференции «Научное наследие академика Л.А.Орбели. Структурные и функциональные основы эволюции функций, физиология экстремальных состояний», посвященной 125-летию со дня рождения академика Л.А.Орбели (г.Санкт-Петербург, 2008), XVI Международной конференции студентов, аспирантов и молодых ученых «Ломоносов-2009» (г.Москва, 2009), региональной конференции молодых ученых Астраханской государственной медицинской академии (г.Астрахань, 2010). По материалам диссертации опубликовано 11 печатных работ, 3 из которых - в журналах из перечня ВАК РФ.
Положения диссертации были доложены на расширенном межкафедральном заседании при Астраханской государственной медицинской академии.
Структура диссертации. Работа оформлена по традиционному плану, включает введение, обзор литературы, материалы и методы исследований, главу собственных исследований, обсуждение, выводы, библиографический список.
Общий объем диссертации – 138 страниц, работа иллюстрирована 6 таблицами и 29 рисунками. Библиографический список включает 235 источников, из них 167 – иностранных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Проведено две серии экспериментов на 168 самцах беспородных крыс массой 200-220г. Животные содержались на стандартной диете. Все эксперименты на животных и выведение их из опыта были проведены в соответствии с принципами биоэтики, правилами лабораторной практики (GLP). Методы соответствуют этическим нормам, изложенным в Женевской конференции (1971), положении «Об утверждении правил лабораторной практики» (Минздрав СССР №775 от 12.08.1977), «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» (1985) и в соответствии с приказом МЗ РФ №267 от 19.06.2003.
В ходе экспериментов под наркозом крыс декапитировали, извлекали грудной отдел аорты, очищали от жировой и соединительной тканей и помещали в охлажденный физиологический раствор Кребса-Хенселейта. Сосуды нарезались на кольцевые фрагменты толщиной 1-1,5 мм, которые крепили на держателях в термостатируемых камерах с физиологическим раствором (37ºС), аэрированным 5% карбогеном. Измерение силы сокращения изолированных фрагментов сосудов проводили в изометрическом режиме по методу Mulvany M.J. и Halpern W. (1977). Для оценки функционального состояния сосудов на них воздействовали норадреналином (НАдр) в концентрации 10-7М, а затем добавляли карбахол (10-5 М). Расслабление сосуда более чем на 50% свидетельствовало о целостности эндотелиального слоя.
Для идентификации 5HT-рецепторов, опосредующих вазоконстрикторный и вазодилататорный эффект серотонина, в работе использованы серотонин и эндотелин-1 (Sigma), селективные агонисты и антагонисты 5НТ-рецепторов: для 5HT1А рецепторов – агонисты бушпирон (“RBI”) и (R)-(+)-8-ОН-DPAT (“Alexis”) и антагонисты NAN-190 (“RBI”) или (S)-WAY 100135 (“Tocris”); для 5HT1В – агонист CGS 12066B (“Tocris”); для 5HT1D - агонист L-694,247 (“Alexis”); для 5HT2А – антагонист кетансерин (“Alexis”); для 5HT2В – BW 723C86 (“Axxora”); для 5HT2С и 5HT1С – неселективный агонист SCH 23390 (“Tocris”); для 5HT3 – агонист 5HTQ (“RBI”) и антагонист – 3-тропанил-3,5-дихлоробензоат (MDL-72222) (“RBI”); для 5HT4 - агонист RS 67506 (“Tocris”). Для активации 5HT1, 5HT5 и 5HT7 рецепторов использовали их неселективный агонист 5-карбоксамидотриптамин (“Sigma”). В ходе экспериментов применяли блокаторы прозасин (“RBI”) для α1-адренорецепторов (α1-АР) и скополамин («Sigma”) для мускариновых рецепторов. В качестве деполяризующего раствора применяли раствор Кребса-Хенселайта, содержащий 15mM KCl.
В условиях целостного организма моделировали долгосрочное воздействие глюкокортикоидов с помощью внутрибрюшинного введения крысам дексаметазона (KRKA, Россия) в дозе 3 мг/кг веса животного в течение 5 дней. Для оценки влияния глюкокортикоидов на регуляцию сосудистого тонуса исследовали силу изометрического сокращения изолированных колец аорты на серотонин, эндотелин-1, норадреналин, ангиотензин II и вазопрессин.
Выделение тотальной РНК из образцов контрольных и экспериментальных сосудов осуществляли тризольным методом. Определение концентрации РНК проводили спектрофотометрическим методом. Обратную транскрипцию и ПЦР проводили на амплификаторе MasterCycler personal (Eppendorf, США). С помощью системы гель-документирования BioRad Molecular Imager Gel Doc XR System под ультрафиолетовым излучением сравнивали интенсивность свечения ПЦР-продуктов, окрашенных бромистым этидием. ПЦР с детекцией в реальном времени проводили на приборе Abi Prizm 3700 фирмы Applied Biosystems (США). Специфические праймеры для анализа исследуемых генов были изготовлены фирмой «Синтол» (Россия).
Статистическая обработка данных проводилась в программе Statistica 6.0. При оценке данных использовали критерий Стьюдента. Различия между показателями считались достоверными при уровне значимости P < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Определение функциональной активности серотонинэргических рецепторов в аорте крысы
5-НТ1А рецепторы. Показано, что агонист 5НТ1А-рецепторов бушпирон в концентрации 10-8М и 10-7М не стимулировал сокращение аорты. Применение бушпирона в концентрации 10-6 М приводил к существенному увеличению силы изометрического сокращения аорты. Предварительная инкубация сосудов с антагонистом α1-АР прозасином (10-7М) предотвращала констрикцию сосудов в ответ на воздействие высоких концентраций бушпирона, что подтверждает литературные данные о сродстве агонистов 5НТ1А-рецепторов к α1-АР (Yoshio R. et al., 2001). Таким образом, усиление тонуса сосудов под воздействием агонистов 5НТ1А-рецепторов связано с неспецифической активацией α1-АР (рис.1).
Бушпирон, добавленный к аорте на фоне тонической фазы сокращения НАдр, приводил к зависимому от концентрации расслаблению сосуда. Аналогичные результаты были получены при применении другого селективного агониста 5НТ1А-рецепторов (R)-(+)-8-ОН-DPAT hydrobromide (8-ОН-DPAT). В концентрациях 10-8-10-6 М данный агонист не влиял на сократимость изолированной аорты крысы. Сокращение сосуда наблюдалось только при увеличении концентрации до 10-5М. В то же время воздействие 8-ОН-DPAT (10-6 и 10-5 М) на предсокращенный НАдр сосуд приводил к его расслаблению.
Наиболее выраженным (до 80%) расслабление аорты было при воздействии на нее агонистов 5НТ1А-рецепторов в концентрации 10-5М. Кинетика кривой расслабления изолированных сосудов после добавления агонистов 5НТ1А-рецепторов бушпирона и 8-ОН-DPAT (10-6 и 10-5 М) на фоне тонического сокращения сходна с аналогичной кривой после воздействия на аорту карбохолина (КХ).
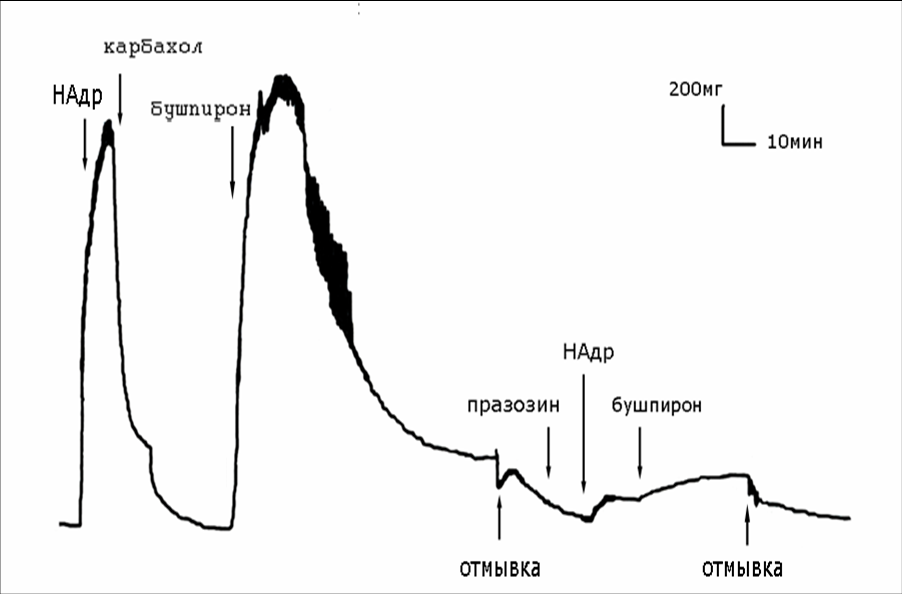
Рис. 1. Подавление вазоконстрикторного действия агониста 5-НТ1А рецепторов бушпирона блокатором α1-АР прозасином.
Активируя мускариновые рецепторы эндотелия, КХ вызывает образование окиси азота и гиперполяризующего фактора (Cocks T., Angus J., 1983). Для того, чтобы исключить возможность неспецифического взаимодействия бушпирона и 8-ОН-DPAT с мускариновыми рецепторами и опосредованную через эти рецепторы релаксацию сосудов, были поставлены эксперименты с использованием неселективного блокатора мускариновых рецепторов скополамина (10-6 М, 10-5 М).
После инкубации предсокращенного НАдр сосуда со скополамином (10-5М) ответ на КХ полностью исчезает, но остается неизменной релаксирующая реакция на воздействие 8-ОН-DPAT – агониста 5НТ1А-рецепторов (рис.2).
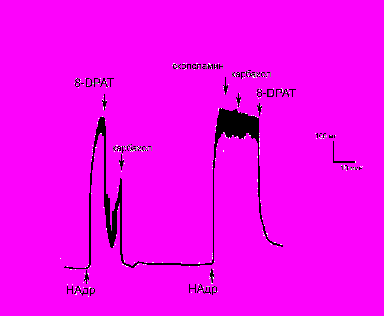
Рис.2. Расслабление аорты, предсокращенной норадреналином, под влиянием 8-ОН-DPAT на фоне блокады мускариновых рецепторов скополамином.
Противоположный эффект получен при добавлении 8-ОН-DPAT в концентрации 10-5М к сосуду, предсокращенному эндотелином-1 (ЭТ-1) в концентрации 10-8М. Под воздействием этого агониста 5НТ1А-рецепторов сила сокращения сосуда значительно возрастала вместо релаксации, наблюдаемой в экспериментах на фоне НАдр (рис.3А). Для того чтобы понять причину подобной инверсии ответа на агонист 5НТ1А-рецепторов 8-ОН-DPAT были поставлены опыты, в которых после сокращения сосуда ЭТ-1 активировали α1-АР с помощью НАдр, что приводило к дополнительной вазоконстрикции, и на этом фоне на сосуд воздействовали 8-ОН-DPAT (10-5М). Под влиянием 8-ОН-DPAT сила сокращения сосуда уменьшалась (рис.3Б).
Полученные данные указывают на то, что стимулирующее действие на тонус сосудов бушпирона (10-6М) и 8-ОН-DPAT (10-5М) обусловлено их неспецифическим действием, которое реализуется через активацию α1-АР.
Выявленный на предварительно сокращенном сосуде релаксирующий эффект агонистов 5НТ1А-рецепторов бушпирона и 8-ОН-DPAT свидетельствует о причастности этих рецепторов к осуществлению вазодилататорного эффекта серотонина. Полученные результаты не противоречат литературным данным, согласно которым активация 5НТ1А-рецепторов приводит к релаксации сосудов по NO-зависимому механизму (Nebigil C. et al., 1995).
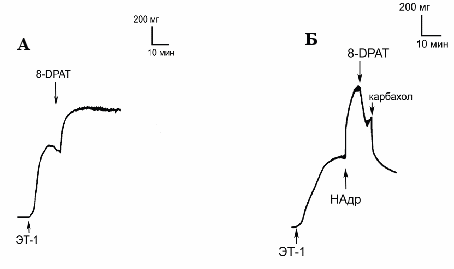
Рис.3. Влияние агониста 5НТ1А-рецепторов 8-ОН-DPAT на силу сокращения изолированной аорты.
5НТ1В-рецепторы. Для оценки функциональной роли рецепторов 5HT1B типа в обеспечении реакции сосудов на серотонин использовали селективный агонист этих рецепторов CGS 12066B dimaleate (CGS). CGS в концентрации 10-7 -105 М не изменял тонус изолированных фрагментов грудного отдела аорты в состоянии «покоя», но дозозависимо расслаблял сосуд, предсокращенный НАдр или ЭТ-1. Наиболее выраженный релаксирующий эффект (95-100%) наблюдался при применении CGS в концентрации 10-5М.
После блокады мускариновых рецепторов скополамином, в результате которой полностью устранялось карбахол-зависимое расслабление аорты, воздействие на сосуд агонистом 5HT1B-рецепторов CGS также приводило к его релаксации (рис.4).
5НТ1D-рецепторы. Аналогичные результаты были получены и при исследовании высокоселективного агониста серотониновых рецепторов 5HT1D подтипа L-694,247. Активация 5НТ1D-рецепторов с помощью L-694,247 (10-7-10-5 М) не приводила к изменению силы изометрического сокращения изолированных фрагментов аорты в «покое». Однако воздействие L-694,247 (10-5 М) на сокращенный НАдр или ЭТ-1 сосуд вызывало его расслабление до исходного состояния.
5НТ2А-рецепторы. Анализ литературы показал, что серотонин вызывает сокращение изолированной аорты крысы, действуя через 5НТ2А-рецепторы (MacLean M. et al., 1996). Это подтверждено опытами с применением блокатора 5НТ2А-рецепторов кетансерина. После воздействия на сосуды селективного антагониста 5HT2A-рецепторов кетансерина (10-9-10-8 М) дозозависимо уменьшался вазоконстрикторный ответ на серотонин и не изменялся на НАдр. При увеличении концентрации антагониста до 10-7 М уменьшалась сократительная реакция и на НАдр, а при воздействии на сосуды кетансерина в концентрации 10-6 М – исчезала как на серотонин, так и на НАдр.
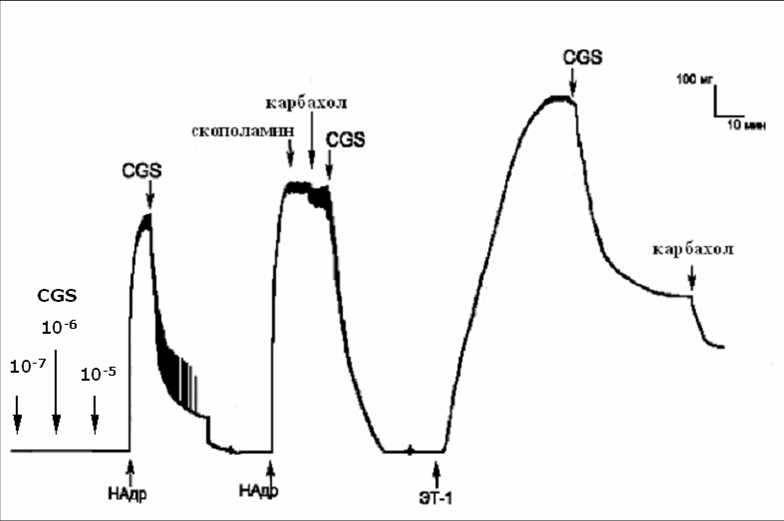
Рис.4. Расслабление аорты, предсокращенной норадреналином, под влиянием агониста 5НТ1В-рецепторов CGS 12066B на фоне блокады мускариновых рецепторов скополамином.
5НТ2В-рецепторы. Воздействие селективного агониста 5HT2B-рецепторов BW 723C86 hydrochloride (BW 723C) в концентрации 10-7-10-5 М не изменяло тонуса изолированных колец аорты. В то же время агонист BW 723C в дозах 10-5-5х10-5 М значительно уменьшал силу изометрического сокращения предсокращенных НАдр или ЭТ-1 сосудов. Схожие данные о роли 5НТ2В-рецепторов в эндотелий-зависимом расслаблении были получены на легочной артерии свиньи (Glusa E. et al., 2000). Выявленный релаксирующий эффект в результате воздействия на изолированные фрагменты аорты крысы BW 723C воспроизводился и после их инкубации с блокатором мускариновых рецепторов скополамином.
5НТ3-рецепторы. Использование селективного агониста 5НТ3-рецепторов 5-HTQ в концентрации 10-5 М не влияло на сокращение изолированной аорты крысы, как в состоянии «покоя», так и после воздействия на сосуд НАдр или серотонина. Антагонист 5НТ3-рецепторов тропанил (MDL-72222) в концентрации 10-6 М полностью подавлял, а в 10-7 и 10-8 М значительно снижал прессорный ответ сосудов на норадреналин, бушпирон и в меньшей степени на серотонин, что свидетельствует о неспецифичности его действия и возможном антагонизме по отношению к α1-АР.
5НТ4-рецепторы. В экспериментах с применением селективного агониста 5НТ4-рецепторов RS 67506 установлено, что активация 5НТ4-рецепторов вызывает расслабление аорты. При добавлении RS 67506 в концентрации 10-5М к предсокращенной НАдр аорте был получен умеренный релаксирующий эффект. Выраженное расслабление аорты наблюдалось при увеличении концентрации RS 67506 до 5х10-5 М. Расслабление сосуда воспроизводилось и при воздействии агониста 5НТ4-рецепторов на сосуд, в котором предварительно были заблокированы мускариновые рецепторы скополамином. В то же время воздействие агониста (5х10-5 М) на сокращенный НАдр сосуд с функционально неактивным эндотелием не приводило к его релаксации. О повреждении эндотелиального слоя изолированных фрагментов аорты свидетельствовало полное отсутствие (менее 5%) расслабляющего эффекта на карбахол. Исчезновение возбуждающего действия агониста 5НТ4-рецепторов RS 67506 на сосудах с поврежденным эндотелием позволяет предположить, что данный тип серотониновых рецепторов локализован в клетках сосудистого эндотелия.
5НТ5- и 5НТ7-рецепторы. Для активации 5НТ5- и 5НТ7-рецепторов использовали неселективный агонист 5-карбоксамидотриптамин – 5СТ (10-8-10-5 М). Помимо 5НТ5- и 5НТ7-рецепторов 5-СТ взаимодействует с рецепторами 5НТ1 типа. В экспериментах на изолированных сосудах нам не удалось выявить существенного влияния данного лиганда на тонус сосудов, находящихся в состоянии «покоя» и тонического сокращения.
Функционирование рецепторов серотонина на фоне деполяризации плазматической мембраны гладкомышечных клеток сосудов
Для выяснения особенностей функционирования 5НТ-рецепторов, были изучены факторы, влияющие на активность различных типов серотониновых рецепторов. Нами было высказано предположение, что развитие гиперреактивности аорты крысы на введение 5НТ связано с потенцированием активности вазоконстрикторных рецепторов и/или с подавлением действия вазодилататорных 5НТ-рецепторов. В экспериментах на изолированных сосудах мы попытались смоделировать условия, при которых усиливается вазоконстрикторная реакция на воздействие 5НТ, и выяснить, какие 5НТ-рецепторы причастны к реализации этого эффекта.
Деполяризация плазматической мембраны гладкомышечных клеток сосудов в результате повышения содержания ионов калия может выступать одним из факторов усиления реакции сосудов на серотонин (Watts S.W., 2000). При каждом последующем воздействии серотонина на сосуд ответная прессорная реакция ослабевает. В то же время, на фоне деполяризации плазматической мембраны сила изометрического сопротивления изолированных фрагментов аорты возрастает, достоверно превышая первоначальную прессорную реакцию на серотонин (рис.5).
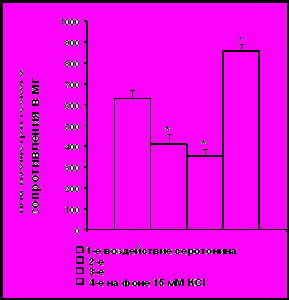
Рис. 5. Усиление вазоконстрикторного эффекта серотонина на фоне деполяризации плазматической мембраны клеток. Примечание: * - обозначена достоверность отличия от исходной силы сокращения, P<0,05.
Установлено, что деполяризация плазматической мембраны увеличивает силу сокращения аорты при воздействии на нее серотонином. В результате этого снимается десенсибилизация к 5НТ, которая развивается после его неоднократного воздействия на сосуды. Такой эффект можно объяснить усилением входа ионов Ca2+ в гладкомышечные клетки через потенциалуправляемые кальциевые каналы, активирующиеся при деполяризации. Благодаря притоку внешнего Ca2+ заполняются внутриклеточные хранилища этого иона, истощенные многократным воздействием серотонина на сосуды, что и приводит к восстановлению сократительной функции гладкомышечных клеток (Kroeze W. et al., 2002). Подтверждением правомерности такого объяснения служат полученные нами данные об отсутствии потенцирующего влияния деполяризующего раствора на серотонин-индуцированное сокращение в бескальциевой среде.
Чтобы оценить возможный вклад этого механизма в регуляцию функциональной активности серотониновых рецепторов, было изучено влияние деполяризации плазматической мембраны клеток на выявленные ранее эффекты агонистов 5НТ-рецепторов. По нашим данным при деполяризации плазматической мембраны свойства рецепторов 5HT1А, 5НТ1В, 5HT1D, 5HT2B и 5HT4 типа не меняются. Таким образом, полученные данные свидетельствуют о том, что ни один из этих подтипов серотониновых рецепторов не причастен к развитию гиперреактивности сосудов в ответ на серотонин при деполяризации мембраны, хотя некоторые авторы такую роль отводят 5НТ1В и 5НТ2В-рецепторам (Smith J.M. et al., 1999; Banes A., Watts S.W., 2003).
По нашим данным, при нормальном потенциале и при деполяризации вазоконстрикторное действие серотонина опосредовано 5НТ2А-рецепторами, поскольку в тех и других условиях оно в одинаковой степени подавляется блокатором этих рецепторов кетансерином. 5HT2A-рецепторы являются основными посредниками серотонин-индуцированнного накопления IP3 и последующего выброса Ca2+, и этот механизм лежит в основе сокращения гладкомышечных клеток аорты. Таким образом, главную роль в усилении вазоконстрикторного эффекта серотонина на фоне деполяризации играют 5НТ2А-рецепторы гладкомышечных клеток сосудов, активируя потенциалуправляемые кальциевые каналы L-типа.
Функционирование рецепторов серотонина на фоне действия вазоактивных агентов
Гиперреактивность сосудов к серотонину развивается при травматическом шоке, гипертензии, атеросклерозе и других патологических состояниях (Watts S.W., 2002; Кожевникова Л.М., Авдонин П.В., 2006). При этом в кровь выбрасываются различные вазоконстрикторы. Мы предположили, что наряду с деполяризацией плазматических мембран определенную роль в усилении сократительной реакции сосудов на воздействие серотонина могут играть и эндогенные вазоконстрикторы, в частности НАдр и ЭТ-1. Действительно, в экспериментах на изолированной аорте крысы мы обнаружили, что предварительная активация α1-АР норадреналином и ЕТА-рецепторов эндотелином-1 приводила к неожиданному усилению прессорного ответа на 5НТ.
Основываясь на результатах анализа полученных данных, мы ожидали, что при полной блокаде вазоконстрикторных 5НТ2А-рецепторов кетансерином (2х10-7 М) в ответ на воздействие 5НТ на фоне тонического сокращения сосудов проявится его релаксирующий эффект. Однако результат оказался противоположным ожидаемому. В результате потенцирующий эффект НАдр и ЭТ-1 отличался от эффекта KCl не только количественно, но и качественно. НАдр и ЭТ-1 в значительной степени снимали блокирование кетансерином серотонин-индуцированного сокращения сосудов. Предсокращенные НАдр или ЭТ-1 сосуды давали сильное сокращение в ответ на воздействие 5НТ в присутствии 10-7 и 2х10-7 М кетансерина. В этих концентрациях блокатор 5НТ2А-рецепторов кетансерин подавлял констрикторную реакцию на серотонин расслабленных сосудов при нормальном потенциале и при деполяризации плазматической мембраны (рис.6).
М
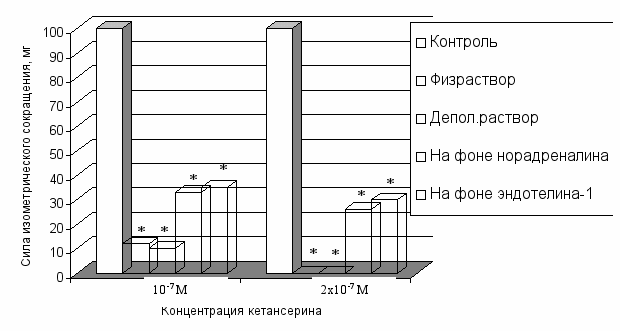 ожно предположить, что активация α1-АР или ЕТА-рецепторов либо меняет свойства 5НТ2А-рецепторов, увеличивая их сродство к 5НТ, либо регулирует функциональную активность других 5НТ-рецепторов. Ранее были опубликованы данные, косвенно свидетельствующие об увеличении сродства 5НТ2А-рецепторов к серотонину в ушной артерии кролика, предсокращенной KCl (Smith J.M. et al., 1999).
ожно предположить, что активация α1-АР или ЕТА-рецепторов либо меняет свойства 5НТ2А-рецепторов, увеличивая их сродство к 5НТ, либо регулирует функциональную активность других 5НТ-рецепторов. Ранее были опубликованы данные, косвенно свидетельствующие об увеличении сродства 5НТ2А-рецепторов к серотонину в ушной артерии кролика, предсокращенной KCl (Smith J.M. et al., 1999). Рис. 6. Подавление серотонин-индуцированной реакции аорты различными концентрациями кетансерина. Примечание: * - обозначена достоверность отличия от исходной силы сокращения, P<0,05.
Предположение о том, что снимается действие вазодилататорных рецепторов, нам кажется менее вероятным, так как агонисты 5НТ1В-, 5HT1D-, 5НТ2B- и 5НТ4-рецепторов расслабляют аорту крысы, предсокращенную НАдр или ЭТ-1. На наш взгляд, в этом потенцирующем эффекте задействованы рецепторы, отличные от 5НТ2А типа.
Не исключено, что в условиях активации эндотелиновых рецепторов реализация вазоконстрикторного эффекта серотонина может осуществляться посредством вазоконстрикторых 5НТ1А-рецепторов (неактивных в состоянии «покоя» сосуда), поскольку агонист этих рецепторов 8-ОН-DPAT увеличивает тонус предсокращенных ЭТ-1 сосудов (см.рис.3А). Мы пришли к выводу, что этот эффект не связан со сродством агониста к α1-АР в отличие от неспецифического действия 8-ОН-DPAT на расслабленный сосуд, где его сократительная реакция полностью снимается празозином (рис.7).
Действие 8-ОН-DPAT на сокращенный ЭТ-1 сосуд не связан с неспецифической активацией α1-АР, так как кривые действия этого агониста на фоне ЭТ-1 с празозином и без него полностью совпадают. Более того, это межрецепторное взаимодействие сохраняется на протяжении долгого времени, поскольку активация ЕТА-рецепторов оказывает потенцирующее действие на вазоконстрикторный эффект серотонина даже после инкубации сосудов с ЭТ-1 с последующей их отмывкой от лиганда.
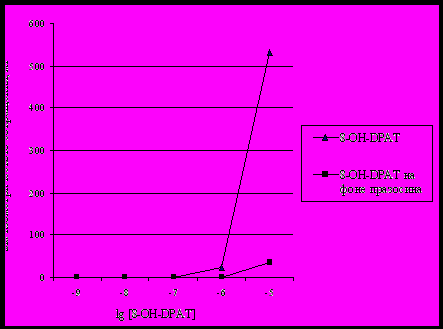
Рис. 7. Зависимость силы сокращения сосуда в состоянии «покоя» от концентрации агониста 5НТ1А-рецепторов 8-ОН-DPAT на фоне блокады α1-адренорецепторов и без нее.
Таким образом, активация α1-АР и ЕТА-рецепторов усиливает вазоконстрикторный эффект серотонина. Показано, что большинство представителей разных семейств G-белок-зависимых рецепторов существуют в виде гомо- и гетеродимеров, образованных близкородственными рецепторами (Kroeze W. et al., 2003). Можно предположить, что активация α1-АР и ЕТА-рецепторов оказывает влияние на лигандную специфичность 5НТ-рецепторов, сигнальные механизмы, а также на процесс димеризации рецепторов и образование гетеродимеров между разновидностями 5HT-рецепторов и/или неродственными рецепторами.
Функционирование рецепторов серотонина на фоне долгосрочного и краткосрочного воздействия глюкокортикоидов
В результате проведенных исследований экспериментально обосновано значение изменения функциональной активности глюкокортикоидных рецепторов в регуляции сосудистого тонуса. Ранее было показано, что природные и синтетические глюкокортикоиды способны приводить к истощению уровня цитозольных глюкокортикоидных рецепторов, угнетению функции коры надпочечников и подавлению биосинтеза стероидов (Izawa M. et al., 1983). При использовании высоких доз глюкокортикоидов очень часто развивается резистентность к их лечебному действию (Bamberger C.M. et al., 1996). Установлено, что глюкокортикоиды являются наиболее мощными регуляторами экспрессии собственных рецепторов. Они ингибируют экспрессию гена глюкокортикоидов во многих клеточных линиях и тканях животных и человека либо на уровне транскрипции, либо посредством уменьшения стабильности мРНК.
Для экспериментального обоснования высказанной гипотезы об участии глюкокортикоидов в регуляции сосудистой реактивности в ответ на основные вазоконстрикторные агенты была предпринята попытка смоделировать десенситизацию глюкокортикоидных рецепторов.
Как показано на рис.8, применение высоких доз дексаметазона в течение 5 дней значительно уменьшает чувствительность сосудов к ангиотензину II (10-8 М), вазопрессину (10-8 М) и эндотелину-1 (10-8 М), существенно повышает прессорную реакцию на серотонин (10-6 М) и практически не изменяет – на норадреналин (10-7 М). Сила изометрического сокращения колец аорты крысы после курса инъекций уменьшается в 2,2 раза на ангиотензин II (c 207±19 мг до 94±22 мг, р<0,01), в 2,5 раза на вазопрессин (с 213±11 мг до 85±15 мг, р<0,05) и в 1,5 раза на эндотелин-1 (с 1207±37 мг до 804±21 мг, р<0,05) по сравнению с контролем. Однако воздействие серотонином на сосуды приводило к увеличению вазоконстрикторной реакции с 298±11 мг до 417±20 мг (р<0,05). При этом глюкокортикоид не изменял эндотелий-зависимого расслабления в ответ на карбахол, что свидетельствует о целостности эндотелия.
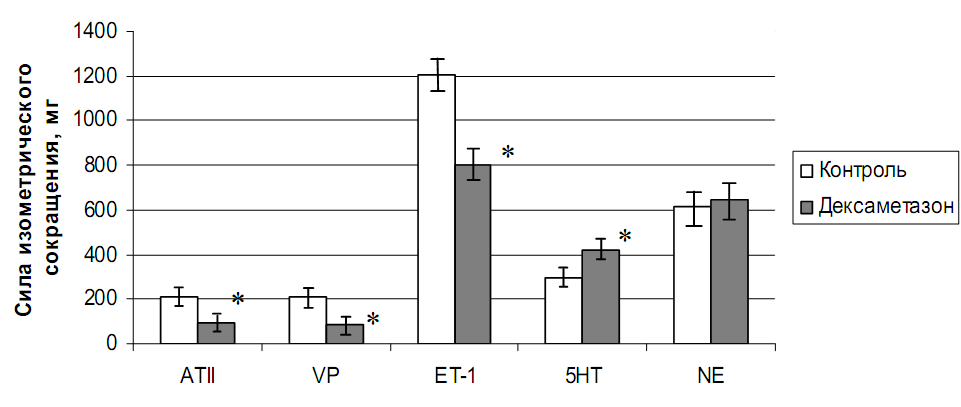
Рис.8. Изменение силы сокращения изолированных колец аорты после длительного применения дексаметазона. Примечания: ATII – ангиотензин II, VP – вазопрессин, ET-1 – эндотелин-1, 5HT – серотонин, NE – норадреналин. * - обозначена достоверность отличия от контроля, P<0,05.
Установлено, что активация глюкокортикоидных рецепторов путем инкубации в течение суток изолированной аорты крысы в культуральной среде DMEM с дексаметазоном в концентрации 10-6 М приводила к увеличению силы сосудистого сокращения в 2 раза в ответ на действие ангиотензина II (с 230±14 мг до 430±19 мг, р<0,01), в 2,8 раза – вазопрессина (с 220±22 мг до 530±16 мг, р<0,01) и в 1,2 раза – норадреналина (с 670±11 мг до 840±15 мг, р<0,01), но не влияла на вазоконстрикторную реакцию, вызванную эндотелином-1. При этом опять фиксировался противоположный ответ на серотонин по сравнению с другими эндогенными вазоконстрикторами (с 330±18 мг до 140±12 мг, р<0,01). Данные приведены на рис.9.
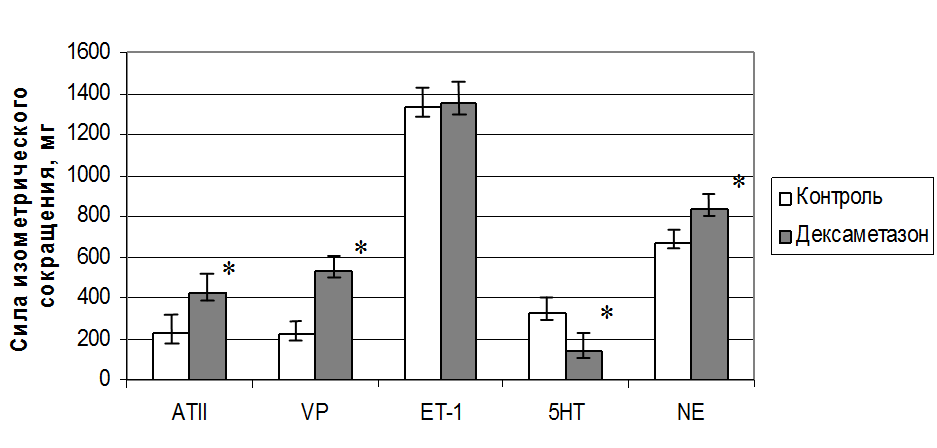
Рис.9. Изменение силы сокращения изолированных колец аорты после инкубации с дексаметазоном (10 мкМ) в течение 24ч. Примечание: сокращения см.рис.8. * - обозначена достоверность отличия от контроля, P<0,05.
В качестве контроля были взяты сосуды после суточной инкубации в среде DMEM. Нами не было выявлено достоверных различий в силе изометрического сокращения свежевыделенных и инкубированных (контрольных) сосудов на ангиотензин II, вазопрессин и серотонин. Это доказывает, что манипуляции с аортой в культуральной среде DMEM без дексаметазона не приводят к изменениям в сосудистой реактивности на исследуемые вазоконстрикторные агенты.
Аналогичные данные о повышении прессорного ответа на норадреналин и ангиотензин II были получены у пациентов с синдромом Иценко-Кушинга (Saruta T., Suzuki H. et al, 1986) и на экспериментальной модели дексаметазон-индуцированной гипертензии у собак (Nakamoto H, Suzuki H. et al, 1991). Имеются данные о том, что адреналэктомия снижает активность вазопрессин-чувствительной аденилациклазы в почках крыс, а введение альдостерона после удаления железы частично восстанавливает этот ответ (Rajerison R. et al, 1974). Схожим образом на эпителиальных клетках почек Xenopus laevis продемонстрировано повышение ответа аденилатциклазы на вазопрессин на фоне активации глюкокортикоидных рецепторов дексаметазоном (Preston A.S. et al., 1988). Полученные экспериментальные данные с эндотелином-1 согласуются с литературными, поскольку введение дексаметазона крысам с водой в течение 5 дней снижало экспрессию ETA и ETB-рецепторов в почках на 67±3% и 65±6% по сравнению с контрольными животными (Villeneuve A. et al., 2000). Отсутствие длительного влияния дексаметазона на сократимость изолированной аорты в ответ на норадреналин не исключает наличия связи между уровнем глюкокортикоидных рецепторов и сниженной экспрессией адренорецепторов. Это подтверждают эксперименты о том, что норадреналин взаимодействует с рецепторами с большим сродством в тесной взаимосвязи с G-белками, чем сам по себе (Haigh R.M., Jones C.T., 1990), а глюкокортикоиды необходимы для физиологического связывания в системе рецептор-G-белок. Регуляция стероидными гормонами числа G-белков, доступных для связывания, является одним из механизмов, с помощью которых осуществляется контроль над трансмембранными сигнальными путями (Haigh R.M. et al., 1990).
Приведенные данные позволяют говорить о том, что десенситизация глюкокортикоидных рецепторов является важным патогенетическим фактором нарушения регуляции сосудистого тонуса, и высказать предположение о глюкокортикоид-зависимых механизмах развития гипореактивности сосудов к вазоконстрикторным гормонам при стресс-реакции.
Результаты настоящего исследования имеют принципиальное значение для понимания роли глюкокортикоидных рецепторов в регуляции сокращения сосудов через 5НТ-рецепторы. Можно сделать вывод о том, что нарушения сосудистого тонуса в результате суточной активации ГРц, в первую очередь, вызваны увеличением чувствительности ангиотензиновых и вазопрессиновых рецепторов. И только при истощении глюкокортикоидных рецепторов, когда сосудистая реакция на ангиотензин II и вазопрессин падает, в качестве компенсаторного механизма включается серотонинэргическая система. Сложный характер изменения реактивности сосудов на серотонин может быть обусловлен наличием нескольких видов рецепторов серотонина, локализованных в эндотелии и в гладкомышечных клетках кровеносных сосудов. Так, показана способность кортикостероидов подавлять транскрипцию гена 5НТ1А-рецепторов в мозге крыс, что может занимать центральное место в патофизиологии депрессии (Wissink S. et al., 2000). Причем прессорный эффект в большей степени опосредуется через глюкокортикоиды, чем через минералокортикоиды, так как первые могут снижать чувствительность к серотонину. Авторы утверждают, что адреналэктомия усиливает, а введение экзогенных кортикостероидов подавляет экспрессию 5НТ1А-рецепторов. Эти результаты подтверждены другими исследованиями, в которых доказано изменение уровня мРНК 5НТ1А, но не 5НТ1В-рецепторов гиппокампа под влиянием кортикостероидов (Neumaier J.F. et al., 2000). Однако нами не были обнаружены публикации, посвященные влиянию стероидных гормонов на уровень плотности рецепторов серотонина в сосудах экспериментальных животных.
Эффекты серотонина осуществляются через 15 особых рецепторов. Физическое разнообразие и противоречивость литературных данных не позволила сделать однозначный вывод о причастности конкретного типа 5НТ-рецепторов к развитию гиперреактивности сосудов на серотонин при десенситизации ГРц. Поэтому для подтверждения результатов физиологических исследований мы исследовали уровень экспрессии генов серотонинэргических рецепторов при краткосрочном и долгосрочном воздействии дексаметазона (рис.10). Ввиду многообразия 5НТ-рецепторов методом количественной полимеразной цепной реакции был определен уровень только рецепторов типа 2А, которые, по литературным и собственным данным, являются основными вазоконстрикторами. Для сравнения нами была изучены плотность ангиотензиновых рецепторов типа 1А и вазопрессиновых рецепторов типа 1А методом количественной ПЦР.
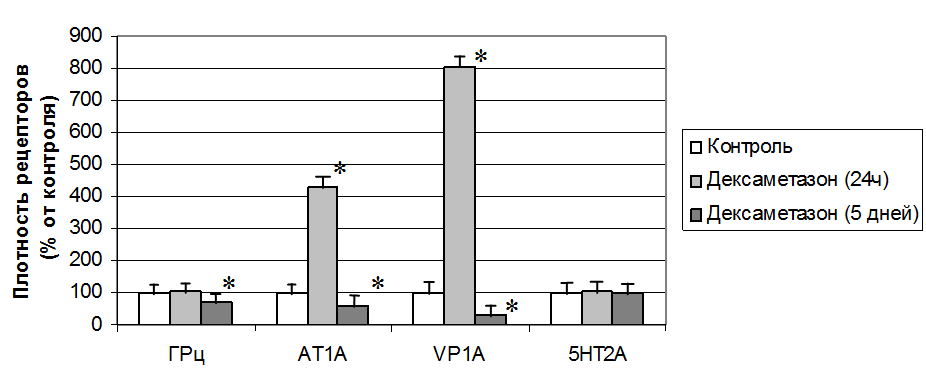
Рис.10. Изменение уровня экспрессии рецепторов в аорте крысы при воздействии дексаметазона методом количественной полимеразной цепной реакции. Примечание: Грц – глюкокортикоидные рецепторы, АТ1А – ангиотензиновые рецепторы типа 1А, VP1A – вазопрессиновые рецепторы типа 1А, 5НТ2А – серотониновые рецепторы типа 2А. * - обозначена достоверность отличия от контроля, P<0,05.
Показано, что усиление реактивности сосудов по отношению к ангиотензину II и вазопрессину после инкубации с дексаметазоном в течение суток вызвано глюкокортикоид-индуцированной активацией экспрессии их рецепторов, о чем свидетельствует 4-кратное увеличение содержания мРНК АТ1А-рецепторов для ангиотензина II и 8-кратное – мРНК V1A-рецепторов для вазопрессина в аорте крысы. Выявлено, что активация глюкокортикоидных рецпторов (ГРц) не оказывает прямого влияния на плотность вазоконстрикторных 5НТ2А-рецепторов. Предположено, что ГРц могут действовать опосредовано, усиливая экспрессию и функциональную активность мембранных рецепторов других вазоактивных соединений, которые в свою очередь могут изменять свойства 5НТ-рецепторов на уровне межрецепторного взаимодействия («cross-talk»).
Установлено, что воздействие в течение суток на сосуды дексаметазона в концентрации, активирующей ГРц, не приводит к изменению числа собственных рецепторов глюкокортикоидов. Это значит, что стероиды могут относительно длительное время стимулировать ГРц и таким образом усиливать индуцированный синтез мРНК соответствующих мембранных рецепторов. В результате происходит усиление сократительной реакции на воздействие ангиотензина II, вазопрессина и норадреналина.
При истощении ГРц в аорте крысы в 2 раза падает уровень экспрессии генов АТ1А и VP1A-рецепторов, что приводит к снижению вазоконстрикторной реакции сосудов по отношению к ангиотензину II и вазопрессину. Полученные данные подтверждают ранее высказанное предположение о том, что угнетение функциональной активности ГРц может являться одной из причин развития нарушений регуляции сосудистой сократимости.
Экспрессия 5НТ2А-рецепторов при десенситизации ГРц не изменяется, в то время как возрастает сократительная активность сосудов в ответ на действие серотонина, что указывает на иной механизм регуляции чувствительности кровеносных сосудов к серотонину. На наш взгляд, усиление прессорной реакции сосудов на серотонин на фоне истощения ГРц может происходить в результате повышения плотности других вазоконстрикторных 5НТ-рецепторов (например, «молчащих» в покое рецепторов типа 1А).
ВЫВОДЫ
- Вазоконстрикторный эффект серотонина реализуется через 5НТ2А-рецепторы, а вазодилататорный - через 5НТ1В, 5НТ1D, 5НТ2B и 5НТ4 рецепторы.
- В аорте крысы присутствуют вазоконстрикторные и вазодилататорные 5НТ1А-рецепторы.
- Деполяризация плазматической мембраны гладкомышечных клеток сосудов усиливает серотонин-индуцированную реакции через 5НТ2А-рецепторы.
- Потенцирующий эффект норадреналина и эндотелина-1 на серотонин-стимулированную сосудистую реакцию опосредуют вазоконстрикторные 5НТ1А-рецепторы.
- Регуляция тонуса аорты под воздействием серотонина на фоне дексаметазона не зависит от плотности 5НТ2А-рецепторов.
СПИСОК СОКРАЩЕНИЙ
5НТ – 5-гидрокситриптофан, серотонин
5НТ-рецепторы – серотонинэргические рецепторы
НАдр – норадреналин
α1-АР- α1-адренорецепторы
ЭТ-1 – эндотелин-1
ЕТА- эндотелиновые рецепторы типа А
АТ II – ангиотензин II
АТ1А – ангиотензиновые рецепторы типа 1А
ВП – вазопрессин
VP1A - вазопрессиновые рецепторы типа 1А
Грц – глюкокортикоидные рецепторы
ПЦР – полимеразная цепная реакция
ГМК – гладкомышечные клетки
СПИСОК РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
* - обозначены работы, опубликованные в изданиях ВАК РФ
- Бабичева А.Г. Исследование роли разных типов серотониновых рецепторов в регуляции сократимости аорты крысы [Электр.] / А.Г.Давыдова, Л.М.Кожевникова, П.В.Авдонин // Материалы V конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины», посвященной 250-летию Московской медицинской академии им. И.М.Сеченова РАМН. Москва, 2008.
- Бабичева А.Г. Возможные механизмы развития гиперчувствительности к серотонину при травматическом шоке [Текст] / Давыдова A.Г., Кожевникова Л.М., Авдонин П.В. // Материалы Международного междисциплинарного симпозиума «От экспериментальной биологии к превентивной и интегральной медицине». – Украина, Судак – 2008. – С.43-45.
- Бабичева А.Г. Активация серотониновых рецепторов в аорте крысы эндогенными вазоконстрикторами [Текст] / Давыдова А.Г., Кожевникова Л.М., Авдонин П.В. // Материалы стендовых докладов молодых ученых на XV школе «Актуальные проблемы биологии развития» ИБР РАН. М.: ООО «Блок», С.24-26.
- Бабичева А.Г. Феномен гиперчувствительности сосудов к серотонину при шоке как результат межрецепторного взаимодействия [Текст] / Давыдова А.Г., Кожевникова Л.М., Авдонин П.В. // Сборник материалов Всероссийской конференции «Научное наследие академика Л.А.Орбели. Структурные и функциональные основы эволюции функций, физиология экстремальных состояний», посвященной 125-летию со дня рождения академика Л.А.Орбели. – СПб.: ВВМ, 2008. – С. 73-74.
- Бабичева А.Г. Исследование роли глюкокортикоидных рецепторов в нарушении гормональной регуляции тонуса сосудов при геморрагическом и травматическом шоке [Текст] / Давыдова А.Г., Кожевникова Л.М., Авдонин П.В. // Сборник материалов Всероссийской конференции «Научное наследие академика Л.А.Орбели. Структурные и функциональные основы эволюции функций, физиология экстремальных состояний», посвященной 125-летию со дня рождения академика Л.А.Орбели. – СПб.: ВВМ, 2008. – С. 71-72.
- Бабичева А.Г. Экспрессия и функциональная активность 5НТ-рецепторов в аорте и брыжеечной артерии крысы [Текст] // Тезисы докладов конференции молодых ученых XV школы «Актуальные проблемы биологии развития» // Онтогенез, Том 40, №4, 2009, С.313-314.
- * Бабичева А.Г. Деполяризация плазматической мембраны и активация рецепторов эндогенных вазоконстрикторов как возможные механизмы усиления вазоконстрикторного ответа на серотонин при травматическом шоке у крыс [Текст] / Кожевникова Л.М., Давыдова А.Г., Авдонин П.В. // Известия РАН. Серия биологическая. 2009. №3, С.343-357.
- Бабичева А.Г. Влияние дексаметазона на экспрессию и функциональную активность рецепторов ангиотензина-II и вазопрессина в аорте крысы [Электр.] // Материалы XVI Международной конференции студентов, аспирантов и молодых ученых «Ломоносов-2009». Москва, 2009.
- * Бабичева А.Г. Влияние глюкокортикоидов на регуляцию сосудистого тонуса аорты крысы [Текст] / Бабичева А.Г., Тризно Н.Н. // Астраханский медицинский журнал. – 2010. - №4. – С.32-38.
- * Бабичева А.Г. Физиологические особенности гиперчувствительности аорты крысы к серотонину [Текст] / Бабичева А.Г., Тризно Н.Н. // Естественные науки. – 2010. - №4. – С.144-154.
- Бабичева А.Г. Изменение функциональной активности рецепторов серотонина в аорте крысы [Текст] / Бабичева А.Г., Тризно Н.Н. /Сб.науч.ст. «Вестник Торгово-технологического института»//Под ред. С.Л.Ивановой, Н.В. Мандриковой– 2010. – Н.Челны. – С.22-31.
