Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
Машенцева A.А.1, Калмошкенова Ж.Д.1, Сейтембетов Т.С.1,3,
Поляков В.В.2, Сейтембетова А.Ж.3
1Евразийский национальный университет им. Л.Н.Гумилева, Астана, Казахстан, 010008 ул.Мунайтпасова 5, Астана Казахстан,
2Северо-Казахстанский государственный университет им. М.Козыбаева, Петропавловск,
3АО «Медицинский университет «Астана», г. Астана, Казахстан
mashentseva.a@gmail.com
В работе [1] было проведено исследование фенолокислот масла почек тополя бальзамического, произрастающего на территории Северного Казахстана. Методами тонкослойной хроматографии доказано наличие коричной (1), о-кумаровой (2), кофейной (4), феруловой (5).
Нами проведено исследование антирадикальной активности данных соединений по отношению к различным инициаторам свободных радикалов. Также в данный ряд нами были включены м-кумаровая (3) и хлорогеновая (6) кислоты, стандартные вещества - аскорбиновая кислота(7) и бутилгидроксианизол ВНА (8). Анализ концентрационных кривых антирадикальной активности позволил произвести вычисления эффективного коэффициента ингибирования, указывающего на минимальное количество антиоксиданта, необходимого для уменьшения на 50% количества свободных радикалов в реакционной смеси.
С использованием методов квантовой химии нами были проведены расчеты таких показателей как потенциал ионизации (IP), энергия сродства к электрону (EA) и энтальпия диссоциации О-Н связи (BDE), которые, по мнению [2] наиболее полно характеризуют восстановительную способность фенольных антиоксидантов.
Полученные расчетные данные достаточно хорошо согласуются с экспериментальными данными IC50 для ABTS•+ катион радикала. Потенциал ионизации определяет восстановительную активность соединения – его способность легко отдавать электрон. Коричная кислота, не имеющая в структуре молекулы гидроксильных групп имеет самый высокий IP, м-положение ОН группы в гидроксикоричной кислоте, немного понижает восстановительную способность по сравнению с о-замещением. Минимальное значение IP хлорогеновой и аскорбиновой кислот подтверждает их высокий антиоксидантный статус.
Для выявления взаимосвязи «структура-активность» нами проведен корреляционный анализ экспериментальных данных IC50 для ABTS•+ катион радикала и значениями потенциала ионизации с коэффициентом достоверности корреляции R2=0,5265.
Список используемой литературы:
1. Поляков В.В., тАдекенов С.М. Биологически активные соединения растений рода Populus L. и препараты на их основе. – Алматы: Гылым, 1999. – 160 с.
2.Reis M.,.Lobato B, Lameira J., Santos AS., Alves CN. A theoretical study of phenolic compounds with antioxidant properties // European Journal of Medicinal Chemistry. 2007. V.42. P.440-446.
THEORETICAL AND EXPERIMENTAL STUDY OF THE ANTIRADICAL ACTIVITY OF DIFFERENT FLAVONOID-IRON COMPLEXES THROUGH DPPH AND ABTS ASSAYS
Mashentseva A.A.
L.N.Gumilev Eurasian national university, Munaitpasov 5, 010008,
Astana, Kazakhstan. mashentseva.a@gmail.com
Flavonoids are important natural antioxidants and free radical scavengers and have been studied because of their numerous biological activities. Also flavonoids are strong metal chelators which can chelate different metal ions to form complexes. Chelation potency of flavonoids is mainly related to a catechol moiety in the B ring, while redox behavior of ligands in complexes depends on the presence of the 3-OH group in their structure.
It is widely known that antioxidant functions of the flavonoids can be realized through hydrogen atom transferring, controlled by the bond dissociation enthalpy (BDE) of phenol, and electron donating ability, controlled by the ionization potential (IP). It was suggested that compound with low BDE and IP parameters has high H-transferring or electron donating ability [1]. In our study the BDE and IP values for all complexes and parent flavonoids were calculated with density functional theory method. It was founded that all complexes may exert their antioxidant activity through a way of combining hydrogen atom transferring and electron donating mechanism together.
DPPH and ABTS radical scavenging assays was performed in vitro to analyze the free radical scavenging abilities (RSA) of some flavonoid-iron (III) complexes with oxime pinostrobine, quercetine, rutin, techtochrysin. The RSA was compared with the same parameters of parent flavonoids. The results of the IC50 parameter for ABTS and DPPH radicals are indicated the lowest value for techtochrysin-iron complexes. The oxime pinostrobine-iron complex possesses higher scavenger potencies towards ABTS cation radical than parent flavonoids.
For the measurements of the reducing ability, the Fe3+– Fe2+ transformation was investigated in the presence of the flavonoids-iron complexes. The reducing capacity of a compound may serve as a significant indicator of its potential antioxidant activity. Similar to the antioxidant activity, the reducing power of the complexes increased with increasing dosage.
The ionization potential and bond dissociation enthalpy, as the two main factors determining free radical scavenging activity of phenolic antioxidants, were calculated with quantum-chemical software for all compounds.
It could be concluded that all studied complexes has RSA towards different reactive oxygen species and like parent flavonoids can possesses antioxidant activity which might be helpful in preventing or slowing the progress of various oxidative stress related diseases.
ИЗУЧЕНИЕ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ НЕКОТОРЫХ КОМПЛЕКСОВ КВЕРЦЕТИНА С МЕТАЛЛАМИ
Машенцева А.А.1, Лойко О.П.2, Калмошкенова Ж.Д.1, Тулеулов Б.И.3, Халитова А.И.3, Сейтембетов Т.С.1, Адекенов С.М.3
1Евразийский национальный университет им. Л.Н.Гумилева,
010008 ул.Мунайтпасова 5, Астана Казахстан,
2Карагандинский государственный университет им. Е.А. Букетова, ул.Университетская 28,100000, г. Караганда, Казахстан,
3АО МНПХ«Фитохимия», ул.Газалиева 4, 100000, г. Караганда, Казахстан, mashentseva.a@gmail.com
В настоящее время одним из перспективных направлений в области биоорганической химии является создание нетоксичных высокоэффективных антиоксидантов гибридного строения, имеющего несколько мишеней действия в организме человека. Модификация структуры известных ингибиторов позволяет путем направленного синтеза в одной структуре сочетать несколько характеристических групп, что дает основание рассматривать гибридные антиоксиданты, наряду с исходными биофлавоноидами, как потенциальные лекарственные средства нового поколения, корректирующие структурные и функциональны нарушения в организме и являющимися конкурентоспособными лекарственными средствами наряду с фармакопейными препаратами. Ряд публикаций посвящен исследованию реакций комплексообразования природных флавоноидов с различными металлами. Полученные комплексные соединения хелатного типа в ряде случаев обладают более высоким антиоксидантным потенциалом по сравнению с исходными лигандами-флавоноидами.
Нами проведено исследование антиоксидантой (АОА) и антирадикальной (АРА) активности синтезированных комплексов кверцетина с железом, кобальтом и цирконием. АРА оценивали по способности ингибировать стабильный DPPH радикал в диапазоне концентраций 0,1-1,0 мг/мл. В качестве вещества стандарта использовали бутилированный гидроксианизол (ВНА). Динамика изменения АРА приведена на рисунке 1.
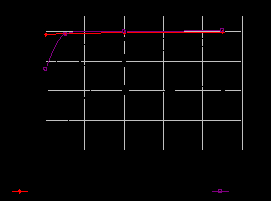

Рис.1. Динамика ингибирования DPPH радикала
На рисунке 2 приведены данные оценки АОА посредством измерения FRAP потенциала (ferric reducing antioxidant power). В данном эксперименте наибольшие значения получены для комплекса кверцетина с кобальтом.

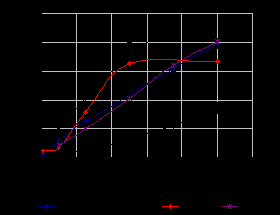
Рис.2. Изменение FPAP потенциала исследуемых комплексов
ФОТОСТАБИЛИЗИРУЮЩИЕ И АНТИОКСИДАНТНЫЕ
СВОЙСТВА АМИДНЫХ ПРОИЗВОДНЫХ САЛИЦИЛОВОЙ
КИСЛОТЫ
Медяник Н.П., Сторожок Н.М.
ГОУ ВПО «Тюменская государственная медицинская академия» Росздрава, 625023 Тюмень, ул. Одесская, 54, факс (3452) 20-74-21,
E-mail : nadinstor@mail.ru
Характерной особенностью производных салициловой кислоты является поглощение в области 300 нм, что используются для защиты кожи от УФ-облучения (метилсалицилат), а также для светостабилизации полимерных материалов. В НИОХ им. Н.Н. Ворожцова СО РАН синтезирована группа амидных производных салициловой кислоты, имеющих два заместителя, представляющих собой остатки пространственно затрудненных фенолов. Ранее показано, что соединения ингибируют процесс окисления как за счет уничтожения пероксильных радикалов (k7 = 1,7×104 М-1×с-1), а также разрушения пероксидов. Проявление синергизма в действии различных фрагментов молекулы N-замещенных амидов салициловой кислоты показывает перспективность этих соединений в качестве антиоксидантов (АО). Возможность фотоабсорбции и связанные с этим преимущества этого класса соединений в качестве ингибиторов УФ-инициированного окисления ранее не изучались.
В настоящей работе в сравнении с рядом природных и синтетических фенолов исследована кинетика и продукты фотопревращений 1-(N-4-гидроксифенил-3,3´,5´-тритрет-бутил)-5-этилсалициловой кислоты (I) и 1-(N-4-гидроксифенилпропил-3´,5´-дитритрет-бутил) салициловой кислоты (II), закономерности ингибирования УФ-инициированного окисления.
Для регистрации оптических спектров использовали спектрофотометр HP 8453 фирмы «Hewlett Packard», ИК-спектрофотометр Specord-75IR. Импульсный фотолиз проводили неодимовым лазером Nd:YAG (355 нм) с длительностью импульса 5 нс, площадью засветки 0.03 см2, энергией в импульсе 2 мДж. Стационарный фотолиз растворов амидов осуществляли серией импульсов указанного лазера, либо 4 мин облучением ртутной лампой ДРШ-250-3 (313-365 нм) в герметичной кювете d=0,4 cм, равноудаленной (10 см) от источника и сферического зеркала. Кинетику УФ-инициированного окисления изучали манометрическим методом при 60оС в установках типа Варбурга, скорость инициирования 0,67×10-8 М×с-1.
Анализ спектральных данных показал, что при фотолизе амидов салициловой кислоты образуются феноксильные радикалы RO, при этом ионизации N-H групп не происходит. При УФ-облучении кислород переходят в триплетное состояние, при поглощения второго кванта света - в возбужденное синглентное состояние, предшествующее образованию RO. Феноксильные радикалы гибнут по закону 2 порядка, константа скорости рекомбинации составляет kрек 2.3×108 л×моль-1×с-1. Показано, что скорость фотопревращения зависит от химического строения фенолов, наиболее легко фотолизируются пространственно незатрудненные фенолы. Установлено, что продукты фотолиза фотонеактивны. Изучение ингибирующего действия ряда природных и синтетических фенолов, включая N- замещенные амиды салициловой кислоты, показало, что ряд эффективности АО не связан со способом инициирования. N-замещенные амиды салициловой кислоты при УФ-инициированном окислении проявляют АО активность, сравнимую с действием известных синтетических фенолов. Низкая токсичность и высокая эффективность производных салициловой кислоты позволяет рассматривать их в качестве перспективных АО для пищевой технологии, медицины и фармации.
ВЛИЯНИЕ ВВЕДЕНИЯ АНТИОКСИДАНТОВ НА
СВОБОДНОРАДИКАЛЬНЫЕ ПРОЦЕССЫ В МОЗГЕ КРЫС ПРИ ГИПОТЕРМИИ
Мейланов И.С., Кличханов Н.К., Исмаилова Ж.Г., Астаева М.Д.,
Магомедов К.Г., Шихамирова З.М., Дибиргаджиева П.Ш.,
Раджабова З.Г., Сулейманова П. И
Дагестанский государственный университет, г. Махачкала,
ул. Гаджиева, 43а,тел.: 8(8722)675915, e-mail: meylanovis@mail.ru
Гипотермия представляет собой экстремальное состояние для гомойотермного организма. Окислительный стресс, который сопровождает такого рода состояние, особенно опасен для нейронов головного мозга. Нами было обнаружено, что кратковременная умеренная гипотермия 30°С приводит к окислительному стрессу в белках синаптических мембран мозга крыс: степень карбонилирования мембранных белков резко возрастает. В то же время, содержание малонового диальдегида (МДА) и диеновых конъюгатов (ДК) в липидах суспензии синаптосом при этом снижается. Таким образом, гипотермия подавляет перекисное окисление липидов, но увеличивает окисление мембранных белков.
В настоящей работе нами исследовано влияние гипотермии на степень карбонилирования мембранных белков, содержание МДА и ДК в синаптосомах мозга крыс на фоне внутрибрюшинного введения перед охлаждением животных даларгина (аналог лей-энкефалина, однократно за 30 минут до охлаждения), витамина С (аскорбиновой кислоты, однократно в сутки в течение 7-ми дней ) и -токоферола (витамин Е, однократно в сутки в течение 7-ми дней ) в дозе 500 мкг/кг веса тела, 100 мг/кг веса тела и 40 мг/кг веса тела соответственно.
Гипотермия на фоне курсового введения витаминов С и Е приводит к снижению содержания МДА в суспензии синаптосом, однако, это снижение составляет лишь 25% по сравнению с контролем, в то время как без введения снижение содержания МДА при гипотермии составило 44%. Содержание ДК в суспензии синаптосом при гипотермии на фоне введения антиоксидантов практически не изменилось по сравнению с контролем. Таким образом, введение антиоксидантов снизило влияние гипотермии на перекисное окисление липидов мембран синаптосом, хотя и не устранило это влияние полностью.
Введение даларгина привело к существенному уменьшению содержания карбонильных групп в белках синаптических мембран при нормотермии. Однако введение даларгина не предотвратило существенного возрастания степени карбонилирования белков при гипотермии. Систематическое введение аскорбата предотвращает возрастание карбонилирования белков при гипотермии. Гипотермия на фоне введения витамина Е не оказала существенного влияния на содержание карбонилов в белках. Таким образом, введение антиоксидантов предотвращает существенное повышение степени карбонилирования белков синаптических мембран при кратковременной умеренной гипотермии.
Введение антиоксиданта должно подавлять интенсивность свободнорадикальных процессов в клетке. Однако свободнорадикальные процессы разворачиваются в двух принципиально различных средах: 1. в водной среде, куда экспонированы аминокислотные радикалы белков, 2. в гидрофобной среде жирнокислотных остатков внутренней области мембраны. Естественно предположить, что водорастворимые антиоксиданты должны оказывать больший эффект на процессы, происходящие в одной фазе, а жирорастворимые – в мембранах. Действительно, в наших экспериментах аскорбат в большей степени уменьшил карбонилирование белков мембран при гипотермии, чем -токоферол.
Работа выполнена при финансовой поддержке гранта РНП №2.1.1/1605.
ЦИТОХАЛАЗИН D И КАЛИКУЛИН А МОДУЛИРУЮТ ВЛИЯНИЕ ОКИСЛЕННОГО ГЛУТАТИОНА И ГЛУТОКСИМА НА ТРАНСПОРТ Na+ В КОЖЕ ЛЯГУШКИ
Мельницкая А.В., Крутецкая З.И., Лебедев О.Е., Крутецкая Н.И., Бутов С.Н., Антонов В.Г.
Санкт-Петербургский государственный университет, г. Санкт-Петербург (199034, Университетская наб., д. 7/9, avm242@hotbox.ru)
Кожа амфибий и другие изолированные эпителиальные системы являются классическими модельными объектами для исследования механизмов транспорта ионов через биологические мембраны. Ранее нами было показано, что транспорт Na+ в коже лягушки модулируется различными окисляющими агентами, такими как цистамин, цистин, окисленный глутатион (GSSG) и его синтетический аналог препарат глутоксим® (ФАРМА-ВАМ, Москва). Впервые обнаружено, что GSSG и глутоксим, приложенные к базолатеральной поверхности кожи лягушки, имитируют действие инсулина и стимулируют трансэпителиальный транспорт Na+. Впервые выявлено также участие тирозинкиназ и фосфатидилинозитолкиназ в стимулирующем действии GSSG и глутоксима на транспорт Na+ в коже лягушки. В то же время, механизмы действия GSSG и глутоксима на транспорт Na+ остаются неясными.
Ранее нами было обнаружено, что транспорт Na+ в коже лягушки зависит от структурно-функциональной организации цитоскелета. Известно также, что актиновые филаменты имеют высокую редокс-чувствительность и легко подвергаются S-глутатионилированию. В связи с этим, представлялось целесообразным исследовать возможную роль актинового цитоскелета в регуляции GSSG и глутоксимом транспорта Na+ в коже лягушки Rana temporaria с использованием деполимеризатора микрофиламентов цитохалазина D и стабилизатора микрофиламентов каликулина А.
Для регистрации вольт-амперных характеристик кожи лягушки использовали автоматизированную установку фиксации потенциала. Транспорт Na+ оценивали как амилорид-чувствительный ток короткого замыкания (ISC). Статистический анализ проводили с применением t-критерия Стьюдента.
Впервые показано, что предварительная обработка апикальной поверхности кожи цитохалазином D (5 и 20 мкг/мл) и каликулином А (25 мкМ) существенно снижает стимулирующее действие GSSG и глутоксима на транспорт Na+ в коже лягушки. Обнаружено также, что цитохалазин D модулирует эффект GSSG и глутоксима на транспорт Na+ в коже лягушки. Так, высокие концентрации (20 мкг/мл) цитохалазина D полностью подавляют стимулирующее действие окисляющих агентов, тогда как низкие концентрации (5 мкг/мл) цитохалазина D изменяют также кинетику влияния GSSG и глутоксима: наблюдается некоторое усиление начальной и полное подавление второй фазы стимулирующего действия GSSG и глутоксима на транспорт Na+.
Таким образом, нами впервые показана важная роль актинового цитоскелета в действии GSSG и глутоксима на транспорт Na+ в коже лягушки. Результаты наших экспериментов свидетельствуют о том, что любые изменения в структуре (деполимеризация или стабилизация) микрофиламентов приводят к снижению стимулирующего действия GSSG и глутоксима на транспорт Na+ в коже лягушки. Полученные данные свидетельствуют также о ключевой роли микрофиламентов в реализации поздних этапов действия GSSG и глутоксима, а также о том, что и начальные этапы стимулирующего действия окислителей на транспорт Na+ опосредованы перестройками в структуре актинового цитоскелета.
СОВМЕСТНОЕ ВЛИЯНИЕ АРОМАТИЧЕСКИХ АМИНОВ И МЕРКАПТОЭТАНОЛА НА ОКИСЛЕНИЕ И cis/trans ИЗОМЕРИЗАЦИЮ НЕНАСЫЩЕННЫХ ЛИПИДОВ
Менгеле Е.А., Круговов Д.А., C. Ferreri, Chatgilialoglu C., Касаикина О.Т.
ИХФ РАН, ИБХФ РАН,** Istituto per la Sintesi Organica e la Fotoreattività, Consiglio Nazionale delle Ricerche; 119991 Москва, ул. Косыгина 4, elena-mengele@yandex.ru
Известно, что тиильные радикалы катализируют cis/trans изомеризацию ненасыщенных липидов [1,2], которые в природе синтезируются и существуют в cis- конформации. Процесс окисления липидов молекулярным кислородом развивается по цепному свободно-радикальному механизму и оказывает влияние на процессы . cis/trans изомеризации, протекающей в присутствии тиолов, продуцирующих тиильные радикалы в обменных радальных реакциях. В [3] показано, что скорость cis/trans изомеризации падает как в присутствии кислорода, так и при введении антиоксидантов фенольного типа. В представленной работе исследовано влияние антиоксидантов типа ароматических аминов на окисление и cis/trans изомеризацию ненасыщенных липидов (метиллинолеат и соевый лецитин), катализированную тиильными радикалами, образующимися из меркаптоэтанола.
Установлено, что добавка меркаптоэтанола, RSH, незначительно увеличивает скорость окисления метиллинолеата, LH, инициированного АИБН, и стимулирует образование trans-изомеров (50оС). Дифениламин, DA, замедляет окисление, но в отличие от фенольных антиоксидантов DA практически не влияет на скорость cis/trans изомеризации ненасыщенных кислотных остатков соевого лецитина, а в случае метиллинолеата даже увеличивает ее в инертной атмосфере. При совместном присутствии RSH и DA в присутствии О2 заметно (в 1,5 раза) увеличиваются и скорость окисления, и скорость cis/trans изомеризации.
Исследование влияния меркаптоэтанола на окисление метиллинолеата, ингибированное
гидрированными хинолинами, ГХ, сильными нетоксичными антиоксидантами [4,5], было установлено следующее: 1. В случае 6-этоксизамещенного ГХ, образующего в реакциях свободно-радикального окисления аминильные и нитроксильные радикалы, при добавке RSH исчезает период индукции и увеличивается скорость окисления; 2. В случае 8-гидрокси-замещенного ГХ, реагирующего с пероксильными радикалами как фенол с образованием промежуточных феноксильных радикалов, при добавке RSH имеет место продолжительный период индукции, свидетельствующий о синергическом антиокислительном действии RSH и 8-гидрокси-ГХ.
Увеличение скорости окисления и cis/trans изомеризации ненасыщенных субстратов в присутствии аминов и RSH указывает на существование следующих реакций передачи цепи: LO2* + >NH ® LO2H + >N*;
>N* + RSH ® >NH + RS*;
RS* + LH ® L’*;
L’* + O2 ® LO2*
[1] C.Chatgilialoglu, A.Altieri, H.Fischer. J.Am.Chem.Soc. 2002, 124, 12818;
[2] C.Chatgilialoglu, C.Ferreri. Acc.Chem.Res. 2005, 36, 441.
[3]. Е.А.Менгеле, К.Феррери, К. Чатжилиалоглу, О.Т.Касаикина. Вестн. Моск. Ун-та.Сер.2. Химия. 2010, 51, №3б 243.
[4] O.T.Kasaikina, A.M.Kashkay, T.V.Maximova. Oxid. Comm., 2000, 23, No.3, Р.383.
[5] D.A.Krugovov, V.G.Kondratovich, O.T.Kasaikina. Petrol. Chem., 2007, 47, No. 3, p. 193.
