Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
АНТИОКСИДАНТНАЯ АКТИВНОСТЬ ФЕНОЛЬНЫХ
СОЕДИНЕНИЙ ВИДОВ ФЛОРЫ ГРУЗИИ
Алания М.Д.,.Кавтарадзе Н.Ш, Сагареишвили Т.С.,
Шалашвили К.Г.,.Сутиашвили М.Г., Малания М.А
Институт фармакохимии им. И.Г.Кутателадзе, 0159, Тбилиси, ул. П.Сараджишвили 36, Тел.: (995) 32 53 14 94; Факс: (995) 32 52 00 23;
Е-mail: merialania@yahoo.com
Некоторые виды растений флоры Грузии были изучены на содержание фенольных соединений. Выделены обогащенные действующими веществами суммы и индивидуальные соединения. В сумме преимущественно преобладают фенольные соединения: флавоноиды, танины, антоцианы а в ряде случаев дополнительно обнаружены циклоартаны.
Активность исследовалась в опытах in vitro. Антиоксидантная активность (АОА) экстрактов оценивалась определением промежуточного липидно-пероксидного процесса малондиальдегида (МДА). Липидно- перекисное иницирование происходит под влиянием двухвалентных ионов железа. МДА определяется тестом тиобарбитуровой кислоты спектрофотометрическим методом. Результаты приведены в табл.1.
Данные, приведенные в таблице показывают, что экстракты в эксперименте in vitro в сыворотке крови человека вызывают значительное снижение промежуточного липидно-перекисного продукта малондиальдегида намного превосходящие таковые в препаратах сравнения – ЭДТА и -токоферол. На основании результатов исследования можно заключить, что изученные объекты обладают высокой антиоксидантной активностью.
Таблица 1
Относительная антиоксидантная активность обьектов по определению МДА
| № | Объекты исследования | Относительная АОА в % |
| 1 | Очищенный препарат листьев Salvia officinalis | 175 |
| 2 | Сумма антоцианов Urtica dioica L. | 157 |
| 3 | Сумма фенолов Rhododendron caucasicus | 147 |
| 4 | Сумма флавоноидов листьев Astragalus caucasicus | 144 |
| 5 | Сумма двух изофлавонов плодов Maclura aurantiaca | 140 |
| 6 | Сумма флавоноидов листьев Pueraria hirsuta L. | 136 |
| 7 | Сумма полифенолов Hamamelis | 134 |
| 8 | Сумма танинов Geranium pusillum | 133 |
| 9 | Сумма фенольных соединений Fraxinus ornus | 127 |
| 10 | Сумма флавоноидов листьев Astragalus tana | 120 |
| 11 | Сумма экстрактивных в-в плодов Maclura aurantiaca | 117 |
| 12 | Сумма экстрактивных в-в корней Maclura aurantiaca | 103 |
| 13 | Суммарный препарат иглиц Pinus silvestris | 102 |
| 14 | ЭДТА | 90 |
| 15 | -токоферол | 97 |
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ВЛИЯНИЯ ГИБРИДНЫХ АНТИОКСИДАНТОВ НА СТРУКТУРУ И ФУНКЦИИ КОМПОНЕНТОВ БИОЛОГИЧЕСКИХ МЕМБРАН
Алексеева О.М., Ким Ю.А.1, Миль Е.М., Албантова А.А. , Бинюков В.И., Голощапов А.Н., Бурлакова Е.Б.
Институт биохимической физики им. Н.М. Эмануэля РАН, г. Москва 117334 Москва, ул. Косыгина д.4., 939-74-09, olgavek@yandex.ru, 1Институт Биологии клетки РАН, Пущино, Россия.
Одной из первых мишеней на пути инородного вещества в организме животного является внеклеточная мембрана. Поэтому были последовательно исследованы воздействия тестируемых веществ на структурные и функциональные свойства всех компонентов мембран: липидные, белок- липидные домены, поверхностные рецепторы и каналы. Протестированы: пространственно затрудненный фенол фенозан, сильный антиоксидант, влияющий на структуру и функции мембран, без определенной мишени воздействия; и, синтезированные на основе фенозана гибридные антиоксиданты – ИХФАНы, с холиновым фрагментом, обуславливающим мишень воздействия – ацетилхолинэстеразой, и с варьирующий по длине цепи жирнокислотным остатком, заякоривающий ИХФАНы по всей толщине бислоя. ИХФАНЫ являются мультитаргетными (многомишенными) веществами. Методом адиабатной дифференциальной калориметрии изучалось влияние на структурную организацию микродоменов в мультиламмелярных гигантских липосомах из индивидуального фосфолипида и белок- липидных доменах в тенях эритроцитов, являющихся адекватной моделью внеклеточной мембраны для большинства клеток.. Влияние на растворимые белки – сывороточный альбумин (БСА) исследовалось спектральным анализом с измерением собственной флуоресценции БСА. Активность поверхностных каналов целых клеток эритроцитов регистрировалась потенциометрически с применением ионселективных электродов. По первичному светорассеянию регистрировались Са2+-К+ и -Сl--зависимые изменения объема клетки асцитной карциномы Эрлиха (АКЭ), отражающие механизмы передачи информации внутрь клетки и обратный ответ. На основании тестирования структурного и функционального воздействия широкого диапазона концентраций (10-21 М – 10-3 М) фенозана и ИХФАНов - С8, -С10, -С12, -С16 (АО), на ряд биологически значимых мишеней предлагается схема взаимодействия изучаемых АО с компонентами мембраны.
Большие концентрации 10-3 - 10-5 М, фенозана и ИХФАНов значительно меняют структуру мембран – деструктурируют микродомены липидов, в результате чего, переформируются и белок-липидные домены. При концентрации 10-5 10-4 М ИХФАНы формируют собственную фазу в бислое, имеющую иные термоиндукционные параметры. Естественно, такие домены ИХФАНов будут влиять на рафтовое окружение интегральных и ассоциированных рецепторов и ферментов клеточной мембраны, влияя на функциональные активности. Максимально действуют ИХФАНы С10 и С12, меньше С8 и С16, по-видимому, длина заякоривающего фрагмента С10, С12 оптимальна. Эффекты фенозана, не имеющего в составе молекулы жирнокислотного остатка, значительно слабее; собственная фаза не формируется; воздействие проявляется при больших концентрациях. Наиболее уязвимыми структурными мишенями оказались липидные бислои и растворимые белки. БСА меняет свою конформацию в присутствии ИХФАНов: высокие концентрации – 10-3, 10-5 М способствуют тушению собственной флуоресценции, при средних – 10-7, 10-8 М, напротив, происходит возгорание флуоресценции в ряду по возрастающей: С8 - С10 - С12 - С16. Вероятно, адсорбируясь на поверхности белка в зависимости от длины жирнокислотного остатка ИХФАНы, защищают триптофанилы от тушения водой. Белок-липидные мембраны структурно значительно устойчивее, и действие АО проявляется функционально: меняется активность P2Y рецепторов, CRAC и регуляторов апоптоза Bcl-2 и p53, проявляются морфологические изменения эритроцитов. Предлагаемая подборка методов исследования позволяет оценить побочные эффекты определенных концентраций тестируемых веществ, а также оценить аддитивность мультитаргетных биологически активных веществ и приблизиться к составлению схемы механизма их действия.
ИНГИБИРОВАНИЕ АВТООКИСЛЕНИЯ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ СМЕСЬЮ ЭФИРНЫХ МАСЕЛ
Алинкина Е.C., Теренина М.Б., Крикунова Н.И.,
Фаткуллина Л.Д., Воробьёва А.К., Мишарина Т.А.
Институт биохимической физики имени Н.М. Эмануэля РАН; Москва, 119334, Москва, ул. Косыгина, 4; Т.(495)939 71 81;
E-mail: peppy.87@mail.ru
Известно, что многие эфирные масла, выделенные из пряно-ароматических растений, обладают антиоксидантными свойствами и способны ингибировать окисление липидов в модельных системах различной степени сложности: в растворах, эмульсиях, липосомах, липопротеиновых комплексах и т.д. Степень ингибирования окисления зависит от состава системы, ее физико-химического состояния, природы, строения и концентрации липидов и эфирных масел. Целью работы являлось изучение ингибирования специально составленной смесью эфирных масел (Композиция 1) автоокисления смеси метиловых эфиров насыщенных и ненасыщенных высших жирных кислот (МЭЖК) в гексановом растворе. Оценка биологической активности Композиции 1 проводится в опытах с мышами. Контрольный образец содержал по 2.0 мг/мл смеси МЭЖК и 0.2 мг/мл тетрадекана (внутренний стандарт) в гексане. К таким же растворам добавили по 0,002 и 0,2 мг/мл смеси эфирных масел. Автоокисление проводили на свету при комнатной температуре в течение 12 месяцев. Каждую неделю пробирки открывали и продували 10 мл воздуха с помощью пипетки. Количественное содержание веществ в образцах определяли методом капиллярной газовой хроматографии каждые две недели в течение 2-х месяцев, а затем через каждый месяц окисления. Применение ГХ метода позволило оценить количественные изменения каждого МЭЖК с увеличением времени окисления, определить степень и скорость окисления в контрольном образце и в образцах, содержащих эфирные масла в двух концентрациях. Во всех образцах не наблюдали окисления насыщенных жирных кислот. В контрольном образце через 21 день начиналось окисление тетра- и гексаеновых кислот, через 80 дней – диеновой кислоты и только через 100 дней – моноеновых кислот. Малая доза смеси эфирных масел увеличивала срок начала окисления диеновой кислоты до 100 дней и только до 30 дней - тетра- и гексаеновых кислот. В образцах с большой дозой сроки начала окисления ненасыщенных кислот увеличивались: моно- и диеновых МЭЖК - до130 дней, тетраеновых – более 100 дней и докозогексаеновой кислоты – до 84 дней. Также существенно увеличилось время практически полного (осталось менее 2%) окисления докозогексаеновой кислоты - с 98 до 370 дней. Через 370 дней окисления в контрольном образце осталось только 10% октадиеновой и 55% олеиновой кислот. В присутствии смеси эфирных масел эти кислоты сохранялись на 70% и 80%, соответственно. Следует отметить, что скорости окисления тетра- и гексаеновой кислот в контрольном образце и с малой дозой эфирных масел были практически одинаковы, с большой дозой они были в 2 раза меньше. Таким образом, установлено, что скорость окисления ненасыщенных жирных кислот в растворе зависела от степени их ненасыщенности. Предложенная композиция эфирных масел является эффективным ингибитором автоокисления полиненасыщенных жирных кислот в растворах.
Работа выполнена при финансовой поддержке Программы фундаментальных исследований РАН ОХНМ-09 «Медицинская и биомолекулярная химия», проект 01-РАН-09.
АКТИВНОСТЬ КАТАЛАЗЫ В ТКАНЯХ КРЫС ПРИ
ХРОНИЧЕСКОЙ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИИ И
ДЕЙСТВИИ МЕЛАТОНИНА И ТИОКТОВОЙ КИСЛОТЫ
Аллекрад Х., Попова Т.Н., Матасова Л.В., Клокова А.И
Воронежский государственный университет, г. Воронеж, 394006,
Университетская пл., 1, (4732)208278, larissamatasova@yandex.ru
Известно, что хроническая алкогольная интоксикация приводит к окислительному стрессу путем усиления образования свободных радикалов и разрушения антиоксидантной системы защиты в клетках [Koch O.R., 1991]. В настоящее время внимание исследователей привлекают средства антиоксидантной защиты, в основе которых лежат естественные метаболиты клеток. Мелатонин, продуцируемый эпифизом и экстрапинеальными тканями, участвует в синхронизации биоритмов, регуляции репродуктивной и иммунной систем, антистрессовой защите [Yu H.S., 1993]. Тиоктовая кислота (ТК; α-липоевая кислота) - ссылка скрыта пируватдегидрогеназного и 2-оксоглутаратдегидрогеназного комплексов. Целью работы явилось исследование влияния мелатонина и тиоктовой кислоты на активность каталазы в тканях крыс при хронической алкогольной интоксикации. В качестве объекта исследования использовались белые лабораторные крысы-самцы массой 150-200 г. В ходе эксперимента животные были разделены на пять групп: в 1 й группе (n=19) крыс содержали на стандартном режиме вивария; 2 ю группу (n=12) составляли животные с хронической алкогольной интоксикацией, которую создавали путем добавления к стандартному рациону 15% этанола регулярно в течение месяца; в 3 й группе (n=9) животным с 14 дня развития патологии внутрибрюшинно вводили ТК в дозе 35 мг/кг каждые 48 часов в течение последующих 14 дней; крысам 4 й группы (n=8) по аналогичной схеме вводили ТК в дозе 70 мг/кг; крысам 5 й группы (n=9) по представленной выше схеме вводили мелатонин в дозе 1 мг/кг; крысам 6 й группы (n=10) по той же схеме вводили мелатонин в дозе 2 мг/кг. Материал для исследования забирали через 28 дней после начала алкоголизации. Метод определения активности каталазы основан на способности пероксида водорода образовывать с молибдатом аммония комплекс, концентрацию которого определяли при длине волны 410 нм [Королюк М.А., 1988]. Данные обрабатывали с использованием t–критерия Стьюдента, различия считали достоверными при p<0,05.
При хронической алкогольной интоксикации наблюдалось повышение активности каталазы по сравнению с контрольными значениями: в печени и сердце в 2,7 и 2,2 раза соответственно, в сыворотке крови крыс - в 3 раза. Активация каталазы имеет значение не только для обезвреживания пероксидов, но и для ускорения окисления алкоголя. При введении тиоктовой кислоты в дозах 35 и 70 мг/кг было выявлено снижение активности каталазы по сравнению со значениями при патологии: в печени в 1,8 и 1,9 раза, в сердце – в 1,5 и 1,6 раза, в сыворотке крови - в 1,2 и 1,4 раза по сравнению С данными при патологии. При введении мелатонина в дозах 1 и 2 мг/кг активность каталазы также снижалась по сравнению со значениями при патологии: в печени в 1,7 и 1,8 раза, в сердце – в 1,3 и 1,8 раза, в сыворотке крови - в 1,1 и 1,7 раза. Полученные данные могут быть объяснены антиоксидантным действием ТК [Smith A.R., 2004] и мелатонина [Reiter R.J., 2000]. Кроме того, ТК, являясь коферментом, может активировать окисление продукта метаболизма алкоголя ацетил-КоА в печени, снижая его использование в процессе биосинтеза жирных кислот и предотвращая жировое перерождение печени.
ОСОБЫЕ СТРУКТУРЫ ВОДЫ (ОСВ), КАК УНИВЕРСАЛЬНЫЕ БИОАНТИОКСИДАНТЫ РЕГУЛЯТОРЫ СВОБОДНО-РАДИКАЛЬНЫХ ПРОЦЕССОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ: ЧТО ОБ ЭТОМ ПОВЕДАЛИ ГИДРАТИРОВАННЫЕ ФУЛЛЕРЕНЫ.
Андриевский Г.В.
Институт Физиологически Активных Соединений,
61072, Харьков, Украина, пр. Ленина, 58; Тел.: +38 057 763 0521
E-mail: yard@kharkov.ua
В сентябре 2005 в своем письме академику РАН Скулачеву В.П. были высказаны мысли по поводу того, какими свойствами должен был бы обладать идеальный биоантиоксидант (БАО) и который, в частности,
(а) нейтрализовывал бы только избыток свободных радикалов и не затрагивал бы их уровень, минимально необходимый для нормального функционирования биологической системы;
(б) регулировал бы свободнорадикальные процессы на уровне как гидрофобных, так и гидрофильных компартментов биологической системы в целом;
(в) не изменял бы естественные состояния гидратных оболочек, непосредственно окружающих нормальные (нативные) биологические структуры и, более того, стабилизировал бы и то, и другое;
(г) не воспринимался бы организмом, как чужеродное вещество, т.е. был бы нетоксичным в целом, неиммуногенным и т.п., а на уровне клетки, не влиял бы на ее нормальный гомеостаз;
(д) имитировал бы работу ферментов антиоксидантной защиты, например, был бы СОД-миметиком;
(е) работал бы как своеобразный катализатор самонейтрализации свободных радикалов в очень малых дозах и в течение длительного времени (напр. дни, недели) после однократного введения в организм.
Как показали наши, более чем 16-и летние исследования, удовлетворить таким требованиям в настоящее время может гидратированный фуллерен С60 (ГФС60, C60HyFn) – супрамолекулярный комплекс сферической молекулы углерода С60 с прочносвязанными, высоко упорядоченными молекулами воды. (ссылка скрыта).
Фуллерен С60, является одновременно и природным, и синтетическим веществом, а его гидратированная форма (ГФС60) проявляет многоплановую, позитивную биологическую активность на уровне как биомакромолекул, клеток, так и целостного организма. Также оказалось, что антиоксидантная эффективность ГФС60 превышает таковую для многих известных БАО в сотни-тысячи раз. Такое, после проведения в Украине официальных фармакологических и клинических испытаний ГФС60 в виде их водных растворов (ВРГФС60, C60FWS), позволило приступить к их госрегистрации в качестве антиоксидантного продукта для профилактики и терапии (дополнительной к основной) широкого круга заболеваний человека.
В тоже время, анализ многочисленных фактов универсальной биологической активности ГФС60, в т.ч. и когда он применяется в сверхмалых дозах, однозначно свидетельствует, что причиной этому является не сама молекула фуллерена С60: все биологические эффекты ГФС60 обусловлены особыми структурами воды (ОСВ), которые он вокруг себя способен организовывать и стабилизировать на расстояниях в десятки-сотни раз превышающих размер самой молекулы С60 (~ 1нм) (см. страницу «Фуллерены и вода» на сайте ссылка скрыта).
Более того, оказалось, что такие ОСВ являются весьма подобными тем структурам воды (мерцающим кластерам), которые она сама по себе, естественным образом формирует в своем объеме.
С другой стороны не должно быть удивительным то, что при зарождении Жизни, управляемой свойствами воды, структурные и конформационные особенности важнейших биологических молекул и их содружеств, особенности их гидратации должны были быть отражением структуры и свойств наноразмерных ОСВ.
Но, чтобы абиотический синтез учитывал свойств подобных ОСВ, эти структуры должны были бы быть стабильными и долгоживущими во времени. Помочь им в таком должна была некая наноразмерная матрица. И к настоящему времени накопилось достаточно фактов, чтобы полагать, что именно углеродные фуллерены, в содружестве с водой, были той самой матрицей, благодаря которой зарождалась углеродная Жизнь.
Косвенным подтверждением этой гипотезы являются уникальные антиоксидантные и радиопротекторные свойства ГФС60 и его растворов, механизмы антирадикальной активности которых, с точки зрения зарождения и развития биологической материи, являются универсальными и определяются структурными свойствами самой воды. Обобщая, можно сказать, что НЕ МОЖЕТ БЫТЬ БОЛЕЕ УНИВЕРСАЛЬНОГО АНТИОКСИДАНТА, А ТОЧНЕЕ, РЕГУЛЯТОРА СВОБОДНО- РАДИКАЛЬНЫХ ПРОЦЕССОВ, ЧЕМ ВОДНЫЕ СТРУКТУРЫ, УПОРЯДОЧЕННЫЕ ВПОЛНЕ ОПРЕДЕЛЕННЫМ ОБРАЗОМ, и которые, на начальном этапе эволюции биологических молекул, служили им в качестве «защитников» от их расщепления на свободные радикалы, вызываемого действием радиоактивного излучения, жестких ультрафиолетовых лучей, Реактивных Форм Кислорода и т.п..
Действительно, ведь не могла же Природа, порождая Жизнь, ждать, когда из простейших молекул синтезируются «нужные», сложные молекулы антиоксидантов (например, каротиноидов, флавоноидов и т.п), чтобы они в дальнейшем, выступая в качестве антирадикальных защитников, способствовали бы началу целенаправленного синтеза и наработке важнейших биологических молекул – ДНК, РНК, аминокислот и белков, липидов, углеводов и т.п.
Экспериментальные факты, подтверждающие вышесказанное, будут приведены и обсуждены в настоящем докладе.
ОЦЕНКА АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ ЭКСТРАКТА СЕМЯН ЛЬНА И ЕГО КОМПОЗИЦИЙ
С ДИГИДРОКВЕРЦЕТИНОМ
Андриуцэ Е.Н., Ильясов И.Р., Тюкавкина Н.А., Белобородов В.Л., Савватеев А.М.
ГОУ ВПО Московская медицинская академия им. И.М. Сеченова,
г. Москва, ул. 5-ая Парковая, д.21, стр.1, тел. (499)165-37-47, caress.kitten@mail.ru
В настоящее время проявляется большой интерес к такой группе биологически активных веществ, как полифенолы. К ним относятся флавоноиды, одним из которых является дигидрокверцетин (ДГК), обладающий широким спектром фармакологической активности. Другими заслуживающими внимания представителями биологически активных полифенолов являются лигнаны, в частности, диглюкозид секоизоларицирезинола (СДГ). Его доступным источником служат семена льна масличного (Linum usitatissimum Linn.).
Цель работы – определить антирадикальную активность ДГК, экстракта семян льна и их композиций по отношению к генерированным в модельных условиях радикал-катионам 2,2′-азинобис(3-этилбензотиазолин-6-сульфоната) ABTS+·.
Материалы и методы. Объектами исследования были ДГК и сухой экстракт семян льна (содержание СДГ не менее 40%), композиции экстракта семян льна и ДГК при молярных соотношениях их основных компонентов 10:1; 5:1; 1:1; 1:5; 1:10. Оценку антирадикальной активности (АРА) ДГК, экстракта и композиций осуществляли деколоризационным спектрофотометрическим методом, основанным на способности соединений ингибировать предварительно генерируемые в модельных условиях радикал-катионы ABTS+•. В качестве инициатора образования ABTS+· использовали пероксидисульфат калия. АРА выражали как процент ингибирования ABTS+• по формуле: %ингибирования = 100•(1 – А2/А1), где А1 – оптическая плотность раствора ABTS+• в фосфатном солевом буфере на длине волны 730 нм без добавления антиоксиданта, А2 – оптическая плотность раствора ABTS+• через 4 мин после добавления антиоксиданта.
Результаты. Экстракт семян льна и дигидрокверцетин ингибируют генерированные радикал-катионы ABTS+· в соответствии с их АРА, что выражается степенью уменьшения концентрации свободных радикалов ABTS+• под действием изучаемых антиоксидантов. Для каждого из исследованных объектов были получены линейные зависимости процента ингибирования ABTS+• в интервале 20-60% от концентрации образца в растворе вида y=ax+b. Линейные зависимости характеризуются коэффициентами корреляции от 0,987 (ДГК) до 0,999 (композиция ДГК:СДГ = 5:1). Для оценки АРА на основании полученных уравнений линейной регрессии рассчитывали IC50 (мг/л) (ДГК – 1,34, СДГ – 8,23, композиции ДГК:СДГ = 1:10 – 9,38, 1:5 – 8,15; 1:1 – 4,81; 5:1 – 2,63; 10:1 – 2,06) и
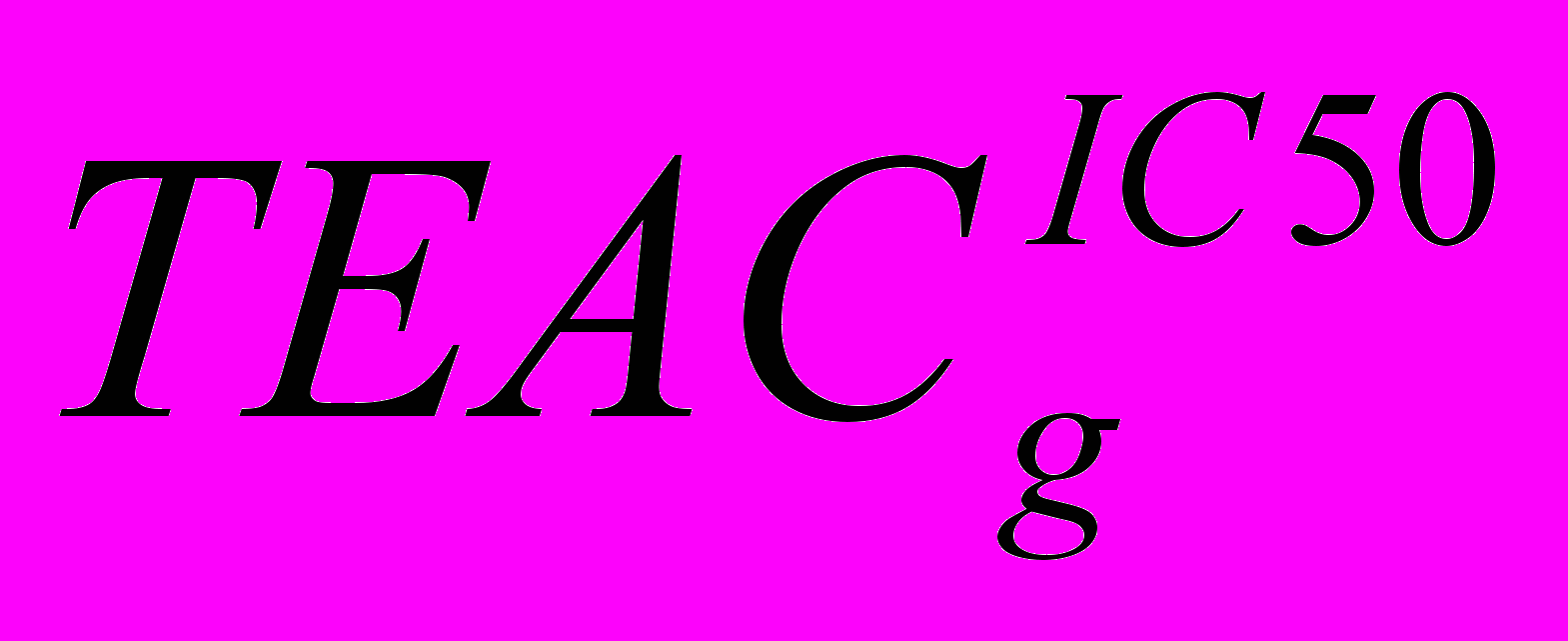 , выраженный как концентрация тролокса (ммоль/л), соответствующая по АРА концентрации 1 мг/л изучаемого объекта (ДГК – 7,29, СДГ – 1,19), композиции ДГК: СДГ = (1:10 – 1,04, 1:5 – 1,20; 1:1 – 2,04; 5:1 – 3,72; 10:1 – 4,75). Для композиций экстракта семян льна с ДГК обнаружен эффект антагонизма, симбатно изменяющийся в интервале от 11,7% (композиция ДГК: СДГ=10:1) до 40,9% (композиция ДГК:СДГ = 1:10).
, выраженный как концентрация тролокса (ммоль/л), соответствующая по АРА концентрации 1 мг/л изучаемого объекта (ДГК – 7,29, СДГ – 1,19), композиции ДГК: СДГ = (1:10 – 1,04, 1:5 – 1,20; 1:1 – 2,04; 5:1 – 3,72; 10:1 – 4,75). Для композиций экстракта семян льна с ДГК обнаружен эффект антагонизма, симбатно изменяющийся в интервале от 11,7% (композиция ДГК: СДГ=10:1) до 40,9% (композиция ДГК:СДГ = 1:10).Выводы. Осуществлена оценка антирадикальной активности дигидрокверцетина, экстракта семян льна и их композиций. Установлено, что АРА дигидрокверцетина в шесть раза выше таковой для секоизоларицирезинола диглюкозида. Для композиций экстракта семян льна с дигидрокверцетином обнаружен эффект антагонизма, возрастающий с повышением содержания СДГ в смеси.
