Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
ИЗМЕНЕНИЕ СТРУКТУРЫ ЦИТОСКЕЛЕТА В
ТРАНСФОРМИРОВАННЫХ И ЭМБРИОНАЛЬНЫХ КЛЕТКАХ ПРИ ДЕЙСТВИИ N-АЦЕТИЛЦИСТЕИНА И АЛЬФА-ЛИПОЕВОЙ КИСЛОТЫ
Вахромова Е. А., Кирпичникова К. М., И. А. Гамалей
Институт цитологии РАН, г. Санкт-Петербург ,Тихорецкий пр., д. 4,
тел. (812)-2973802; vakhromova.cath@gmail.com
Исследовали влияние двух антиоксидантов (NAC и ALA) на структуру актинового и тубулинового цитоскелета мышиных эмбриональных фибробластов и разных трансформированных клеток: мышиных фибробластов 3T3-SV40, мышиной гепатомы МГ22а, карциномы человека HeLa. Выясняли, каким образом реорганизация цитоскелета в присутствии антиоксидантов влияет на поверхностные свойства клеток, а именно, на их чувствительность к литической активности естественных киллерных клеток (ЕКК). Известно, что ЕКК могут без предварительной сенсибилизации узнавать и лизировать многие трансформированные (опухолевые или зараженные вирусами) и некоторые нормальные клетки (например, эмбриональные). Обнаружили, что действие NAC и ALA, в целом, сходно: оба вызывают дозо-зависимую разборку актинового цитоскелета, не нарушая при этом целостности системы микротрубочек. Это характерно для всех клеток, хотя морфологическая картина клеточного монослоя и самих клеток при действии антиоксидантов различается. Существенное отличие действия NAC от ALA заключается в том, что после удаления NAC из среды культивирования в клетках происходит постепенная реполимеризация актинового цитоскелета, при этом формируются утолщенные, хорошо выраженные стресс-фибриллы, отсутствовавшие в контрольных клетках. Такая жесткая организация актинового цитоскелета характерна для нормальных клеток, а появление ее у трансформированных клеток свидетельствует о реверсии (нормализации) трансформированного фенотипа. Аналогичной картины после удаления ALA не наблюдали. Вместе с тем обнаружили, что действие антиоксиданта меняет не только морфологические, но и функциональные свойства и трансформированных, и эмбриональных клеток: их чувствительность к литической активности ЕКК снижается или исчезает совсем, т.е. клетки перестают узнаваться и лизироваться ЕКК. В случае ALA потеря чувствительности всех клеток к литической активности ЕКК происходит непосредственно после действия агента и коррелирует с разборкой микрофиламентов. В случае NAC исчезновение чувствительности к ЕКК возникает только после удаления агента и коррелирует с появлением в клетках выраженных стресс-фибрилл. Возникает вопрос: связаны ли между собой организация актинового цитоскелета клетки и ее чувствительность к литической активности ЕКК. Для ответа на него моделировали действие антиоксидантов с помощью латрункулина В – деполимеризатора актина. Разборка актинового цитоскелета латрункулином, равно как и его деполимеризация в присутствии ALA, сопровождается уменьшением чувствительности клеток к ЕКК. При этом необходимо отметить определенные различия морфологической картины клеток и клеточного монослоя в целом в результате разборки микрофиламентов разными агентами. Таким образом, изменение чувствительности клеток к литическому лействию ЕКК связано не с конкретной организацией актинового цитоскелета, а с его реорганизацией, возможно, любой: деполимеризацией, реполимеризацией или появлением жестких стресс-фибрилл. Можно предположить, что изменение структуры микрофиламентов вызывает ряд молекулярных перестроек, ведущих к принципиальному изменению поверхностных свойств клеток.
Работа поддержана РФФИ (проект 09-04-00467)
Пост-гипоксический окислительный стресс и
антиоксиданты
Веселова Т.В., Веселовский В.А.
Биологический факультет МГУ имени М.В.Ломоносова ,119991, Москва, Ленинские горы, дом 1, стр. 12, Тел.: (495)939-32-73.
E-mail: taveselova@yandex.ru
Из медицинской практики известно, что активная оксигенация ишемической ткани может привести к отрицательным эффектам (пост-ишемическому окислительному стрессу).
Мы наблюдали подобное явление у семян гороха во время проращивания. Известно, что практически все семена при замачивании и проростании страдают от дефицита кислорода. Это явление удобно наблюдать, регистрируя замедленную люминесценцию эндогенных порфиринов набухающих семян. Зародыши семян гороха не повреждались при недостатке кислорода и продолжали развиваться. Однако во время проклевывания семян, когда кислород поступал к клеткам зародыша, они активно генерировали перекись водорода, удвоение ДНК прекращалось и ядерная ДНК деградировала. Выросшие проростки имели морфологические нарушения, были нежизнеспособными, всхожесть партии семян снижалась.
Если замачивание семян проводили в присутсивии антиоксидантов (пропилгаллат и карназин) число дефектных проростков уменьшалось, а всхожесть партии семян возрастала.
АНТИОКСИДАНТНЫЙ ЭФФЕКТ ГАНГЛИОЗИДА GM1 ПРИ
ДЕЙСТВИИ НА КЛЕТКИ РС12, РОЛЬ МОДУЛЯЦИИ СИСТЕМ ТРАНСДУКЦИИ СИГНАЛА
Власова Ю.А.
Институт эволюционной физиологии и биохимии им. И.М.Сеченова РАН, г. Санкт-Петербург, 194223, Санкт-Петербург, пр. Мориса Тореза, 44, (812)5523012, vlasovayu @rambler.ru
Ганглиозиды представляют собой сложные гликосфинголипиды, содержащие сиаловые кислоты, они характерны для нервных клеток позвоночных. Основные ганглиозиды мозга млекопитающих (GM1, GD1a, GT1b и GD1b) обладают свойствами природных нейропротекторов. Целью настоящей работы было изучение механизма антиоксидантного эффекта ганглиозида GM1 на клетки нейрональной линии РС12 в условиях окислительного стресса. Показано, что ганглиозид GM1 повышает жизнеспособность клеток линии РС12 при действии на них перекиси водорода и оказывает антиоксидантный эффект. Преинкубация клеток РС12 с 10 мкМ ганглиозида GM1 приводит к ярко выраженному снижению образования активных форм кислорода в клетках РС12, индуцированного перекисью водорода. Первые полчаса после воздействия перекиси водорода этот эффект еще не выражен, но он наблюдается уже через 1 час и особенно ярко выражен через 2 часа. Показано, что антиоксидантное действие ганглиозида GM1 опосредуется тирозинкиназой Trk рецепторов. Так, присутствие в среде инкубации ингибитора этого фермента практически предотвращало способность ганглиозида снижать аккумуляцию активных форм кислорода в клетках РС12 в условиях окислительного стресса, вызванного перекисью водорода. Изучено также влияние протеинкиназ, активирующихся после активации тирозинкиназы Trk рецепторов (“downstream”). Найдено, что в присутствии ингибиторов протеинкиназы, регулируемой внеклеточными сигналами (ERK 1/2) или фосфатидилинозит 3-киназы (PI 3-киназы), оказавшихся наиболее эффективными, GM1 терял способность ингибировать образование активных форм кислорода, менее выражен был эффект ингибитора протеинкиназы С. Таким образом, антиоксидантное действие ганглиозида GM1 опосредуется тирозинкиназой Trk рецепторов и ферментами, активируемыми этой протеинкиназой - ERK 1/2, PI 3-киназой и, возможно, протеинкиназой С. Найдено, что ганглиозид GM1 защищает митохондрии клеток РС12 от повреждающего действия перекиси водорода, он увеличивает скорость дыхания в присутствии FCCP на фоне олигомицина по сравнению со скоростью дыхания при действии на клетки одной перекиси водорода. Активация тирозинкиназы Trk рецепторов и затем протеинкиназ Erk 1/ 2 или PI 3-киназы может приводить к активации фактора транскрипции CREB, что в свою очередь может приводить к увеличению синтеза и активности антиапоптотических белков, например bcl-2, стабилизирующих функции митохондрий и снижающих образование в них АФК. Возможно и увеличение синтеза ферментов антиоксидантной защиты. Результаты исследования представляют интерес для понимания механизма нейропротекторного действия ганглиозидов.
РЕДОКС-АКТИВНОСТЬ КАРБОНАТНЫХ ВОДНЫХ СИСТЕМ: РОЛЬ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ.
Воейков В.Л., Буравлева Е.В., Виленская Н.Д., До Минь Ха,
Малышенко С.И.
Биологический факультет, Московский государственный университет им. М.В.Ломоносова, г. Москва, Ленинские горы, 119991, (495) 939-12-68, v109028v1@yandex.ru
Практически все природные воды, включая водную основу живых организмов, представляют собой карбонатные водные системы, так как в них всегда присутствуют в том или ином соотношении представители семейства карбонатов:
СО2H2CO3HCO3−CO32−
Известно, что карбонаты играют важнейшую роль в обеспечении аэробного дыхания. Даже небольшие изменения содержания СО2 в альвеолярном воздухе влияют на интенсивность дыхания значительно сильнее, чем содержание в воздухе кислорода. Снижение концентрация бикарбоната в крови ниже определенного уровня тесно коррелирует со многими патологическими состояниями, включая онкологические заболевания. Повышение тем или иным способом содержания в крови бикарбонатов оказывает выраженное терапевтическое действие. Бикарбонаты участвуют в регуляции дыхания не только на уровне организма, но и на тканевом и клеточном уровне, что было обнаружено еще в 30-е годы. Их действие не сводится лишь к нормализации кислотно-щелочного баланса, но обеспечивается, по-видимому, гораздо более тонкими механизмами, среди которых важную роль играет вовлеченность карбонатов в протекающие в водных системах ферментативные и неферментативные реакции с участием активных форм кислорода,.
Нами было обнаружено, что при добавлении к водным растворам бикарбонатов солей Fe(II) наблюдается волна излучения, регистрируемая чувствительными детекторами фотонов. Интенсивность излучения повышалась в присутствии люминесцентного зонда на активные формы кислорода (АФК) - люминола. Последовательное добавление к растворам солей Fe(II) сопровождалось возникновением послевательных волн излучения. Это свидетельствовало, что в растворах бикарбонатов спонтанно протекают цепные реакции с участием АФК. Если в бикарбонатные растворы предварительно добавляли H2O2 в субмиллимолярных концентрациях, люминол-зависимое излучение этих растворов, находящихся в герметически закрытых пробирках, не затухало в течение многих месяцев, даже если они находились в полной темноте. Ряд химических и физических факторов в сверх-малых дозах и крайне низкой интенсивности оказывал влияние на интенсивность излучения из бикарбонатных растворов. Так, гидратированные фуллерены, проявляющие сходное с каталитическим антиоксидантное действие (Андриевский и др., 2009), в дозах, соответствующих концентрациям 10-12 - 10-23 М устойчиво повышали интенсивность излучения из бикарбонатных водных систем в 2-3 раза. Добавление каталазы и тайрона как к активированным Н2О2, так и к неактивированным бикарбонатным растворам резко снижало интенсивность их излучения. Обнаружено также, что параметры излучения из активированных водных растворов бикарбоната существенно меняются в периоды лунного и солнечного затмений и зависят от других космо- физических факторов.
Учитывая, что представители семейства карбонатов являются обязательными компонентами биологических и любых других природных водных систем, полученные нами и имеющиеся в литературе результаты указывают, что они могут играть принципиально важную регуляторную роль во всех протекающих в водных системах процессах, в которых принимают участие активные формы кислорода, в частности, в процессах клеточного дыхания.
КИНЕТИЧЕСКИЕ И ТЕРМОДИНАМИЧЕСКИЕ АСПЕКТЫ
ВЗАИМОДЕЙСТВИЯ 2.2-ДИФЕНИЛ-1-ПИКРИЛГИДРАЗИЛА С ПРИРОДНЫМИ ФЕНОЛЬНЫМИ АНТИОКСИДАНТАМИ
Волков В.А., Пахомов П.М.
Тверской государственный университет, г. Тверь, vl.volkov@mail.ru
Стабильный радикал 2,2-дифенил-1-пикрилгидразил (ДФПГ) достаточно широко применяется для оценки антирадикальных свойств различных систем природного происхождения. Тем не менее, по -своему химическому
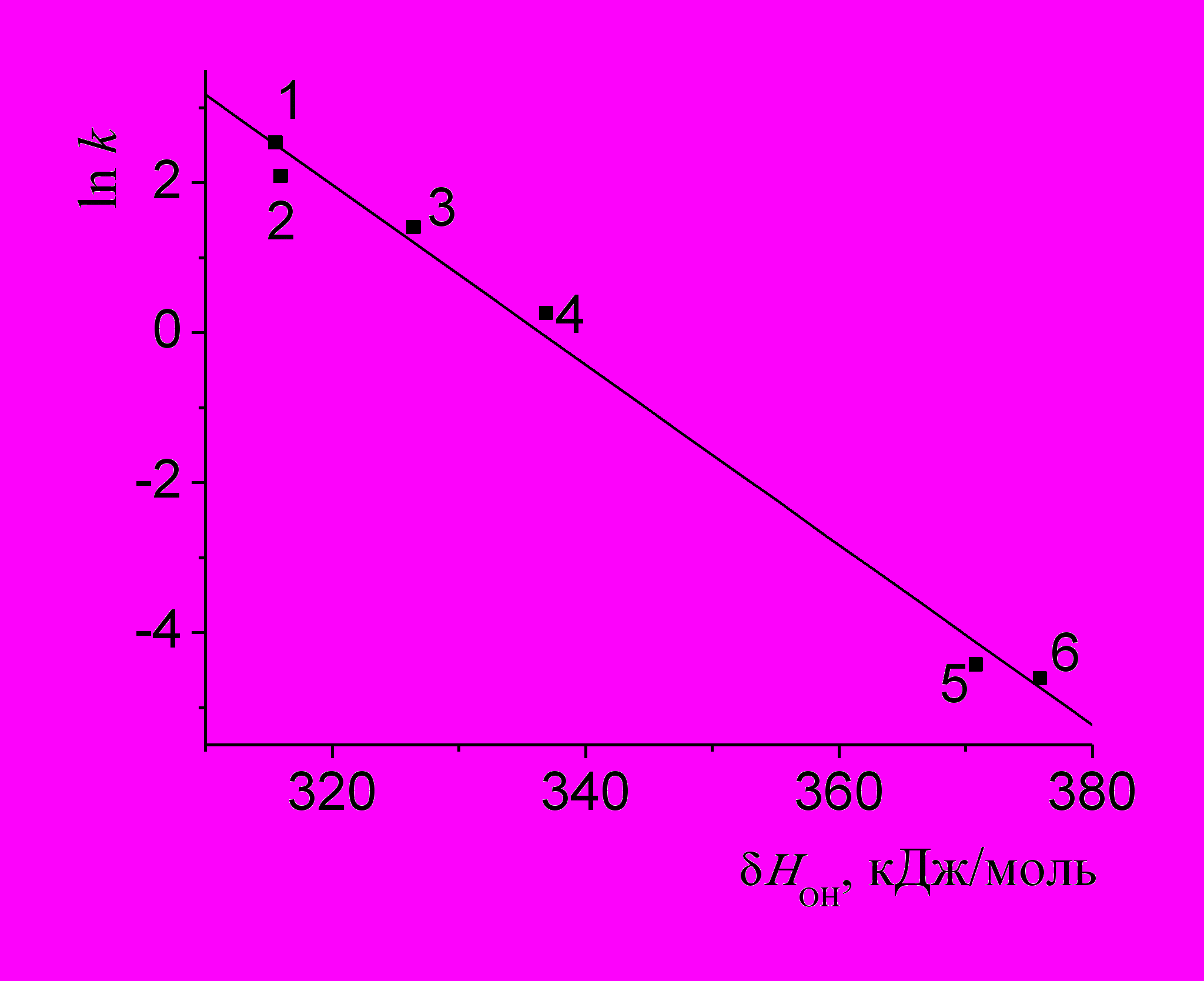
Рис. Корреляционная связь расчетной энтальпии диссоциации ОН групп фенольных АО и логарифмов констант скорости их взаимодействия с радикалом ДФПГ: 1 – галловая кислота; 2 – эпикатехин; 3 – пирокатехин; 4 – протокатеховая кислота; 5 – хризин; 6 – п-оксибензойная кислота.
отличается от радикалов, ведущих цепи жидкофазного перекисного окисления. В данной работе была поставлена задача выявить взаимосвязь реакционной способности фенольных антиоксидантов природного происхождения в отношении стабильного радикала ДФПГ с их химическим строением и термодинамическими параметрами молекул. В качестве реакционной среды использовался 0,1 мМ раствор HCl в этаноле [1;2]. Несмотря на то, что полученные в ходе эксперимента величины констант скорости взаимодействия фенольных АО с ДФПГ приблизительно на 5 порядков меньше, чем констант скорости взаимодействия этих же веществ с алкилпероксидными радикалами в липофильной среде [3], в обоих случаях наблюдаются аналогичные корреляции “структура – активность”.
Обнаружена (см. рис.) линейная взаимосвязь между величиной логарифма константы скорости реакции ДФПГ с АО и энтальпией диссоциации фенольной OH-группы, рассчитанной аддитивным методом [4].
Результаты проведенных исследований подтверждают корректность использования радикала ДФПГ для первичной оценки антирадикальной активности антиоксидантов природного происхождения, в том числе в сложных многокомпонентных системах.
СПИСОК ЛИТЕРАТУРЫ
- Волков В.А., Дорофеева Н.А., Пахомов П.М. // Хим.-фарм. журн., 2009. Т.43, №6.- С. 27- 31.
- Волков В.А., Пахомов П.М. // Труды IX Ежегодной Международной молодежной конференции ИБХФ РАН-ВУЗы «Биохимическая физика», 9–11 ноября 2009 г., Москва. – М., 2009. – С. 49-52.
- Tikhonov I., Roginsky V., Pliss E. // Int. J. Chem. Kinet. – 2009. – Vol. 41. – P. 92-100.
- Wright J. S., Johnson E. R., DiLabio G. A. // J. Am. Chem. Soc. 2001. Vol. 123. P. 1173-1183.
АКТИВИРОВАНИЕ ЗАЩИТНЫХ РЕАКЦИЙ У РАСТЕНИЙ КАРТОФЕЛЯ IN VITRO С ПОМОЩЬЮ ЭКЗОГЕННЫХ СТЕРОИДНЫХ ГЛИКОЗИДОВ В УСЛОВИЯХ АБИОТИЧЕСКОГО СТРЕССА
Волкова Л.А., Урманцева В.В., Бургутин А.Б., Маевская С.Н.,
Носов А.М.
Институт физиологии растений им. К.А.Тимирязева РАН, 127276 Москва, Ботаническая ул., 35, факс (495)977-80-18, la-volkova@yandex.ru.
Стероидные гликозиды – это биологически активные соединения, агликоны которых – сапогенины – представляют собой С27 стероиды с циклопентанопергидрофенантреновым скелетом (кольца А, В, С, D). В зависимости от строения стероидной части их разделяют на две основные группы: ряда спиростана (спиростаноловые) и фуростана (фуростаноловые). Используемые нами фуростаноловые гликозиды (ФГ) обладают широким спектром биологического действия, показанного в основном на животных клетках. У них обнаружены иммуномодулирующая, анаболическая, гепатопротекторная, овуляторная активности (1). На растениях действие ФГ в условиях абиотического стресса изучено гораздо слабее. Имеются сведения, что ФГ являются стабильным радикалом, имеющим подвижный атом водорода у гемикетальной гидроксильной группы при С-22. В связи с этим определили антирадикальные свойства ФГ в отношении анион-радикала кислорода и гидроксил-радикала, а также уровень индуцирования устойчивости при действии ФГ в условиях ОС. Для создания ОС были использованы воздействия абиотической природы, вызывающие окислительные повреждения - паракват (метилвиологен) и гипотермия. В нестрессовых условиях в концентрации 4,5 мкМ ФГ способствовали значительному увеличению активности пероксидаз. При этом снижение перекисного окисления липидов (ПОЛ) ниже контрольного уровня на фоне остающихся без изменения активностей СОД и каталазы может свидетельствовать о включении механизмов, связанных с репарационными процессами, устраняющими продукты ПОЛ. Стимуляция защитных реакций в растениях картофеля при экзогенном действии ФГ может осуществляться через генерацию активных форм кислорода (АФК). Результаты исследования показали, что после обработки ФГ через 5 мин в листьях наблюдалось увеличение АФК на 42%, которое через 15 мин снизилось на 20%, а через 30 мин уровень АФК приблизился к контрольному значению (без ФГ) и оставался без изменения до конца наблюдения (90 мин). В условиях абиотического стресса ФГ стимулировали адаптивные реакции, связанные с активацией гваякол зависимой пероксидазы и снижением уровня ПОЛ. При действии параквата (50 мкМ) в течение 11 дней и гипотермии (+4оС) – 28 дней уровень ПОЛ в варианте с ФГ был ниже на 20-40% по сравнению с действием стрессовых факторов. Показано, что в водной среде в бесклеточной системе ФГ проявляют антирадикальные свойства в отношении гидроксил-радикала в диапазоне концентраций от 4,5 до 65 мкМ; а в отношении супероксида эффект был незначителен. Антирадикальную активность ФГ определяли по количеству ТБК-активных продуктов (ТБК-АП), образовавшихся в результате деструкции 2-дезоксирибозы в реакции Фентона. Количество ТБК-АП в реакционной среде в присутствии ФГ снижалось на 20 – 50%. Таким образом, экзогенные ФГ в низкой концентрации (4,5 мкМ) способны индуцировать у клеток картофеля адаптивный ответ, проявляя при этом непосредственно антиоксидантное действие, что может приводить к снижению уровня липопероксидации в условиях окислительного стресса.
КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ, СИНТЕЗ И СВОЙСТВА АНТИОКСИДАНТОВ.
Володькин А.А., Бурлакова Е.Б., Заиков Г.Е., Евтеева Н.М.,
Ломакин С.М.
Учреждение Российской Академии наук Институт биохимической физики им. Н.М. Эмануэля, 119991 Москва, ул Косыгина, 4
Факс: (095) 1374101. E-mail: chembio@sky.chph.ras.ru
Использование результатов квантово-химических расчетов структур потенциальных антиоксидантов из класса пространственно-затрудненных фенолов позволило осуществить направленный синтез ранее неизвестных соединений с улучшенными антиокислительными свойствами. К таким соединениям относятся жирорастворимый трет.бутиловый эфир 3-(3,5-ди-трет.бутилфенил-4-гидрокси)пропионовой кислоты - анфенол-1 (константа к7 =2.106 л.мол-1.с-1, коэффициент обрыва цепи f=3 ) и водо-растворимые производные 1(карбокси)- -(N-метиламид)- 2-(3’,5’-ди-трет.-бутил-4’-гидрокси-фенил)пропионовой кислоты – натриевая соль (анфенол-2) и калиевая соль (анфенол-3). Моделирование основано на квантово-химических расчетах в приближении РМ6, результаты которых позволили рассчитать энергии О-Н связей фенольного гидроксила и изменения энтальпии и энтропии в обратимых процессах с участием пероксида и антиоксиданта. Водорастворимые анфенол-2 и анфенол-3 образуют кристаллогидраты, в водных растворах сольваты, что оказывает влияние на антиокислительные свойства в зависимости от их структуры. Установлено, что в структурах анфенолов-2 и –3 атомы металла образуют координационные связи с системой ароматического цикла и атомами кислорода пара-заместителя и эти структуры могут существовать в виде донорно-акцепторных образованием с участием молекул воды. Энергии О-Н связи фенольного гидроксила в донорно-акцепторных комплексах анфенол-2 – nН2О мало зависят от числа связанных молекул воды и находятся в пределах 72,5 ккал.мол-1.
Анфенолы-2 и 3 синтезированы гидролизом диэтилового эфира 1-(N-метиламид)-2-(3’,5’-ди-трет.-бутил-4’-гидроксифенил) малоновой кислоты, в результате которого образуются анфенолы и (N-метиламид)-2-(3’,5’-ди-трет.-бутил-4’-гидроксифенил)-пропионовой кислоты ( амид гомолога тироксина). Эти соединения образуются в процессе сопряженных реакций гидролиза и декарбоксилирования, выход которых зависит от условий реакции. Сравнительные данные антиокислительной активности соединений получены в модельной реакции окисления метилолеата в присутствии липидной фракции (вытяжки) печени мышей линии С3НА, которым за 1 час до забоя вводили инъекцию антиоксиданта. Преимущество этого метода связано с возможностью в адекватных условиях тестировать как жиро-, так и водо-растворимые соединения и это свойство использовано в данной работе. Наиболее высокую антиокислительную активность проявляет анфенол-2, который растворяется в воде (рН=7), малотоксичен (LD50 > 1500 мг.кг-1). Предварительными испытаниями установлено, что анфенол-2 является высокоэффективным ростостимулятором, проявляет защитные свойства при ожогах, радиационным поражением (лимфоциты крови) и других патогенных воздействий. Стимулируют развитие эмбрионов и могут быть перспективными при внутривенном введении.
СТРЕСС-ПРОТЕКТОРНАЯ АКТИВНОСТЬ ПРОДУКТОВ
ПЕРЕРАБОТКИ ВИНОГРАДА НОВОЙ СЕЛЕКЦИИ
Воронина Л.Н.1 , Загайко А.Л.1, Огай Ю.А.2 , Волынкин В.А.2, Левченко С.В.2
1 Национальный фармацевтический университет г. Харьков
2 Национальный Институт винограда и вина «Магарач», ул. Кирова, 31, Ялта, Крым, Украина 98600 Е-mail: magarach@rambler.ru
Благодаря полифенолам винограда, сосредоточенных в виноградных ягодах и винах и являющихся мощными антиоксидантами растительного происхождения можно защитить организм человека от многих патологий, в числе которых атеросклероз, ишемия, дисбактериоз, алиментарная аллергия, синдром хронической усталости, преждевременное старение и многие другие заболевания неинфекционной этиологии.
Задачей исследования было изучение биоаксидантной активности продуктов переработки сорта винограда Красень селекции НИВиВ «Магарач» в сравнении с сортом Каберне Совиньон. Исследования биологической активности веществ виноматериалов и безалкогольных концентратов проводили в Харьковском Национальном фармацевтическом университете (Украина) методами, принятыми в фармакологии. В работе использовали беспородных крыс-самцов, массой 180-220 г., содержащихся на сбалансированном питании в виварии ЦНИЛ НФаУ, оборудованном в соответствии с санитарными нормами. Животным на протяжении 21 суток ежедневно перорально вводили столовые виноматериалы сорта «Красень» в дозах, соответствующих 300 мл вина на человека массой 70 кг. Второй группе животных вводили спирт в дозе, соответствующей 30 мл спирта на человека массой 70 кг, с учетом коэффициентов видовой чувствительности. Третьей группе - пищевой полифенольный концентрат в дозах, соответствующих по содержанию полифенолов дозам введенных вин, а также в активных действующих дозах (9 мг полифенолов/100 г массы тела). Контрольным животным вводили соответствующий объем физиологического раствора. Стресс вызывали иммобилизацией на животе в течение 3 часов. Животных декапитировали через 3 часа после иммобилизации. Кровь собирали для получения сыворотки. Печень перфузировали холодной средой выделения (0,25 M сахароза в 0,025 М трис-HCl, pH 7,5), гомогенизировали в гомогенизаторе Поттера из расчета 1 г печени в 2 мл среды выделения. Все манипуляции с животными проводили под хлоралозо-уретановым наркозом.
Было установлено, что у стрессированных животных по сравнению с контрольными происходит увеличение выброса липидов из печени в кровь для возмещения энергозатрат на стресс, что проявляется в снижении уровня липидов в гомогенате печени увеличении липидов в сыворотке крови. Одновременно в крови резко возрастает содержание липопротеинов низкой плотности, ответственных за развитие атеросклероза. Кроме выраженной липодемии, другой стресс - реакцией является активация процесса свободно–радикального окисления. При этом как в печени, так и в крови наблюдается снижение содержания собственных антиоксидантов – α–токоферола и аскорбиновой кислоты, увеличение содержания продуктов перекисного окисления липидов – диеновых коньюгат, одновременно снижается активность нативных антиоксидантных ферментов как в печени (каталаза), так и в крови (пароксоназа). Гиперлипидемия и активация свободно–радикального окисления липидов сильно увеличивают риск сердечно сосудистых–заболеваний. Это свидетельствует о том, что виноматериалы и концентраты проявили в разной степени выраженную стресс-протекторную активность, при этом наибольшая активность - при использовании виноматериала «Красень». Его потребление соответствовало наименьшему содержанию в крови атерогенных липопротеинов низкой плотности, а также продуктов перекисного окисления липидов- диеновых коньюгат. Также показатели стресс-протекторной активности виноматериала «Красень», не только не уступают аналогичным показателям виноматериала «Каберне-Совиньон», но по некоторым показателям превосходят их.
