Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ И АНТИОКСИДАНТНАЯ
АКТИВНОСТЬ В СУСПЕНЗИОННЫХ И КАЛЛУСНЫХ
КУЛЬТУРАХ ГРЕЧИХИ ТАТАРСКОЙ
Гумерова Е.А., Утина Д.Б., Румянцева Н.И.
Казанский институт биохимии и биофизики КазНЦ РАН, г. Казань, 420111 ул. Лобачевского, д. 2/31, а/я 30, тел.(843) 231-90-42, gumeri@mail.ru
Гречиха татарская Fagopyrum tataricum Gaertn. является источником рутина и других фенольных соединений, обладающих высокой антиоксидантной активностью. Каллусные и суспензионные культуры клеток широко используются в биотехнологии в качестве продуцентов вторичных метаболитов. Известно, что вторичный метаболизм зависит от гетерогенности культуры и ее способности к различным видам дифференцировок, а также условий культивирования. Кроме того, по содержанию фенольных соединений и их антиоксидантной активности можно судить о степени развития в культуре in vitro окислительного стресса, который в свою очередь оказывает влияние на морфогенный потенциал культуры. Поэтому целью данной работы было изучение содержания фенольных соединений и их антиоксидантной активности в суспензионных и каллусных культурах гречихи татарской с разным морфогенным потенциалом.
Для опытов мы использовали морфогенные и неморфогенные каллусные культуры гречихи татарской и полученные из них морфогенные и неморфогенные суспензионные культуры. Каллусные и суспензионные культуры выращивали на средах с минеральными солями В5, содержащих гормоны 2,4-Д – 2 мг/л, ИУК – 0,5 мг/л, НУК – 0,5 мг/л, кинетин – 0,2 мг/л. Содержание фенольных соединений определяли с помощью реактива Фолина-Чокальтеу, антиоксидантную активность – с использованием радикала DPPH и стандарта Trolox.
Нами было установлено, что морфогенные каллусные и суспензионные культуры гречихи татарской не различались по содержанию внеклеточных спирторастворимых и водорастворимых фенольных соединений, тогда как неморфогенные культуры накапливали в среде культивирования в 1,5-2,5 раза больше водорастворимых фенолов, чем спирторастворимых фенолов.
Показано, что в суспензионных морфогенных культурах содержание внутриклеточных фенолов было в 2-4 раза выше, чем в неморфогенных, тогда как содержание внеклеточных фенолов в морфогенных и неморфогенных практически не отличалось.
В каллусной морфогенной культуре содержание внутриклеточных фенолов было в 3 раза выше, чем в неморфогенной, при этом содержание внеклеточных фенолов в морфогенных каллусах было на 19% ниже, чем в неморфогенных.
Несмотря на бóльшее содержание фенольных соединений в среде культивирования по сравнению с тканями (разница в 10 раз в суспензиях и в 100 раз в каллусах), внеклеточная антиоксидантная активность, наоборот, в обоих случаях была в 10 раз ниже внутриклеточной. Антиоксидантная активность внутриклеточных фенольных соединений морфогенных суспензионных и каллусных культур гречихи татарской была в 4-5 раз выше по сравнению с неморфогенными культурами. Интересно, что антиоксидантная активность внеклеточных фенолов морфогенных суспензионных культур была в 2 раза выше по сравнению с неморфогенными, в то время как в каллусных культурах она была приблизительно одинаковой.
Работа выполнена при финансовой поддержке гранта 09-04-97039-р_Поволжье_а.
ОБЕСПЕЧЕННОСТЬ СЕЛЕНОМ ГЕМОГЛОБИНА КАК
АНТИОКИСЛИТЕЛЬНЫЙ ФАКТОР ПРИ СТРЕССОРНЫХ
ВОЗДЕЙСТВИЯХ
Гусейнов Т.М., Дадашов М.З., Гулиева Р.Т., Яхъяева Ф.Р.
Институт Физики, НАНА, г. Баку, Азербайджан, thuseynov@physics.ab.az
Устойчивость организма к окислительному стрессу регулируется системой гемостаза, включающей в себе комплекс природных антиоксидантов. Одним из важных элементов которой является селен. Он может активно включаться в гемоглобин, состояние окисленности которого имеет существенное значение для развития перекисного окисления липидов (ПОЛ) эритроцитарных мембран.
В качестве удобной природной модели селендефицитного состояния организма и эритроцитов, в частности, может рассматриваться беременность, в ходе которой «емкость» системы природных антиокислителей (АО) истощается. Сам гемоглобин, как гемопротеид, обладает пероксидазной активностью, которая в присутствии GSH может рассматриваться как глутатионпероксидазная (ГП) активность (квази).
Целью настоящей работы явилось изучение насыщенности селеном гемоглобина на окислительный стресс, индуцированный такими факторами окружающей среды, как УФ-облучение, озон, электрические поля высокой напряженности.
Эритроциты женщин поздних сроков беременности показывают низкую загруженность селеном гемоглобина и существенно ускорение скорости накопления ПОЛ (МДА) при действии указанных стрессорных факторов. Характерно, что в ходе самой беременности при истощении селена в эритроцитах и гемоглобине сама ГП активность остается на стабильном уровне.
Удалось показать, что, несмотря на отсутствие видимой связи между содержанием селена в гемоглобине и ее ГП (квази) активностью она имеет выраженную видовую специфичность. Она присутствует в гемоглобине тех видов, у которых слабо выражена чувствительность к дефициту селена, и особенно видов, обладавших низкой истинной ГП активностью в эритроцитах, т.е. помогает «истинной» ГП в обезвреживании перекисей.
Значение «нагруженности» селеном гемоглобина для его окислительной резистентности можно проследить на модели УФ воздействия на лизаты эритроцитов начальных и поздних сроков беременности. С этой целью мы пропускали лизаты эритроцитов через гельхроматографическую колонку для оценки активности глутатионпероксидазы гемоглобиновых фракций. Пропустив и отделив начальные «неокрашенные» фракции лизатов в которых содержались каталаза (возможно вносит свой вклад в активность ГП, мол. масса ≈250 кДа), истинная ГП (мол. масса ≈86 кДа) от «окрашенного» фронта основного гемоглобинового элюата мы разделили последующую часть содержимого колонки на 5-7 фракций по 5 мл. При оценке содержания в них селена, активности ГП удалось выяснить, что в «норме» содержание селена в гемоглобиновых фракциях достаточно высокое и он более менее равномерно распределен по ним. Однако ГП активность в начале элюции имеет относительно высокое значение и убывает по мере роста номера фракций. УФ-облучение приводит к уширению «окрашенной» зоны и это более заметно для лизатов эритроцитов поздних сроков беременности. ГП активность гемоглобина под действием УФ- облучения явно уменьшается. Как уже указывали, сам гемоглобин в большей мере окислен и уширение «окрашенной» зоны сопровождается миграцией селена в ее верхние слои «окрашенной» зоны.
Указанные факты подчеркивают важность обеспеченности селеном гемоглобина, что позволяет рассматривать ее как фактор АО защиты наряду с SeГП, каталазой, СОД и т.д.
КИНЕТИЧЕСКИЕ ЭФФЕКТЫ СОВМЕСТНОГО
ИНГИБИРУЮЩЕГО ДЕЙСТВИЯ
α – ТОКОФЕРОЛА С ПРИРОДНЫМИ СОЕДИНЕНИЯМИ
ИЗОПРЕНОИДНОГО СТРОЕНИЯ
Дарюхина Е.Н., Сторожок Н.М.
ГОУ ВПО «Тюменская государственная медицинская академия» Росздрава, 625023 г. Тюмень, ул. Одесская, 54; тел.:(3452) 20-74-21, эл. почта: Nadinstor@mail.ru
Ингибиторы окисления зачастую вводят в липидные системы, включающие биоантиоксиданты (биоАО) различного химического строения (ά-токоферол (ά-ТФ), β-каротин, астаксантин и витамин D3 и т.д.) без учёта возможных эффектов их взаимодействия. В литературе имеются данные, констатирующие проявление эффектов антагонизма или синергизма в действии β-каротина и α-ТФ при разных соотношениях. Особенность влияния на процессы окисления астаксантина и витамина D3 в композициях с α-ТФ не изучена.
В связи с этим, целью настоящей работы явилось исследование кинетических эффектов совместного действия α-ТФ с соединениями изопреноидного строения (β-каротином, витамином D3 и астаксантином) в процессе окисления метилолеата (МО). В работе использовали манометрический метод поглощения кислорода. Процесс окисления инициировали азобисизобутиронитрилом (АИБН) при Т=3330 С. Попарно изучали ингибирующее действие смесей α-ТФ с β-каротином, астаксантином и витамином D3. Сопоставляли между собой сумму периодов индукции опытов, в которых окисление МО ингибировалось индивидуальными соединениями (Στi), с эффектом, получаемым при совместном действии компонентов (τΣ). Эффективность действия смеси количественно оценивали по абсолютному значению Δτ, определяемому по уравнению Δτ = τΣ - Στi, либо в относительных единицах (Δτ/ Στi)х100%.
В опытах поочередно менялось количество одного из компонентов, концентрация второго оставалась постоянной. Сопоставляли кинетический эффект совместного действия и молярные соотношения биоАО. Показано, что при разных соотношениях в действии компонентов возможно проявление аддитивности, эффектов синергизма или антагонизма. При постоянном количестве α-ТФ эффективность бинарных смесей в зависимости от концентрации β-каротина и атаксантина описывалась U-образной кривой, а для смеси α-ТФ с витамином D3 носила линейный характер. Знак эффекта определялся количеством полиена. При их малых концентрациях в совместном действии с α-ТФ констатировались эффекты синергизма. По мере роста количества изопреноидов уменьшается брутто-эффективность их смесей с ά-ТФ. При содержании полиена в 15 раз превышающего концентрацию α-ТФ, эффект антагонизма с витамином D3 достигает 50%, для смеси с β-каротином - 41,2%, а для композиции с астаксантином – 15%. Для полиенов со сравнительно более высокой степенью ненасыщенности эфыфект антагонизма был менее выражен. Переход совместного действия смеси из области антагонизма в область синергизма происходит при определённых соотношениях концентраций α-ТФ / полиен. Положительный знак эффекта констатируется для композиций с преобладанием в смесях α-ТФ в 100, 12 и 4 раза по сравнению витамином D3, астаксантином и β-каротином, соответственно.
Результаты настоящей работы представляют практический интерес, поскольку обосновывают соотношение бинарных смесей α-ТФ с рядом известных биоАО (β-каротином, астаксантином и витамином D3, совместно обеспечивающих высокое ингибирующее действие за счет проявления эффектов синергизма.
ВЛИЯНИЕ МУЛЬТИПРОБИОТИКА «АПИБАКТ®» НА
ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ В ПЕЧЕНИ КРЫС ПРИ ДЛИТЕЛЬНОМ ГИПОАЦИДНОМ СОСТОЯНИИ
Дворщенко Е.А., Сенин С.А., Береговая Т.В., Остапченко Л.И.
Киевский национальный университет имени Тараса Шевченко, г. Киев, 01033, Украина, г. Киев, ул. Владимирская, 60, тел. 044 5221795, e-mail: k21037@gmail.com.
Длительное использование блокаторов протонной помпы париетальных клеток желудка при лечении пациентов с гиперацидными состояниями приводит к снижению выделения секретина и холецистокинина, что угнетает желчную секрецию, вызывая нарушения в гепатобилиарной системе. Неспецифическим механизмом структурно-функциональных изменений клеток при патологии является нарушение баланса между образованием активных форм кислорода и их нейтрализацией. Это приводит к истощению запасов внутриклеточных антиоксидантов и активации процессов перекисного окисления липидов (ПОЛ).
Известно, что антиоксидантными свойствами обладают пробиотики (Ускова М.А., 2009). Нами был использован мультипробиотик "Апибакт®", который представляет собой концентрированную биомассу живых клеток мультикомпонентного симбиоза пробиотических бактерий (бифидобактерий, лактобактерий, молочнокислых стрептококков и пропионовокислых бактерий) и 2,5% спиртовой экстракт прополиса. Последний также обладает антиоксидантными свойствами.
Целью нашей работы было изучить действие мультипробиотика "Апибакт®" на интенсивность процессов ПОЛ в печени крыс при длительной желудочной гипохлоргидрии.
Эксперименты проведены на белых нелинейных половозрелых крысах-самцах. Гипоацидное состояние моделировали внутрибрюшинным введением 14 мг/кг 1 раз в сутки омепразола (Sigma, USA) на протяжении 28 дней (1 группа). Крысам второй группы одновременно с введением омепразола перорально вводили мультипробиотик "Апибакт
 " в дозе 0,14 мл/кг. В качестве контроля использовали крыс, которым на протяжении 28 суток вводили внутрибрюшинно 0,2 мл воды для инъекций. Через сутки после последнего введения омепразола в гомогенате печени определяли содержание диеновых конъюгатов – в гептан-изопропанольном экстракте спектрофотометрическим методом, шиффовых оснований – флуориметрическим методом, ТБК-активных соединений – по реакции с тиобарбитуровой кислотой. Для статистической обработки результатов использовали t-критерий Стьюдента.
" в дозе 0,14 мл/кг. В качестве контроля использовали крыс, которым на протяжении 28 суток вводили внутрибрюшинно 0,2 мл воды для инъекций. Через сутки после последнего введения омепразола в гомогенате печени определяли содержание диеновых конъюгатов – в гептан-изопропанольном экстракте спектрофотометрическим методом, шиффовых оснований – флуориметрическим методом, ТБК-активных соединений – по реакции с тиобарбитуровой кислотой. Для статистической обработки результатов использовали t-критерий Стьюдента.Установлено, что у крыс после длительного угнетения желудочной секреции соляной кислоты омепразолом в печени возрастало содержание продуктов пероксидации липидов: диеновых конъюгатов – в 2,2 раза, ТБК-активных соединений – в 1,7 раза, шиффовых оснований – в 1,6 раза относительно контроля. Показано, что при введении животным с гипоацидным состоянием мультипробиотика "Апибакт®" в гепатоцитах количество продуктов ПОЛ снижалось: диеновых конъюгатов – в 1,7 раза, ТБК-активных соединений – в 1,4 раза и шиффовых оснований – в 1,3 раза относительно группы животных, которым вводили только омепразол.
Таким образом, при длительной желудочной гипохлоргидрии в печени активируются процессы ПОЛ, что свидетельствует о развитии окислительного стресса в гепатоцитах. Мультипробиотик "Апибакт
 " частично восстанавливает нарушенный окислительно-антиоксидантный баланс в печени крыс с гипоацидным состоянием.
" частично восстанавливает нарушенный окислительно-антиоксидантный баланс в печени крыс с гипоацидным состоянием.ЭФФЕКТ КУРКУМИНА И N-АЦЕТИЛ-L-ЦИСТЕИНА НА СОСТОЯНИЕ МЕТАБОЛИЗМА АЛЬВЕОЛЯРНЫХ МАКРОФАГОВ В УСЛОВИЯХ ВОЗДЕЙСТВИЯ СИГАРЕТНОГО ДЫМА
Девина Е.А., Таганович А.Д.
Белорусский государственный медицинский университет, г. Минск, проспект Дзержинского, 83 тел. 272-67-88, Devinal@mail.ru
Сигаретный дым состоит из большого количества оксидантов и свободных радикалов (1017 спин на грамм смолы), попадая в альвеолярное пространство, активные формы кислорода инициируют цепную химическую реакцию с образованием свободнорадикальных продуктов. Антиоксиданты способны ослабить или предотвратить развитие окислительного стресса, индуцированного сигаретным дымом в клетках легких. Куркумин - малоизученный, но перспективный препарат, выделенный из корней Curcuma longa. N-ацетил-L-цистеина (N-АЦ) - фармакопейный лекарственный препарат, обладающий антиоксидантной активностью. Целью настоящей работы было изучить дозозависимый эффект куркумина и N-ацетил-L-цистеина (N-АЦ) на функциональное состояние и показатели метаболизма альвеолярных макрофагов (АМ) в условиях воздействия экстракта сигаретного дыма (ЭСД). Использовался куркумин [1,7-bis (4-hydroxy-3-methoxyphenol)-1,6-heptadiene-3,5-dione] в концентрации 5;10;25; 50 мкМ и N-АЦ 0,01 и 0,1 мМ («Sigma», США). Клетки выделяли из бронхоальвеолярной лаважной жидкости крыс. АМ прединкубировали с куркумином или N-АЦ в течение 2 ч, затем инкубировали в течение 1 и 20 ч с ЭСД, содержавшим 0,7 и 2,1 г/л смол. Изучался фагоцитоз, генерация активных форм кислорода, ТБК-активных продуктов перекисного окисления липидов (ПОЛ), окислительная модификация белков. Оценивалась активность ферментов; каталазы (Кат), глутатионпероксидазы (ГПО), супероксиддисмутазы (СОД), внутриклеточный уровень глутатиона (GSH) в АМ.
ЭСД in vitro приводит к достоверному снижению в АМ внутриклеточного уровня GSH и нитрит-ионов, увеличению продукции АФК на фоне снижения активности СОД, Кат и ГПО. Возрастает интенсивность процессов ПОЛ, угнетается фагоцитоз. Характер изменений имеет прямую зависимость от концентрации ЭСД и длительности воздействия. Установлено, что N-АЦ 0,01 и 0,1мМ и куркумин в относительно низких концентрациях 5 и 10 мкМ препятствуют изменению значений определяемых показателей в АМ, контактирующих с ЭСД. Куркумин 25 мкМ не был столь эффективен в предотвращении возникающих изменений в АМ, контактирующих с ЭСД. Куркумин 50 мкМ резко увеличивал количество Н2О2, уровень ТБК-активных продуктов ПОЛ и окисление белков. Отмечалось снижение способности к фагоцитозу, угнетение активности Кат и, в меньшей степени, активности СОД.
Таким образом, снижение внутриклеточной концентрации SH-соединений и активности ГПО и Кат в АМ под влиянием сигаретного дыма, эффективно устраняется N-АЦЦ. Однако эта эффективность ограничена длительность контакта клеток со смолами и концентрацией смол в сигаретном дыме.
куркумин относительно в низких концентрациях 5 и 10 мкМ стимулирует фагоцитоз и проявляет выраженную антиоксидантную активность в клетках легких, подвергающихся воздействию сигаретного дыма. При высокой концентрации (25 и 50 мкМ) куркумин оказывает прооксидантный эффект.
Обнаруженный неоднозначный дозозависимый эффект куркумина следует учитывать при его использовании в качестве антиоксиданта.
Работа выполнена при финансовой поддержке Фонда фундаментальных исследований НАН Беларуси.
КЛАССИФИКАЦИЯ ПАРАМЕТРОВ АНТИОКСИДАНТНОЙ
АКТИВНОСТИ
Дейнека В.И., Анисимович И.П., Фролов П.А., Дейнека Л.А.
Белгородский государственный университет, г. Белгород,
308015 Белгород, ул. Победы 85, тел. (4722)301169, deineka@bsu.edu.ru
Антиоксидантная активность веществ природного происхождения и синтетических продуктов рассматривается как их важнейшая обобщенная характеристика. Это связано, в частности, с тем, что, как следует из литературных данных, именно антиоксидантные свойства являются определяющими во многих аспектах биологической активности веществ. К настоящему времени разработано множество различных методов определения антиоксидантной активности in vitro, общей проблемой которых, кроме соответствия с антиоксидантной активностью in vivo, является не тождественность не только абсолютных, но и относительных характеристи, полученных различными методами. В научной литературе при этом используются даже различные словосочетания: «antioxidant activity», «antioxidant capacity», «antioxidant power» и т.д., причем их использование не всегда достаточно обосновано.
На основании анализа научной литературы и собственных данных мы предлагаем классификацию параметров антиоксидантной активности, основанную на анализе кинетических кривых изменения концентрации активных компонент в соответствующих реакционных смесях. Таких независимых друг от друга параметров должно быть не менее трех.
Если в методе исследуется исчезновение оксиданта (как при использовании стабильного радикала дифенилпикрилгидразила или подобных методов) или накопления продуктов его восстановления, то кинетические кривые лучше представлять в координатах «число моль оксиданта, отнесенное к числу моль антиоксиданта, как функция времени». В этом случае возможны два варианта: а) на начальном участке наблюдается быстрое изменение, но после некоторого времени выдерживания реакционной смеси кривая выходит на плато, что свидетельствует о завершении процесса; б) кривая не выходит на плато за разумное время.
В случае а) можно выделить два участка. Наклон кривой на начальном участке зависит от константы скорости реакции исходного антиоксиданта, и может быть использован для определения кинетического параметра антиоксидантной активности. Только этот параметр имеет смысл сопоставлять с иными характеристиками индивидуальных соединений в системах QSPR или QSAR (количественная взаимосвязь между строением и свойством или активностью соединений). Конечные горизонтальные участки соответствуют емкостному параметру антиоксидантной активности. Для многих веществ этим участкам соответствует потеря большого числа электронов (более 2-х), что соответствует протеканию ряда последовательных процессов окисления, которые уже имеют лишь опосредованное отношение к строению исходного антиоксиданта.
Наконец, относительная или пропорциональная антиоксидантная активность может быть использована для характеристики веществ или их смесей, если выход на стационарный режим практически невозможен, но существует вещество, кинетическая кривая которого геометрически подобна аналогичной для кривой сопоставляемого вещества.
МЕХАНИЗМ АНТИМАЛЯРИЙНОГО ДЕЙСТВИЯ
АРТЕМИЗИНИНА И ЕГО АНАЛОГОВ: РОЛЬ ЗАМЕСТИТЕЛЕЙ
Денисов Е.Т., Денисова Т.Г.
Институт проблем химической физики РАН, г. Черноголовка
142432, г. Черноголовка, Московская обл., Россия, e-mail: det@icp.ac.ru
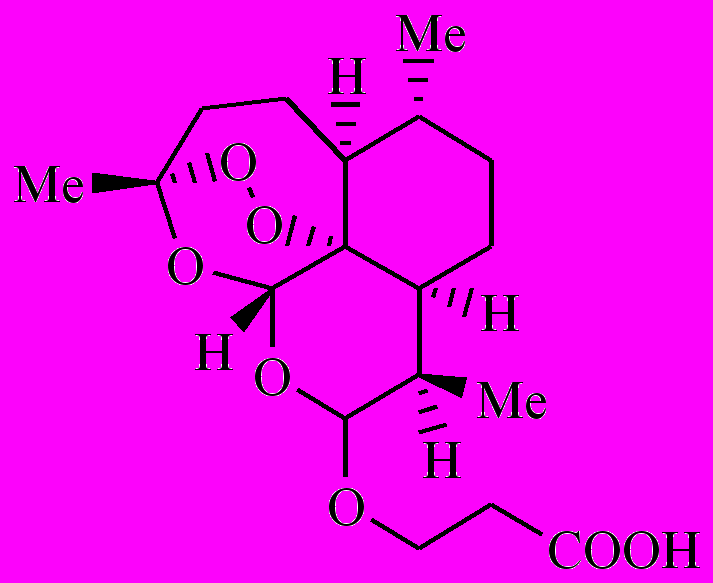
Как было показано ранее, артемизинин (1) в аэробных условиях, окисляясь, превращается в полиатомный гидропероксид [1-3]. Полиатомный гидропероксид по реакции с комплексами Fe(II) распадается с образованием свободных радикалов. Образовавшиеся радикалы вызывают в малярийном паразите окислительный стресс. Возникают следующие вопросы: 1) все образовавшиеся из 1 радикалы одинаковы по своей лечебной активности или нет? 2) как влияют заместители на этот процесс? Чтобы найти ответ на эти вопросы, мы предприняли кинетическое исследование внутримолекулярного окисления 8ми аналогов 1 (соединения 2-9).
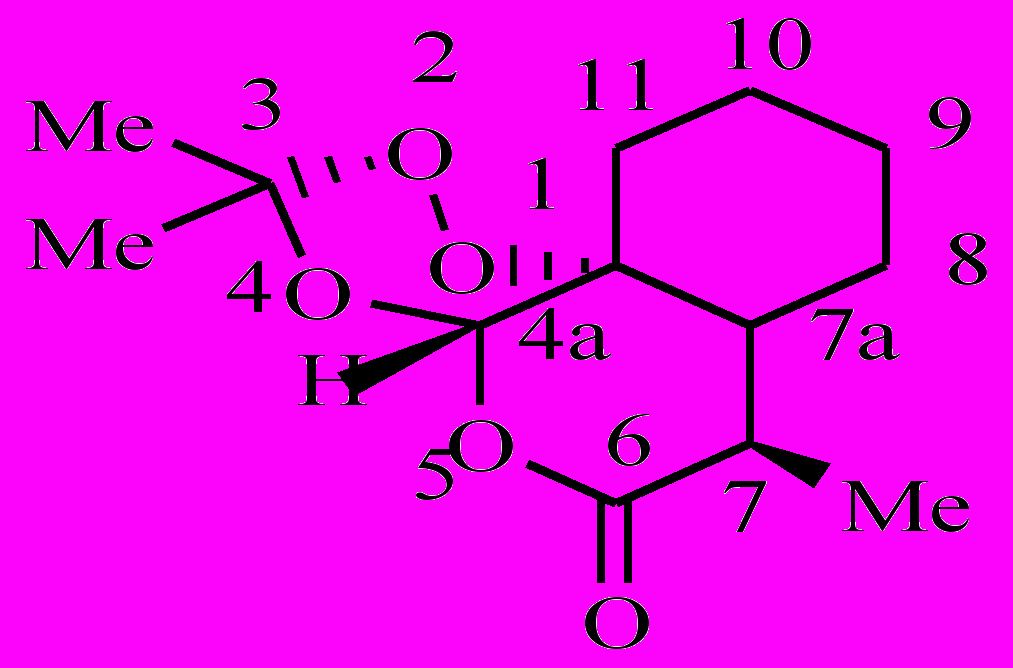 | 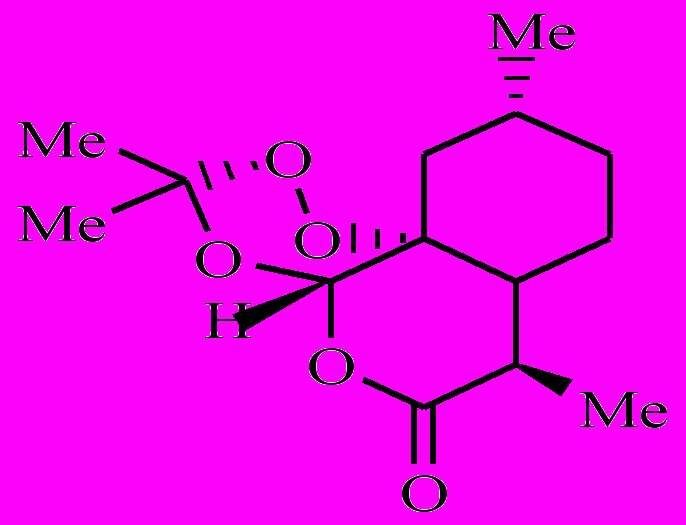 | 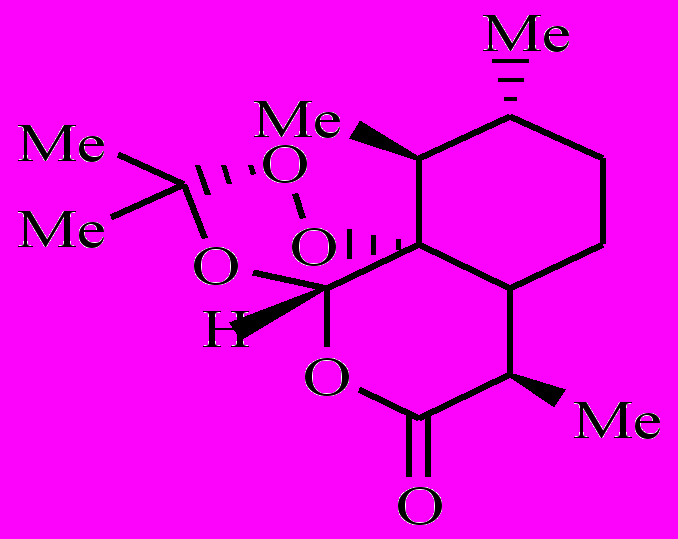 | 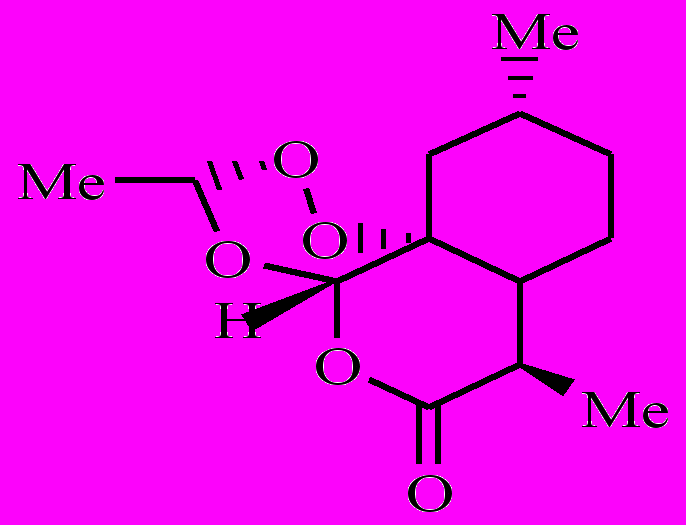 |
| 2 | 3 | 4 | 5 |
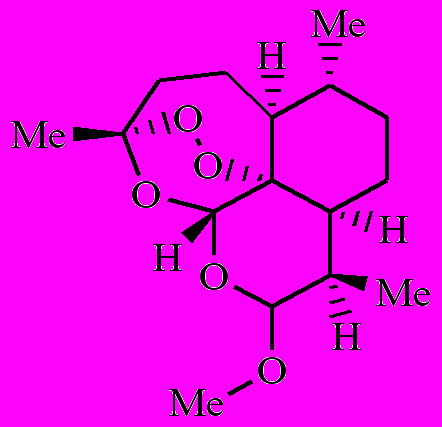 | 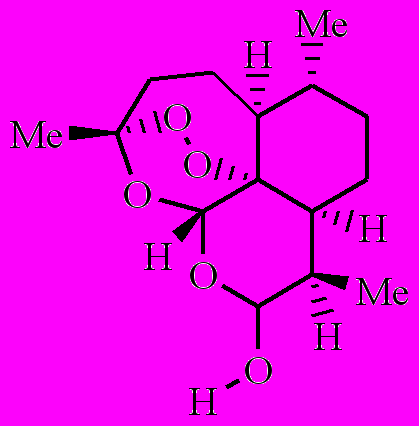 |  | 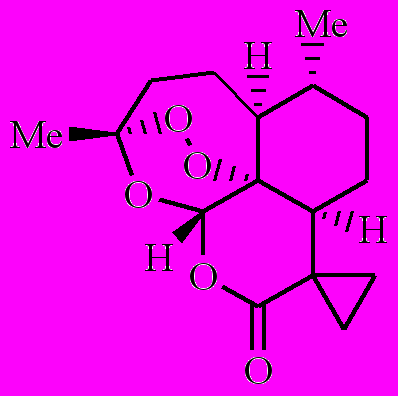 |
| 6 | 7 | 8 | 9 |
