Ультраструктурная и цитохимическая характеристика макрофагов, инфицированных рнк-содержащими вирусами 03. 00. 25 гистология, цитология, клеточная биология
| Вид материала | Автореферат |
СодержаниеСравнительная оценка морфофункциональной активности резидентных макрофагов, инфицированных вирусами Неспецифическая эстераза |
- Морфофункциональная характеристика пульпы зуба и оценка иммунного статуса при кариесе,, 552.48kb.
- Морфофункциональная характеристика слизистой оболочки кишечника потомства самок крыс, 303.36kb.
- Овчарова Анастасия Никитовна Морфологическая характеристика тонкой и толстой кишки, 377.67kb.
- Структурно-функциональная характеристика нонапептидергической гипоталамо-гипофизарной, 343.48kb.
- Закономерности дегенерации и адаптации сетчатки глаз при экспериментальных ретинопатиях,, 745.16kb.
- Влияние биологически активных клеточных компонентов растений на структурные изменения, 324.85kb.
- Экспериментальное обоснование применения нейропептидов в комплексной терапии острого, 259.86kb.
- Цитологические особенности вторичных миелодисплазий при лимфомах 03. 00. 25 гистология,, 526.98kb.
- Эколого-морфологическая характеристика репродуктивной активности рыжей полёвки (clethrionomys, 243.57kb.
- Молекулярные механизмы апоптоза при окислительном стрессе 14. 00. 16 патологическая, 606.37kb.
Сравнительная оценка морфофункциональной активности резидентных макрофагов, инфицированных вирусами
семейств Picornaviridae, Flaviviridae и Bunyaviridae
Установлено, что не все вирусы в одинаковой степени чувствительны к действию ферментных систем моноцитов/макрофагов (Соловьев, 1986). Одни легко инактивируются фагоцитами (группа I), а другие резистентны к их действию и способны к активной и нередко длительной репродукции (группа II). По основным биохимическим параметрам макрофаги не имеют принципиальных отличий от других клеток человека и животных. Пути метаболизма и механизмы его регуляции общие. Вместе с тем можно выделить важные особенности обмена данных клеток, связанные, с одной стороны, с особенностями их ультраструктуры, а с другой, — со специализацией их функций как фагоцитов. Поэтому определенное значение приобретают исследования, связанные с изучением ферментативного состояния клеток моноцитарно-макрофагальной системы в ответ на заражение различными вирусами.
В зараженных хантавирусом, ВКЭ, полиовирусом и энтеровирусами ECHO 1, Коксаки В1 и 71 макрофагах, была исследована активность ферментов плазмалеммы, как показателей стимуляции клеток (5'-нуклеотидаза, АТФаза), ферментов кислородзависимой системы NADPНоксидазного комплекса первого порядка, связанных с мембраносодержащими структурами (НСТ-тест), ферментов третьего порядка, принимающих участие в общем окислительном метаболизме клеток – ЛДГ, СДГ и ЦХО. Кроме того, была исследована активность фермента супероксиддисмутазы – высокоспецифичного антиоксиданта, служащего для регуляции уровня кислородных радикалов, а также лизосомальных ферментов, катализирующих процессы расщепления макромолекул (кислая фосфатаза и неспецифическая эстераза). Параллельно изучалась нитроксидобразующая активность фагоцитов. Для сравнительного анализа данных по исследованию активности ферментных систем макрофагов, зараженных указанными вирусами, мы использовали регрессионный анализ. В таблице приведены данные сравнительного анализа коэффициентов регрессии методом простой модификации t-критерия (табл.).
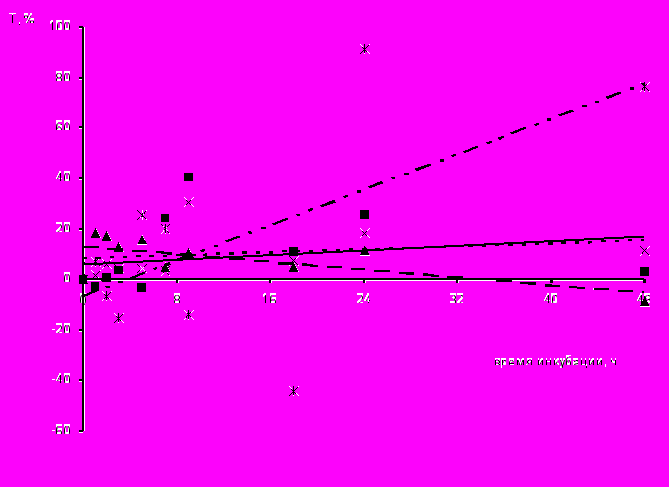
При исследовании активности эктофермента плазмалеммы – 5'-нуклеотидазы определена достоверная стимуляция макрофагов в первые минуты контакта с энтеровирусом Коксаки В1 и полиовирусом (рис. 2). В ответ на введение группы «одетых» вирусов, имеющих суперкапсид, стимуляция клеток наступала в более поздние сроки (после 3 ч инкубации). Подобные результаты были получены нами при определении активности АТФазы. Так, в ответ на заражение хантавирусом, реакция клеток по показателям активности этого фермента была более выраженной, затем следовала активность АТФазы фагоцитов, инфицированных вирусом Коксаки В1, полиовирусом, вирусом клещевого энцефалита и хантавирусом. Значения коэффициентов регрессии для этих клеток составили -4,9168; -2,9298; 4,7427 и -11,852 соответственно. Отрицательное значение константы -0,2265 для данных по содержанию АТФазы в фагоцитах, зараженных ВКЭ, подтверждало позднюю активацию этого фермента, через 18 ч после заражения.
Интерес представляют данные, полученные при изучении активности 5'-нуклеотидазы и АТФазы в макрофагах, зараженных энтеровирусом ECHO11. Значения активности указанных ферментов в клетках, зараженных эти вирусом, находились на более высоком уровне и составили 12,178 и 15,93, что достоверно (p<0.01) отличалось от коэффициентов регрессии указанных ферментов в макрофагах, инфицированных остальными вирусами (табл.). Вместо снижения внутриклеточного содержания 5'-нуклеотидазы и АТФазы – ферментов, которые обычно расходуются при различных пространственных преобразованиях плазмалеммы, в клетках, в случае контакта с энтеровирусом ECHO11, мы наблюдали противоположный процесс – их синтез. На это указывает линия с положительными значениями индекса стимуляции (рис. 1). Известно, что синтез пуриновых нуклеотидов осуществляется из инозинмонофосфата и образующиеся нуклеозидмонофосфаты АМФ и ГМФ переходят в дифосфаты АДФ и ГДФ под действием различных ферментов с участием 5'-нуклеотидаза. В свою очередь цитоплазматическая область АТФаз участвует в реакционном цикле фосфорилирования/дефосфорилирования, приобретая попеременно два конформационных состояния, ответственных за транспорт ионов, и принимает активное участие в переносе синтезированных нуклеотидов (Кольман, 200). Если сравнить данные количественной ОТ-ПЦР, то именно при заражении макрофагов энтеровирусом ECHO 11 было установлено значимое различие между показателями количества специфической вирусной РНК через 4 и 24 ч инкубации зараженных клеток, что указывало на ее внутриклеточный синтез. Таким образом, этот вирус, являясь «неодетым», т.е. без суперкапсида, спосо бен очень быстро инициировать синтез собственной РНК, и полученные нами данные об увеличении внутриклеточного содержания эктоферментов в зараженных энтеровирусом ECHO11 макрофагах косвенно подтверждают наличие в них активного синтеза нуклеотидов.
При анализе метаболической активности макрофагов, зараженных всеми использованными РНК-содержащими вирусами, установлена стимуляция фер-
Таблица. Достоверность различий коэффициентов регрессии, определенная методом модифицированного t – критерия для двух малых выборок.
| t – критерии между | Исследуемые ферменты клеток | ||||||||
| коэффициентами регрессии для клеток, зараженных РНК-содержащими вирусами | 5’-нуклеоти-даза n=10 | АТФаза n=10 | СДГ n=9 | ЛДГ n=9 | ЦХО n=10 | СОД n=5 | NO n=6 | КФ n=11 | Неспецифическая эстераза n=11 |
| вирус Коксаки В1 / полиовирус вирус Коксаки В1 / энтеровирус ECHO11 вирус Коксаки В1 / ВКЭ вирус Коксаки В1 / хантавирус | -0,181348 -3,8504*** -0,49703 1,9039072 | 0,057506 -2,36427* 0,70978 0,5222992 | 1,653426 -2,32738* -2,4381* – | 1,068166 0,3466424 1,1594047 – | -1,37232 -1,35974 -5,6256*** – | -0,00556 -0,00115 -0,00583 – | -0,08749 0,113365 -2,50026* 0,04787 | -0,96509 -0,5109 -13,525*** 2,8913*** | -4,4245*** -5,7186*** 9,3784*** – |
| полиовирус / энтеровирус ECHO11 полиовирус / ВКЭ поливирус / хантавирус | -3,9896*** -0,32806 1,49215 | -2,37292 0,590461 0,690024 | -1,00417 2,88597** – | -0,66817 -0,1955 – | -0,12744 -2,4942** – | 0,000404 -0,002 – | 0,151274 -0,12943 0,077866 | 0,550322 -2,64145** 8,6405*** | -1,1721133 11,192*** – |
| энтеровирус ECHO11 / ВКЭ энтеровирус ECHO11 / хантавирус | 1,623722 3,4136*** | 1,4059 1,404164 | -1,36188 – | 0,533125 – | -4,2627*** – | -0,00354 – | -2,8746* -2,4492* | -0,2521 0,070257 | 11,109*** – |
| ВКЭ / хантавирус | 2,93715** | 0,200225 | – | – | – | – | 0,251676 | 0,151471 | – |
Примечание: значимость различий *** p<0,01; ** p<0,02; * p<0,05

а)

б)
Рис. 2. Линейная зависимость активности эктоферментов плазмалеммы 5`-нуклеотидазы (а) и АТФазы (б) макрофагов, инфицированных РНК-содержащими вирусами, от времени инкубации. Применен МНК. В этом рис. и далее, по оси ординат Т – индекс стимуляции в %;


 энтеровирус Коксаки В1 полиовирус
энтеровирус Коксаки В1 полиовирус
Х

 энтеровирус ECHO 11 ВКЭ
энтеровирус ECHO 11 ВКЭЖ
хантавирус

ментов кислородзависимой системы (рис. 3). При этом степень активации ферментов этой системы зависела от вида вируса, которыми заражались клетки. Наибольшая их активность отмечалась в случае инфицирования макрофагов вирусами, способными к внутриклеточному размножению, а именно: ВКЭ и энтеровирусом ECHO 11. Наиболее ярко отражали активацию метаболизма клеток показатели внутриклеточного содержания СДГ и ЛДГ (рис. 3а,б). При инфицировании клеток ВКЭ и энтеровирусом ECHO 11 с увеличением времени инкубации происходило нарастание активности указанных ферментов, тогда как в макрофагах, зараженными остальными вирусами, активация не происходила.
Необходимо отметить, что данные по активности СДГ можно расценивать двояко (рис. 3б). Известно, что при определении цитотоксического действия инфектов на клетки используется метод, основанный на уменьшении количества метилтиазолилтетразолия бромида (МТТ), преобразование которого в формазан происходит с помощью СДГ митохондрий (Cotter, 2001). Чем меньше формазана в клетках, тем меньше активность СДГ, структура которой нарушается при неблагоприятных воздействиях. Таким образом, при заражении макрофагов вирусами, обладающими более выраженным цитопатогенным воздействием на клетки (полиовирусом и энтеровирусом Коксаки В1), по сравнению с энтеровирусом ECHO 11, наблюдалось снижение активности СДГ.
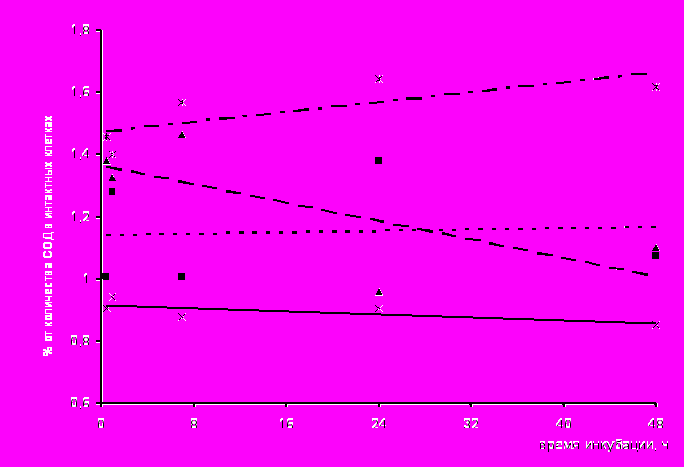
При исследовании активности ЦХО и СОД достоверно от клеток, инфицированных другими вирусами, отличались макрофаги, зараженные ВКЭ (рис. 3в,г; табл.). Так, коэффициент регрессии активности ЦХО для клеток, инфицированных ВКЭ, составил 1,7531, тогда как для фагоцитов, зараженных остальными вирусами, он был меньше единицы, а для СОД – 0,004.
Изучение роли нитроксидобразующей активности макрофагов при вирусных инфекциях начато относительно недавно. Определено, что NO может оказывать прямое противовирусное действие, и поэтому исследование нитроксидобразующей активности моноцитов/макрофагов, которые относятся к одним из главных поставщиков метаболитов NO, при вирусных инфекциях приобретает особенное значение (Kreil, 1996). Нами с помощью различных методов была определена роль нитроксидобразующей системы в функциональной активности макрофагов, зараженных РНК-содержащими вирусами. С помощью непрямого метода флюоресцирующих антител изучалась активность индуцибельной NO-синтазы (iNOS), с помощью цитохимического метода определяли внутриклеточную активность НАДФ диафоразы, а также проводили ультра структурное выявление этого фермента. Параллельно исследовалось внутри клеточное содержание метаболитов оксида азота (NO) – нитритов и активности цитохромоксидазы (ЦХО), фермента четвертого комплекса дыхательной цепи митохондрий, принимающего участие в аэробном окислении клеток. В качестве простетической группы этот фермент содержит ци-тогемин, с которым связывается молекула NO. Определение внутриклеточного содержания ЦХО позволяет косвенно оценить способность клеток к продукции NO по нитритредуктазному пути (Меньшикова, 2000).
а)
б)
Рис. 3. Линейная зависимость активности ферментов кислородзависимой системы макрофагов, инфицированных РНК-содержащими вирусами, от времени инкубации. Применен МНК. а) СДГ; б) ЛДГ;
в)
г)
Рис. 3. Продолжение; в) ЦХО; г) СОД.
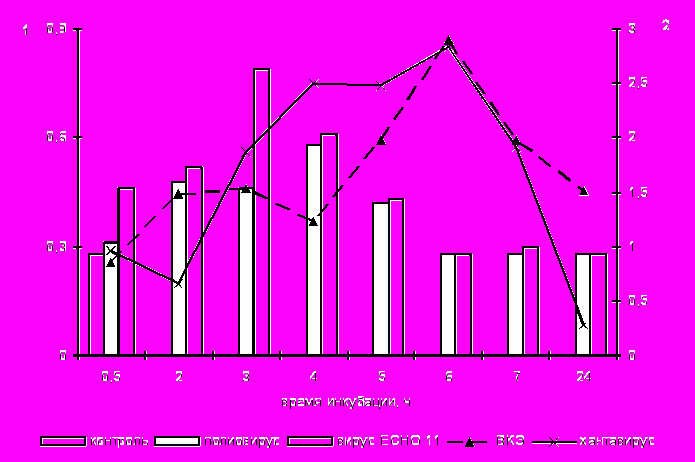
Результаты цитохимического исследования активности NO-синтазы выражали в виде среднего цитохимического коэффициента, распределяя клетки по степени включения специфического для НАДФ-диафоразы субстратного компонента (рис. 4а). Установлено, что достоверное (р<0,05) повышение активности NO-синтазы отмечается в период проникновения (от 5 до 60 мин) в фагоциты вирусов, имеющих суперкапсид (хантавирус и ВКЭ).
При инфицировании макрофагов энтеровирусами, не содержащими липопротеиновой оболочки, достоверное повышение внутриклеточного содержания NO-синтазы выявляется после 2-х ч инкубации. Необходимо отметить, что повышенное содержание этого фермента после контакта фагоцитов с вирусами, содержащими суперкапсид, отмечалось на протяжении всего срока наблюдения. По-нашему мнению, совпадение пика активности NO синтазы с периодом наличия внутриклеточной репродукции «одетых» вирусов указывает на реализацию защитных функций макрофага в ответ на его заражение.
При изучении активности iNOS в макрофагах, зараженных РНК-содержащими вирусами, наибольшее количество клеток со специфическим свечением отмечалось после 1 ч инкубирования с ВКЭ и составило 75±6,5 %. Затем к 5 ч оно снижалось до уровня интактных клеток – 5±0,6 %, к 7 ч возрастало до 25±1,6 %, понижаясь к концу срока наблюдения. Подобная активность iNOS, но на более низких показателях наблюдалась нами в случае инфицирования клеток хантавирусом, тогда как при заражении макрофагов группой «неодетых» вирусов эта активность была незначительной, и специфическое свечение отмечалось в единичных клетках. С помощью ультраструктурного исследования нами установлено, что локализация НАДФ-диафоразы в макрофагах, зараженных ВКЭ, наблюдается во внутрицитоплаз матических везикулах.
При заражении резидентных макрофагов РНК-содержащими вирусами также отмечалось повышение внутриклеточного содержания метаболитов NO – нитритов (рис. 4б). Уровень нитритов в интактных клетках был принят за 0%. Наибольшее внутриклеточное содержание метаболитов NO отмечалось в клетках, инфицированных вирусами, содержащими суперкапсид – ВКЭ и хантавирусом. Постепенное достоверное (р<0,05) повышение уровня нитритов наблюдалось с первых минут после заражения макрофагов ВКЭ, и максимальное значение показателей для этих клеток определялось через 48 ч инкубации – 38,5±2,2 % (р<0,05). При инфицировании макрофагов хантавирусом максимальное содержание метаболитов NO отмечалось после 6 ч инкубации и составило 38,6±2,5 %, после чего отмечалось его постепенное снижение до 3,4±0,5 %. Наибольшее внутриклеточное содержание нитритов в макрофагах, зараженных пикорнавирусами, обнаруживалось при их контакте с энтеровирусом ECHO 11. При постепенном повышении от момента введения в культуру клеток вируса (1 ч; 11,2±1,3 %), показатели содержания метаболитов NO достигали максимального значения через 24 ч инкубации – 18,7±1,7 %, после чего следовало их резкое снижение.
Нами установлено, что наибольшая активность ЦХО обнаруживалась в
а)
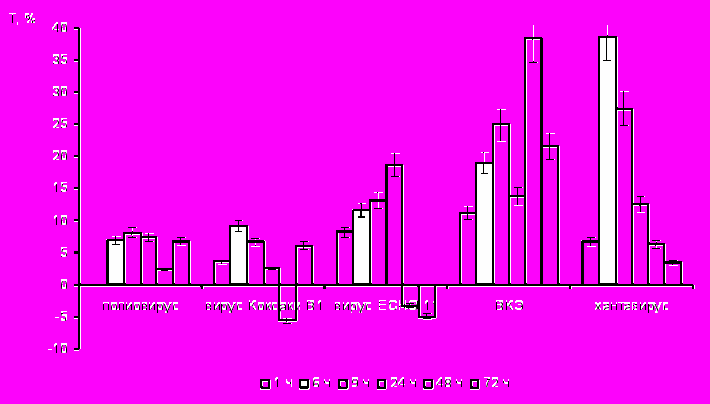
б)
Рис. 4. Внутриклеточное содержание NO-синтазы (а) и метаболитов NO (б) в макрофагах, зараженных РНК-содержащими вирусами, по оси ординат 1 –СЦК для клеток, инфицированных вирусами без суперкапсида, по оси ординат 2 – СЦК для фагоцитов, зараженных вирусами с наличием его; б) оси ординат – Т.
макрофагах, зараженных ВКЭ. Так, ее повышение выявлялась через 1 ч контакта клеток с вирусом (рис. 3в), показатель составил 14,7±0,7 % относительно контроля. Через 48 ч в фагоцитах обнаруживалась максимальная активность фермента, и показатель составил 76,3±6,7%. Необходимо отметить разнонаправленность изменения активности NO-синтазы и ЦХО в макрофагах, инфицированных ВКЭ. Это проявлялось в повышении СЦК при гистохимическом определении активности NO-синтазы на фоне понижения в этих клетках активности ЦХО, причем показатели внутриклеточного содержания метаболитов NO оставались на высоком уровне. По сравнению со значениями для макрофагов, зараженных ВКЭ, при инфицировании клеток пикорнавирусами внутриклеточное содержание ЦХО находилось на низком уровне (рис. 3в).
Таким образом, нами установлено, что резидентные макрофаги под воздействием РНК-содержащих вирусов в различной степени способны к наработке активных форм NO. Степень наработки NO этими клетками зависит от вида вируса. Так, в случае инфицирования макрофагов группой вирусов, имеющих суперкапсид (хантавирус, ВКЭ), отмечается генерация NO как по нитроксидсинтазному пути при участии в качестве катализатора фермента нитроксидсинтазы, так и по нитритредуктазному пути, на что указывало повышение активности ЦХО. При заражении клеток группой вирусов, не содержащих липопротеиновой оболочки (полиовирус, энтеровирусы Коксаки В1 и ECHO 11), преимущественно имеет место нитритредуктазный путь образования NO.
В целом, нами установлено, что в момент проникновения РНК-содержащих вирусов (до 1 ч после заражения) в клетках выявляется стимуляция кислородзависимой и нитроксидобразующей ферментных систем (рис. 1). Причем в случае инфицирования макрофагов вирусами, способными в них размножаться, нарастание ферментативной активности этих систем носило более выраженный характер. На это указывало повышение активности как НАДФ-оксидазного комплекса первого порядка, локализованного в плазматической мембране, так и активности митохондриальных ферментов третьего порядка – лактатдегидгеназы, сукцинатдегидрогеназы и цитохромоксидазы. Волнообразное изменение активности этих ферментов в макрофагах в первом периоде (до 3 ч) отражало реакцию клеток на проникновение вирусов, а во втором (с 5 до 48 ч) – наличие синтеза и выхода вирусных частиц во внеклеточное пространство. Помимо этого, в макрофагах, зараженных «одетыми» вирусами, ВКЭ и хантавирусом, отмечалась активная наработка метаболитов NO, которая в начальном периоде инфекции (15 мин – 4 ч) коррелировала с изменением активности ферментов кислородзависимого метаболизма клеток (рис. 3). В поздние сроки наблюдения (от 1 до 4-х сут) в этих клетках было выявлено повышение активности фермента супероксиддисмутазы, принимающей участие в ликвидации избыточного количества активных метаболитов кислорода. На наш взгляд, первоначальное повышение активности клеточных ферментов указывало на период активации макрофагов в ответ на введение инфекта, а последующее их повышение – на период увеличения их синтетической активности макрофагов, что совпадало с наибольшим количеством антигенсодержащих клеток в этот период. Особенно наглядно это было выявлено при изучении динамики активности ферментов кислородзависимой системы макрофагов, которая отражала изменение метаболизма клетки в процессе репродукции в них вирусных компонентов.
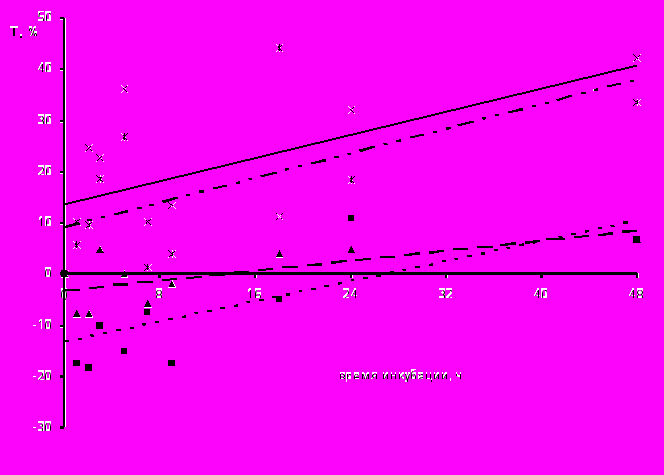
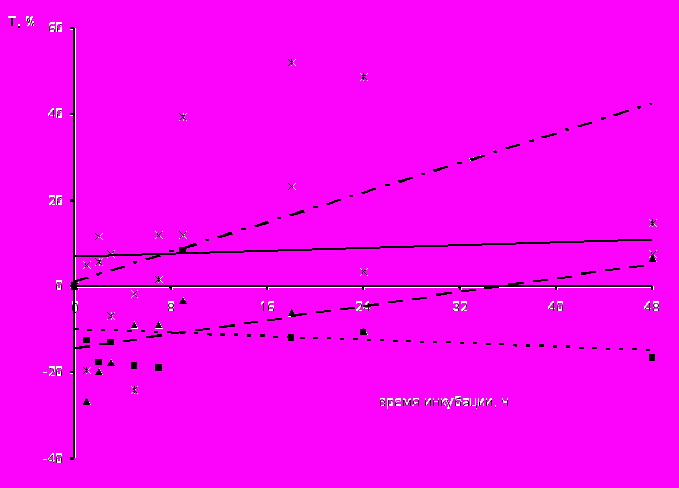
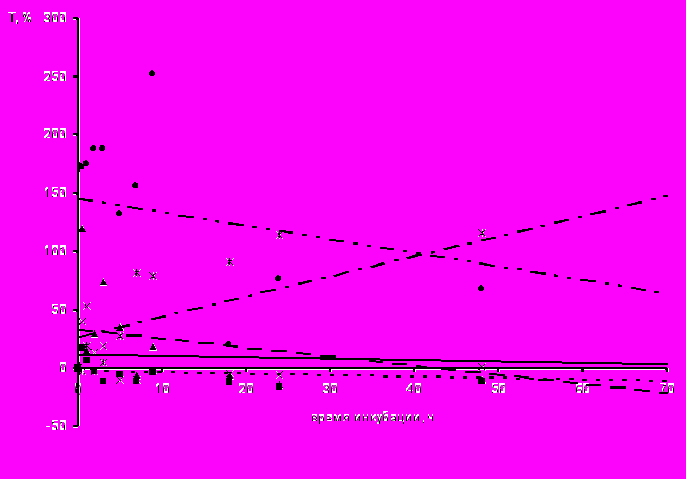
Отличие использованных нами видов вирусов с наличием суперкапсида – хантавируса и ВКЭ, помимо геномной последовательности, обусловлено различной структурой нуклеокапсида – спиральной и икосаэдрической, различной полярностью РНК – отрицательной или положительной, а также структурой поверхности их суперкапсида. По нашим данным, несмотря на все перечисленные отличия указанных вирусов, они оказывали равное по степени выраженности воздействие на метаболизм макрофагов как клеток-мишеней. Тем не менее, необходимо отметить, что в зависимости от наличия липопротеиновой оболочки определялось воздействие вирусов на различные ферментативные системы макрофагов. Так, установлено, что активность цитоплазматических ферментов, участвующих в процессах расщепления макромолекул – кислой фосфатазы и неспецифической эстеразы – зависела от вида вируса, которыми были инфицированы макрофаги (рис. 5). В макрофагах, зараженных вирусами, содержащими суперкапсид (ВКЭ, хантавирус), увеличивалась активность кислой фосфатазы, тогда как при инфицировании клеток группой вирусов без липопротеиновой оболочки (полиовирус и энтеровирусы 71, ECHO11 и Коксаки В1) – неспецифической эстеразы. Причем, активность КФ в случае заражения макрофагов хантавирусом повышалась в первые часы после заражения, а в случае инфицирования ВКЭ – после 4-х ч (рис. 5а). В обоих случаях повышенное внутриклеточное содержание КФ отмечалось до конца срока наблюдения. На наш взгляд, высокая активность КФ связана с участием этого фермента в этапе депротеини зации вирусов, а именно в их освобождении от суперкапсида, что подтверждается данными других исследователей о низком значении рН в эндосомах или в окружающем вирус участке цитоплазмы (Stiasny, 2002). При таком значении рН и активизируется КФ, последующее накопление которой, на фоне активного синтеза вирусных компонентов, мы связываем с реализацией макрофагами защитных функций.
Иная динамика показателей была получена нами при изучении активности неспецифической эстеразы в макрофагах, зараженных РНК-содержащими вирусами (рис. 5б). Наибольшая активность этого фермента определялась в клетках, инфицированных группой «неодетых» вирусов, причем повышенное внутриклеточное содержание неспецифической эстеразы в макрофагах отмечалось с первых минут инфицирования до конца срока наблюдения.
Известно, что изменения активности неспецифической эстеразы в макрофагах отражают их физиологическую или иммунологическую стимуляцию (Хейхоу, 1983). На наш взгляд, в случае заражения макрофагов вирусами, относящимся к группе «неодетых», у которых отсутствует суперкапсид, высокое содержание этого фермента отражает активную стимуляцию клеток в ответ на внедрение инфекта. Это предположение усиливает факт, что наибольшую эстеразную активность макрофагов мы наблюдали после их контакта с полиовирусом, который обладал, по нашим данным, наибольшим цитопатогенным дей-

а)
б)
Рис. 5. Линейная зависимость активности лизосомальных ферментов макрофагов, инфицированными РНК-содержащими вирусами, от времени инкубации; а) кислой фосфатазы; б) неспецифической эстеразы.
ствием на культуру клеток. Таким образом, несмотря на активную наработку макрофагами неспецифической эстеразы, что можно отнести к защитной реакции клетки, фагоциты не способны уничтожить внедренный в них вирус.
Итак, анализ результатов комплексного исследования метаболизма макрофагов, зараженных РНК-содержащими вирусами, позволяет сделать вывод, что информация о ферментативной активности клеток дает возможность охарактеризовать реакцию фагоцитов на усиление синтетических процессов, связанных с репродукцией в них вирусов. Этот вывод основан на том, что биосинтез компонентов вирусных частиц осуществляется при участии ферментов клетки-хозяина и статистически достоверный сдвиг этой активности может рассматриваться как показатель воздействия вирусов на клетки. Таким образом, применение высокочувствительных методов определения активности ферментов и регрессионного анализа данных можно отнести к важным способам индикации защитных реакций макрофагов и репродуктивной активности вирусов, а также для дифференцировки типа их воздействия на клетки.
В целом, анализ полученных нами данных показал, что комплексное исследование взаимодействия макрофагов с РНК-содержащими вирусами, особенно с позиций их структурных отличий, позволит подойти к пониманию контролируемой коррекции молекулярных и метаболических процессов, происходящих в клетках-хозяевах. Этот вывод усиливается известным фактом, что успешный исход вирусного заболевания происходит при достижении баланса между индукцией антивирусных эффекторных механизмов, реализация которых связана с клеточными элементами моноцитарно/макрофагальной системы. На наш взгляд, для понимания механизмов иммунологических реакций организма в патогенезе вирусных инфекций необходима oбъективная оценка роли местных факторов иммунитета, где ключевыми являются вышеуказанные клетки. Значение этих клеток многогранно, и наряду с тем, что фагоциты могут осуществлять положительный противовирусный эффект путем поглощения, обезвреживания, элиминации вирусов, а также фагоцитоза инфицированных вирусами клеток, в результате чего они начинают продуцировать в месте заражения цитокины, макрофаги могут выполнять и отрицательную функцию. При первичном иммунном ответе оно выражается в том, что проникшие в фагоциты вирусы могут в них репродуцироваться. В результате этого возникает депрессия функциональной активности клеток, причем такие фагоциты могут уничтожать здоровые клетки в месте воспаления, когда продуцируемые ими активные радикалы кислорода и NO, помимо противо-вирусного действия, инициируют процесс апоптоза клеток и увеличивают проницаемость капилляров. В этом случае, моноциты/макрофаги при вирусном инфицировании организма не всегда проявляют себя в качестве защитного барьера. Тем не менее, активация этих клеток при репродукции в них вируса позволяет им осуществить антигенпредставляющую функцию для стимуляции В- и Т-лимфоцитов и активации цитотоксических Т- лимфоцитов для уничтожения инфицированных клеток при развитии специфического иммунного ответа.
