Исследование тепловых эффектов экзотермических реакций при термодиффузионном упрочнении деталей сельхозмашин
| Вид материала | Исследование |
СодержаниеСписок литературы |
- Обеспечение работоспособности и ресурсосбережения при восстановлении и упрочнении сложнопрофильных, 494.07kb.
- Лекция 12. Индивидуальный и рыночный спрос, 48.69kb.
- Контроль нагруженности деталей сельхозмашин металлическими покрытиями тютрин, 56.62kb.
- Батышев Константин Александрович исследование, 709.6kb.
- Эволюция структурно-фазовых состояний при термомеханическом упрочнении балочного профиля, 23.3kb.
- Тема лекций и их содержание, 19.16kb.
- Iii кинетика и механизм гетерогенных каталитических реакций, влияние реакционной среды, 1807.15kb.
- Моделирование и динамическая стабилизация нановыглаживания прецизионных поверхностей, 151.88kb.
- 3 Допуски и посадки деталей машин и механизмов, 86.91kb.
- Л. Н. Антоновой на региональном экспертно-аналитическом семинар, 357.61kb.
Вестник Брянского государственного технического университета. 2011. № 3(31)
УДК 631.31
В.В. Коршунов, Г.В. Гурьянов
ИССЛЕДОВАНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ЭКЗОТЕРМИЧЕСКИХ РЕАКЦИЙ ПРИ ТЕРМОДИФФУЗИОННОМ УПРОЧНЕНИИ ДЕТАЛЕЙ СЕЛЬХОЗМАШИН
Рассмотрены основные теоретические положения по выбору составов для термодиффузионного упрочнения деталей.
Ключевые слова: тепловые эффекты, экзотермические реакции, термодиффузионное упрочнение, диффузионно-активные смеси, легирующие элементы, энерговыделение, экзотермический состав, термит.
Повысить долговечность дисков лущильника при термодиффузионном упрочнении возможно при помощи легирующих элементов, таких, как азот и углерод, которые позволяют получить поверхность с достаточно хорошим сопротивлением абразивному изнашиванию [1]. Для этого нужно применять диффузионно-активные смеси, использующиеся при упрочнении ТВЧ.
Такие смеси позволяют получить в диапазоне температур 600…1500С достаточное количество легирующих компонентов, которые полноценно диффундируют в поверхность детали. Однако условия протекания диффузии элементов при экзотермическом упрочнении значительно отличаются от нагрева ТВЧ, поэтому необходимо изменить соотношение компонентов. Вероятно, нужно будет определять толщину слоя и равномерность распределения диффузионно-активного вещества на поверхности детали.
Также требуется изменить и связующее вещество, которое должно обеспечивать хорошее распределение и прочное закрепление компонентов диффузионно-активной смеси на поверхности детали. Компоненты должны находиться в достаточно близком контакте с поверхностью детали для полноты осуществления реакции [2]. Для решения этих задач необходимо выбрать экзотермический состав, что проблематично без теоретического обоснования.
Экзотермический состав должен отвечать следующим основным требованиям:
- он должен обеспечивать температуру нагрева детали от 600 до 1500С [3];
- характер горения смеси должен быть плавным при наименьшем газовыделении, не должен быть взрывоопасным [4];
- продукты экзотермических реакций не должны быть плотными, чтобы легко отделяться от поверхности детали, при этом качество её поверхности не должно ухудшаться [5];
- продукты экзотермических реакций не должны быть жидкими, прилипать к детали или свариваться с ней [6];
- процесс экзотермического упрочнения должен длиться от 5 до 15 мин [7];
- компоненты должны быть недорогими и недефицитными, подготовка их к использованию не должна быть трудоемкой [8].
Целью исследования является определение теоретических принципов подбора экзотермических порошков.
Задачи исследования:
1. Рассмотреть виды экзотермических реакций и выбрать из них наиболее приемлемую.
2. Проанализировать составы, обеспечивающие необходимое энерговыделение для получения приемлемой температуры осуществления диффузии легирующих элементов в поверхностный слой упрочняемой детали.
3. Выделить из выбранных составов смеси, имеющие наименьшее газовыделение.
4. Подобрать компоненты, способствующие образованию после сгорания экзотермического состава легко отделяемых от детали шлаков.
5. Подобрать компоненты, позволяющие управлять скоростью экзотермических реакций.
В общем виде реакции экзотермического процесса могут быть выражены следующим уравнением:
2nМе + mO2 = 2MenOm +Qр, (1)
где Qр - тепловой эффект экзотермической реакции; Me - активный металл; m,n - количество атомов.
Величина Qр определяется как разница теплосодержаний исходных и конечных продуктов реакции. Для подавляющего большинства металлов величина Qр положительна, что соответствует экзотермичности реакции окисления и образования устойчивого химического соединения. Только для таких металлов, как золото, серебро и некоторые другие, эта величина не всегда является положительной (химическое соединение бывает неустойчиво в данных условиях).
Интенсивные экзотермические реакции могут протекать не только по уравнению (1). В тех случаях когда окислитель ( O2 ) находится в соединении с другим элементом ( Ме ), экзотермические реакции могут быть описаны следующим уравнением:
MkOm+nMe=MenOm+kM+Qp, (2)
где Me активный металл; М – неактивный металл; m,n,k количество атомов.
Следует отметить, что тепловой эффект реакции (2) в большинстве случаев ниже теплового эффекта реакции (1).
Реакция по уравнению ( 1 ) представляет собой (в случае окисления кислородом) горение металла в среде кислорода. Поэтому для упрочнения термодиффузионным методом, когда деталь находится под толщей песка, практическое использование такой системы менее удобно, чем системы, описываемой уравнением ( 2 ), где кислород находится в связанном состоянии. Следовательно, для термодиффузионного упрочнения наиболее подходит уравнение экзотермических реакций ( 2 ).
Для протекания реакции необходимо, чтобы изобарный потенциал оксида активного металла, отнесенный к одному молю O2, был значительно больше изобарного потенциала оксида восстанавливаемого металла. В этом случае теплосодержание системы МkOm + nMe в процессе реакции будет уменьшаться, восстановительно-окислительный процесс пойдет с выделением тепла, вызывая разогрев продуктов реакции.
Интенсивное протекание металлотермической реакции будет наблюдаться только в том случае, когда выделяющееся тепло способно значительно повысить температуру начала реакции и превысить критическую температуру начала реакции. Так, реакция между порошком оксида железа и порошком Al весьма экзотермична; теплота, выделяющаяся при этом, вполне достаточна, чтобы в дальнейшем превысить критическую температуру (600°С) и обеспечить нормальное течение реакции.
В случае же применения системы SiO2+Al теплота образования Al2O3 больше теплоты образования SiO2, но так как теплота реакции этой системы значительно меньше, чем теплота реакции системы Fe2O3+Al, нормальное течение реакции с отделением металлического кремния не наблюдается. Следовательно, оксид кремния можно применять в качестве замедляющей добавки в энерговыделяющем составе при термодиффузионном упрочнении.
Результаты процесса применительно к термитной сварке определяются полнотой восстановления оксида металла и его отделением от шлаков. Если температура процесса недостаточно высока, то восстановленные капельки металла не в состоянии преодолеть вязкость тугоплавких оксидов металла - восстановителя, полного отделения металла в виде единого слитка не наблюдается.
Величина теплового эффекта реакции непосредственно влияет на температуру. Чем выше температура, тем больше степень диссоциации исходного оксида, тем полнее отделение восстановленного металла.
В литературе в некоторых случаях для оценки химического средства вместо изобарного потенциала используется тепловой эффект реакции, определенный как разница теплосодержаний исходных и конечных продуктов реакции. Поскольку изменение энтропии существенного влияния на процесс не оказывает, то для оценки металлотермических процессов может быть использован тепловой эффект реакции.
При повышении температуры горения рассматриваемых металлов и их оксидов в последних могут происходить разовые превращения, сопровождающиеся изменением их теплоемкостей и тепловыми эффектами превращений. Поэтому теплота образования оксида при различных температурах будет изменяться у различных систем в зависимости от свойств компонентов.
Так, для системы 2Mg+О2 в точке 1 происходит плавление магния при 649,5 С. При этом тепловой эффект изменения агрегатного состояния магния равен 2 ккал/моль (скрытая теплота плавления), т. е. теплота дополнительно поглощается системой. Точка 2 соответствует переходу жидкого магния в парообразное состояние (t=1103С ). Скрытая теплота испарения составляет 32,0 ккал/моль, что соответствует более резкому изменению (уменьшению) теплоты образования оксида в зависимости от температуры при температуре выше 1400 °С, хотя при 25 °С теплота образования MgO выше теплоты образования Al2O3.
Это означает, что при температурax больше 1400 С алюминий активнее магния, т. е. при этих условиях возможна реакция
3MgО+2Al=Al2O3+3Mg.
В качестве кислородосодержащих веществ используются также нитраты ( Ва(NО3)2, KN03, NaNО3), хлораты ( KCLО3, Ba(CLО3)H2О) и перхлораты (KClO4). Составы, содержащие указанные соли и активные восстановители (например, Mg и Al), нашли широкое применение в пиротехнике. Как правило, эти составы обладают более высоким тепловым эффектом, отнесенным к единице суммарного веса составляющих компонентов, чем составы с окислителями на основе оксидов металлов. Следует напомнить, что указанные соли часто используются в качестве подогревающих добавок. Обычно все эти окислители отдают кислород в процессе горения легче, чем оксиды металлов. Например, распад хлората калия сопровождается даже выделением тепла:
2KClO3=2КCl+3O2+20 ккал.
При этом скорость реакции и её тепловой эффект возрастают настолько, что процесс приобретает взрывной характер. В таблице приведены некоторые данные о тепловом эффекте реакций горения пиротехнических составов.
Прежде чем рассматривать принципы подбора композиций порошков с целью определения возможности использования различных окислителей, необходимо проанализировать рекомендованные в пиротехнике составы, содержащие нитраты и хлораты. В качестве восстановителей использовались порошки алюминия и магния. Литературный анализ показал, что единственно приемлемым по плавному характеру горения может быть состав, близкий к 60%NaNO3+40%Al.
Составы 60%KClO4+40%Mg, 60%KCLO4+40%Al и 60%NaNO3+40%Mg имеют взрывной характер горения с разбрасыванием продуктов реакции, поэтому применение их для нагрева деталей нецелесообразно. Термитные составы на основе окалины и порошков алюминия или магния вполне приемлемы для использования в качестве энерговыделяющих компонентов.
Таблица
Тепловой эффект реакций горения пиротехнических составов
| Состав | Продукты горения | Тепловой эффект, ккал/г |
| 83%KClO4+17%Be | KCl+BeO | 3,19 |
| 60% KClO4+40%Mg | KCl+MgO | 2,24 |
| 66%KClO4+34%Al | KCl+Al2O3 | 2,45 |
| 60%NaNO3+40%Al | Na2O+Al2O3+N2 | 2 |
| 75%Fe2O3+25%Al | Fe+Al2O3 | 0,92 |
В связи с тем что натриевая селитра ( NaNO3 ) и окалина, а также оксиды железа вполне доступны по своей стоимости и приемлемы для использования в пастах в качестве окислителей, принципы подбора компонентов рассматривались применительно к составам с указанными окислителями и порошком алюминия в качестве восстановителя.
Необходимо рассмотреть два типа реакции горения: 1) продуктами реакции частично являются газообразные вещества; 2) продукты реакции твердые или жидкие (количество горючего вещества (Al ) в обоих случаях одинаково).
Если принять температуру реакции около 3000 °С, что близко к истинному значению, то продуктом реакции, способным эффективно передать тепло образцу, является оксид алюминия. Оксид натрия (tвозг= 1578 °С) и азот при температуре реакции будут находиться в газообразном состоянии и не смогут в полной мере передать тепло нагреваемой поверхности, а в процессе образования они будут выходить из зоны реакции, унося тепло.
Потери тепла, связанные с выходом азота из зоны реакции, определяются выражением
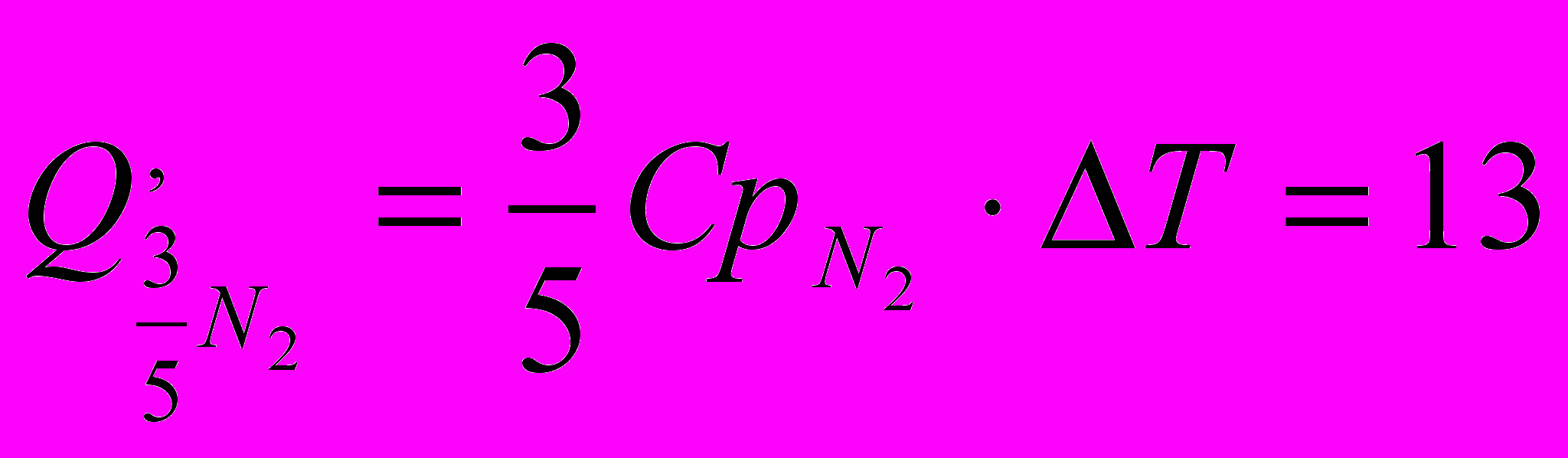 ккал.
ккал.Средняя теплоемкость азота Cpn2 в интервале температур 298 … 3000 °С равна 8 кал/мольград.
Коэффициент 3/5 учитывает число молей, участвующих в реакции. Потери, связанные с выходом из зоны реакции газообразной окиси натрия, могут быть определены как количество тепла
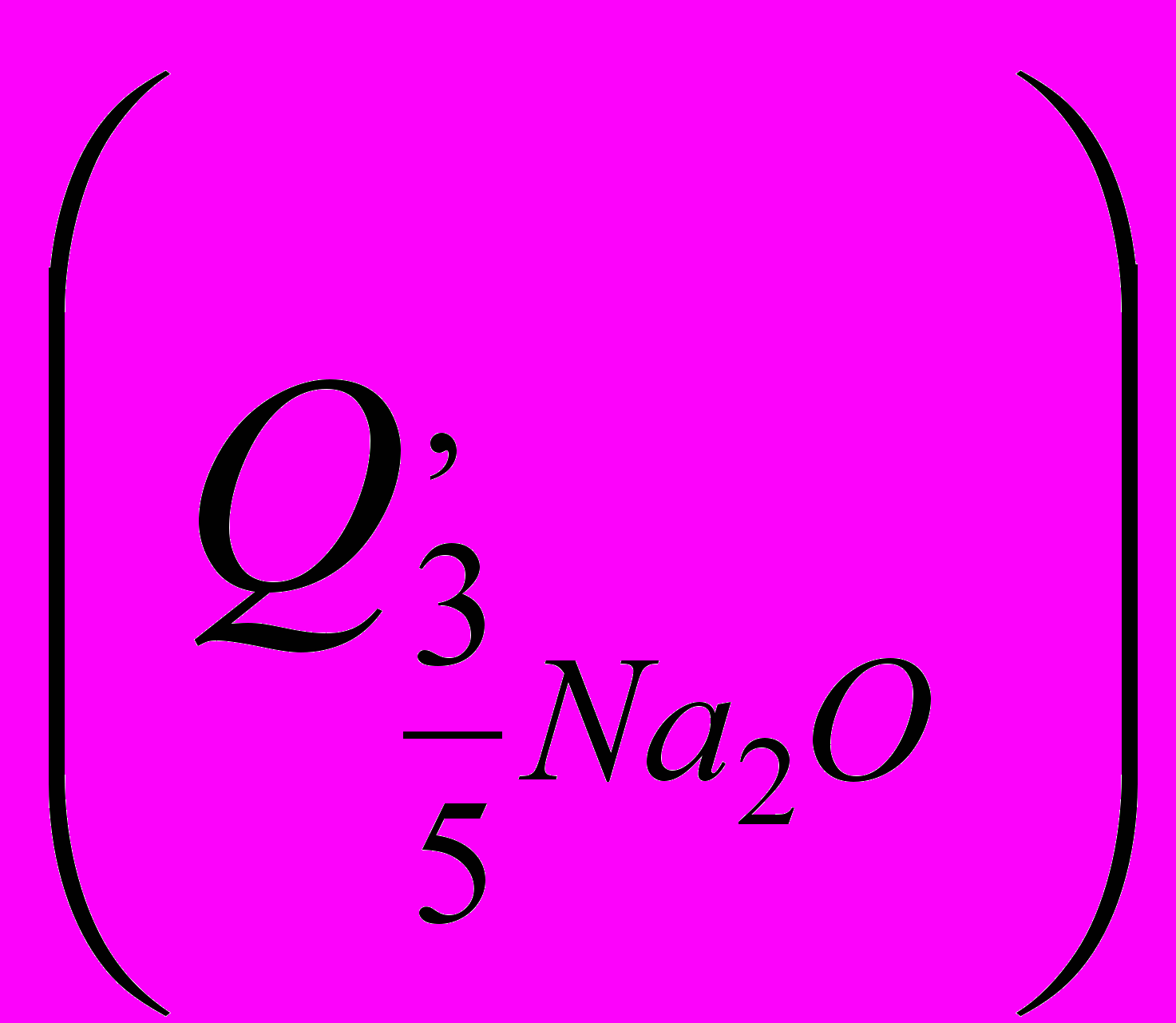 , затраченное на её нагрев (в количестве 3/5 молей) до температуры 3000 С . При этом тепловые затраты следует подсчитывать с учетом происходящих изменений агрегатного состояния оксида натрия:
, затраченное на её нагрев (в количестве 3/5 молей) до температуры 3000 С . При этом тепловые затраты следует подсчитывать с учетом происходящих изменений агрегатного состояния оксида натрия: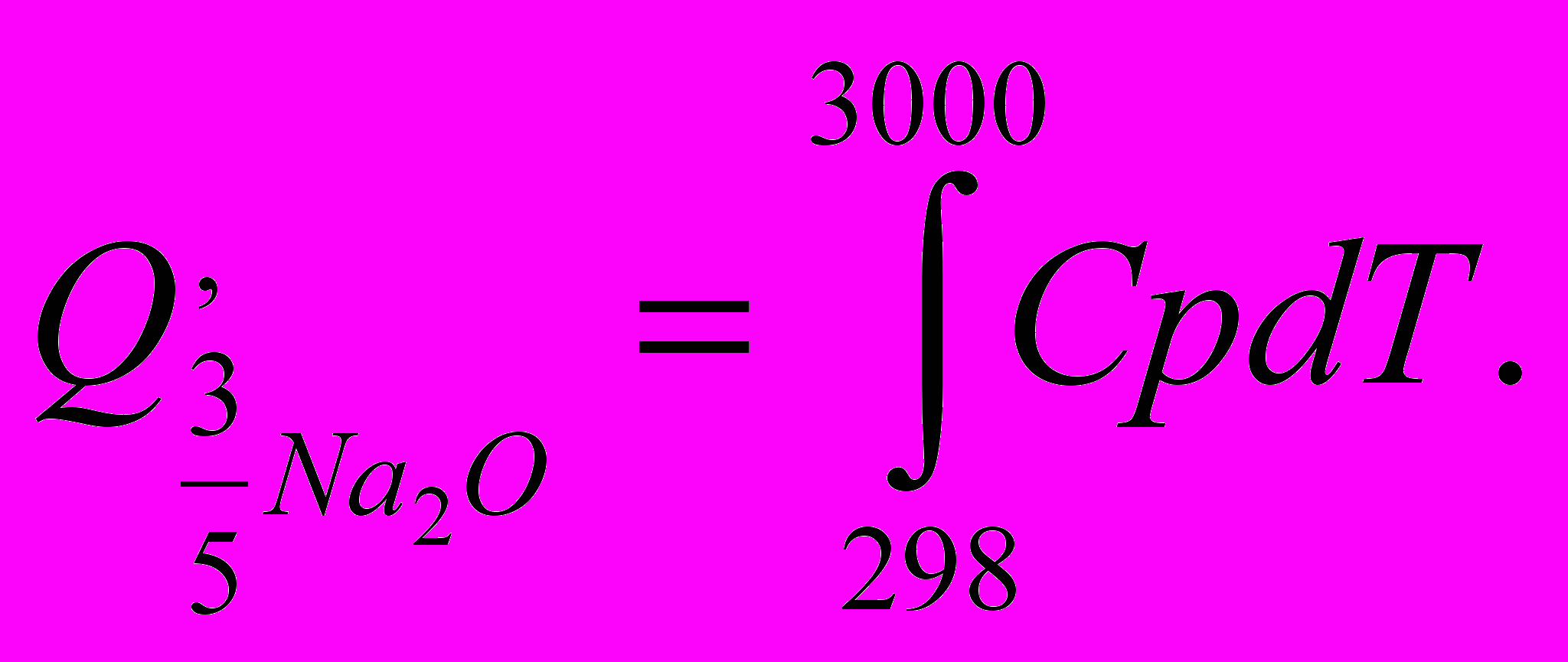
Исходные данные для расчета:
- в интервале температур 298 С….1578 С СР=15,7+5,4Т10-3;
- L плавления=7,14
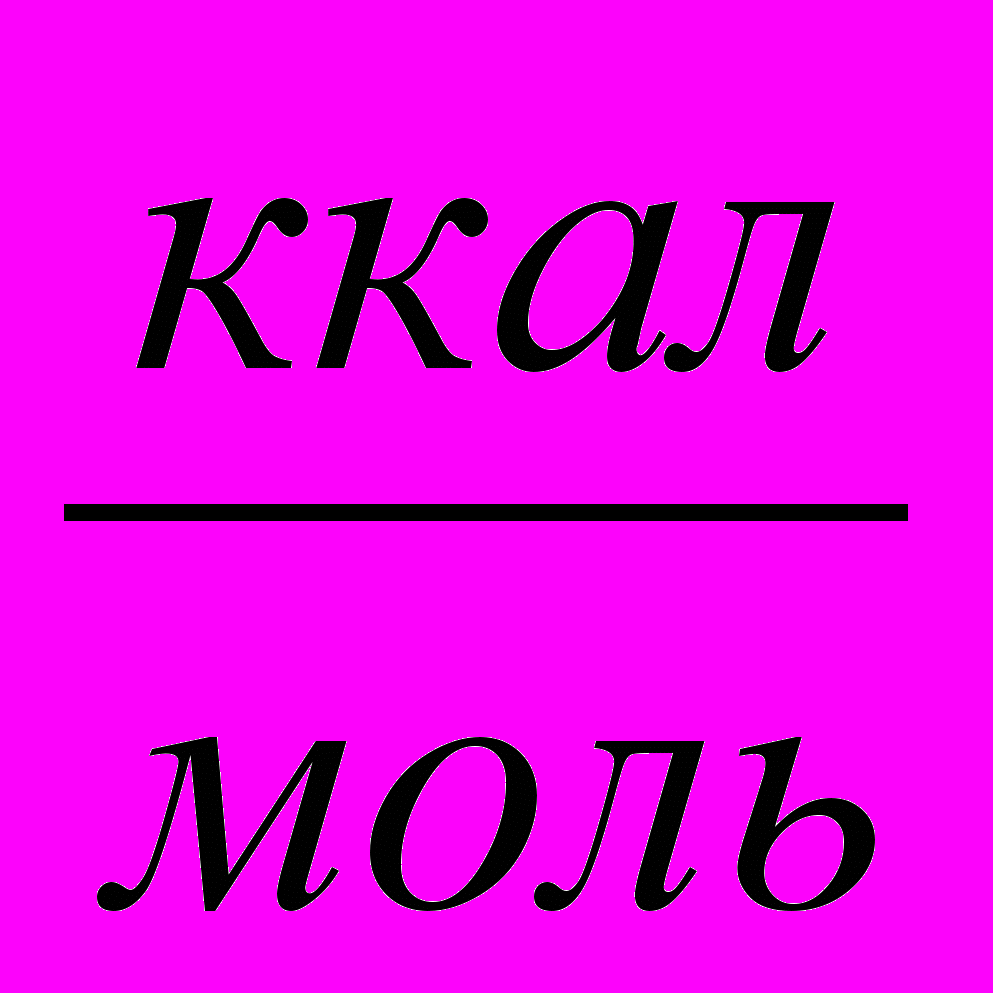 ;
;- L возгорания=110
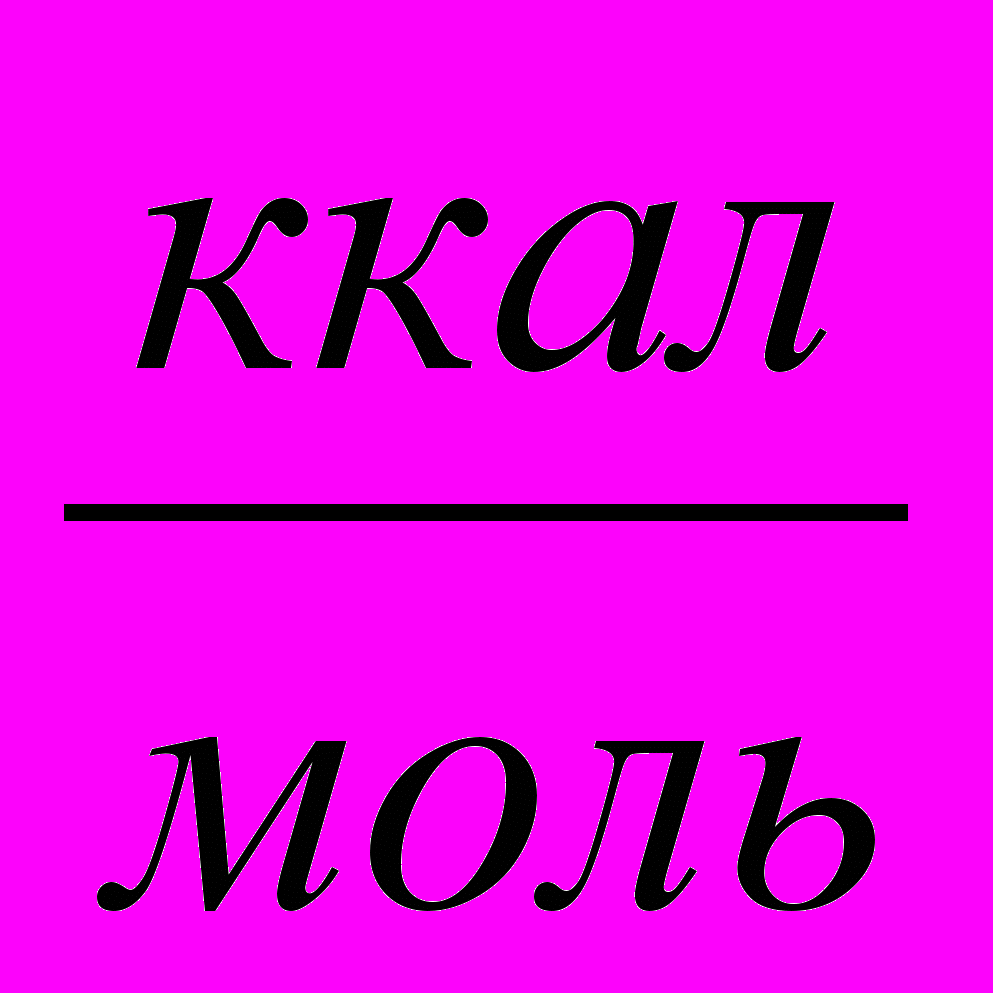 .
.В интервале температур 1578 …3000 С значение Ср принимается, как для трехатомного газа, 13 кал/мольград.
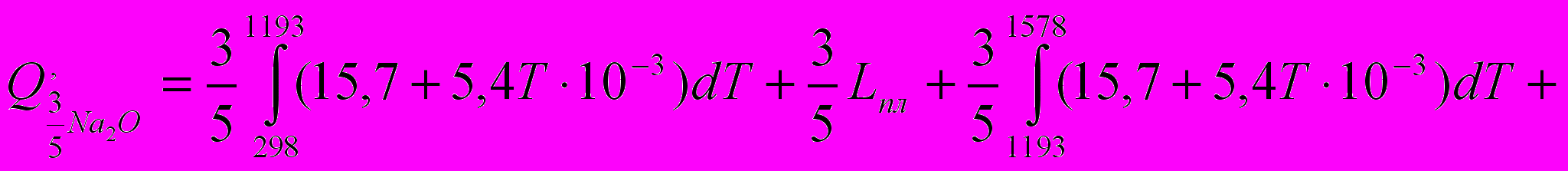
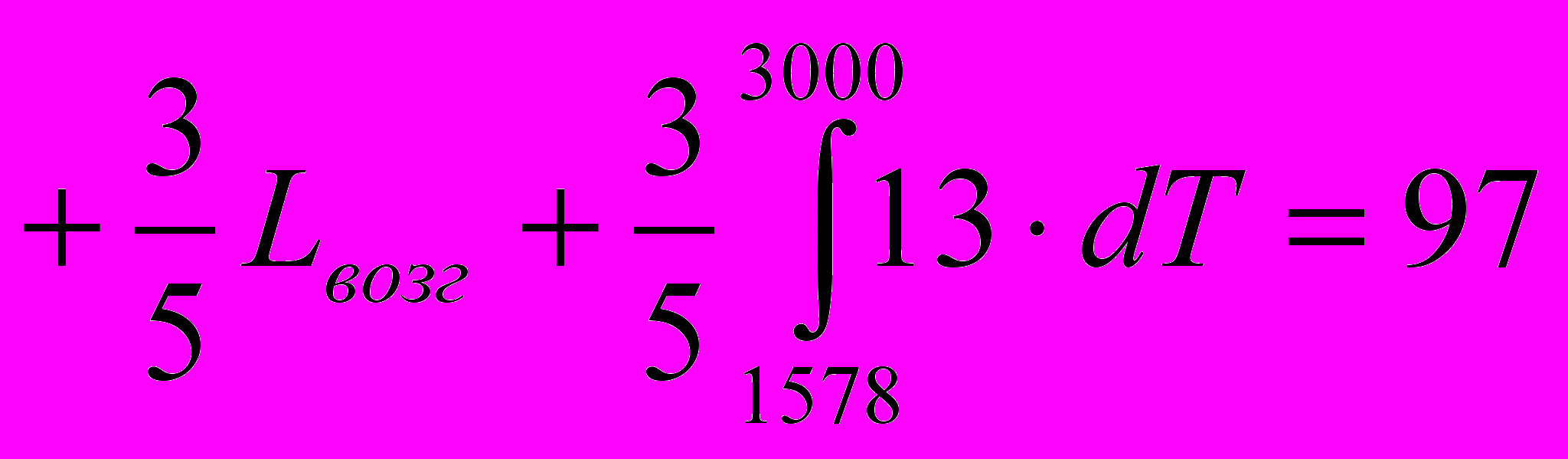 ккал ,
ккал , 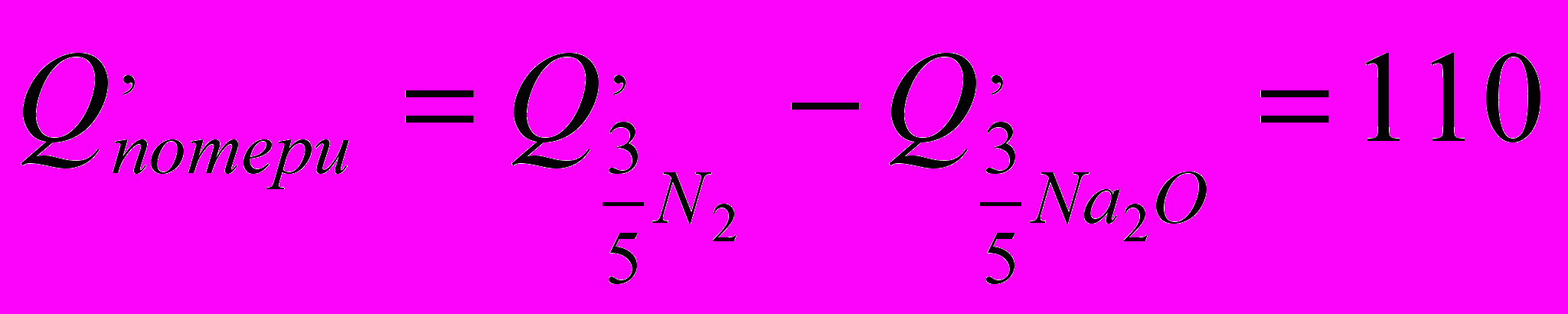 ккал
ккалТепло, которое остается в зоне реакции у поверхности образца, оказывается равным уже не 320 ккал, а только лишь 210 ккал, или 65 % от общего теплового эффекта реакции. Реакция Fe3O4+Al происходит без выделения газов, и всё выделившееся тепло остается в зоне реакции.
Таким образом, тепловой расчет показывает, что при близких тепловых эффектах реакции ( Qр ) значительно выгоднее использовать в качестве компонентов пасты или порошка окислители, не образующие газообразных продуктов реакции. Даже если Qp1 реакции с окислителем типа NaNO3 значительно превосходит Qp2 реакции с окислителем типа Fe3O4, то целесообразность использования тех или иных компонентов может зависеть и от ряда других факторов, поскольку количество полезного тепла в зоне реакции будет отличаться в первом и во втором случаях незначительно, в то время как Qp1 превосходит Qp2 на 65%.
Если предположить, что количество тепла, заключенное в продуктах реакции пасты или порошка, одинаковое (в одном случае это Al2O3, в другом - Al2O3+Fe), то передача тепла от прилегающих слоев продуктами реакции в пасте или порошке будет пропорциональна их теплопроводности. Если этими слоями будут оксид алюминия, а во втором случае - оксид алюминия и восстановленное железо, то тепло, переданное образцу в одинаковый промежуток времени при одинаковой разности температур
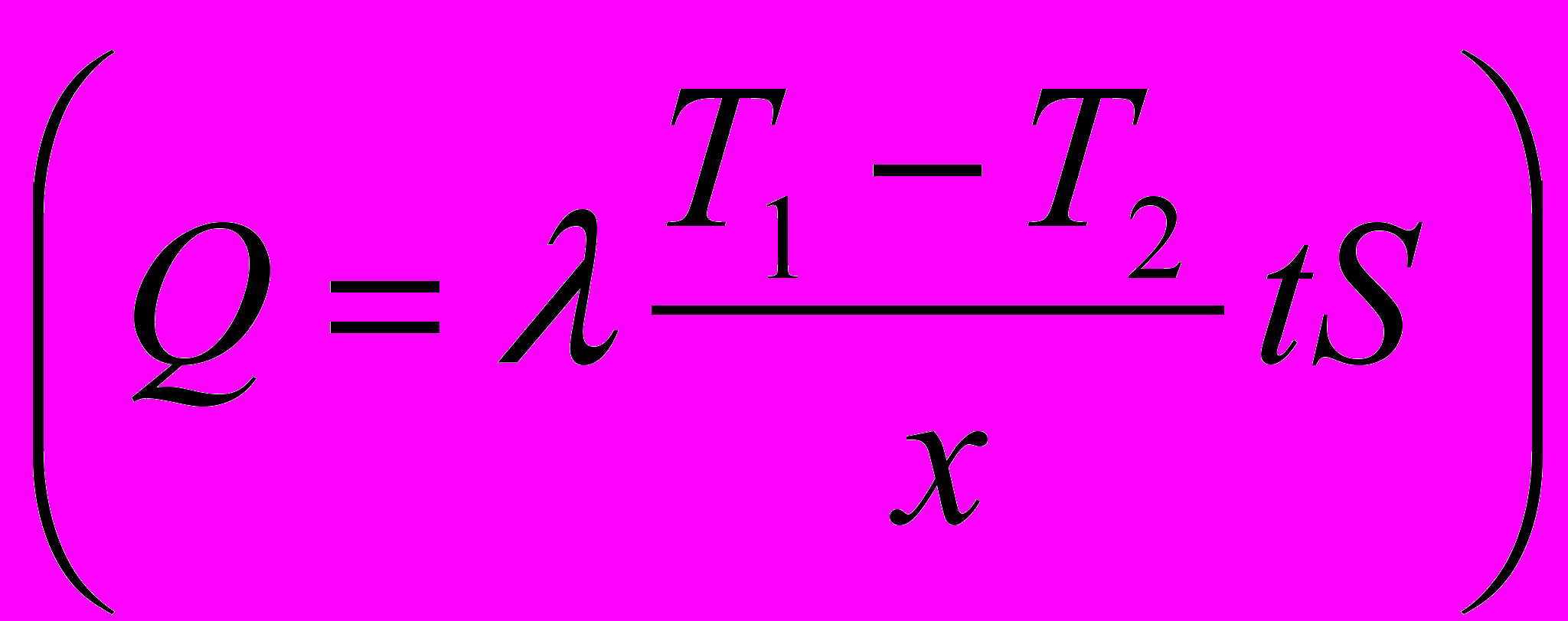 ,
, будет выражаться отношением
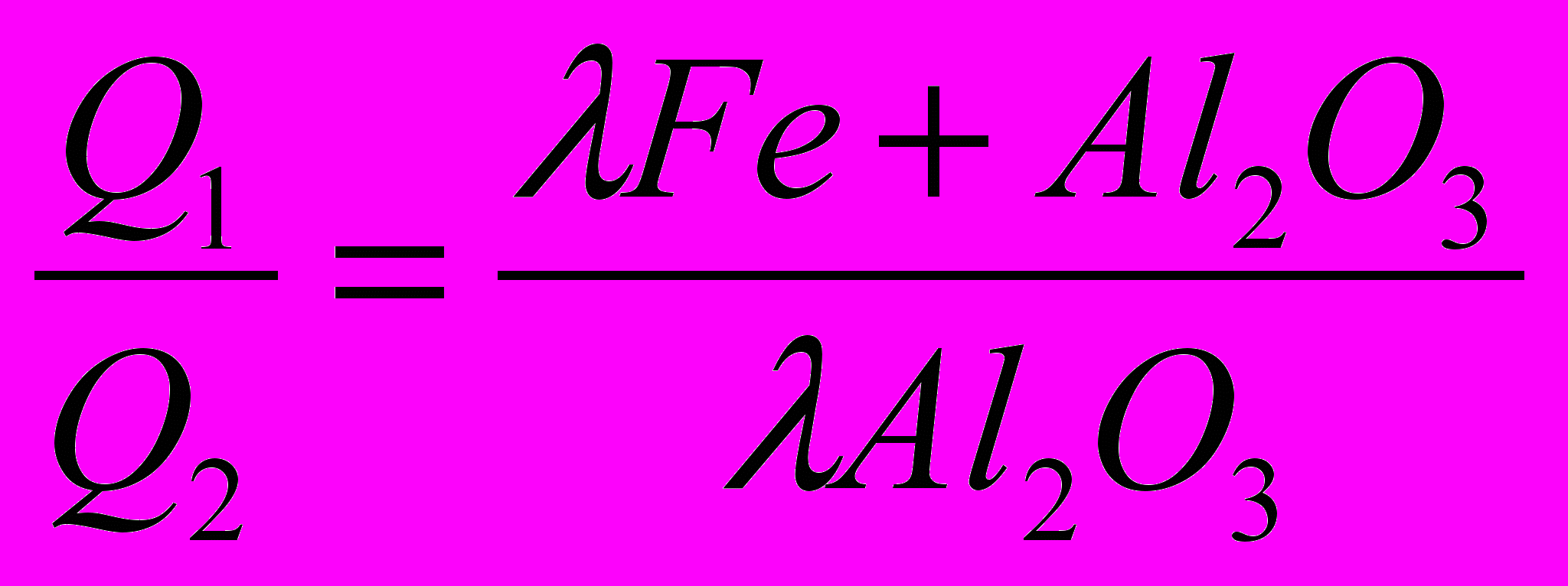 ,
, а это означает, что чем больше тепловой поток в образец, тем интенсивнее нагрев образца и меньше потери в окружающую среду. Особенно заметно это должно проявляться при больших скоростях и высоких температурах реакций.
Анализируя результаты исследования, можно сделать следующие выводы:
1. Наиболее приемлемым видом взаимодействия компонентов при экзотермических реакциях являются реакции замещения, в которых участвуют оксиды металлов.
2. Экспериментальные исследования по энерговыделению следует проводить со следующими компонентами: NaNO3, Fe3O4, Al, Mg.
3. Для предотвращения газовыделения, образования расплавленного железа и получения легкоотделяемых шлаков в состав энерговыделяющей смеси следует вводить Fe3O4, SiO2.
4. При получении энерговыделяющей смеси эффективными являются многоцелевые добавки, позволяющие одновременно влиять на несколько параметров процесса (Fe3O4, SiO2, NaNO3, Al, Mg).
СПИСОК ЛИТЕРАТУРЫ
- Бызов, Л. А. Графические методы измерения связей между выделениями / Л.А. Бызов. - М.: Госпланиздат, 1980. - 350с.
- Березовский, А.А. Математические модели и приближенные методы решения нелинейных проблем теплопроводности и диффузии / А.А. Березовский. - Киев,: Наука, 1991. - 32 с.
- Беляев, Н. М. Методы нестационарной теплопроводности: учеб. пособие / Н. М. Беляев, А.А. Рядно. - М.: Высш. шк., 1988. - 328 с.
- Бровкин, Л. А. Температурные поля тел при нагреве и плавлении в промышленных печах / Л.А. Бровкин. - Иваново: ИЭИ, 1983. - 364 с.
- Бровкин, Л. А. Температурные поля в процессах с фазовыми превращениями / Л.А. Бровкин, В. А. Гусев, В. М. Захаров, В. М. Шипилов. - Иваново: ИвГУ, 1980.- 74 с.
- Бровкин, Л. А. Средства измерения температуры и их проверка / Л.А. Бровкин, В.Ф. Муравьев. - М.: ИПКНЕФТЕХИМ, 1985. - 153 с.
- Бахвалов, Н. С. Численные методы: учеб. пособие / Н.С. Бахвалов, Н.П. Жидков, Г.М. Кобельков. - М.: Наука, 1987. - 600 с.
- Вантерберг, В. Н. Температура реакции железного термита / В. Н. Вантерберг, С.А. Венер. - М., 1996.- 293с.
Материал поступил в редколлегию 8.06.11.
