Днк наномеханические роботы и вычислительные устройства
| Вид материала | Документы |
Содержание4. Модели нанороботов X[1] = cctctagtgatcttattcgc X[1] = ggacttcggtccagtgctcgtgcactaggccgttcgacc X[5] = cttagacaggaggttaggtgcctcgtgatgtccagtcgc S = aaaaa S = aaaaaaa |
- Программа-минимум кандидатского экзамена по специальности 05. 12. 13 «Системы, сети, 121.7kb.
- Программа-минимум кандидатского экзамена по специальности 05. 12. 13 «Системы, сети, 151.82kb.
- Домашние роботы, 181.38kb.
- Программа-минимум кандидатского экзамена по специальности 05. 12. 14 «Радиолокация, 134.92kb.
- Программа-минимум кандидатского экзамена по специальности 05. 12. 14 «Радиолокация, 236.33kb.
- Концепция: техники активации ДНК скрытые (виртуальные) структуры днк: множественные, 1618.54kb.
- В. А. Климёнов 2010 г. Рабочая программа, 267.99kb.
- Международная конференция «Microcad-2011», секция «Информатика и моделирование», 11.06kb.
- Учебно-методический комплекс дисциплины вычислительные системы, сети и телекоммуникации, 338.43kb.
- Определение: генетический код это система записи информации о последовательности расположения, 51.8kb.
4. Модели нанороботов
В современных нанотехнологиях большое внимание уделяется разработке различных наномеханических устройств, являющихся аналогами простейших традиционных механических узлов. Это моторы для прямолинейного движения [1], [2], роторные моторы [3] – [8], передаточные приводы [9], переключатели [10] – [11], челноки (идея, впервые предложенная в [12], получила интенсивное развитие [13] – [16], в частности, активно исследуются конструкции челноков на основе химических [17] – [21], электрохимических [22], [23] и фотохимических [24] – [26] технологий), турникеты [27], храповики [28], щипцы [29], [30], ножницы [31], элеваторы [32].
Технология обнаружения конкретных нуклеотидов и нуклеотидных последовательностей является критической как для исследования генетических материалов, так и для мониторинга деятельности наномеханических роботов, в частности, для считывания информации с наномеханических вычислительных устройств. Традиционно для обнаружения конкретных нуклеотидов и нуклеотидных последовательностей используется метод, заключающийся в маркировке нуклеотидов. Однако этот метод, во-первых, является весьма трудоемким и потому непригоден для массового использования, во-вторых, может нарушить среду, в которой функционирует наномеханическое устройство, в-третьих, меняет физические свойства нуклеотидов, что может повлечь отказ наномеханического устройства. Поэтому в последние годы активно изучаются методы обнаружения нуклеотидов, не использующие маркеров. В частности, предложены оптические [33] – [37], электрохимические [38] и пьезоэлектрические [39] сенсоры (см. также [40] – [43]). Интересно отметить, что в работе [44] предложена модель наномеханического сенсора (см. также [45] – [47]). Развитие этой технологии может позволить для мониторинга деятельности одного наномеханического робота использовать другой.
Все наномеханические устройства естественным образом делятся на небиологические, гибридные и биологические. При этом большинство небиологических и гибридных устройств привлекает для функционирования внешние источники энергии, а для биологических устройств активно развивается направление по созданию механизмов с автономным питанием. На сегодняшний день существуют гибридные устройства на основе электрохимический [48] – [53], оптической [54] – [59], магнитной [60], [61] и механической технологий [44]. Активно развивается направление, в рамках которого в качестве источника энергии для наномеханических устройств предполагается использовать свет или иные виды электромагнитного облучения (см., например, [62] – [65]). В [5] и [6] предложены роторные моторы на основе энергии света. В работе [66] предложена конструкция наномеханического устройства на оптической энергии, состоящего из одной молекулы, полученой полимеризацией azobenzene. Следует отметить, что физические свойства azobenzene хорошо изучены и такие молекулы уже неоднократно применялись в различных фотозависимых системах (см. [67] – [88]). Устройства, осуществляющие механическое движение на основе электростатического взаимодействия ионов предложены в работах [89] и [90].
Молекулы РНК имеют много различных полезных свойств, благодаря которым они играют важнейшую роль во внутриклеточных процессах. В частности, они могут выступать носителями информации, источниками энергии и т.д. Значительную часть молекул РНК можно рассматривать как механические устройства, выполняющие простейшие операции. Эти устройства являются сенсорами, переключателями, катализаторами и др. Механическая модель функционирования этих естественных устройств была впервые обнаружена при изучении интронов [91] и позднее раскрыта в исследованиях [92] – [102]. В частности, в [102] в 1990 году было опубликовано об обнаружении первого сенсора естественного происхождения. В том же году появились первые публикации экспериментов с искусственно созданными сенсорами (см. [103], [104]) и катализаторами (см. [105]). Использованный при получении этих устройств метод заключается в экспериментальном исследовании последовательностей РНК, которое осуществляется в рамках процесса направленной эволюции (SELEX: systematic evolution of ligands by exponential enrichment [104]), цель которого – обеспечение выполнимости фиксированного свойства и отсечение побочных свойств. Процесс направленной эволюции предоставил исследователям сравнительно простой и эффективный инструмент получения генетических последовательностей с заданными свойствами, что привело к весьма бурному развитию исследований по созданию наномеханических устройств на основе РНК и ДНК (см. [103] – [1007]).
Стандартный метод направленной эволюции SELEX предназначен, вообще говоря, только для конструирования механических сенсоров. В рамках этого метода берется генетическая последовательность, распознавание которой по каким-либо соображениям представляет интерес. После этого генерируется популяция случайных последовательностей РНК. Распознаваемая последовательность обездвиживается и на нее направляется сгенерированная популяция. Наблюдение за взаимодействием последовательностей РНК и распознаваемой последовательности позволяет определить то, какие именно участки последовательности отвечают за те или иные свойства, кроме того, это дает возможность из случайного набора последовательностей выбрать последовательность, обладающую заданными свойствами. После этого осуществляется селекция популяции. В качестве критерия приспособленности выступает способность последовательности РНК обнаружить распознаваемую последовательность, переместиться к ней и прикрепиться на ней. Используется также направленная эволюция, при которой в качестве распознаваемой последовательности выступает какая-либо нежелательная последовательность и, соответственно, последовательности РНК, распознающие эту последовательность, исключаются из дальнейшего отбора (см., например, [180], [304], [345], [346], [376], [383], [446], [552], [604], [736], [917], [783]). Обычно цикл направленной эволюции повторяется от пяти до пятнадцати раз. В результате успешной эволюции получается последовательность РНК, которую можно рассматривать как механический сенсор.
Типичный подход к созданию начальной популяции последовательностей РНК, участвующей в направленной эволюции, заключается в том, что берется некоторая последовательность РНК, некоторые участки этой последовательности оставляются неизменными, а остальные подвергаются интенсивной модификации.
Размеры модифицируемых областей последовательностей, участвующих в направленной эволюции, представляют весьма важное значение для конструирования устройств. Наиболее типичными являются области от 40 до 80 нуклеотидов. Широко используются и меньшие по размерам области. Например, в работах [252], [326], [375], [564], [597], [604], [635] рассматривались области от 20 до 23 нуклеотидов. В [486] рассматривалась последовательность вида
X[1]X[2]X[3]X[4]X[5],
где
X[1] = CCTCTAGTGATCTTATTCGC,
X[3] = CTGCCAAGGGCCTTTCGGCTGGTAT,
X[5] = CCCAGTTAACGCCAGCGAGGAGGCT,
а X[2] и X[4] – случайные последовательности, состоящие из четырех или пяти нуклеотидов. В [738] рассматривались последовательности аналогичной структуры, у которых X[1], X[3], X[5] имели вид
X[1] = GGACTTCGGTCCAGTGCTCGTGCACTAGGCCGTTCGACC,
X[3] = AGGATATGCTTCGGCAGAAGG,
X[5] = CTTAGACAGGAGGTTAGGTGCCTCGTGATGTCCAGTCGC
и
X[1] = GGACTTCGGTCCAGTGCTCGTGCACTAGGCCGTTCGACC,
X[3] = ACAGTGAAAAAAGACGTGTGAATGTCACACTGAAAAAA,
X[5] = CTTAGACAGGAGGTTAGGTGCCTCGTGATGTCCAGTCGC,
соответственно, а X[2] и X[4] были случайными последовательностями из трех или четырех нуклеотидов. Иногда применяют и довольно большие области. Например, в [253], [304], [316], [534], [764], [870], [980] использовалась область из 120 нуклеотидов, в [783] область состояла из 134 нуклеотидов, а в [571] применялась область из 228 нуклеотидов. Существенность размеров модифицируемых областей последовательностей объясняется тем, что для области, состоящей из k нуклеотидов, пространство решений имеет размер 4k. Поэтому при увеличении размеров области экспоненциально возрастает вычислительная нагрузка при подготовительном моделировании для направленной эволюции. Кроме того, чисто технически лабораторное оборудование позволяет использовать от 0.1 до 10 nmol вещества, что соответствует примерно от 421 до 427 последовательностей.
Учитывая имеющиеся ограничения по размеру, действия полным перебором весьма нежелательны. Поэтому большое внимание уделяется не только размерам модифицируемых областей, но и другим существенным деталям и ограничениям: расположению модифицируемой области в последовательности, отношению количества нуклеотидов разных видов и т.д. Например, в [324] в качестве исходной была взята последовательность
GGGAGCTCAGAATAAACGCTCAAAGACGGT
GAAACTGAAATCTAATCCGTCTGAACCCTG
GATTTCGACATGAGGCCCGGATCCGGC,
состоящая из 87 нуклеотидов, у которой изменялся участок между 24-м и 63-м нуклеотидами, при этом заменялось 30% от общего количества нуклеотидов. Степень изменения исходной последовательности может определяться в зависимости от общего количества нуклеотидов (как в только что рассмотренном примере) или в зависимости от количества нуклеотидов, для которых изменения допустимы. Например, в [163] рассматривались последовательности
CGACGTCGCTCGAATGCTGATAGTAGTTCTCC
TTTAAGGAGTTTGGGTGGTGGGTGGGTGTTAG
ATGTTGAGATCGTTAGCATGTTTCGCCGAGCTA
и
CGACGTCGCTCGAATGCCGGGCTCGCGTTGCC
GAGGGGGTGGGTTTGGGTCACCACTGGCGTAG
GAAGCCAAGGGTGTGGTGTGCAGCGCCGAGCTA,
у которых модифицировались нуклеотиды с 18-го по 79-й с вероятностью 12%. Несколько более простой подход рассмотрен, например, в [963]: исходная последовательность вообще не рассматривалась, а требуемая последовательность строилась в предположении, что начальный отрезок имеет вид
GGGACAGGGCTAGC,
заключительный отрезок имеет вид
GAGGCAAAGCTTCCG,
а по середине расположены 30 случайных нуклеотидов. В [163] применялась направленная эволюция последовательности, у которой начальный отрезок имеет вид
CGACGTCGCTCGAATGC,
заключительный отрезок имеет вид
CGCCGAGCTAGAGGTCCTTC,
а по середине расположены 70 нуклеотидов, представляющих собой случайную последовательность с примерно равным количеством вхождений A, G, C и T. В [944] применялась направленная эволюция последовательности, у которой начальный отрезок имеет вид
GGTTGGCAGCAGAAGATAGCA,
заключительный отрезок имеет вид
GTCGGTCAAGGGAGGGATCCTA,
а по середине расположены 60 нуклеотидов, представляющих собой случайную последовательность с количеством вхождений нуклеотидов A, G, C и T, распределенным в отношении 25/25/30/20.
Рассматриваются и более тонкие подходы к организации направленной эволюции. Например, можно взять за основу не случайную последовательность, а уже готовое РНК-устройство. После этого запускается процесс малых изменений, направленный на получение новых полезных свойств с сохранением ранее полученных. В частности, в работе [430] за основу был взят сенсор АТФ:
AGCCAGCTTAATGAGCAAGGGGGTTGCTGGCACCGAAGTG
CCACAGTTTCTTCCCAACCCGGCGTACATGCAACCACTCC.
Начальный участок последовательности
AGCCAGCTTAATGAGCAAGG
и заключительный участок
GGCGTACATGCAACCACTCC
были оставлены без изменений, к заключительному участку была добавлена последовательность
TATAGTGAGTCG TATTACGC,
а средний участок
GGGTTGCTGGCACCGAAGTGCCACAGTTTCTTCCCAACCC
подвергался незначительным модификациям. Другой интересный подход к направленной эволюции предложен в работе [963]. Для сенсора
GGGACAGGGCUAGCAGUAGGAUUGGGUGAGGGGAUGUGCUG,
полученного обычными методами направленной эволюции, структура слабых связей
1 – 40, 2 – 39, 4 – 37, 5 – 36, 6 – 35, 10 – 33, 11 – 32, 13 – 27, 14 – 26
оказалась интересной с функциональной точки зрения, но не устойчивой. Для закрепления структуры слабых связей такого типа была проведена направленная эволюция, критерием которой выступала стабильность слабых связей. Полученная в результате последовательность сенсора имеет вид:
GGGCUAGGGCUAGCAGUAGGAUUGGGUGAGGGGAUAGCC.
При этом в схеме слабых связей пара 1 – 40 была заменена на 3 – 38. Следует отметить, что идея повторной селекции является достаточно распространенной (см., например, [153], [196] – [200], [252], [346], [389], [416], [431], [519], [552], [594], [609]). При этом направленная селекция не обязательно преследует своей целью улучшение уже полученной последовательности. Например, в [433] к уже готовому сенсору была добавлена новая случайная область, после чего процесс направленной эволюции был повторен. Повторная селекция может применяться не только к искусственно синтезированным устройствам, но и к последовательностям РНК природного происхождения (см., например, [508], [656]). Кроме того, в отдельных случаях модификация областей РНК осуществлялась не только с использованием обычных нуклеотидов, но и искусственно синтезированных (см., например, [661], [845]). При этом искусственные нуклеотиды применяются не только для повышения разнообразия случайных последовательностей, но и в чисто технических целях. Например, могут применяться нуклеотиды 5-iodouracil для привлечения методов фотохимии к организации лабораторного процесса (см. [356], [449]).
Как правило, механические сенсоры конструируются для обнаружения небольшого фиксированного фрагмента генетической последовательности, который характерен только для последовательностей такого вида и не встречается в других последовательностях. Например, в [112] рассматривается следующий фрагмент, состоящий всего из девятнадцати нуклеотидов (см. также [732]):
AGCGCGTGATGAACTTCGA.
Такая стратегия наилучшим образом работает для объектов распознавания существенно различающихся между собой. Однако ведутся исследования и в области создания механических сенсоров, позволяющих распознавать и незначительно отличающиеся последовательности. В частности, в [359] предложена конструкция сенсора, разделяющего Human Influenza A virus A/Panama/2007/1999(H3N2) и Human Influenza A virus A/Aichi/2/1968(H3N2). В случае с Human Influenza A virus A/Panama/2007/1999(H3N2) и Human Influenza A virus A/Aichi/2/1968(H3N2) оба вируса являются патогенными. Поэтому, вообще говоря, их разделение представляет интерес преимущественно с точки зрения выбора правильного метода лечения, а обнаружение возможно стандартными медицинскими способами. Несколько иная ситуация с Prion Protein (PrP). Этот белок имеет две формы: PrPC и PrPSc [1008]. Форма PrPC является безвредной, но имеет тенденцию к переходу в форму PrPSc. Форма PrPSc вызывает такие заболевания как Creutzfeldt–Jacob disease и Gerstmann–Straussler–Scheinker syndrome (см., например, [1009], [1010]). Известно несколько способов для обнаружения формы PrPSc (см., например, [1011] – [1019]), что позволяет диагностировать указанные выше болезни, но не позволяет диагностировать предрасположенность к ней, поскольку предрасположенность определяется формой PrPC. На сегодняшний день единственным методом для обнаружения формы PrPC является механический сенсор, предложенный в работе [784].
Следует отметить, что в большинстве случаев сенсоры и переключатели, полученные из РНК, представляют собой конструкции, составленные из небольшого количества сравнительно маленьких последовательностей (до нескольких сотен нуклеотидов). Например, в [112] рассмотрены переключатели, один из которых получен из последовательностей
GATCCGGCAAGCTGACCCTGAAGT,
GGTATACTTCAGGGTCAGCTTGCCG,
ATACCAGCCGAAAGGCCCTT,
CTGCCAAGGGCCTTTCGGCT,
GGCAGACTTCAGGGTCAGCTTGCCTTTTTTGGAAA,
AGCTTTTCCAAAAAAGGCAAGCTGACCCTGAAGT,
а второй – из последовательностей
GATCCAGCGCGTGATGAACTTCGA,
AGTTCATCACGCGCTG,
ATACCAGCCGAAAGGCCCTTGGCAGTCGAAG,
TGAACTTCGACTGCCAAGGGCCTTTCGGCTGGTATTCGA,
TTCATCACGCGCTTTTTTGGA,
AGCTTCCAAAAAAGCGCGTGA.
Конструкция сенсоров и переключателей обеспечивает им сравнительно небольшие размеры. Это существенно облегчает создание из таких устройств комплексов для решения более сложных задач.
Направленная эволюция предполагает создание устройства лабораторным путем. При этом генетические последовательности, из которых собирается устройство, могут отсутствовать в генетическом коде организма, в котором предполагается функционирование устройства. В работах [546], [711] и [864] предложен подход, заключающийся в поиске кодов устройств непосредственно в геноме, основываясь на общем исследовании функциональных возможностей РНК в зависимости от кода (см., например, [1020] – [1039]). Преимущество такого подхода заключается в том, что вместо размещения в клетке искусственно синтезированных устройств мы можем организовать синтез непосредственно в клетке.
Большое внимание уделяется различным технологиям, позволяющим усовершенствовать метод направленной эволюции на лабораторном уровне. При этом возникают различные технологии, представляющие существенный интерес и за пределами задачи организации направленной эволюции. В частности, активно изучаются вопросы совершенствования методов обеспечения неподвижности распознаваемой последовательности (см., например, [110], [154], [179], [354], [368], [444], [445], [483], [504], [507], [508], [530], [534], [553], [560], [643], [656], [748], [750], [762], [772], [783], [870], [884], [914], [950], [951], [954]). При этом если для метода направленной эволюции неподвижность генетической последовательности – это вопрос чистоты лабораторного эксперимента, то в глобальном случае – это вопрос поддержания стабильности в наносистеме. Следует отметить, что отдельные технологии обеспечения лабораторного процесса направленной эволюции выходят за рамки чисто биологических и представляют интерес для разработки гибридных систем (см., например, [267], [356], [449], [599], [643], [648]).
Направленная эволюция позволяет отсекать только побочные свойства, обусловленные линейной структурой РНК. Поэтому активно развивается направление, в рамках которого изучаются пространственные свойства уже сконструированных РНК-устройств (см., например, [127], [130], [132], [162], [169], [192], [206], [247], [251], [255], [284], [312], [314], [318], [323], [335], [346], [353], [383], [393], [395] – [398], [402], [431], [446], [454] – [458], [485], [549], [554], [576] – [578], [600], [640], [642], [686], [696], [721] – [723], [740], [746], [764], [776], [824], [854], [855], [874], [887], [898] – [900], [917], [920], [925], [928], [933], [949], [972], [978], [986], [989], [990], [993], [1001]). Для получения точной картины пространственного поведения РНК-устройств существенное внимание приходится уделять исследованию неклассических слабых связей (см., например, [132], [398]). Следует отметить, что не смотря на значительную трудоемкость задачи изучения пространственной структуры РНК, в последние годы наблюдается существенный прогресс в этой области благодаря применению X-ray кристаллографии (см., например, [1040] – [1045]).
В работе [480] предложена модель механического сенсора для стероидов. Стартовав с 91014 идентичных последовательностей, после 13 раундов направленной эволюции было получено 19 сенсоров размером от 95 до 100 нуклеотидов. Оказалось, что все 19 последовательностей различны. Последующие исследования (см. [481]) показали, что для распознавания стероидов существенна не сама нуклеотидная последовательность, а ее способность формировать трехвалентный наноузел (см. [1046] – [1050], см. также [1051] – [1054]). В результате в [481] была предложена модель сенсора на основе трехвалентного наноузла, составленного из последовательности
GCAGGGTCAATGGAATTAATGATC
AATTGACAGACGCAAGTCTCCTGC
со слабыми связями
1 – 48, 2 – 47, 3 – 46, 4 – 45, 5 – 44, 6 – 31, 7 – 30, 8 – 29, 9 – 28, 10 – 27,
11 – 26, 12 – 25, 13 – 24, 14 – 23, 32 – 43, 33 – 42, 34 – 41, 35 – 40.
Отметим, что слабая связь 12 – 25 образована неклассической парой G – A.
В работе [435] рассмотрены шесть конструкций сенсора, распознающего вирус гепатита С. Все шесть конструкций обладают аналогичной структурой вторичных связей, в рамках которой последовательность РНК имеет вид
X[k,1]Y[k,1]Z[k,1]Y[k,2]Z[k,2]Y[k,3]Z[k,3]Y[k,4]Z[k,4]Y[k,5]
Z[k,5]Y[k,6]Z[k,6]Y[k,7]Z[k,7]Y[k,8]Z[k,8]Y[k,9]X[k,2],
где k – номер последовательности. При этом Y[k,1] и Y[k,9], Y[k,2] и Y[k,3], Y[k,4]Y[k,5] и Y[k,6], Y[k,7] и Y[k,8] – пары последовательностей, образующих слабые связи и разделяющих последовательность на свободные участки, комплементарные участки и петли; X[k,1] и X[k,2] – свободные последовательности; Z[k,2], Z[k,4], Z[k,5], Z[k,7] – петли; Z[k,1], Z[k,3], Z[k,6] и Z[k,8] образуют разделенную петлю. Ни для какого из участков структуры вторичных связей совпадения нуклеотидов для всех шести сенсоров нет. Таким образом, здесь, как и в случае [480], существенна не сама нуклеотидная последовательность, а структура вторичных связей. Это говорит о том, что в отдельных случаях можно существенно повысить эффективность направленной эволюции, варьируя не саму случайную последовательность, а возможные структуры вторичных связей.
В качестве объекта распознавания в рамках процесса направленной эволюции не обязательно выступают последовательности ДНК или РНК. Имеются механические сенсоры, способные обнаруживать белки, антибиотики, вирусы и т.д. В частности, в [237] предложена конструкция механического сенсора, позволяющего обнаруживать вирус гепатита С. В работах [242], [244], [415] опубликованы результаты исследований по сенсорам, распознающим ионы металлов.
Следует отметить, что РНК-сенсоры обладают довольно большими вычислительными возможностями с точки зрения распознавания языков. В частности, в работе [1055] предложена теоретическая конструкция распознавателя контекстно-зависимых языков, основанная на природных принципах взаимодействия молекул РНК. Тот факт, что, обнаруживая запрограммированную эволюцией последовательность, механический сенсор перемещается к ней и прикрепляется на ней, позволяет использовать подобные сенсоры как узлы для конструирования более сложных устройств, которые способны не только распознавать последовательности, но и преобразовывать. В частности, в работе [111] сенсор выступает как конструктивный элемент катализатора, а в [837] сенсор является частью переключателя.
Серия работ [1056] – [1062] посвящена WPCR-машинам. Хотя эти машины обладают довольно ограниченными вычислительными возможностями, их существенным достоинством является способность работать параллельно, при этом выполняя различные программы.
Теоретический фундамент вычислений на основе самоорганизации был заложен еще в 1963 году в [1063]. Идея использования нанорешеток, построенных из молекул ДНК, для создания различных устройств на основе самоорганизации впервые была высказана в 1982 году в [1064]. В [1065] была предложена модель вычислений на основе нанорешеток. В работах [1066] – [1070] последовало дальнейшее развитие модели, предложенной в [1065], направленное на поиск новых нанорешеток, пригодных для вычислений, расширение функциональности модели, экспериментальное тестирование, исследование сложности нанорешеток и др. В работах [1071] – [1081] были проведены исследования, направленные на отработку отдельных логических элементов и механизмов движения с использованием неавтономных ДНК наномеханических роботов на основе нанорешеток. В частности, были предложены роботы способные осуществлять поворот [1071] – [1073], открытие – закрытие [1074] – [1076], расширение – сжатие [1077] – [1079] и движение [1080], [1081]. В работах [1082] – [1087] предложены различные модели автономных ДНК наномеханических роботов. Первые эксперименты по автономным вычислениям при помощи нанорешеток описаны в [1088] – [1092]. Накопление теоретической базы и практического опыта в области создания устройств с использованием нанорешеток привело к постепенному переходу к разработке полноценных вычислительных устройств. В частности, в работе [1093] предложена конструкция конечного автомата. В [1094] построены конечный автомат, недетерминированный конечный автомат, вероятностный автомат, там же предложена конструкция медицинского робота и модель краулера, перемещающегося по двумерной нанорешетке. В [1095] построена универсальная машина Тьюринга.
Отметим, что ведутся разработки нанороботов, которые могут быть использованы для строительства ДНК наномеханических устройств или совместной работы с ними. В частности, конструкция наноробота, предназначенного для контроля за процессами в клетке, предложена в [1097]. Активно изучаются вопросы, связанные с разработкой нанороботов с использованием вирусов как доков для роботов, синтетических платформ, наношаблонов и др. (см. [1098] – [1115]). В работе [1116] предложен ДНК наномеханический робот, разработанный на основе бактериальных патогенов Rickettsia rickettsii, предназначенный для управления полимеризацией.
В работе [1096] предложена конструкция (см. рисунок 3), которая посредством добавления одной последовательности ДНК запускает каскад преобразований (HCR: hybridization chain reaction). Эта конструкция предполагает наличие некоторого количества заблаговременно размещенных в лабораторной тубе наноструктур двух типов – T и T’. В лабораторную тубу добавляется последовательность ДНК S. Предполагается, что последовательность S гибридизируется с частью наноструктуры T, освобождая при этом последовательность S’. В свою очередь последовательность S’ гибридизируется с частью наноструктуры T’, освобождая при этом последовательность S. Этот цикл преобразований приводит к связыванию исходной последовательности S с парой наноструктур T и T’ и освобождению нового экземпляра последовательности S. Этот цикл будет повторяться до тех пор, пока наноструктуры T или T’ не будут исчерпаны.
Такой каскад преобразований может, вообще говоря, протекать либо в соответствии с принципом свободной энергии, либо с применением ферментов, стимулирующих разрыв слабых связей.
В частности, в простейшем случае (с модельной точки зрения) все экземпляры последовательности S могут быть полностью идентичны. При этом последовательность S’ равна S, наноструктуры T и T’ равны между собой и являются конкатенацией последовательности S и последовательности, комплементарной к ней. В этом случае получающаяся в результате каскада преобразований последовательность является непосредственным повтором последовательности S, образующим двойную спираль с непосредственным повтором комплементарной к ней последовательности.
Даже этот весьма простой случай представляет существенный практический интерес. Например, такой каскад преобразований можно использовать в медицине для обнаружения последовательностей фиксированного типа и оценки их количества. Кроме того, синтез периодической последовательности ДНК, получаемой в результате HCR, можно использовать для построения длинных молекул ДНК из фрагментов непосредственно в клетке или лабораторной тубе.
Рассматриваемая конструкция каскада имеет два недостатка. Во-первых, нет гарантии зацикливания последовательности преобразований (см. рисунок 4). Во-вторых, нет механизма, управляющего направлением распространения процесса в пространстве.
Зацикливания каскадного процесса можно избежать, если, например, использовать в молекулах T и T’ частично комплементарные участки. Рассмотрим, например, случай, когда
S = AAAAA,
T = TTTTTAACAA,
T’ = TTGTTAAAAA,
где нуклеотиды в каждой из последовательностей T и T’ имеют слабые связи в парах 1 – 10, 2 – 9, 4 – 7, 5 – 6. Гибридизация S и T ведет к уменьшению свободной энергии. Гибридизация освободившегося участка T и T’ также приводит к уменьшению свободной энергии. Это уменьшение свободной энергии препятствует обращению процесса.
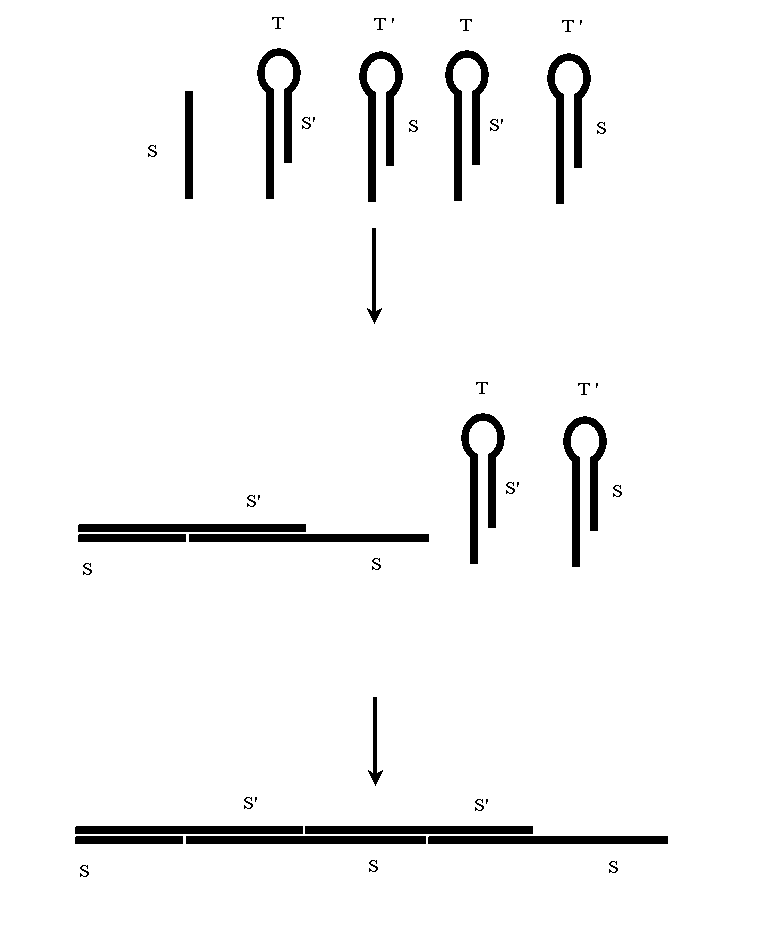
Рис.3. Каскад преобразований, предложенный в [1096].
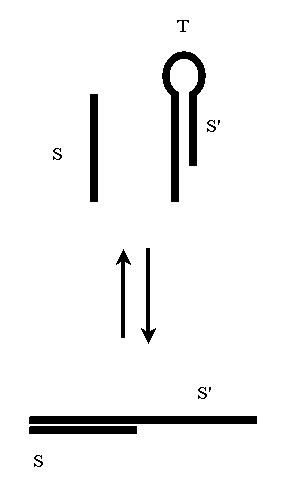
Рис.4. Зацикливание каскадного процесса.
Только что рассмотренная конструкция предполагает идентичность всех экземпляров T и, соответственно, идентичность всех экземпляров T’. Если рассмотреть случай, когда используются модифицированные копии T и T’, то каскадный процесс без повторений можно продолжить на большее количество преобразований. Например,
S = AAAAAAA,
T[1] = TTTTTTTACAAAAA,
T’[1] = TGTTTTTAACAAAA,
T[2] = TTGTTTTAAACAAA,
T’[2] = TTTGTTTAAAAAAA.
При достаточной длине последовательностей S, T и T’ отсутствия повторений пожно добиться на любом заданном количестве преобразований. Варьируя количество некомплементарных пар можно управлять абсолютными величинами свободных энергий.
Создание механизма, управляющего направлением распространения процесса в пространстве, может осуществляться различными путями. Можно выделить две основные группы методов: размещение молекул T и T’ на геометрически устойчивой конструкции, регулировка плотности расположения молекул T и T’ в пространстве.
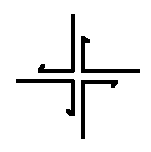
Рис.5. Конструкция 3-6 руки, предложенная в [1117].
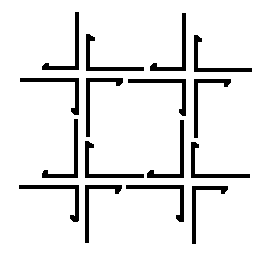
Рис.6. Нанорешетка, составленная из четырех 3-6 рук.
Для регулировки плотности расположения молекул T и T’ в пространстве можно использовать различные методы для создания самоорганизующихся систем независимых структур. Например, методы, основанные на генетических алгоритмах или искусственных иммунных системах. Другую возможность дает использование вирусов или нанорешеток в качестве доков. Экспериментально синтезированной нанорешетки, пригодной для выполнения функций дока, пока нет. Однако поставленные к настоящему времени эксперименты показывают, что подобная конструкция принципиально возможна. В частности, за модельную основу можно взять конструкцию куба, состоящего из шести стенок и каркаса. Для стенок дока можно, например, использовать нанорешетку, составленную из 3-6 рук, предложенную в [1117] (см. рисунки 5 и 6). Можно также использовать нанорешетку, построенную по той же схеме, что и нанорешетка на рисунке 6, но с использованием других наноузлов. Например, можно использовать наноузлы, предложенные в работе [1118] (см. рисунок 7). Отметим, что нанорешетка по типу представленной на рисунке 6 с наноузлами, изображенными на рисунке 7, экспериментально конструировалась (см. [1092], см. также [1089]). Размер одной клетки составляет менее 30 nm в одном измерении. Существует технология программирования клеток этой решетки, которая позволяет, в частности, снизить проницаемость клеток (см. [1119]). Следует также отметить, что наноузлы, изображенные на рисунке 7 имеют четыре последовательности ДНК в сечении на протяжении всей конструкции и на каждом из четырех концов (в отличие от двух у 3-6 руки), что существенно облегчает сцепление полученной из них нанорешетки с другими структурами (см., в частности, [1094]).
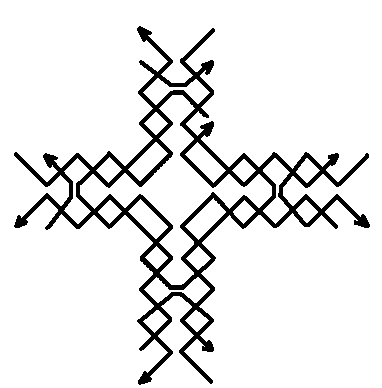
Рис.7. Конструкция наноузла, предложенная в [1118]. С геометрической точки зрения этот наноузел составлен из девяти последовательностей ДНК и получен наложением четырех последовательностей ДНК, изображенных на рисунке 8.а, и пяти последовательностей ДНК, изображенных на рисунке 8.б.
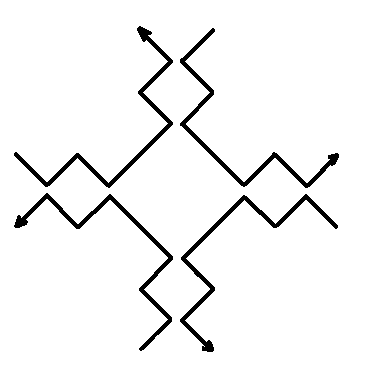
Рис.8.а. Конструктивные элементы нанорешетки, изображенной на рисунке 7.
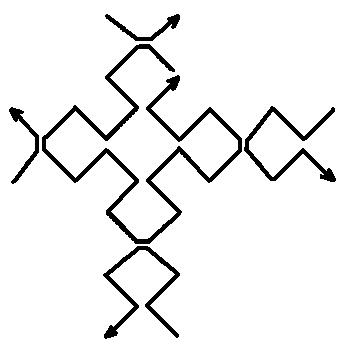
Рис.8.б. Конструктивные элементы нанорешетки, изображенной на рисунке 7.
В качестве остова для конструкции дока можно рассмотреть нанорешетку кубической формы (см., например, [1120]). Например, конструкцию, представленную на рисунке 9.
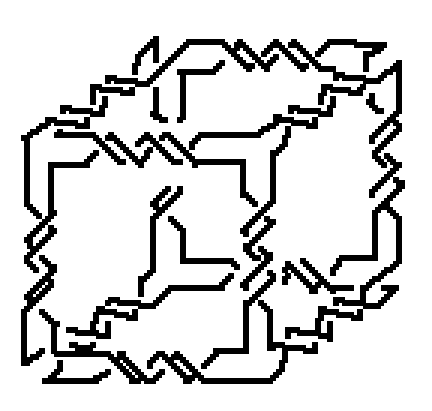
Рис.9. Нанорешетка в форме куба.
Рис.10. Конструктивные элементы нанорешетки, изображенной на рисунке 9.
Еще один подход к организации взаимодействия между молекулами заключается в создании синтетических генных регуляторных сетей, искусственных биологических систем и генетических булевых автоматов, т.е. схем, в рамках которых взаимодействие между генетическими последовательностями поддерживается при помощи простейших устройств (см., например, [1121] – [1149]).
Одна из ключевых проблем нанотехнологий in vivo – распространение процессов между клетками. Хотя на внутриклеточном уровне успехи нанотехнологий довольно существенны, большинство разрабатываемых роботов неспособны перемещаться между клетками. В то же время многие важные для живых систем задачи могут быть решены только при наличии межклеточного взаимодействия. Кроме того, весьма заманчиво выглядит идея размещения наноробота лишь в одной клетке после чего он сам обеспечит свое размножение и распространение по многоклеточному организму.
Один из подходов к решению этой проблемы заключается в использовании вирусов и бактерий в качестве носителей нанороботов. Кроме того, для обеспечения перемещения между клетками и межклеточного обмена сигналами можно попытаться использовать гибридные и неорганические нанороботы. Одним из ключей к решению этой проблемы могут стать коллективные ритмы многоклеточных систем. Феномен коллективных ритмов наблюдается у живых организмов на всех уровнях (см., например, [1150] – [1154]). Период коллективных ритмов может колебаться от доли секунды до нескольких лет. Предложено несколько моделей и теорий, объясняющих феномен коллективных ритмов (см. [1151], [1155] – [1172]). Особое направление составляют вопросы исследования коллективных ритмов подвижных клеток (см. [1158], [1162], [1163], [1168], [1171]). Доказано, что межклеточные сигналы в популяции клеток существенны для глобального обмена информацией как у прокариотов, так и у эукариотов (см. [1173], [1174]). Однако сигнальные системы многоклеточных и одноклеточных организмов существенно отличаются (см. [1156], [1172], [1175]). С точки зрения возможности управления межклеточным обменом информацией представляет интерес тот факт, что у всех подвижных клеток межклеточный обмен информацией осуществляется при помощи специальных сигнальных молекул (см. [1158], [1162], [1163], [1168]).
