«Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
| Вид материала | Автореферат |
- «Российский государственный медицинский университет Федерального агентства по здравоохранению, 975.58kb.
- «Российский государственный медицинский университет Федерального агентства по здравоохранению, 545.1kb.
- «Сибирский государственный медицинский университет Федерального агентства по здравоохранению, 927.55kb.
- Кубанский государственный медицинский университет федерального агентства по здравоохранению, 821.27kb.
- «Казанский государственный медицинский университет Федерального агентства по здравоохранению, 863.64kb.
- «Саратовский государственный медицинский университет имени В. И. Разумовского Федерального, 378.09kb.
- Гепатопротекторные свойства флавоноидов (фармакодинамика и перспективы клинического, 671.3kb.
- «ультразвуковая диагностика кишечной непроходимости» 14. 00. 27 хирургия, 401.81kb.
- «Рязанский государственный медицинский университет имени академика И. П. Павлова Федерального, 241.22kb.
- Программа подготовки аспирантов по кардиологии составили: д м. н., профессор, 643.17kb.
На правах рукописи
УДК 612.43; 591.434
СЛЕСАРЕВ СЕРГЕЙ МИХАЙЛОВИЧ
Эпифизарная и тканевая регуляции
временнÓй организации пролиферации
обновляющихся тканей
03.00.25 – гистология, цитология, клеточная биология
Автореферат
диссертации на соискание ученой степени
доктора биологических наук
Москва
2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» и в Государственном образовательном учреждении высшего профессионального образования «Ульяновский государственный университет» Федерального агентства по образованию
Научные консультанты:
доктор биологических наук, профессор Антохин Александр Иванович
доктор медицинских наук, профессор Хайруллин Радик Магзинурович
Официальные оппоненты:
доктор медицинских наук, профессор Дубовая Татьяна Клеониковна
доктор биологических наук, профессор Доронин Юрий Константинович
доктор биологических наук Григорян Элеонора Норайровна
Ведущая организация:
Московский государственный медико-стоматологический университет
Защита диссертации состоится «___»___________2009 года на заседании диссертационного совета Д 208.072.04 при Российском государственном медицинском университете (117997, Москва, ул. Островитянова, д. 1).
С диссертацией можно ознакомиться в библиотеке Российского госу-дарственного медицинского университета (117997, Москва, ул. Островитянова, д. 1).
Автореферат разослан «____»____________2009 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук, профессор А.И. Щеголев
общая характеристика работы
Актуальность работы. В основе организации живых систем лежит ритмичность их функционирования. Суточная периодичность физиологических процессов представляет собой одно из проявлений многочисленных приспособительных реакций организма, направленных на поддержание его устойчивости. Из всех абиотических факторов стабильно во времени изменяется только продолжительность световóго дня. Поэтому сформировавшиеся в ходе эволюции циркадианные ритмы организмов синхронизированы с продолжительностью фотопериодов. Являясь фундаментальным свойством живой материи, биоритмы проявляются в функционировании всех систем организма. Циркадианные ритмы обладают высокой чувствительностью к различным видам внешних воздействий, а их нарушения могут служить первыми симптомами начинающихся отклонений в жизнедеятельности организма в целом (Хильдебрандт и др., 2006). Десинхроноз может завершаться формированием определенной патологии, а также усугубить течение имеющихся заболеваний, что диктует необходимость изучения биоритмов функционирования различных органов и систем организма, а также факторов и уровней их регуляции (Анисимов, 2007).
Вопрос о суточной периодичности репродукции клеток является частью общей проблемы биологических ритмов. Изучение механизмов формирования циркадианного ритма пролиферации необходимо для понимания процессов онтогенетического развития, физиологической и репаративной регенерации, поддержания структурного гомеостаза тканей, а также определения закономерностей развития злокачественных новообразований. Выяснение хронобиологических особенностей деления клеток и механизмов контроля пролиферации позволяет осуществлять её направленную регуляцию.
По современным представлениям пролиферирующие или потенциально способные к пролиферации клетки и соответствующие механизмы регуляции пролиферации в комплексе составляют пролиферативную систему тканей. Иерархическая структура механизмов регуляции репродукции клеток включает в себя как организменные, так и тканевые регуляторы (Романов, 2000). На организменном уровне формирование циркадианных и сезонных ритмов, в том числе и циркадианного ритма пролиферации, осуществляется при участии эпифиза, продуцирующего гормон мелатонин и комплекс биологически активных пептидов (Арав и др., 2004; Casson et al., 2008). В настоящее время ритмогенную функцию эпифиза связывают с выработкой мелатонина, синтез и секреция которого имеет циркадианный характер (Кветная и др., 2005). Однако вопрос эпифизарной регуляции биоритмов пролиферации до сих пор является дискуссионным, и ряд принципиальных положений всё ещё не находит объяснения. Причина этого кроется, с одной стороны, во множественном характере влияния мелатонина на пролиферацию, затрудняющем анализ его действия, а с другой стороны, в неизученности ритмогенной роли биологически активных пептидов эпифиза.
Основным внутрисистемным регулятором биоритмов митотической активности определенного вида тканей является кейлон-антикейлонная система, представляющая собой всеобщую систему регуляции структурного гомеостаза (Антохин, 1979; Романов, 1984; Смирнов, 1998). Изучение взаимосвязи организменного и тканевого уровней регуляции биоритмов пролиферации имеет существенный теоретический и практический интерес. В ряду нерешенных проблем остается неизученным аспект взаимосвязи эпифизарной и тканевой регуляций биоритмов пролиферации. Механизмы эпифизарной регуляции ритмичности функционирования пролиферативной системы организма и их универсальность для тканей, развивающихся из различных эмбриональных листков не определены.
Цель исследования: установление механизмов эпифизарной регуляции биоритмов пролиферации обновляющихся тканей.
Задачи исследования:
- изучить суточную динамику пролиферации эпителиев пищевода, тощей кишки и клеток герминативного центра лимфатических узелков трахеобронхиальных лимфатических узлов интактных беспородных белых крыс;
- разработать пути анатомического доступа к эпифизу беспородных белых крыс и методику его экстирпации;
- установить влияние эпифизэктомии и последующего введения биологически активных веществ эпифиза (пептидов и мелатонина) эпифизэктомированным беспородным белым крысам на суточную динамику пролиферации эпителиев пищевода, тощей кишки и клеток герминативного центра лимфатических узелков трахеобронхиальных лимфатических узлов;
- исследовать суточную динамику продукции тканевых регуляторов пролиферации интактных беспородных белых крыс;
- определить влияние эпифизэктомии и последующего введения биологически активных пептидов эпифиза эпифизэктомированным беспородным белым крысам на суточную динамику продукции тканевых регуляторов пролиферации;
- выявить взаимосвязь эпифизарной и тканевой регуляций биоритмов пролиферации.
Научная новизна. Впервые установлен универсальный характер эпифизарной регуляции циркадианного ритма пролиферации обновляющихся тканей беспородных белых крыс. Показано, что ткани, развивающиеся из различных эмбриональных листков (эпителии пищевода, тощей кишки и клетки герминативного центра лимфатических узелков трахеобронхиальных лимфатических узлов) утрачивают циркадианный ритм пролиферации после эпифизэктомии и восстанавливают его после введения биологически активных пептидов эпифиза. Впервые выявлено, что эпифиз-эктомия вызывает исчезновение циркадианного ритма продукции тканевых регуляторов пролиферации беспородных белых крыс. Показана регуляторная роль пептидов эпифиза в формировании циркадианного ритма продукции тканевых регуляторов пролиферации (кейлонов и антикейлонов). Впервые установлена взаимосвязь эпифизарной и тканевой регуляций циркадианного ритма пролиферации, которая заключается в синхронизирующем влиянии биологически активных пептидов эпифиза на продукцию тканевых регуляторов пролиферации.
Научно-практическая значимость работы. Выполненное исследование носит фундаментально-прикладной характер и посвящено изучению гуморальной регуляции функционирования различных органов и тканей. В работе представлены данные, с одной стороны, демонстрирующие универсальность эпифизарной регуляции циркадианного ритма пролиферации различных тканей, а с другой, раскрывающие механизм такого влияния. Научно-теоретическая значимость диссертации определяется тем, что полученные данные о роли эпифиза в формировании циркадианного ритма пролиферации существенно расширяют представления о регуляции циркадианных ритмов функций организма в целом. Практическое значение работы заключается в возможности использования полученных данных для разработки методов применения биологически активных пептидов эпифиза в клинической практике с целью коррекции нарушений пролиферативных процессов, стимулирования регенерации, коррекции десинхронозов. Особое значение приобретает установленный в ходе исследования факт недостаточности однократного в течение суток введения мелатонина для формирования суточного ритма пролиферации, что указывает на необходимость создания форм пролонгированного действия мелатонина. Разработаны пути анатомического доступа к эпифизу беспородных белых крыс и методика его экстирпации. Предлагаемый метод является хирургическим методом удаления эпифиза у беспородных белых крыс и других грызунов. Метод позволяет прооперировать в сжатые сроки значительное количество животных, надежен и не сложен в исполнении, что определяет возможность его широкого использования в хронобиологических исследованиях. На основе методов спектрального анализа и наименьших квадратов разработаны компьютерные программы для выявления биоритмов пролиферации и определения их периодов, которые могут быть использованы для выявления периодических процессов в любых биологических системах. Результаты исследования могут быть внедрены в учебный процесс при преподавании дисциплин медико-биологического профиля, включающих разделы «Цитология», «Эндокринная система».
Основные положения, выносимые на защиту
- Эпифизарная регуляция циркадианного ритма пролиферации является универсальной для обновляющихся тканей беспородных белых крыс при сохраняющейся органной специфичности.
- Эпиталамин, как препарат комплекса биологически активных пептидов эпифиза восстанавливает циркадианный ритм пролиферации обновляющихся тканей (эпителиев пищевода, тощей кишки и клеток герминативного центра лимфатических узелков трахеобронхиальных лимфатических узлов) беспородных белых крыс после эпифизэктомии.
- Эпифизэктомия вызывает исчезновение циркадианного ритма продукции тканевых регуляторов пролиферации (кейлонов и антикейлонов) беспородных белых крыс при сохраняющемся ультрадианном ритме их продукции.
- Введение биологически активных пептидов эпифиза (эпиталамина) эпифизэктомированным беспородным белым крысам приводит к восстановлению циркадианного ритма продукции тканевых регуляторов пролиферации (кейлонов и антикейлонов).
- Предложенный анатомический доступ к эпифизу беспородных белых крыс и разработанный на его основе метод эпифизэктомии является оптимальным для использования в хронобиологических исследованиях.
Внедрение результатов исследования в практику. Результаты исследования используются в учебном процессе при обучении студентов специальностей “Лечебное дело”, “Педиатрия”, “Стоматология”, “Сестринское дело”, “Медицинская биохимия”, “Медицинская биофизика”, “Медицинская кибернетика” в преподавании дисциплин медико-биологического профиля: “Гистология, эмбриология, цитология”, “Анатомия человека”, “Биология” на кафедре биологии медико-биологического факультета Российского государственного медицинского университета, кафедре гистологии, цитологии и эмбриологии Ярославской государственной медицинской академии, кафедре анатомии и гистологии Белгородского государственного университета, кафедре гистологии Башкирского государственного медицинского университета. Результаты диссертационной работы внедрены также в работу лаборатории эмбрионального гистогенеза ГУ НИИ морфологии человека РАМН.
Апробация работы. Основные положения и результаты диссертационного исследования представлены на V и VI международных научно-технических конференциях “Математическое моделирование физических, экономических, технических, социальных систем и процессов” (Ульяновск, 2003, 2005), Всероссийской научной конференции “Гистологическая наука России в начале XXI века: итоги, задачи, перспективы” (Москва, 2003), V Всероссийской научно-технической конференции “Современные проблемы математики и естествознания” (Нижний Новгород, 2003), выездном пленуме НОГР “Новые горизонты гастроэнтерологии” (Новосибирск, 2004), VII интернациональном конгрессе морфологии позвоночных (Флорида, 2004), II международном симпозиуме “Проблемы ритмов в естествознании” (Москва, 2004), V общероссийском съезде анатомов, гистологов и эмбриологов (Казань, 2004), VIII конгрессе международной ассоциации морфологов (Орел, 2006), Всероссийской конференции с международным участием “Медико-физиологические проблемы экологии человека” (Ульяновск, 2007), научно-практической конференции, посвященной 45-летию образования Медико-биологического факультета РГМУ “Медико-биологические науки для теоретической и клинической медицины” (Москва, 2008), международной научно-практической конференции “Актуальные вопросы аграрной науки и образования. Новое в морфологии живых организмов (норма и патология)” (Ульяновск, 2008), международной научно-практической конференции “Аграрная наука и образование на современном этапе развития. Актуальные вопросы ветеринарной медицины, биологии и экологии” (Ульяновск, 2009), III съезде Российского общества патологоанатомов (Самара, 2009) и на совместной научно-практической конференции кафедры биологии Медико-биологического факультета, кафедры биологии педиатрического факультета, кафедры морфологии Медико-биологического факультета, кафедры эндокринологии факультета усовершенствования врачей, лаборатории медицинских клеточных технологий, лаборатории молекулярной и клеточной биологии Российского государственного медицинского университета, кафедры общей биологии экологического факультета, кафедры морфологии медицинского факультета и кафедры анатомии человека медицинского факультета Ульяновского государственного университета.
Публикации. По материалам диссертации опубликовано 33 научные работы, в том числе 10 в рецензируемых научных журналах, рекомендованных ВАК; 1 монография.
Объем и структура диссертации. Диссертационная работа изложена на 281 странице машинописного текста, состоит из введения, обзора литературы, описания материала и методов исследования, результатов собственного исследования и их обсуждения, выводов, практических рекомендаций. Список литературы содержит 420 работ, в том числе 225 отечественных и 195 зарубежных авторов. Диссертация иллюстрирована 132 рисунками (фотографии, графики, фазограммы) и 34 таблицами.
Содержание работы
Материал и методы исследования
Материал исследования. Эксперименты выполнены на 670 самцах беспородных белых крыс массой 160-200 г и 80 самцах беспородных белых мышей массой 18-22 г. В соответствии с правилами GCP диссертационная работа прошла этическую экспертизу и была одобрена этическим комитетом ГОУ ВПО РГМУ Росздрава (протокол №81 от 23 июня 2008 года). Распределение животных в экспериментальных группах показано в таблице 1.
Животные в течение 20 дней адаптировались к режиму освещенность:темнота=12:12 (освещение с 6 до 18 часов). На всем протяжении опыта доступ к пище и воде был свободным. Принимая во внимание данные литературы, в схему эксперимента не были включены группы ложнооперированных, а также интактных животных, которым вводили биологически активные вещества эпифиза (Арушанян и др., 1993; Хавинсон, 2001; Перцов, 2006; Abbasoglu et al., 1995). Исследования проводились на 40-й день после эпифизэктомии, в период, когда происходило полное заживление раны и оперированные животные не отличались от интактных.
Для изучения роли биологически активных веществ эпифиза в формировании биоритмов пролиферации, эпифизэктомированным животным ежедневно с 26-го по 41-й день после эпифизэктомии в 18 часов (время смены фоторежима со световой фазы на темновую) подкожно вводили мелатонин (10 мг/кг), эпиталамин (2,5 мг/кг), одновременно эпиталамин
(2,5 мг/кг) и мелатонин (10 мг/кг). Кроме того, 50-ти эпифизэктомированным животным подкожно вводили эпиталамин (2,5 мг/кг) в 6 часов (время смены фоторежима с темновой фазы на световую). Эпиталамин – препарат полипептидной природы, очищенный от индоламинов, получаемый путем экстракции из эпиталамо-эпифизарной области мозга крупного рогатого скота. Для изучения роли эпифиза в формировании биоритмов продукции тканевых регуляторов пролиферации, одной группе эпифизэктомированных животных ежедневно с 26-го по 41-й день после эпифизэктомии в
18 часов подкожно вводили эпиталамин (2,5 мг/кг). Второй группе эпифиз-эктомированных животных подкожно вводили эпиталамин (2,5 мг/кг) в 6 часов. При выборе доз руководствовались соответствующими данными литературы (Батурин и др., 1990; Lewinski et al., 1991; Anisimov et al., 2000).
Таблица 1
Распределение животных в экспериментальных группах
| Серия экспериментов | Экспериментальная группа | Число животных |
| 1. Исследование роли эпифиза в формировании биоритмов пролиферации обновляющихся тканей. | 1. Интактные контрольные. 2. Эпифизэктомированные. 3.Эпифизэктомированные с последующей инъекцией мелатонина. 4. Эпифизэктомированные с последующей инъекцией пептидов эпифиза. 5. Эпифизэктомированные с последующей одновременной инъекцией пептидов эпифиза и мелатонина. | 90 90 90 90+50 60 |
| 2. Исследование роли эпифиза в формировании биоритмов продукции тканевых регуляторов пролиферации. | 1. Интактные контрольные. 2. Эпифизэктомированные. 3. Эпифизэктомированные с последующей инъекцией пептидов эпифиза. | 50 50 50+50 |
| 3. Оценка биологической активности кейлон-антикейлон-ных препаратов. | 1. Животные, получавшие кейлон-анти-кейлонный препарат, выделенный у интактных контрольных крыс. 2. Животные, получавшие кейлон-анти-кейлонный препарат, выделенный у эпифизэктомированных крыс. 3. Животные, получавшие кейлон-анти-кейлонный препарат, выделенный у эпифизэктомированных с последующей инъекцией пептидов эпифиза крыс. | 20 20 20+20 |
Выведение животных из эксперимента производили под эфирным наркозом на 40 – 41-й день после эпифизэктомии через каждые три часа. Исследование роли эпифиза в регуляции биоритмов пролиферации обновляющихся тканей проводили в течение двух суток. Исследование роли эпифиза в формировании биоритмов продукции тканевых регуляторов пролиферации интактных, эпифизэктомированных и эпифизэктомированных с последующим введением пептидов эпифиза животных проводили в течение суток. Влияние утреннего (6 часов) введения пептидов эпифиза эпифизэктомированным животным на формирование циркадианного ритма пролиферации также изучалось в течение суток.
Методика эпифизэктомии.

 Исследование биологической роли эпифиза базируется преимущественно на двух экспериментальных подходах – полной или частичной эпифизэктомии и введении в организм биологически активных веществ эпифиза. В некоторых работах эффект “функциональной эпифизэктомии” достигается путем содержания животных в условиях круглосуточного освещения, что вызывает нарушение биоритмов активности ферментных систем эпифиза и, как следствие, нарушение биоритмов продукции основных его гормонов (Бекчанов и др., 1998). Вместе с тем данный метод не позволяет полностью исключить влияние биологически активных веществ эпифиза на организм. Проводимая рядом исследователей электрокоагуляция пинеальной железы не может гарантировать полного её разрушения (Арушанян и др., 1993), поэтому более надежными следует признать хирургические методы её удаления, которые и получили наиболее широкое распространение (Ованесов, 1987; Хавинсон и др., 2000).
Исследование биологической роли эпифиза базируется преимущественно на двух экспериментальных подходах – полной или частичной эпифизэктомии и введении в организм биологически активных веществ эпифиза. В некоторых работах эффект “функциональной эпифизэктомии” достигается путем содержания животных в условиях круглосуточного освещения, что вызывает нарушение биоритмов активности ферментных систем эпифиза и, как следствие, нарушение биоритмов продукции основных его гормонов (Бекчанов и др., 1998). Вместе с тем данный метод не позволяет полностью исключить влияние биологически активных веществ эпифиза на организм. Проводимая рядом исследователей электрокоагуляция пинеальной железы не может гарантировать полного её разрушения (Арушанян и др., 1993), поэтому более надежными следует признать хирургические методы её удаления, которые и получили наиболее широкое распространение (Ованесов, 1987; Хавинсон и др., 2000). С учетом вышеизложенного, а также на основе анализа существующих методических приемов нами был разработан оригинальный метод эпифизэктомии. Основные результативные исследования были выполнены на основе указанного метода. Предлагаемый нами метод является хирургическим методом удаления эпифиза у белых крыс и других грызунов. Наркоз осуществляли путем внутрибрюшинного введения тиопентала натрия в дозе 50 мг/кг. Голова животного жестко фиксировалась на операционном столике за ушные проходы и верхнюю челюсть. В области предполагаемого разреза кожи удаляли шерстный покров, а освобожденную поверхность дезинфицировали этиловым спиртом. В области срединной линии головы производили разрез кожи длинной 1,5 см. После обнажения крыши черепа в межтеменной кости на расстоянии 4 мм каудальнее от пересечения сагиттального и теменно-межтеменного швов высверливали отверстие диаметром 3 мм, в которое затем вводили препаровальную иглу и рассекали твердую мозговую оболочку. Удаление эпифиза осуществляли путем резекции участка межтеменной и теменных костей с подлежащим эпифизом (рис.1). С целью предотвращения последующего сращения соединительной ткани с тканью мозга на отверстие в костях крыши черепа накладывалась стерильная вощеная бумага, после чего рана зашивалась.

Рис. 1. Операционное поле. 1 – костный лоскут с эпифизом
Контроль удаления эпифиза осуществлялся визуально (рис.2). Эпифизэктомированных животных продолжали содержать при режиме освещенность:темнота = 12:12 (освещение с 6 до 18 часов).
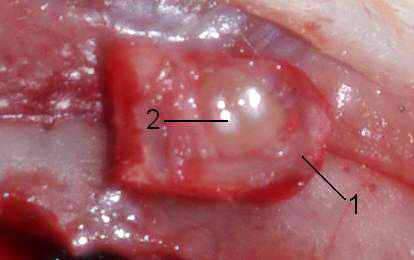
Рис. 2. Костный лоскут с эпифизом. 1 – костный лоскут; 2 - эпифиз
Существующие хирургические методы эпифизэктомии занимают больше времени, т.к. непосредственное удаление эпифиза производится после удаления костного лоскута и остановки кровотечения. В предложенном нами методе удаление участка кости с подлежащим эпифизом производится одновременно, а затем осуществляется остановка кровотечения. Во время остановки кровотечения проводится эпифизэктомия у следующего животного.
В хронобиологических исследованиях используется большое количество животных, эпифизэктомия у которых должна производиться за короткий промежуток времени. Это невозможно выполнить существующими методами эпифизэктомии. Предлагаемый нами метод позволяет проводить до 50 операций в день, оперируя за две недели до 500 животных. Выживаемость животных после операции составила 60%. Таким образом, предлагаемый метод эпифизэктомии является оптимальным для использования в хронобиологических исследованиях.
Модели изучения биоритмов пролиферации. В качестве моделей для изучения роли эпифиза в формировании биоритмов пролиферации были выбраны эпителии пищевода и крипт тощей кишки, а также клетки герминативного центра лимфатических узелков трахеобронхиальных лимфатических узлов, которые являются классическими моделями изучения физиологической регенерации.
Определение антирадикальной активности кейлон-антикейлонной системы печени. В качестве модели для изучения роли эпифиза в формировании биоритмов продукции тканевых регуляторов пролиферации служила печень белых крыс. Антирадикальная активность кейлон-антикейлонной системы печени изучалась у интактных (n=50), эпифизэктомированных (n=50) и эпифизэктомированных с последующей инъекцией пептидов эпифиза (n=100) животных. Последним вводили пептиды эпифиза в 6 (n=50) или 18 часов (n=50). После декапитации и вскрытия беспородных белых крыс извлеченную печень замораживали в жидком азоте и хранили в морозильной камере. Для получения комплексных экстрактов печеночных кейлона и антикейлона доли печени очищали от соединительнотканной капсулы, а ткань гомогенизировали. Дистиллированной водой из ткани печени извлекали водорастворимые компоненты, которые подвергали центрифугированию и спиртовому фракционированию охлажденным до +40С этанолом. Использовалась фракция, полученная при осаждении между 70 и 87% насыщения. Антирадикальную активность препаратов определяли на модифицированном хемилюминометре
ХЛМ 1Ц-01 (Пашков, 1991) по степени гашения хемилюминесценции в системе, генерирующей свободные радикалы и выражали в условных единицах на 1 мг белка. Получение препаратов и определение их антирадикальной активности проводили на базе кафедры биологии с экологией Воронежской государственной медицинской академии им. Н.Н. Бурденко (зав. – профессор А.Н. Пашков). Для концентрирования и хранения кейлон-антикейлонных препаратов их лиофилизировали.
Для исследования биологических свойств кейлон-антикейлонных препаратов лиофилизированные фракции, полученные от крыс, декапитированных в дневные и ночные часы, вводили частично гепатэктомированным мышам внутрибрюшинно однократно в 18 часов. Выбор оптимальной дозы (5 мг/мышь) осуществляли на основе анализа данных литературы (Смирнов, 1998). Животных предварительно подвергали частичной гепатэктомии под эфирным наркозом по общепринятой методике (Stewart, 1979). В эксперименте использовались кейлон-антикейлонные препараты печени, полученные от крыс, декапитированных в 2100, 2400, 300 (группа 1) и 900, 1200, 1500 (группа 2). Контролем служили частично гепатэктомированные животные. На гистологических препаратах, окрашенных гематоксилин-эозином, осуществляли подсчет фигур митоза на 5000 гепатоцитов и выражали в ‰.
Гистологическая техника. Для исследования брали среднюю треть пищевода, проксимальный участок тощей кишки и трахеобронхиальные лимфатические узлы. Органы фиксировали в течение 1 часа в жидкости Карнуа, обезвоживали в спиртах и заключали в парафин. Серийные срезы пищевода и тощей кишки окрашивали гематоксилин-эозином. Срезы лимфатических узлов окрашивали пиронином-метиловым зеленым по Браше с докраской гематоксилином. Окрашенные срезы заключали в канадский бальзам.
Учет количества делящихся клеток производили в базальном слое многослойного плоского неороговевающего эпителия пищевода, концевых отделах продольно срезанных крипт тощей кишки на участке размером в 25 клеток с каждой стороны крипты от её дна и герминативном центре лимфатического узелка трахеобронхиальных лимфатических узлов. Митотический индекс (МИ) в промилле вычисляли как отношение количества делящихся клеток к 5000 изученных клеток эпителия пищевода, 1000 клеток эпителия тощей кишки и 2000 клеток герминативного центра. Статистическую обработку результатов проводили с использованием метода Фишера – Стьюдента.
Выявление и характеристика биоритмов. Выявление биоритмов пролиферации и продукции тканевых регуляторов деления клеток, а также определение их периодов осуществлялось методом наименьших квадратов и спектральным анализом значений МИ или антирадикальной активности. Компьютерные программы данных методов разработаны совместно с сотрудниками кафедр прикладной математики (д.ф.-м.н., профессор А.А. Бутов, к.ф.-м.н., доцент И.А. Санников) и теоретической физики (д.ф.-м.н., профессор В.М. Журавлев) Ульяновского государственного университета. Анализ циркадианных ритмов пролиферации обновляющихся тканей и антирадикальной активности кейлон-антикейлонной системы печени беспородных белых крыс проводили с использованием графически-параметрического метода (Романов и др., 1979; Филиппович, 1980).
