Магазины электрических величин
| Вид материала | Документы |
- Рабочей программы дисциплины Электроэнергетические системы и сети по направлению подготовки, 21.71kb.
- Отчет по лабораторной работе должен содержать: наименование работы и номер, схемы, 365.83kb.
- Экзаменационные вопросы по курсу «Электротехника и электроника», 23.91kb.
- Бизнес-план магазина товаров для детей Содержание, 138.19kb.
- 1. Основные понятия и обозначения электрических величин и элементов электрических цепей., 277.03kb.
- Цифровой вольтметр щ-304, 137.06kb.
- Телемеханики, 26.01kb.
- Отдел метрологического обеспечения измерений электрических величин, 42.58kb.
- Курсовая работа по курсу «основы физических измерений», 226.86kb.
- Теория электрических цепей (часть, 63kb.
МОЛЕКУЛЯРНЫЕ И АТОМНЫЕ ПУЧКИ, направленные потоки молекул или атомов, движущихся в вакууме практически без столкновения друг с другом и с молекулами остаточных газов. М. и а. п. позволяют изучить свойства отд. ч-ц, пренебрегая эффектами, обусловленными столкновениями, кроме тех случаев, когда сами столкновения явл. объектом исследований. В 1911 франц. физик Л. Дюнуайе продемонстрировал прямолинейный пролёт в вакууме атомов Na. Позднее нем. физик О. Штерн с сотрудниками использовал М. и а. п. для измерения скорости молекул и эффективных сечений их соударений друг с другом, а также для исследования явлений, обусловленных электронными спинами и магн. моментами ат. ядер. В 1937 амер. физик И. Раби использовал М. и а. п. в резонансных экспериментах вначале для измерения магн. моментов ядер, а затем для измерения различных характеристик молекул, атомов и ядер. Источник М. и а. п.— камера, соединённая с высоковакуумным объёмом отверстием или узким капилляром

Рис. 1. Схема опыта для изучения хим. реакции, происходящей при пересечении пучка атомов водорода с пучком молекул К2. Т.к. вольфрамовый детектор одинаково чувствителен к молекулам К2 и КОН, а платиновый — менее чувствителен к КОН, то, комбинируя оба детектора, можно различать эти молекулы.
(рис. 1). Исследуемые молекулы или атомы вводятся в камеру в виде газа или пара при давлении неск. мм рт. ст. Давление газа должно быть достаточно малым, чтобы ср. длина l свободного пробега ч-ц внутри источника равнялась диаметру соединит. отверстия или была несколько больше него. В этом случае ч-цы вылетают из источника независимо друг от друга (в случае капилляра l должна быть соизмерима также с длиной капилляра). Чрезмерное увеличение l за счёт уменьшения давления в источнике, не улучшая существенно св-в М. и а. п., уменьшает их интенсивность. Для увеличения интенсивности пучков применяют источники с неск. отверстиями или капиллярами, расстояния между к-рыми должны быть несколько больше их диаметра. Соударения с ч-цами остаточного газа разрушают М. и а. п. Длина М. и а. п. в идеальном вакууме была бы чрезвычайно велика, т. к. возможны были бы только соударения «догона».
М. и а. п. дают возможность изучать отд. акты столкновения между двумя ч-цами (в отличие от хим. и газодинамич. методов, в к-рых из-за множеств. столкновений ч-ц друг с другом наблюдаются лишь усреднённые эффекты). Измеряются сечения упругих и неупругих соударений ч-ц, встречающихся под разными углами и при разных скоростях (рис. 1), наблюдаются хим. реакции между ч-цами и изучается угловое и энергетич. распределение продуктов реакции. Иногда сталкивающиеся пучки предварительно поляризуют или, наоборот, измеряют появляющуюся поляризацию.
В р е з о н а н с н ы х э к с п е р и м е н т а х (метод Раби) ч-цы, вылетая из источника в вакуум (10-7 мм рт. ст. или 10-5 Па), пролетают через неоднородное магн. поле H1 искривляющее их траекторию (рис. 2),
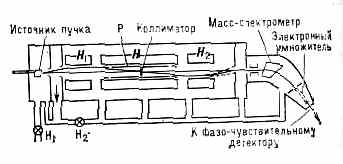
Рис. 2. Схема эксперимента по наблюдению магн. резонанса в мол. пучке. Пролёт ч-цы через прибор определяется по искривлению её траектории; отклонения увеличены относительно типичных размеров прибора (длина прибора 3 м, макс. поперечное сечение 0,01 см); Р — резонатор, в к-ром возбуждается эл.-магн. поле резонансной частоты; H1 — форвакуумный насос; Н2 — высоковакуумный насос.
что обусловлено вз-ствием их магн. моментов с неоднородным магн. полем. Далее ч-цы пролетают через коллиматор . и попадают в область детектора, где неоднородное магн. поле H2 компенсирует искривления их траекторий. Конфигурации полей H1 и Н2 в точности противоположны. Для идентификации молекул их пропускают через масс-спектрометр, после чего они регистрируются электронным умножителем, соединённым с детектором. При плавном изменении частоты колебаний эл.-магн. поля в зазоре магнита Н, создающего однородное магн. поле, измеряют интенсивность пучка, регистрируемого детектором; =0(ξ2-ξ1)/ћ (где ξ1 и ξ2 -уровни энергии молекул). Молекулы под действием эл.-магн. поля, возбуждаемого в резонаторе Р, могут переходить из состояния с энергией ξ1 в состояние с энергией ξ2 и обратно. Если по магн. св-вам состояния ξ1 и ξ2 различны, то поле Н2 не компенсирует отклонение, вызванное полем Н1 для части молекул, испытавших переход. Эти молекулы движутся по траектории, показанной пунктиром. При =0 интенсивность, регистрируемая детектором, имеет минимум. По величине 0 определяют разность энергий уровней ξ1 и ξ2 исследуемых молекул.
Если изменения траектории обусловлены вз-ствием электрич. моментов молекул с неоднородными электрич. полями, квант. переходы вызваны колебаниями электрич. поля в резонаторе (см. Параэлектрический
434
резонанс). Применяется также сочетание обоих методов, напр. однородное пост. электрич. поле используют в экспериментах с магн. резонансом, а однородное магн. поле в опытах с параэлектрич. резонансом.
Резонансные эксперименты дали большое количество информации о строении молекул, атомов и ат. ядер. Были измерены спины, магн. дипольные и электрич. квадрупольные моменты ядер. В частности, был обнаружен электрический квадрупольный момент дейтрона, исследована тонкая структура ат. спектров, в результате чего был открыт лэмбовский сдвиг. Измерение постоянной тонкой структуры дало пока единств. доказательство существования у ядер электрич. октупольных моментов. Были измерены вращат. магн. моменты и электрич. дипольные моменты молекул, энергия вз-ствия ядерных магн. моментов с вращат. магн. моментами молекул, зависимость электрич. и магн. свойств от ориентации молекул; квадрупольные моменты молекул, энергия межъядерных магн. вз-ствий в молекулах и др. Частота колебаний, соответствующая линиям сверхтонкой структуры магнитного резонанса в М. п а. п.,— основа для определения секунды в пассивных квантовых стандартах частоты.
М. и а. п. позволяют накапливать ч-цы с более высокой энергией и создавать инверсию населённостей (см. Молекулярный генератор). Генератор на пучке атомов водорода использовался как для исследования атома водорода, так и для создания активного квант. стандарта частоты.
• Смит К. Ф., Молекулярные пучки, пер. с англ., М., 1959; Р а м з а й Н., Молекулярные пучки, пер. с англ., М., 1960; English T.C., Zorn J. С., Molecular beam spectroscopy, в кн.; Methods of experimental physics, 2 ed., v. 3, N. Y., 1974.
Н. Ф. Рамзай.
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ, кристаллы, образованные из молекул, связанных друг с другом слабыми ван-дер-ваальсовыми силами или водородной связью (см. Межмолекулярное взаимодействие, Межатомное взаимодействие). Внутри молекул между атомами действует более прочная, обычно ковалентная связь. Фазовые превращения М. к.: плавление, возгонка, полиморфные переходы (см. Полиморфизм) — происходят, как правило, без разрушения отд. молекул. Большинство М . к.— кристаллы органич. соединений (нафталин и др.). М. к. образуют также нек-рые простые в-ва (Н2, галогены, N2, O2, S8), бинарные соединения типа СО2, металлоорганич. соединения и нек-рые комплексные соединения. К М. к. относятся и кристаллы мн. полимеров, в т. ч. кристаллы белков и нуклеиновых кислот (см. Биологические кристаллы). Особым случаем М. к. явл. кристаллы отвердевших благородных газов, в к-рых ван-дер-ваальсовы силы связывают между собой не молекулы, а
атомы. Для М. к. характерны низкие темп-ры плавления (от —150 до -350 °С), большие коэфф. теплового расширения, большая сжимаемость, малая твёрдость. Большинство М. к. при обычной темп-ре — диэлектрики, нек-рые М. к. (напр., органич. красители) — полупроводники.
• Китайгородский А. И., Молекулярные кристаллы, М., 1971. См. также лит. при ст. Кристаллохимия.
П. М. Зоркий.
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ, спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам. Типичные М. с.— полосатые, они наблюдаются в виде совокупности более или менее узких полос в УФ, видимой и ИК областях спектра; при достаточной разрешающей способности спектральных приборов мол. полосы распадаются на совокупность тесно расположенных линий. Структура М. с. различна для разл. молекул и усложняется с увеличением числа атомов в молекуле. Видимые и УФ спектры весьма сложных молекул сходны между собой и состоят из немногих широких сплошных полос. М. с. возникают при квантовых переходах между уровнями энергии ξ' и ξ" молекул согласно соотношению:
hv=ξ'-ξ", (1)
где hv — энергия испускаемого или поглощаемого фотона частоты v. При КРС hv равна разности энергий падающего и рассеянного фотонов. М. с. гораздо сложнее атомных спектров, что определяется большей сложностью внутр. движений в молекуле, т. к. кроме движения эл-нов относительно двух и более ядер в молекуле происходит колебат. движение ядер (вместе с окружающими их внутр. эл-нами) около положения равновесия и вращат. движения её как целого. Электронному, колебат. и вращат. движениям молекулы соответствуют три типа уровней энергии ξэл, ξкол и ξвр н три типа М. с.
Согласно квант. механике, энергия всех видов движения в молекуле может принимать только определённые значения (квантуется). Полная энергия молекулы ξ приближённо может быть представлена в виде суммы квантованных значений энергий, соответствующих трём видам её внутр. движений:
ξξэл +ξкол+ξвр, (2) причём по порядку величины
ξэл:ξкол:ξвр = 1: m/M:m/M, (3)
где т — масса эл-на, а М имеет порядок массы ядер атомов в молекуле, т.е. m/M~10-5—10-3, следовательно:
ξэл >> ξкол >>ξвр. (4) Обычно ξэл порядка неск. эВ (сотен кДж/моль), ξкол ~ 10-2—10-1 эВ, ξвр~10-5—10-3 эВ.
Система уровней энергии молекулы характеризуется совокупностями далеко отстоящих друг от друга электронных уровней энергии (разл. ξэл при ξкол=ξвр=0). расположенных значительно ближе друг к другу колебательных уровней (разл. ξкол при заданном ξэл и ξвр=0) и ещё более близких друг к другу вращательных уровней (значения ξвр при заданных ξэл
и ξкол).
Электронные уровни энергии а к б
на рис. 1 соответствуют равновесным конфигурациям молекулы. Каждому электронному состоянию соответствует определённая равновесная конфигурация и определённое значение ξэл; наименьшее значение соответствует осн. электронному состоянию (осн. электронный уровень энергии молекулы).

Рис. 1. Схема Уровней энергии двухатомной молекулы, а и б — электронные уровни; v' и v" — квант. числа колебат. уровней; J' и J" — квант. числа вращат. уровней.
Набор электронных состояний молекулы определяется св-вами её электронной оболочки. В принципе значения ξэл можно рассчитать методами квант. химии, однако эта задача решается только приближённо и для сравнительно простых молекул. Важную информацию об электронных уровнях молекул (их расположении и их хар-ках), определяемую её хим. строением, получают, изучая М. с.
Весьма важная хар-ка электронного уровня энергии — значение квантового числа 5, определяющего абс. величину полного спинового момента всех эл-нов. Химически устойчивые молекулы имеют, как правило, чётное число эл-нов, и для них 5 = 0, 1, 2, . . .; для осн. электронного уровня типично 5=0, для возбуждённых — 5 = 0 и 5=1. Уровни с S=0 наз. синглетными, с S=1 — триплетными (т. к. их мулътиплетность =2S+1=3).
В случае двухатомных и линейных трёхатомных молекул электронные уровни характеризуются значением квант. числа Л, определяющего абс. величину проекции полного орбитального момента всех эл-нов на ось молекулы. Уровни с =0, 1, 2, ...
435
обозначаются соответственно , П, , . . ., а и указывается индексом слева вверху (напр., 3, 2П). Для молекул, обладающих центром симметрии (напр., СО2, СН6), все электронные уровни делятся на чётные и нечётные (g и u соответственно) в зависимости от того, сохраняет или нет определяющая их волновая функция знак при обращении в центре симметрии.
Колебательные уровни энергии можно найти квантованием колебат. движения, к-рое приближённо считают гармоническим. Двухатомную молекулу (одна колебат. степень свободы, соответствующая изменению межъядерного расстояния r) можно рассматривать как гармонич. осциллятор, квантование к-рого даёт равноотстоящие уровни энергии:
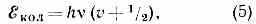
где v — осн. частота гармонич. колебаний молекулы, v=0, 1, 2, . . .— колебат. квант. число.
Для каждого электронного состояния многоатомной молекулы, состоящей из N3 атомов и имеющей f Колебат. степеней свободы (f=3N-5 и f=3N-6 для линейных и нелинейных молекул соответственно), получается / т. н. нормальных колебаний с частотами vi(ill, 2, 3, . . ., f) и сложная система колебат. уровней энергии:
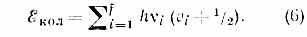
Набор частот норм. колебаний в осн. электронном состоянии явл. важной хар-кой молекулы, зависящей от её хим. строения. В определённом норм. колебании участвуют либо все атомы молекулы, либо их часть; атомы совершают гармонич. колебания с одинаковой частотой vi, но с разл. амплитудами, определяющими форму колебания. Норм. колебания разделяют по форме на валентные (изменяются длины хим. связей) и деформационные (изменяются углы между хим. связями — валентные углы). Для молекул низшей симметрии (см. Симметрия молекулы) f=2 и все колебания невырожденные; для более симметричных молекул имеются дважды и трижды вырожденные колебания, т. е. пары и тройки совпадающих по частоте колебаний.
Вращательные уровни энергии можно найти квантованием вращат. движения молекулы, рассматривая её как тв. тело с определёнными моментами инерции. В случае двухатомной или линейной трёхатомной молекулы её энергия вращения ξвр=М2/2I, где I — момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М — вращат. момент кол-ва движения. Согласно правилам
квантования, M2=(h/4pi2)J(J+1), где
f=0, 1,2,. . .— вращательное квант. число; для ξвр получаем:
ξвр=(h2/8pi2I)J(J+1) = hBJ(J+1), (7)
где вращат. постоянная В=(h/8piI2)I
определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний.
Разл. типы М. с. возникают при разл. типах переходов между уровнями энергии молекул. Согласно (1) и (2):
ξ=ξ'-ξ"==ξэл+ξкол+ξвр,
причём аналогично (4) ξэл>>ξкол>>ξвр. При ξэл0 получаются электронные М. с., наблюдаемые в видимой и УФ областях. Обычно при ξ0 одновременно ξкол0 и ξвр0; разл. ξкол при заданном ξэл соответствуют разл. колебат. полосы (рис. 2), а разл. ξвр при заданных ξэл и ξкол отд. вращат. линии, на к-рые распадаются колебат. полосы (рис. 3).

Рис. 2. Электроино-колебат. спектр молекулы N2 в близкой УФ области; группы полос соответствуют разл. значениям v= v'-v".
Совокупность полос с заданным ξэл (соответствующих чисто электронному переходу с частотой эл=ξэл/h) наз. системой полос; полосы обладают разл. интенсивностью в зависимости от относит. вероятностей переходов (см. Квантовый переход).

Рис. 3. Вращат. расщепление электронно-колсбат. полосы 3805,0 Å молекулы N2.
Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу; могут накладываться друг на друга и неск. таких полос. Характерные дискретные электронные спектры наблюдаются в замороженных р-рах органич. соединений.
Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются с помощью спектральных приборов со стеклянной (видимая область) и кварцевой (УФ область, см. Ультрафиолетовое излучение) оптикой. При ξэл = 0, а ξкол0 получаются колебат. М. с., наблюдаемые в ближней ИК области обычно в спектрах поглощения и КРС. Как правило, при заданном ξкол ξвр 0 и
колебат. полоса распадается на отд. вращат. линии. Наиболее интенсивны в колебат. М. с. полосы, удовлетворяющие условию v=v'- v"=1 (для многоатомных молекул vi=v'i- v"i=1 при vk=v'k-v"k=0; здесь i и k определяют разл. нормальные колебания). Для чисто гармонич. колебаний эти правила отбора выполняются строго; для ангармонич. колебаний появляются полосы, для к-рых v>1 (обертоны); их интенсивность обычно мала и убывает с увеличением v. Колебат. М. с. (точнее, колебательно-вращательные) изучают с помощью ИК спектрометров и фурье-спектрометров, а спектры КРС — при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения. При ξэл=0 и ξкол=0 получаются чисто вращат. спектры, состоящие из отд. линий. Они наблюдаются в спектрах поглощения в далёкой ИК области и особенно в микроволновой области, а также в спектрах КРС. Для двухатомных, линейных трёхатомных молекул и достаточно симметричных нелинейных молекул эти линии равноотстоят (в шкале частот) друг от друга.
Чисто вращат. М. с. изучают с помощью ИК спектрометров со спец. дифракц. решётками (эшелеттами), фурье-спектрометров, спектрометров на основе лампы обратной волны, микроволновых (СВЧ) спектрометров (см. Субмиллиметровая спектроскопия, Микроволновая спектроскопия), а вращат. спектры КРС — с помощью светосильных спектрометров.
Методы молекулярной спектроскопии, основанной на изучении М. с., позволяют решать разнообразные задачи химии. Электронные М. с. дают информацию об электронных оболочках, возбуждённых уровнях энергии и их хар-ках, об энергии диссоциации молекул (по схождению уровней энергии к границе диссоциации). Исследование колебат. спектров позволяет находить характеристические частоты колебаний, соответствующие наличию в молекуле определённых типов хим. связей (напр., двойных и тройных связей С—С, связей С—Н, N—Н для органич. молекул), определять пространств. структуру, различать цис- и транс-изомеры (см. Изомерия молекул). Особо широкое распространение получили методы инфракрасной спектроскопии — одни из наиболее эффективных оптич. методов изучения строения молекул. Наиболее полную информацию они дают в сочетании с методами спектроскопии КСР. Исследование вращат. спектров, а также вращат. структуры электронных и колебат. М. с. позволяет по найденным из опыта моментам инерции молекул находить с большой точностью параметры равновесных конфигураций — длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спект-
436
ры изотопич. молекул (в частности, молекул, в к-рых водород заменён дейтерием), имеющих одинаковые параметры равновесных конфигураций, но разл. моменты инерции.
М. с. применяются также в спектральном анализе для определения состава в-ва.
• Кондратьев В. Н., Структура атомов и молекул, 2 изд., М., 1959; Е л ь я ш е в и ч М. А., Атомная и молекулярная спектроскопия, М., 1982; Герцберг Г., Спектры и строение двухатомных молекул, пер. с англ., М., 1949; его же, Колебательные и вращательные спектры многоатомных молекул, пер. с англ., М., 1949; его же. Электронные спектры и строение многоатомных молекул, пер. с англ., М., 1969; Применение спектроскопии в химии, под ред. В. Веста, пер. с англ., М., 1959. См. также лит. при ст. Лазерная спектроскопия.
М. А. Ельяшевич.
