Ростовые и метаболические эффекты терапии рекомбинантным гормоном роста и половыми стероидами у девочек с синдромом Шерешевского-Тернера 14. 00. 03 Эндокринология
| Вид материала | Автореферат диссертации |
- С раневой инфекцией под влиянием квч терапии, 32.59kb.
- Общие принципы терапии больных с синдромом зависимости от алкоголя щие принципы терапии, 86.25kb.
- Оганов Рафаэль Гегамович 16. 00-18. 00 Дискуссия Боль в спине. Принципы терапии в практике, 637.85kb.
- Экспериментальные и клинические исследования, 89.43kb.
- Клинико-экономический анализ консервативной тактики лечения пациентов с синдромом диабетической, 457.09kb.
- Анестезиология и реаниматология, 184.1kb.
- Обучение гештальт-терапии – особенная деятельность, 53.82kb.
- Использование циклоферона в терапии папилломавирусной инфекции, 94.1kb.
- Ограничение употребления алкоголя, поваренной соли и жиров часто делает медикаментозную, 141.41kb.
- Программа обучения в клинической ординатуре по специальности «Эндокринология», 455.08kb.
1 2
На правах рукописи
Панкратова Мария Станиславовна
Ростовые и метаболические эффекты терапии рекомбинантным гормоном роста и половыми стероидами у девочек с синдромом Шерешевского-Тернера
14.00.03 – Эндокринология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2009
Работа выполнена в ФГУ Эндокринологический научный центр Росмедтехнологий
(директор – академик РАН и РАМН И.И.ДЕДОВ)
|
Защита состоится « ___» ____________2009 г. в 14 часов на заседании Диссертационного совета Д. 208.126.01 в ФГУ Эндокринологический научный центр Росмедтехнологий по адресу: Москва, ул. Дм.Ульянова, дом 11.
С диссертацией можно ознакомиться в библиотеке ФГУ ЭНЦ Росмедтехнологий
Автореферат разослан «____» ______________ 2009 г.
| Учёный секретарь Диссертационного совета, доктор медицинских наук, профессор | Е.А. Трошина |
Актуальность исследования
Синдром Шерешевского–Тернера (СШТ) встречается с частотой 1 случай на 2000-2500 новорожденных девочек, характеризуется частичной (мозаичной) или полной X-моносомией и является наиболее распространенной хромосомной аномалией, приводящей к низкорослости и гипергонадотропному гипогонадизму.
Исследования последних 15 лет свидетельствуют, что применение препаратов рекомбинантного гормона роста (рГР) значительно увеличивает конечный рост детей с синдромом Шерешевского-Тернера, что приводит к улучшению качества жизни и социальной адаптации этих пациентов (Carel J, 1998; Betts P, 1999; Ranke M, 2002; Bondy С, 2007).
При своевременно начатом лечении препаратами гормона роста и использовании оптимизированной эстрогенотерапии удается достоверно увеличить конечный рост (Chernausek S, 2000; Quigley H, 2002). Вариабельность ростового ответа у девочек с СШТ зависит от множества факторов, таких как генетически детерминированный рост, степень задержки роста, возраст начала терапии, длительность лечения (Ranke M, 2000; Donaldson M, 2006). В последние годы широко обсуждается роль влияния делеционного полиморфизма гена рецептора гормона роста на эффективность терапии рГР (Binder G, 2005; Buzi F, 2007; Geffner P, 2007).
Ввиду того, что у детей с СШТ возможно возникновение нарушения углеводного и липидного обменов, обосновано проведение длительного комплексного мониторинга при терапии рГР с учетом особенностей данной патологии (Saenger Р, 2001; Bakalov V, 2004; Gravholt С, 2004).
В последние годы вопрос о сроках назначения заместительной терапии эстрогенами у данных пациенток на фоне терапии рекомбинантным гормоном роста является широко обсуждаемым (Chernausek S, 2002; Sybert V, 2004; Rosenfield R, 2005). В настоящее время применяются различные схемы индукции пубертата в сочетании с ростстимулирующей терапией, однако вопрос об оптимальной схеме терапии, которая способствовала бы достижению оптимально роста остается открытым.
Цель исследования: изучить ростовые и метаболические эффекты применения гормона роста у девочек с СШТ и определить оптимальную схему индукции пубертата.
Задачи исследования:
- Изучить основные антропометрические показатели у пациенток с синдромом Шерешевского-Тернера до и на фоне терапии рГР
- Оценить показатели ИФР–1 и ИФРСБ-3 как маркеров эффективности применения гормона роста при синдроме Шерешевского-Тернера.
- Исследовать делеционный полиморфизм гена рецептора гормона роста в оценке эффективности ростстимулирующей терапии и анализе ростового прогноза.
- Исследовать метаболические эффекты применения рГР при синдроме Шерешевского-Тернера на основании изменения показателей липидного спектра, углеводного обмена, минеральной плотности костной ткани на фоне ростстимулирующей терапии.
- Разработать оптимальный алгоритм инициации пубертата при синдроме Шерешевского-Тернера.
Научная новизна:
В настоящей работе впервые в Российской Федерации на когорте российских девочек представлены данные о клинических, ростовых и метаболических аспектах применения гормона роста при СШТ. В результате проведенного исследования получены достоверные данные об эффективности ростстимулирующей терапии рГР у детей с СШТ и улучшении ростового прогноза. Установлена прямая корреляционная зависимость между ростовым фактором ИФР-1 и скоростью роста на лечении рГР. Выявлена взаимосвязь делеционного полиморфизма гена рецептора гормона роста с эффективностью терапии рГР у девочек с СШТ. Показано протективное влияние терапии рГР на липидный обмен и состояние костной ткани, а также отсутствие неблагоприятных эффектов терапии рГР в отношении углеводного обмена. Определено, что ранняя индукция пубертата низкими дозами эстрогенов у девочек с СШТ оптимизирует ростовой прогноз.
Практическая значимость:
Полученные в работе данные свидетельствуют о том, что применение гормона роста увеличивает скорость роста и улучшает ростовой прогноз, а также оказывает протективное влияние на липидный обмен и состояние костной ткани у девочек с СШТ. При этом отмечено отсутствие неблагоприятных эффектов терапии рГР на углеводный обмен, что позволяет рекомендовать применение гормона роста при лечении низкорослости у девочек с СШТ как эффективное и безопасное лечение. Разработаны схемы терапии препаратами рекомбинантного гормона роста в сочетании с препаратами половых стероидов для своевременной индукции пубертата и оптимизации ростового прогноза у девочек с СШТ.
Апробация работы.
Основные положения диссертации представлены в виде устных докладов на Всероссийской научной конференции молодых эндокринологов (Москва, апрель 2007 г), на заседании Московской Ассоциации Эндокринологов (Москва, октябрь 2007 г), на Всероссийском конгрессе молодых ученых (Москва, октябрь 2008 г). Результаты работы внедрены в практику отделения патологии пола и развития Института детской эндокринологии ФГУ ЭНЦ Росмедтехнологий; используются в сертификационных курсах повышения квалификации педиатров-эндокринологов РФ на кафедре детской эндокринологии с курсами эндокринологии и диабетологии факультета послевузовского профессионального образования ГОУ ВПО Московской Медицинской Академии им. И.М.Сеченова Росздрава. Диссертация апробирована на межотделенческой конференции ФГУ ЭНЦ Росмедтехнологий (25 ноября 2008 года).
Публикации.
По теме диссертации опубликовано 7 печатных работ, из них 1 статья в журнале, рецензируемом ВАК РФ.
Объем и структура диссертации.
Диссертация изложена на 136 страницах машинописного текста, состоит из введения, литературного обзора, материалов и методов исследования, главы собственных результатов, обсуждения, заключения, выводов, практических рекомендаций, списка литературы, включающего 12 отечественных и 183 зарубежных источника. Работа содержит 25 таблиц и 17 рисунков.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В Эндокринологическом научном центре Росмедтехнологий на базе НИИ детской эндокринологии (директор – проф. В.А.Петеркова) за 2005-2008 гг было обследовано 92 девочки с синдромом Шерешевского-Тернера в возрасте от 2,5 до 15,5 лет (средний возраст 9,4±2,7 лет). У всех девочек диагноз был подтвержден результатами кариотипирования. Критериями, включающими в исследование, являлись: рост ниже 5-й перцентили и/или скорость роста ниже 10-й перцентили для популяции здоровых девочек, отсутствие ранее терапии рГР, половое развитие по Таннеру – 1, открытые эпифизарные зоны роста, эутиреоз (без или под контролем соответствующей терапии). Критерием исключения являлось наличие тяжелых соматических заболеваний в стадии декомпенсации.
Также был проведен ретроспективный анализ историй болезни 23 девочек с СШТ (средний возраст 14,4±1,2 лет), не получавших терапию рекомбинантным гормоном роста и находившихся на заместительной терапии половыми стероидами.
Клинический осмотр девочек с синдромом Шерешевского–Тернера и оценка параметров физического и полового развития, забор крови для определения ростовых факторов, гормонального и биохимического исследования крови проводились во время скринингового визита, непосредственно перед началом терапии рГР, затем через каждые 6 месяцев терапии.
Оценка физического развития проводилась на основании результатов антропометрических показателей – длины и массы тела. Рост пациенток измерялся с помощью механического стадиометра (Harpender stadiometer, Holtain Ltd, UK) с точностью до 0,1 см. Для оценки степени отклонения роста пациентов от среднего роста в популяции рассчитывался коэффициент стандартного отклонения SDS роста по следующей формуле: SDS = X – X’/SD, где Х – рост пациента, Х’ – средний рост для данного хронологического возраста и пола, SD – стандартное отклонение для данного хронологического возраста и пола. SDS роста для девочек с СШТ рассчитывался с использованием возрастных нормативов роста и SD для девочек с СШТ. SDS роста отца и матери рассчитывался по вышеуказанной формуле. SDS среднего роста родителей рассчитывался по формуле: SDS среднего роста родителей = (SDS отца + SDS матери)/1,61 (Ranke M, 1996). Для оценки отклонения скорости роста пациентки от средней скорости роста в популяции рассчитывался коэффициент стандартного отклонения SDS скорости роста по следующей формуле: SDS скорости роста = (Y – Y’) / SD, где Y – скорость роста за период между хронологическим возрастом 1 и хронологическим возрастом 2, Y’ – средняя скорость роста для данного пола и среднего хронологического возраста, SD – стандартное отклонение роста для данного пола и среднего хронологического возраста. Прогнозируемая скорость роста для детей с СШТ на терапии рГР рассчитывалась по методу Ranke M (1996). Расчет прогнозируемого конечного роста для оценки потенциально возможного роста проводился двумя методами. У пациенток с СШТ до лечения и на фоне терапии рекомбинантным гормоном роста прогнозируемый конечный рост рассчитывался по методу Lion А. (1968). У пациенток с СШТ на фоне терапии половыми стероидами прогнозируемый конечный рост рассчитывался по таблицам Bayley N, Pinneau S (1982). Вес измерялся на напольных калиброванных весах в килограммах. Индекс массы тела рассчитывался по формуле: ИМТ = вес (кг)/рост (м²). SDS веса и ИМТ рассчитывались как X – X’/SD, где Х – lg веса и ИМТ пациента, Х’ – lg среднего веса и ИМТ для данного хронологического возраста и пола, SD – lg стандартного отклонения веса и ИМТ для данного хронологического возраста и пола. SDS длины тела и веса при рождении рассчитывали по вышеуказанным формулам. При рассчете SDS весоростовых показателей пациенток и их родителей использовались популяционные данные, используемые в базе KIGS: SDS роста пациенток, родителей, SDS скорости роста – данные Tanner J, Whitehouse H (1966, 1976), SDS роста и скорости роста для СШТ – Ranke M. (1987), SDS веса и ИМТ – данные Freeman J, Cole T (1995), SDS длины тела и веса при рождении – данные Niklasson A. (1991). Оценка полового развития осуществлялась согласно классификации Tanner (1968 ).
Гормональные исследования проводились в лаборатории гормонального анализа ФГУ ЭНЦ (рук. – проф. Н.П. Гончаров). Образцы венозной крови забирались натощак в утренние часы. Определение концентрации эстрадиола (Е2), лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) проводилось при помощи автоматизированной системы “Vitrus” фирмы “Johnson and Johnson company” методом усиленной люминисценции. Уровень сывороточного ИРФ-1 измерялся при помощи радиоиммунного анализа с использованием коммерческого набора IGF-1 RIA. Уровень ИФРСБ–3 определялся в центральной лаборатории MDS Pharma Service Central Lab в г. Гамбурге (Германия). при помощи иммуноферментного анализа с использованием коммерческого DSL – 10-6600 ACTIVE™ IGFBP3 ELISA производства DSL, Sinsheim, Германия. SDS ИФР-1 и SDS ИФРСБ-3 рассчитывались как X –X’/SD, где Х – lg значений ИФР-1 и ИФРСБ-3 пациента, Х’ – lg средних значений ИФР-1 и ИФРСБ-3 для данного хронологического возраста и пола, SD – lg стандартного отклонения ИФР-1 и ИФРСБ-3 для данного хронологического возраста и пола по референсным данным Lofqvist С (2001, 2004).
Биохимические исследования проводились в биохимической лаборатории ФГУ ЭНЦ (рук. – А.В. Ильин) при помощи анализатора Hitachi 912 по стандартной методике. Определение концентрации глюкозы, общего холестерина, ЛПВП, ЛПНП, триглицеридов, щелочной фосфатазы, кальция, фосфора в сыворотке периферической крови проводилось при использовании стандартных наборов фирмы Roche (Швейцария). Расчет индекса атерогенности сыворотки производился по формуле: (общий холестерин – ЛПВП)/ЛПНП. Определение гликированного гемоглобина (HbA1c) проводилось на анализаторе «ДСА 2000+» фирмы «Bayer» (Германия) методом ингибирования реакции латекс-агглютинации.
Рентгенография кистей с лучезапястными суставами осуществлялась в отделении рентгенологии ФГУ ЭНЦ (рук. – д.м.н. Ремизов О.В.). Костный возраст пациентов определялся в соответствии с методикой, представленной в «Рентгенологическом атласе развития скелета руки и запястья». Greulich W, Pyle S, (второе издание, 1959).
Магнитно-резонансная томография головного мозга проводилась в отделении МР-томографии ФГУ ЭНЦ (рук. – д.м.н. А.В. Воронцов) на томографе фирмы Siemens (Erlangen, Германия) с напряженностью магнитного поля 1 Тесла. Для получения сагиттальных, фронтальных и аксиальных изображений применялись параметры TR/TE/FA = 330/12/70 (импульсные последовательности «турбо-спин-эхо», взвешенные по Т1) и 5000.119.186 (импульсные последовательности «турбо-спин-эхо», взвешенные по Т2). Толщина среза составляла 3 мм для сагиттальных и фронтальных изображений и 4 мм для аксиальных изображений. Исследование осуществлялось без предварительной подготовки в положении лежа на спине.
Ультразвуковое исследование органов малого таза проводилось в отделении функциональной диагностики ФГУ ЭНЦ (рук. – Т.В. Солдатова) на ультразвуковых аппаратах Hewlett Packard Image Point (США), Agilent Sonos 4500 (США) с использованием линейного трансабдоминального датчика с частотой 3,5МГц по общепринятой методике.
Денситометрическое исследование проводилось в отделении функциональной диагностики ФГУ ЭНЦ (рук. – Т.В. Солдатова) врачом к.м.н. Н.И. Сазоновой. Содержание МПКТ определяли на денситометре фирмы “Lunar” (США) методом двухэнергетической рентгеновской абсорбциометрии. Исследование проводилось в поясничном отделе позвоночника (совокупная минеральная плотность кости в регионе L2-L4). Результаты исследования выражались в абсолютном содержании (в граммах) костной ткани и сравнивались с референсной базой данных, представленной фирмой производителем. Полученные значения минеральной плотности кости выражались в г/см2 . Для оценки полученных показателей использовался Z-критерий для данного хронологического и возраста и пола. Показатели денситометрии оценивались и в пересчете на костный возраст пациентки. Значения Z-критерия <-2,5 расценивались как остеопороз, а при его снижении от -1,0 до -2,5 SD как остеопения.
Молекулярно-генетический анализ. Исследование гена рецептора гормона роста (d3-GHR) проводилось в лаборатории молекулярной генетики человека отдела молекулярной биологии и генетики НИИФХМ Росздрава (зав. лабораторией к.б.н. Генерозов Э.В.). Выделение геномной ДНК из цельной венозной крови проводили, используя набор реактивов DNA Prep100 (DIAtom™) по методике, рекомендованной изготовителем. Изучение делеционного полиморфизма d3-GHR осуществлялось с использованием метода ПЦР-амплификации с последующим разделением и анализом фрагментов в агарозном геле. Для анализа наличия/отсутствия делеции 3 экзона GHR были подобраны специфичные комплементарные праймеры. Прямой праймер G1 лежал в консервативном участке, не затронутом делецией и не далеко от ее начала. Два обратных праймера были подобраны особым образом:
- G2 был комплементарен консервативной области, находящейся непосредственно после границ делеции. В норме расстояние между G1 и G2 составляет 3248 пар оснований, а при делеции 3 экзона области, комплементарные праймерам, сближаются и расстояние составляет 532 пары оснований.
- G3 был комплементарен области, затрагиваемой делецией. В норме расстояние между G1 и G3 составляло 935 пар оснований. В случае делеции, ПЦР с использованием данного праймера оказывалась невозможной.
Объем проведенных лабораторно-инструментальных исследований. Уровень ИФР-1 определялся у 92 пациенток до начала терапии рГР и через 1 год терапии, у 72 пациенток через 2 года терапии и у 44 пациенток через 3 года терапии рГР. Уровень ИФРСБ-3 определялся у 30 пациенток до начала терапии рГР и у 29 в течение 2-х лет терапии с интервалом в 6 месяцев. Уровни ЛГ и ФСГ определялись у 68 пациенток различных возрастных групп без терапии половыми стероидами, уровни ЛГ, ФСГ и эстрадиола определялись у 17 пациенток на фоне заместительной терапии эстрогенами в течение 1 года. Определение уровней общего холестерина, ЛПНП, ЛПВП, триглицеридов, HbA1c, тощаковой глюкозы, щелочной фосфатазы, общего кальция и фосфора проводилось у 52 пациенток в течение 1 года терапии рГР с интервалом в 6 месяцев, у 29 пациенток в течение 2-х лет терапии рГР с интервалом в 6 месяцев. МРТ головного мозга проводилось у 65 пациенток с СШТ до начала терапии рГР. Денситометрия поясничного отдела позвоночника проводилась у 28 пациенток (13 получали терапию рГР в течение 1 года, 15 не получали ростстимулирующую и половую терапию). Рентгенография кистей рук проводилась у 92 пациентов до начала терапии рГР и через 1 год терапии, у 72 пациенток через 2 года терапии и у 44 пациенток через 3 года терапии рГР. УЗИ органов малого таза проводилось у 17 пациенток на фоне заместительной терапии эстрогенами в течение 1 года. Молекулярно-генетический анализ делеционного полиморфизма гена рецептора гормона роста проводился у 76 пациенток, получавших терапию рГР в течение 1 года.
Терапия рГР. Пациентки получали терапию рекомбинантным гормоном роста, 92 девочки – в течение одного года, 72 девочки – в течение двух лет, 44 девочки – в течение трех лет. Препараты генноинженерного гормона роста (Сайзен®, Нордитропин Нордилет®, Растан®, Нутропин®, Хуматроп®) вводились ежедневно, подкожно, в вечерние часы, в рекомендованных дозах: 0,05 мг/кг/день.
Терапия половыми стероидами. У 17 пациенток (средний возраст 13,2 ±0,9 лет) после 1 года терапии рекомбинантным гормоном роста проводилась инициация пубертата низкими дозами эстрогенов. Препараты половых стероидов (натуральные эстрогены – Эстрофем®, Эстримакс®, Прогинова®) принимались ежедневно, перорально, в дозе 0,2 мг в сутки в течение 6 месяцев, затем в дозе 0,25 мг в сутки в течение 6 месяцев, всего пациентки наблюдались в течение 1 года. Для сравнительной характеристики различных схем инициации пубертата проведена ретроспективная оценка данных о росте 23 пациенток (средний возраст 14,4 ±1,2 лет), не получавших терапию рекомбинантным гормоном роста и получавших препараты натуральных эстрогенов (Эстрофем®) в дозе 0,5-1 мг в сутки в течение 1 года.
Статистическая обработка полученных результатов производилась с помощью стандартных методов статистического анализа с использованием программного обеспечения для персонального компьютера: Microsoft Excel и Statistica 6.0. Для представления полученных данных использовались методы описательной статистики. Результаты представлены как среднее значение ± SD, при необходимости указан минимум-максимум. Количественные данные в группах проверялись на нормальность распределения с помощью теста Шапиро-Уилка, затем проверялась гипотеза о равенстве дисперсий с помощью теста Левена, при подтверждении истинности этих двух гипотез данные анализировались с помощью параметрических методов статистики, а в обратном случае использовались их непараметрические аналоги. Для проверки статистических гипотез при анализе количественных признаков с параметрическим распределением использовался Т-тест, в случае непараметрического распределения были использованы следующие критерии: критерий Вилкоксона для анализа различий данных для связанных групп; критерий Манна-Уитни для анализа различий данных для несвязанных групп; при множественных сравнениях применялся критерий Крускала-Уоллиса. Выявление меры линейной связи между параметрами проводилось с помощью коэффициента ранговой корреляции Спирмена. Различия принимались как статистически значимые при p<0,05.
Результаты собственных исследований.
Клиническая и антропометрическая характеристика обследованных больных
Результаты работы основаны на данных обследования 92 девочек с синдромом Шерешевского-Тернера, возраст которых на момент первичного обследования составлял от 2,5 до 15,5 лет (средний возраст – 9,4±2,7 лет). Половое развитие на момент первичного обследования соответствовало Таннер 1.
Моносомный вариант кариотипа – 45ХО – отмечался у 62% пациенток, различные варианты мозаицизма, связанные с Х-хромосомой в 25% случаев (мозаичный вариант 45ХО/46ХХ – у 14% пациенток, 45Х0 /46Х, i(Хq) – у 6%, 45ХО/46X,del[Xp] – у 3%, 45ХО/46Х, (Хr) – у 2% пациенток), 46Х, i(Xq) – у 8%, мозаицизм, связанный с У-хромосомой отмечался у 2% пациенток. У 3 % пациенток присутствовали редкие формы кариотипа (1% – 46 X, r(Х), 1% – 45 XО/47 XXX, 1% – 45 XО/46ХХ/47XXX) (рис. 1).
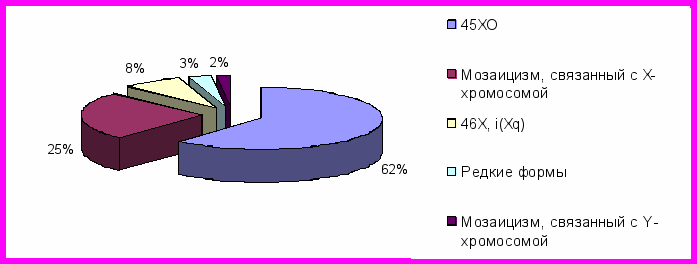
Рис.1. Варианты кариотипов у девочек с СШТ.
Средний возраст постановки диагноза «Синдром Шерешевского-Тернера» составил 8,7±3,5 года. У 22,8% пациенток диагноз был поставлен на первом году жизни, у 13,1% – в дошкольном возрасте (1-6 лет), у 16,3% – в младшем школьном возрасте (7-9 лет), у 43,5% – в среднем школьном возрасте (10-13 лет), у 4,3% – в подростковом возрасте (14-15 лет). Наблюдалось два возрастных пика постановки диагноза – первый год жизни, когда основными проявлениями синдрома являются выраженный лимфостаз, характерные стигмы дисэмбриогенеза и пороки развития органов, и пубертатный период, когда основными проблемами являются выраженная задержка роста и отсутствие полового развития. Распределение пациенток по возрасту на момент постановки диагноза представлено на рисунке 2.
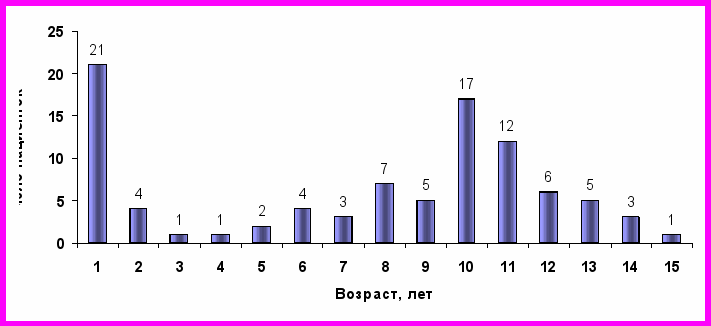
Рис.2. Распределение пациенток по возрасту на момент постановки диагноза.
Для синдрома Шерешевского-Тернера характерно наличие различных пороков развития органов и систем органов, а также сопутствующих заболеваний. Частота встречаемости сопутствующей патологии у обследованных девочек (n = 92) представлена в таблице 2. У 52,7% пациенток отмечалось наличие двух и более пороков развития.
Таблица 2.
Частота встречаемости сопутствующей патологии у девочек с СШТ (n = 92).
| Сопутствующая патология | Количество пациенток | % |
| Патология сердечно-сосудистой системы (коарктация аорты, бикуспидальный аортальтный клапан, дефекты межжелудочковой перегородки, открытое овальное окно, дополнительные хорды левого желудочка, пролапс митрального клапана) | 43 | 47% |
| Патология мочевыводящей системы (подковообразная почка, одностороннее удвоение чашечно-лоханочной системы, патология мочеточников, гидронефроз) | 52 | 56% |
| Патология лимфатической системы (лимфатический отек конечностей, крыловидные складки шеи, дисплазия ногтевых пластинок) | 28 | 30% |
| Патология костной системы (готическое небо, микрогнатия, широкая грудная клетка, вальгусная деформация локтевых суставов, деформация Маделунга) | 76 | 82% |
| Патология органов слуха (аденоидные вегетации, кондуктивная тугоухость, хронические отиты) | 19 | 21% |
| Патология органов зрения (эпикант, птоз, альтернирующее косоглазие, нистагм, астигматизм) | 26 | 28% |
| Гастродуоденальные нарушения (хронический гастродуоденит, синдром мальабсорбции) | 5 | 6% |
| Хронический аутоиммунный тиреоидит | 34 | 37% |
| Многочисленные невусы | 29 | 32% |
Данные антропометрических показателей при рождении, а также показатели роста родителей приведены в таблице 3. Показатели SDS роста родителей и целевого роста девочек с СШТ соответствовали нормативам для здоровой популяции, что свидетельствует об отсутствии отягощенной наследственности по низкорослости. Вес и рост при рождении по группе соответствовал среднепопуляционным нормативам, однако SDS веса был на нижней границе нормы: -0,95±1,33, что характерно для пациенток с наличием СШТ.
Таблица 3.
Основные антропометрические характеристики пациенток с СШТ при рождении и ростовые показатели родителей.
| Показатель | Значение |
| Вес при рождении, г | 2688,7±580,6 (1700 – 4750) |
| SDS веса при рождении | -0,95±1,33 (-3,33 – 2,76) |
| Длина тела при рождении, см | 48,7±3,4 (40 – 56) |
| SDS длины тела при рождении | 0,12±1,45 (-2,76 – 3,44) |
| Неделя гестации | 38,1±2,2 (32 – 40) |
| Рост отца, см | 174,5±6,8 (164 – 190) |
| SDS роста отца | -0,35±1,36 (-1,61 – 2,3) |
| Рост матери, см | 164,4±5,2 (152 – 176) |
| SDS роста матери | 0,08±0,98 (-1,67 – 2,13) |
| Целевой рост пациенток, см | 163,0±5,1 (152,5 – 174) |
| SDS целевого роста | 0,16±0,83 (-1,59 – 2,33) |
При анализе ростовых показателей до лечения у детей допубертатного (до 9 лет, n = 40) и пубертатного возраста (старше 9 лет, n = 52) отмечается выраженное снижение роста и скорости роста уже в допубертатном возрасте. В среднем SDS роста в допубертатном и пубертатном возрасте составили -2,32±0,65 и -3,54±0,77 соответственно, что ниже 5-й перцентили для популяции здоровых девочек. SDS скорости роста в допубертатном и пубертатном возрасте составили -2,11±0,42 и -3,79±0,86 соответственно. Данный факт свидетельствует о наличии выраженной задержки роста с раннего возраста, прогрессирующей со временем и требующей корекции.
Динамика ростовых показателей у девочек с СШТ на фоне терапии рГР
Девочки с СШТ в течение трех лет получали ростстимулирующую терапию препаратами рГР. У девочек с СШТ до лечения наблюдалось прогрессирующее снижение темпов роста, а также отставание костного возраста от паспортного. В среднем SDS роста и скорости роста составили -3,11±0,63 и -2,46±1,52 соответственно, что ниже 5-й перцентили для популяции здоровых девочек и являлось показанием для начала терапии рГР. Средняя скорость роста составила 3,15±1,12 см/год, что также ниже 5-й перцентили для популяции здоровых девочек. SDS роста для популяции девочек с СШТ составил -0,41±0,83, что указывало на отсутствие сопутствующих факторов, угнетающих ростовые процессы. Данные пациенток до и на фоне лечения представлены в таблице 4 в виде среднее ± SD (минимум ÷ максимум).
Таблица 4.
Антропометрические данные пациенток с СШТ до лечения и на фоне терапии.
| Показатель, единицы измерения | До лечения (1) (n=92) | 12 месяцев лечения (2) (n=92) | 24 месяца лечения (3) (n=72) | 36 месяцев лечения (4) (n=44) | p |
| ХВ, годы | 9,4±2,7 (2,5 ÷ 15,5) | 10,3±2,7 (3,5 ÷ 16,5) | 11,2±2,1 (4,6 ÷ 15,9) | 12,1±2,3 (7,5 ÷ 15,3) | |
| КВ, годы | 6,9±1,1 (2 ÷ 11,5) | 7,9±1,80 (3 ÷ 11,5) | 8,6±1,5 (4 ÷ 12) | 9,5±1,5 (7 ÷ 11,5) | |
| КВ/ХВ | 0,72±0,13 (0,56 ÷ 0,92) | 0,73±0,12 (0,59 ÷ 0,94) | 0,81±0,13 (0,63 ÷ 1,0) | 0,78±0,12 (0,59 ÷ 1,0) | р1-2=0,072 р2-3=0,046 р3-4=0,068 |
| SDS веса | -1,57±1,07 (-3,77 ÷ 0,31) | -1,07±1,07 (-2,77 ÷ 0,51) | -0,63±0,83 (-2,28 ÷ 0,83) | -0,42±0,80 (-2,14 ÷ 1,17) | р1-2=0,0012 р1-3=0,0041 р1-4=0,017 |
| SDS ИМТ | 0,07±0,61 (-1,39 ÷ 1,43) | 0,05±0,62 (-1,72 ÷ 1,20) | 0,04±0,87 (-2,01 ÷ 1,56) | 0,06±0,94 (-1,81 ÷ 1,76) | р1-2=0,49 р2-3=0,78 р3-4=0,64 |
| Рост, см | 114,9±9,7 (89,7 ÷ 133,8) | 123,5±8,8 (102,1 ÷ 138,3) | 130,7±5,8 (109,3 ÷ 142,6) | 136,3±4,2 (123,9 ÷145,6) | р1-2=0,0023 р1-3=0,0012 р2-3=0,0067 р1-4=0,0002 р3-4=0,0031 |
| SDS роста | -3,11±0,63 (-4,5 ÷ -1,78) | -2,39±0,87 (-3,85 ÷ -0,82) | -2,06±0,47 (-3,03 ÷ -1,02) | -1,72±0,29 (-2,23 ÷ -1,12) | р1-2=0,000012 р1-3=0,000067 р2-3=0,0014 р1-4=0,000054 р3-4=0,0067 |
| SDS роста (СШТ) | -0,41±0,43 (-1,35 ÷ 1,19) | 0,26±0,54 (-0,63 ÷ 1,38) | 0,72±0,53 (-0,40 ÷ 1,22) | 1,32±0,31 (0,57 ÷ 1,86) | р1-2=0,000014 р1-3=0,000007 р2-3=0,000012 р1-4=0,000003 р3-4=0,000016 |
| Скорость роста, см/год | 3,15±1,12 (1,8 ÷ 6,4) | 8,93±1,59 (5,2 ÷ 12) | 7,10±1,02 (5,9 ÷ 9,0) | 5,21±0,84 (4,4 ÷ 6,8) | р1-2=0,000002 р1-3=0,000015 р1-4=0,000002 |
| SDS скорости роста | -2,46±1,52 (-4,3 ÷ -1,61) | 3,89±1,61 (1,5 ÷ 6,2) | 1,97±1,27 (-1,16 ÷ 4,52) | 1,34±1,67 (-2,35 ÷ 5,95) | р1-2=0,000001 р1-3=0,00013 р1-4=0,0004 |
| ПКР, см | 145,6±6,15 (131 ÷ 157) | 149,8±6,12 (137 ÷ 161) | 152±5,9 (141 ÷ 164) | 154±5,8 (143,5 ÷ 167) | р1-2=0,014 р1-3=0,007 р3-2=0,012 р1-4=0,001 р3-4=0,021 |
Переносимость препарата рГР пациентками, родителями и лечащим врачом по пятибалльной шкале (очень плохая, плохая, удовлетворительная, хорошая и очень хорошая) оценивалась как очень хорошая в 73,3% случаев и хорошая в 26,7% случаев. У 9% пациенток отмечались преходящие лимфатические отеки конечностей, не требовавшие снижения дозировки или отмены препарата. У 3,2% пациенток отмечались случаи местной реакции в месте введения препарата.
