Московский государственный университет имени М. В. Ломоносова биологический факультет на правах рукописи
| Вид материала | Автореферат |
- М. В. Ломоносова биологический факультет н а правах рукописи Столяров Андрей Павлович, 657.12kb.
- Xxi столетия Дунаева Светлана Олеговна, 37.07kb.
- Институциональное развитие местного самоуправления в российской федерации 23. 00., 689.31kb.
- Факультет дополнительного образования, 54.13kb.
- На правах рукописи, 514.74kb.
- Секция «почвоведение» Кинетика поглощения гуминовых кислот угля проростками пшеницы, 2613.34kb.
- Модель оценки инвестиционного климата российских регионов в условиях неопределенности, 111.18kb.
- М. В. Ломоносова филологический факультет слово грамматика речь выпуск II сборник научно-методических, 97.35kb.
- На правах рукописи, 584.81kb.
- Московский государственный университет им. М. В. Ломоносова Факультет иностранных языков, 296.78kb.
Глава VI. Тейхоевые кислоты клеточных стенок как видоспецифический маркер актиномицетов.
Ранее было показано успешное применение признака “наличие тейхоевых кислот” для разделения стафилококков и микрококков (Schleifer and Stackebrandt, 1983): первые содержат ТК, вторые – нет. Идея о возможности использования ТК в систематике актиномицетов была выдвинута впервые немецкими исследователями для рода Brevibacterium (Fiedler et al., 1981) и развита в работе И.Б.Наумовой (Naumova, 1988).
Участие ТК клеточных стенок в жизненно важных процессах, происходящих в живой бактериальной клетке (Neuhaus and Baddiley, 2003; Weidenmaier and Peschel, 2008), их колоссальное структурное разнообразие (см. Главу V, обзоры: Наумова и Шашков, 1997; Потехина, 2006; Naumova et al., 2001), детерминированное информацией, содержащейся в кодирующих их генах (Lazarevic et al., 2002), а также их широкое распространение в грамположительных бактериях (наши данные; Weidenmaier and Peschel, 2008), с очевидной вероятностью демонстрируют возможность их применения в систематике бактерий.
С начала 70-х годов в таксономической практике успешно используется строение пептидогликана (Schleifer and Kandler, 1972) – основного гликополимера клеточной стенки прокариот. Тогда как таксономическая значимость структур ТК и других гликополимеров клеточной стенки с таксономической точки зрения не оценена в полной мере, поскольку до сих пор не проводилось направленного анализа с целью обнаружения коррелятивных связей между наличием и структурой ТК и гликополимеров клеточных стенок актиномицетов и таксономическим статусом последних. К настоящему времени показана возможность использования тейхоевых кислот в качестве видоспецифического маркера для представителей родов Agromyces (Гнилозуб, 1994), Actinomadura, Nonomurea и Brevibacterium (Потехина, 2005).
В настоящей главе анализируются полученные автором и литературные данные о структурных типах и подтипах ТК, обнаруженных в клеточных стенках представителей нескольких родов актиномицетов (Nocardiopsis, Glycomyces, Nocardioides, Streptomyces), принадлежащих 4-м различным семействам четырех подпорядков порядка Actinomycetales.
6.1. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифические маркеры видов и подвидов рода Nocardiopsis.
В данном разделе проанализированы собственные результаты (29 штаммов) и литературные данные (5 штаммов) исследования клеточных стенок 34 штаммов, принадлежащих к 13 видам и подвидам рода Nocardiopsis (семейство Nocardiopsaceae, подпорядок Streptosporangineae, Fisher et al., 1983; Yassin et al., 1993; 1997; Evtushenko et al.,
Ранее было показано успешное применение признака “наличие тейхоевых кислот” для разделения стафилококков и микрококков (Schleifer and Stackebrandt, 1983): первые содержат ТК, вторые – нет. Идея о возможности использования ТК в систематике актиномицетов была выдвинута впервые немецкими исследователями для рода Brevibacterium (Fiedler et al., 1981) и развита в работе И.Б.Наумовой (Naumova, 1988).
Участие ТК клеточных стенок в жизненно важных процессах, происходящих в живой бактериальной клетке (Neuhaus and Baddiley, 2003; Weidenmaier and Peschel, 2008), их колоссальное структурное разнообразие (см. Главу V, обзоры: Наумова и Шашков, 1997; Потехина, 2006; Naumova et al., 2001), детерминированное информацией, содержащейся в кодирующих их генах (Lazarevic et al., 2002), а также их широкое распространение в грамположительных бактериях (наши данные; Weidenmaier and Peschel, 2008), с очевидной вероятностью демонстрируют возможность их применения в систематике бактерий.
С начала 70-х годов в таксономической практике успешно используется строение пептидогликана (Schleifer and Kandler, 1972) – основного гликополимера клеточной стенки прокариот. Тогда как таксономическая значимость структур ТК и других гликополимеров клеточной стенки с таксономической точки зрения не оценена в полной мере, поскольку до сих пор не проводилось направленного анализа с целью обнаружения коррелятивных связей между наличием и структурой ТК и гликополимеров клеточных стенок актиномицетов и таксономическим статусом последних. К настоящему времени показана возможность использования тейхоевых кислот в качестве видоспецифического маркера для представителей родов Agromyces (Гнилозуб, 1994), Actinomadura, Nonomurea и Brevibacterium (Потехина, 2005).
В настоящей главе анализируются полученные автором и литературные данные о структурных типах и подтипах ТК, обнаруженных в клеточных стенках представителей нескольких родов актиномицетов (Nocardiopsis, Glycomyces, Nocardioides, Streptomyces), принадлежащих 4-м различным семействам четырех подпорядков порядка Actinomycetales.
6.1. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифические маркеры видов и подвидов рода Nocardiopsis.
В данном разделе проанализированы собственные результаты (29 штаммов) и литературные данные (5 штаммов) исследования клеточных стенок 34 штаммов, принадлежащих к 13 видам и подвидам рода Nocardiopsis (семейство Nocardiopsaceae, подпорядок Streptosporangineae, Fisher et al., 1983; Yassin et al., 1993; 1997; Evtushenko et al.,
Таблица 2. Тейхоевые кислоты клеточных стенок видов и подвидов рода Nocardiopsis.
| Тейхоевая кислота | N. dassonvillei ssp. dassonvillei | N. synnematofor-mans | N. halotolerans | N. dassonvillei ssp. albirubida 1 | N. alba (3 strains) | N. listeri 2 | N.metallicа | N. prasina | N. lucentensis 2 | N.compostа | N. trehalosi | N.tropica 3 | ||
| | Группа N. dassonvillei | Группа N. alba | | | ||||||||||
| Поли(глицерофосфат-β- N-ацетилгалактозаминилглицерофосфат)/ связь –3-P-3 – | | | | | | | | | | | | | ||
| Поли(глицерофосфат-β- N-ацетилгалактозаминилглицерофосфат)/ связь –3-P-4 – | | | | | | | | | | | | | ||
| Поли(глицерофосфат-β- N-ацетилгалактозаминил-глицерофосфат)/ связь –3-P-3 –, с пируват-кетальной группой | | | | | | | | | | | | | ||
| Поли(глицерофосфат-β- N-ацетилгалактозаминил-глицерофосфат)/ связь –3-P-4 – , с O-сукцинильным остатком | | | | | | | | | | | | | ||
| Незамещенный 3,5-поли(рибитфосфат) ТК1 | | | | | | | | | | | | | ||
| 1,5-Поли(рибитфосфат) с 2,4- пируват-кетальной группой ТК3 | | | | | | | | | | | | | ||
| 1,3-Поли(глицерофосфат) с -N-ацетилглюкозамином ТК2 | | | | | | | | | | | | | ||
| 1,3- Поли(глицерофосфат) с β-глюкозой | | | | | | | | | | | | | ||
| 1,5- Поли(рибитфосфат) с боковыми глицерофосфатными олигомерами | | | | | | | | | | | | | ||
1 Шашков и др, 1997; 2 Стрешинская и др., 1998; 3 Стрешинская и др., 1996.
основная (преобладающая) тейхоевая кислота
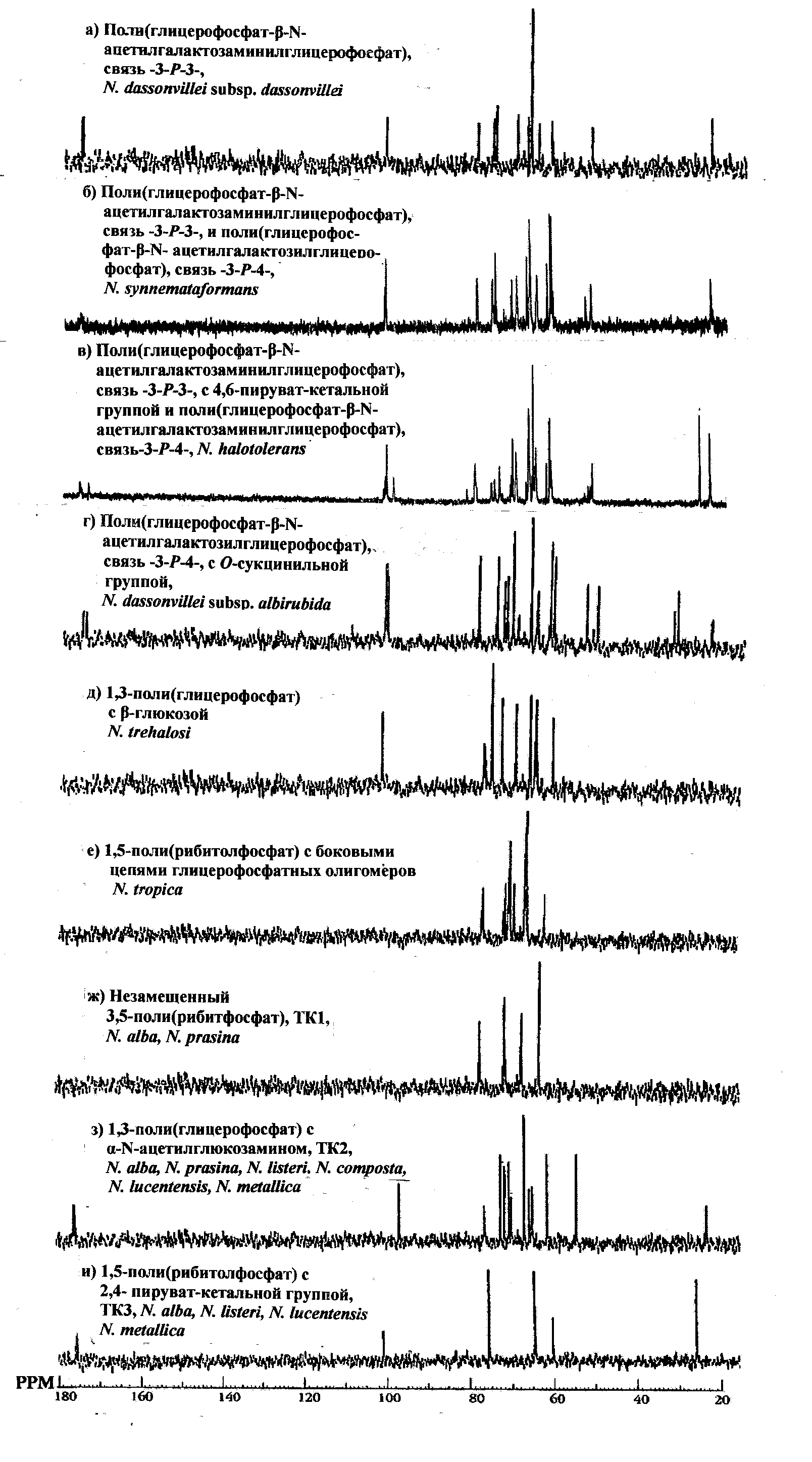
Рис. 5. 13С ЯМР-спектры ТК клеточных стенок видов и подвидов Nocardiopsis.
2000; Al-Zarban et al., 2002; Kämpfer et al., 2002). Структуры и комбинация ТК в клеточных стенках актиномицетов рода Nocardiopsis хорошо коррелируют с филогенетической группировкой этих организмов, основанной на данных анализа генов 16S рРНК и данными ДНК-ДНК гибридизации. С другой стороны, филогенетически близкие организмы (сходство генов 16S рРНК до 99,9%) различаются по составу анионных полимеров.
Таблица 3. Дифференцирующие характеристики видов и подвидов рода Nocardiopsis, основанные на сравнении продуктов химической деградации общей фракции ТК или клеточных стенока).
| Продукты химической деградации | N. dassonvillei ssp. dassonvillei | N. synnematofor-mans | N. halotolerans | N. dassonvillei ssp. albirubida 1 | N. alba (3 штамма) | N. listeri 2 | N.metallicа | N. prasina | N. lucentensis 2 | N.compostа | N. trehalosi | N.tropica 3 |
| | Группа N. dassonvillei | Группа N. alba | | | ||||||||
| Кислотный гидролиз | ||||||||||||
| Глицерин Рибит Глюкоза Глюкозамин Галактозамин Пировиноградная кислота Янтарная кислота | + | + | + + + | + + | + + + + | + + + + | + + + + | + + + | + + | + + | + + | + + |
| Щелочной гидролиз | ||||||||||||
| Глицерин GroP, GroP2 Рибит RboP, RboP2 RboP3 Э3б) Фосфодиэфир Gro c GlcNAc | сл + + | сл + + | сл + + | сл + | + + сл + + | + + сл + | + + сл + | + + сл + + | + + + | + + + | | + + + + + |
а) +, присутствует; , отсутствует; б) Фосфодиэфир содержит два остатка глицерина, один – N-ацетилгалактозамин и три фосфатных группы: P-(3/4)-GalpNAc-(1→2)-snGro-3-P-1-snGro-2-P; 1 Шашков и др, 1997; 2 Стрешинская и др., 1998; 3 Стрешинская и др., 1996.
В первую группу (табл. 2) N. dassonvillei (N. dassonvillei ssp. dassonvillei, N. synnematаformans, N. halotolerans, N. dassonvillei ssp. albirubida) входят организмы, содержащие в клеточной стенке уникальный, обнаруженный только у представителей этого рода поли(полиолфосфатгликозилполиолфосфат). Штаммы вида N. dassonvillei ssp. dassonvillei, имеют единственную ТК с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-3-). Два вида N. synnematаformans и N. halotolerans, содержат по две ТК: минорную – с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-4-) и основную – N. synnematаformans, как и у N. dassonvillei ssp. dassonvillei, а N. halotolerans – ТК с кетально связанным пируватом; и, наконец, подвид N. dassonvillei ssp. albirubida (Шашков и др, 1997), имеет единственную ТК с фосфодиэфирной связью между глицерином и аминосахаром по (-3-P-4-), но несущую сукцинильный остаток по гидроксилу при С3 аминосахара.
Во вторую группу (табл. 2) N. alba (N. alba, N. prasina, N. composta, N. metallica, N. listeri, N. lucentensis) объединяются виды, содержащие в клеточных стенках различный набор полимеров: ТК1, ТК2 и ТК3 (табл. 2). При одинаковом наборе ТК имеются выраженные количестванные различия в их содержании (основная или минорная ТК, N. listeri и N. metallicа), а также степени замещения и длине цепи полимера (N. lucentensis и N. composta). Два других изученных организма этого рода N. tregalosei и N. tropica (Стрешинская и др., 1996) содержат в клеточной стенке ТК иных структур (табл. 2), имеют низкую степень филогенетического родства как между собой, так и с N. dassonvillei и с N. alba.
Следует отметить, что именно на этой группе организмов впервые показана возможность использования 13С ЯМР-спектров как фингерпринтов для идентификации видов и подвидов рода Nocardiopsis (рис. 5).
Кроме того, виды и подвиды рода Nocardiopsis отличаются по набору и комбинации продуктов кислотного гидролиза как самих полимеров, так и нативных клеточных стенок, которые могут быть легко определены с использованием методов хроматографии (табл. 3). Определение некоторых специфических продуктов щелочного гидролиза полимера или нативной клеточной стенки расширяет таксономические возможности при использовании этого подхода. Например, N. alba и N. listeri, которые характеризуются похожими профилями продуктов кислотной деградации (табл. 3), можно отличить друг от друга по наличию в щелочных гидролизатах их клеточных стенок моно- и бисфосфатов рибита у N. alba.
6.2. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифический маркер актиномицетов рода Glycomyces
В данном разделе проанализированы собственные результаты исследования клеточных стенок 5 штаммов трех видов рода Glycomyces (семейство Glycomycetaceae подпорядок Glycomycineae): G. harbinensis (три штамма) и G. rutgersensis, а также G. tenuis, правомочность выделения которых подтверждена данными ДНК-ДНК гибридизации и анализа последовательностей 16S рРНК генов (Labeda et al., 1985).
Виды рода Glycomyces хорошо идентифицируются при сравнении набора и структур ТК клеточных стенок, установленных химическими и ЯМР спектроскопическими методами (табл. 4). Вид G. tenuis характеризуется наличием в клеточных стенках редко встречающейся
Таблица 4. Тейхоевые кислоты клеточных стенок видов рода Glycomyces.
| Тейхоевая кислота | G. tenuis | G. rutgersensis | G. harbinensis (три штамма) |
| 1,4-Поли(эритритфосфат), замещенный по С2(3) эритрита -глюкозамином | | | |
| 1,3-Поли(глицерофосфат), замещенный по С2 глицерина -глюкозой ТК1 | | | |
| 2,3-Поли(глицерофосфат), замещенный по С1 глицерина -глюкозой ТК2 | | | |
эритриттейхоевой кислоты (Potekhina et al., 1993). Для вида G. rutgersensis характерным оказался 1,3-поли(глицерофосфат) практически полностью замещенный по гидроксилам при С2 глицерина -глюкозой, а в клеточных стенках у всех штаммов вида G. harbinensis были обнаружены одновременно две ТК: 1,3-поли(глицерофосфат), замещенный по гидроксилам при С2 глицерина -глюкозой (ТК1) и 2,3-поли(глицерофосфат), замещенный по гидроксилам при С1 глицерина -глюкозой (ТК2), причем количественное соотношение этих двух ТК варьировало в зависимости от штамма (см. ниже).
И в данном случае в качестве дифференцирующих характеристик видов можно использовать продукты кислотной (HCl и HF) и щелочной деградации как самих полимеров, так и нативных клеточных стенок изучаемых организмов: глицерин, эритрит, глюкоза, глюкозамин, различные гликозиды – все эти соединения могут быть легко определены с использованием методов хроматографии и электрофореза.
Изучение спектров 13С ЯМР ТК клеточных стенок видов рода Glycomyces показало, что они значительно различаются между собой (рис. 6), поэтому соответствующие им полимеры можно идентифицировать при наличии соответствующих баз данных по химическим сдвигам.
Характерными явились химические сдвиги в аномерной области атомов углерода при 99,7 м.д. (рис. 6). Учитывая интегральные интенсивности сигналов углеродных атомов ТК1 и ТК2, было вычислено, что в клеточной стенке G. harbinensis NRRL 16897 ТК2 в два раза больше, чем ТК1. Анализ гликозидов, полученных из клеточных стенок двух других штаммов G. harbinensis IFO 14487T и G. harbinensis ВКМ Ас-1247Т показал, что ТК1 и ТК2 находятся в них примерно в одинаковом количестве. Следует учесть, что все три исследуемых штамма были выращены в стандартных условиях – до середины логарифмической фазы роста. Эти данные, вероятно, можно расценивать как штаммовые различия внутри вида G. harbinensis, выявленные с помощью ЯМР-спектроскопических методов анализа.
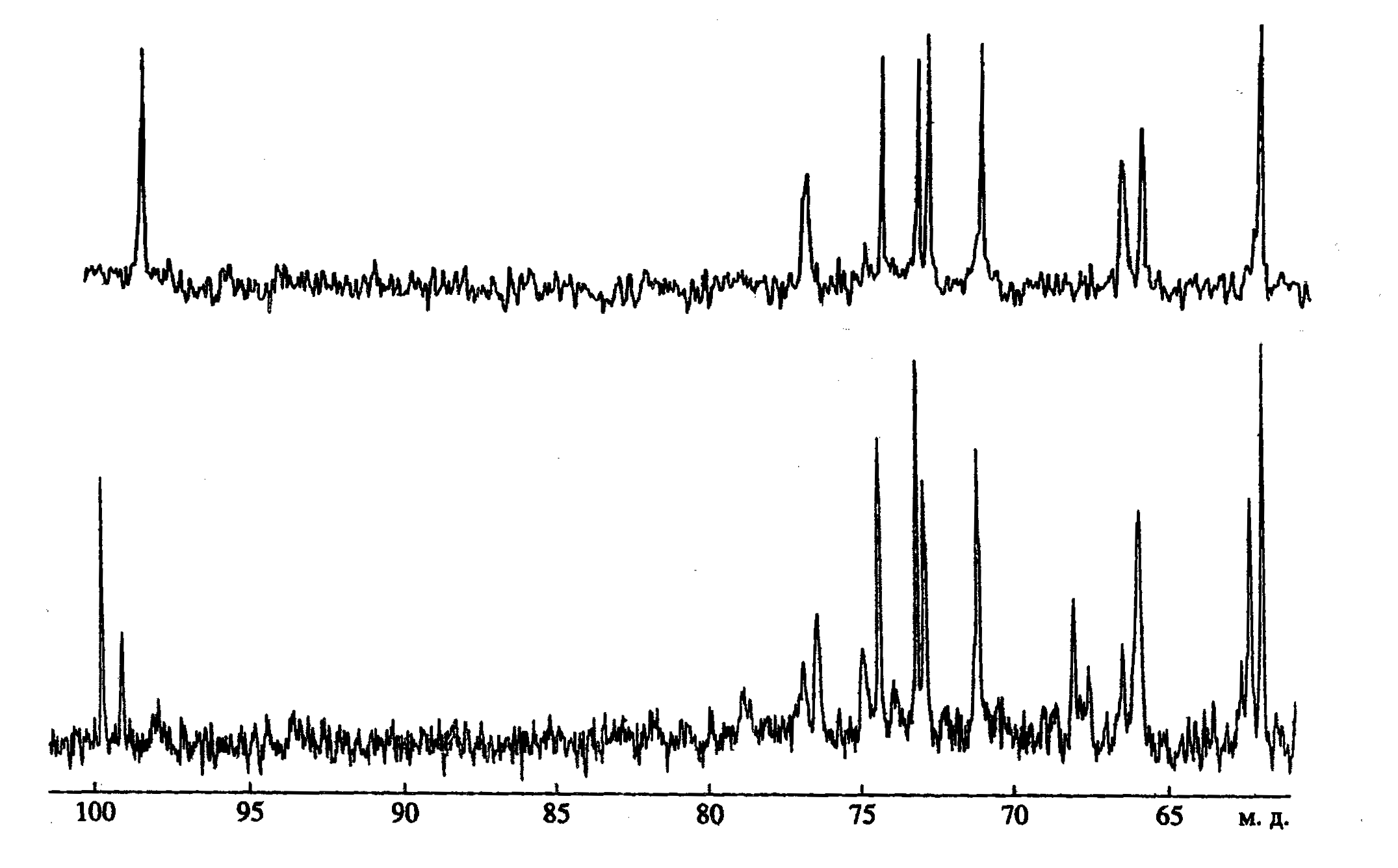
Рис. 6. 13С ЯМР спектры ТК клеточных стенок видов рода Glycomyces. Вверху – для G. rutgersensis, внизу – для G. harbinensis.
6.3. Структуры и набор тейхоевых кислот клеточных стенок как видоспецифические маркеры видов и подвидов рода Nocardioides.
Род Nocardioides (семейство Nocardioidaceae, подпорядок Propionibacterineae) был предложен в 1976 году Г. Праузером (Prauser, 1976) для нокардиоформных актиномицетов с Nocardioides albus в качестве типового вида.
В данном разделе проанализированы собственные результаты обследования клеточных стенок 17 штаммов из этого рода, принадлежащих, как было установлено, к 5-ти видам.
Предварительные исследования клеточных стенок видов рода Nocardioides показали, что ТК, наличие которой определяли по образовавшимся фосфорным эфирам после кислотного гидролиза клеточных стенок, присутствует у N. albus, N. luteus, N. prauseri и N. jensenii, тогда как у N. plantarum – нет. Структуры ТК установлены для видов N. albus, N. luteus и «N. albus» (см. раздел 5.3.), образующих хорошо развитый ветвящийся вегетативный мицелий, и характеризующихся высокой степенью сходства по морфологии и некоторым физиологическим признакам.
В работе изучены образующие мицелий изоляты с белыми колониями (ВКМ Ac-562, ВКМ Ac-563, ВКМ Ac-564, ВКМ Ac-565, ВКМ Ac-566, ВКМ Ac-567, ВКМ Ac-568), выделенные из почв разных регионов. Вследствие большого сходства с видом N. albus (колонии белого цвета и некоторые физиологические признаки) эти изоляты были описаны как штаммы названного вида (Евтушенко и Зеленкова, 1989).
Однако все изученные изоляты содержали в клеточных стенках ТК, идентичную таковой из клеточных стенок N. luteus ВКМ Ас-1246Т, что предполагало их ближайшее родство именно с данным видом.
Изучение ДНК-ДНК гомологии показало, что все упомянутые изоляты имеют 37-45% сходства с N. albus ВКМ Ac-805T, тогда как с N. luteus ВКМ Ас-1246Т – 63-74%, что указывало на их принадлежность к тому же геномовиду (Wayne et al., 1987), что и ВКМ Ас-1246Т.
Кроме того, обнаружено, что и другие изученные в работе штаммы рода Nocardioides (ВКМ, рабочая коллекция: ВКМ AcW-29146, AcW-29169, AcW-29196, а также DSM 46114, DSM 46115) содержали в клеточных стенках ТК полностью идентичную таковой из клеточных стенок N. luteus ВКМ Ас-1246Т, и, следовательно, также скорее всего принадлежали к виду N. luteus – очевидно, наиболее распространенному в природе виду этого рода.
Полученные результаты показали, что члены двух геномовидов, N. albus и N. luteus (включающий штаммы с белой окраской колоний), легко дифференцируются по структуре их ТК, а также по некоторым компонентам их клеточных стенок, таким как рибит и глицерин, которые легко определяются хроматографически в гидролизатах клеточных стенок.
Таким образом, наши исследования позволили уточнить диагноз двух видов рода Nocardioides:
Nocardioides albus. В дополнение к признакам, данным Г.Праузером (1976, 1989), вид характеризуется наличием в клеточных стенках галактозы и глицерина и содержит ТК. ТК является поли(галактозилглицерофосфатом), в котором -D-галактопиранозильные остатки по гидроксилам при С4 замещены -D-глюкопиранозой, несущей по гидроксилу при С4,6 кетально связанную пировиноградную кислоту S-конфигурации; соотношение пиранозной и фуранозной форм галактозы 7 : 1.
Nocardioides luteus В дополнение к признакам, данным Г.Праузером (1984, 1989): вид характеризуется белой или желтой окраской воздушного мицелия; клеточнык стенки содержат галактозу, рибит и ТК. ТК является 1,5поли(рибитфосфатом), замещенным -D-галактопиранозой, несущей по гидроксилу при С4,6 кетально связанную пировиноградную кислоту R-конфигурации, соотношение пиранозной и фуранозной форм галактозы от 3 : 1 до 5 : 1.
Штамм “Nocardioides albus” ВКМ Ас-806 был выделен и описан Г. Праузером. Он характеризовался обильно ветвящимися гифами, растущими на поверхности и внутри агаризованных сред и образовывал нерегулярно ветвящийся или неветвящийся воздушный мицелий. И первичный, и воздушный мицелий распадался на неправильные палочковидные или кокковидные фрагменты, не способные к движению. Цвет колоний был белый, организм не синтезировал кислоту из L-рамнозы и сахарозы. На основании этих свойств он был причислен к виду Nocardioides albus.
Однако уровень сходства ДНК с обоими референтными типовыми штаммами оказался низким и составил: 36,0% с N. аlbus ВКМ Ас-805 Т и 52,2% с N. luteus ВКМ Ac-1246T. Это свидетельствовало о том, что N. аlbus ВКМ Ас-806 представлял собой третий геномовид, и его таксономическое положение, таким образом, оставалось неопределенным.
Кроме того этот штамм отличался как от N. аlbus, так и от N. luteus по составу клеточной стенки (от последнего вида – в меньшей степени).
Так в клеточной стенке ВКМ Ас-806 обнаружено по меньшей мере две ТК: одна из которых полностью идентична рибиттейхоевой кислоте из клеточной стенки N. luteus, за исключением того, что соотношение Galp:Galf составляло 1:1, вторая имела поли(рибитфосфатную) природу, с рамнозой в качестве заместителя. Таким образом, штамм ВКМ Ас-806 дифференцирован от N. luteus соотношением Galp и Galf (1Н ЯМР-спектр, сигналы при 5,34 и 5,04 м.д.) и присутствием бόльшего количества рамнозы в гидролизатах ТК или клеточной стенки (см. раздел 5.3.). Эту разницу легко установить методами хроматографии или ЯМР-спектроскопией, сигнал при 18 мд (рис. 7).
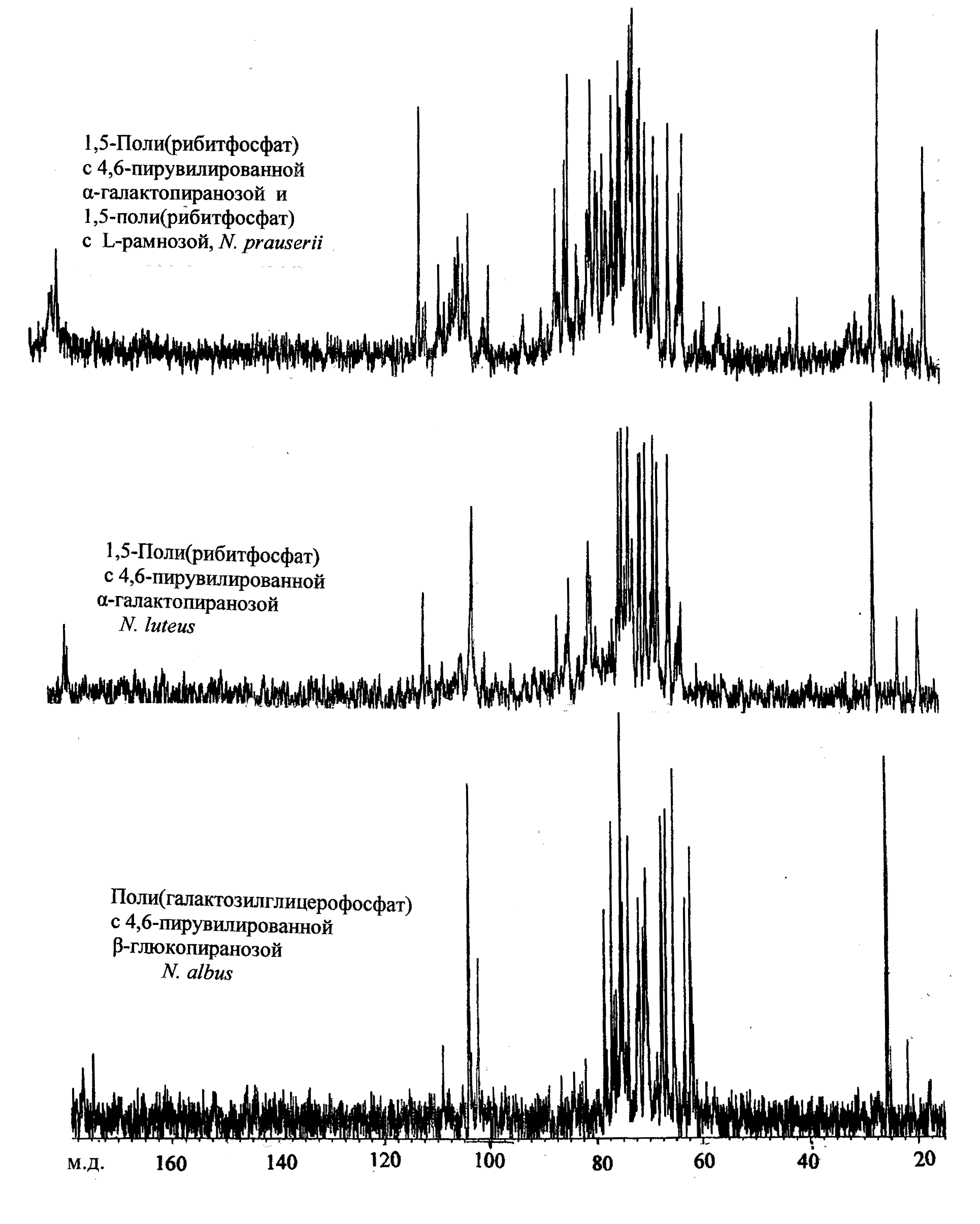
Рис. 7. 13С ЯМР-спектры ТК клеточных стенок видов Nocardioides.
От N. аlbus штамм ВКМ Ас-806 хорошо дифференцируется по наличию рибита и рамнозы (см. раздел 5.3., рис. 7) в гидролизатах ТК или клеточных стенок, которые также легко определяются методами хроматографии.
13С ЯМР-спектры ТК для представителей данного рода могут являться фингерпринтами при идентификации видов (рис. 7).
Принимая во внимание все обнаруженные различия в хемотаксономических признаках изученных видов, а также данные об их ДНК-ДНК гибридизации (36,0-52,2%), также как и существующее определение этих актинобактерий (Wayne et al., 1987), нами был предложен новый вид в составе рода Nocardioides, названный Nocardioides prauseri sp. nov, в честь германского микробиолога Гельмута Праузера, который внес большой вклад в систематику актиномицетов и описание рода Nocardioides (Tul’skaya et al., 2003).
Таким образом, клеточные стенки изученных представителей видов рода Nocardioides содержали ТК разной структуры, что подтверждает видоспецифичность структур ТК внутри этого рода. Наличие пировиноградной кислоты и β-галактофуранозы в структуре полимеров может являться признаком, характерным для изучаемого рода.
6.4. Тейхоевые кислоты клеточных стенок как хемотаксономический маркер кластер-вида “Streptomyces violaceusniger”.
Род Streptomyces семейства Streptomycetaceae является в настоящее время наиболее многочисленным по видовому составу среди бактерий (включает более 500 видов). На протяжении многих лет стрептомицеты как продуценты новых биологически активных природных соединений зачастую необоснованно описывались как новые виды в связи с патентованием, и к началу 70-х годов род насчитывал около 3000 видов, большинство из которых не были включены в Список одобренных наименований (Anderson and Wellington, 2001; Kämpfer, 2006). Достоверная дифференциация близких видов и описание новых внутри групп филогенетически близких организмов по-прежнему остаётся неразрешенной проблемой в терминах традиционных фенотипических характеристик. К одной из таких групп относится фенокластер “S. violaceusniger” (включающий виды S. violaceusniger, S. Castelarensis, S. melanosporofaciens, S. hygroscopicus, S. еndus и ряд других). Видовой статус перечисленных организмов, характеризующихся серым воздушным мицелием, спиральными спороносцами
Таблица 5. Отличительные характеристики ТК изученных стрептомицетов.
| Характеристика | S. melanosporo-faciens ВКМ Ас-1864Т | S. castelarensis ВКМ Ас-832Т | S. hygroscopicus ssp. hygroscopicus ВКМ Ас-831Т | S. endus ВКМ Ас-1331Т | S. endus ВКМ Ас-129 | S. violaceusniger ВКМ Ас-583Т | S. sparsogenes ВКМ Ас-1744 Т |
| Преобладающая ТК3 – 1,3-поли(глицерофосфат) с α-глюкозаминильными заместителями | |||||||
| Степень замещения α-N-ацетилглюкозамином и α-N-глюкозамином, % | 57 | 33 | 66 | 50 | 47 | 40 | - |
| Доля α-N-ацетил-глюкозамина, % | 100 | 83 | 83 | 45 | 50 | 55 | - |
| 1,3-Поли(глицеро-фосфат) с тетраса-харидом | - | - | - | - | - | - | |
| Продукты HF-гидролиза ТК или клеточных стенок | |||||||
| N-ацетилглюкоз-аминилглицерин | | | | | | | |
| Глюкозаминил-глицерин | | | | | | | |
| Трисахарид | | | | | | | |
и складчатой поверхностью спор (Williams et al., 1983а; Al-Tai et al., 1999, подтверждён данными ДНК-ДНК гибридизации (Labeda and Lyons, 1991b; Kumar and Goodfellow, 2008). С целью поиска критериев, дифференцирующих фенотипически и филогенетически близкие
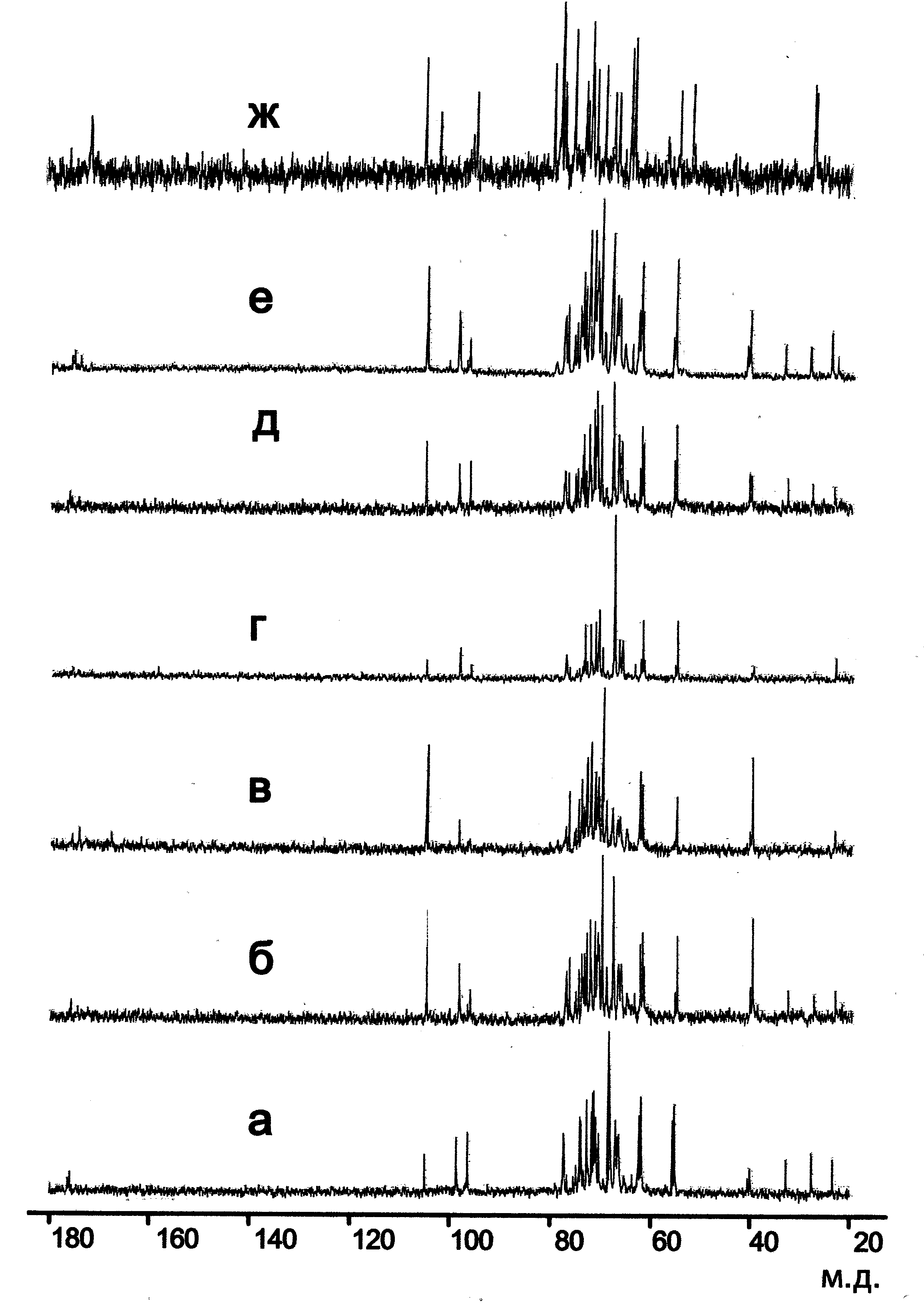
Рис. 8. 13C ЯМР-спектры суммарных препаратов анионных углеводсодержащих полимеров клеточных стенок изучаемых стрептомицетов.
а – S. endus ВКМ Ас-1331Т; б – S. endus ВКМ Ас-129; в – S. hygroscopicus ssp. hygroscopicus ВКМ Ас-831Т; г – S. castelarensis ВКМ Ас-832 Т; д – S. violaceusniger ВКМ Ас-583 Т; е – S. melanosporofaciens ВКМ Ас-1864Т; ж – S. sparsogenes ВКМ Ас-1744 Т.
виды группы “S. violaceusniger” (до 99,8% сходства генов 16S рРНК), было проведено сравнительное изучение ТК их клеточных стенок.
Сходство структуры преобладающей ТК – 1,3-поли(глицерофосфатный) кор с непосредственно присоединенным к остаткам глицерина α-глюкозамином – является еще одним свидетельством того, что филогенетически близкие организмы имеют высокое сходство. Кроме того, клеточные стенки изученных организмов (за исключением филогенетически более удаленного S. sparsogenes) содержали в дополнение к преобладающей ТК незамещенные 1,3- и 2,3-поли(глицерофосфатные) полимеры в минорном количестве. Цепи имеют также О-ацетильные и О-лизильные группы.
Штаммы близких видов кластера “ S. violaceusniger” (S. melanosporofaciens, S. castelarensis, S. hygroscopicus, S. endus и S. violaceusniger) имели разную степень замещения основного полимера (66%; 50%; 40%) и различались по соотношению ацетилированных и неацетилированных глюкозаминильных заместителей (83%; 45%; 55%), выявляемых методом ЯМР-спектроскопии (табл. 5; рис. 8).
Кроме того, S. melanosporofaciens легко дифференцируется от штаммов видов S. hygroscopicus, S. endus и S. violaceusniger по наличию единственного гликозида в HF-гидролизатах клеточных стенок или суммарного препарата полимеров из нее, определяемого с помощью хроматографических методов.
S. sparsogenes, также входящий в фенокластер “S. violaceusniger” (Williams et al., 1983а), но имеющий шиповатую поверхность спор, значительно отличался от вышеперечисленных видов по составу полимеров, и содержал в клеточной стенке две ТК: минорную – незамещенный 1,3-поли(глицерофосфат) и основную – с тетрасахаридом в качестве заместителя по гидроксилам при С2 остатков глицерина. Впоследствии было показано, что этот вид более удален от других исследованных штаммов и на филогенетическом уровне (Kumar and Goodfellow, 2008).
Следует также отметить, что спектры 13С ЯМР полимеров клеточных стенок представителей фенокластера “ S. violaceusniger” в целом имеют некоторые индивидуальные особенности и в данном случае могут быть также использованы как фингерпринты, полезные для дифференциации видов исследуемой группы (рис.8).
Сравнительный анализ собственных результатов исследования организмов рода Streptomyces (представители 3-х фенокластеров, Тульская и др., 1997а; 2003а; 2007а, б; Shashkov et al., 2002a) и литературных данных (5 фенокластеров, работы Стрешинской с соавт.) показывает, что имеется высокая степень корреляции между структурными особенностями тейхоевых кислот и гликополимеров клеточных стенок, с одной стороны, и генотипическими характеристиками организмов, с другой. Ряд фенокластеров, неоднородных по составу полимеров, гетерогенен также и на филогенетическом (геномном) уровне. Штаммы с высоким сходством ДНК-ДНК (55-70%) имеют практически идентичные анионные полимеры клеточных стенок и могут различаться некоторыми нюансами, например, фенокластер “S. violaceusniger”, кластер-вид Streptomyces griseoviridis, кластер-вид Streptomyces cyaneus и др. Результаты исследований открывают новые возможности в решении задачи по уточнению границ видов и реорганизации таксономической структуры рода Streptomyces в целом на основе полифазного подхода.
