Московский государственный университет имени М. В. Ломоносова биологический факультет на правах рукописи
| Вид материала | Автореферат |
- М. В. Ломоносова биологический факультет н а правах рукописи Столяров Андрей Павлович, 657.12kb.
- Xxi столетия Дунаева Светлана Олеговна, 37.07kb.
- Институциональное развитие местного самоуправления в российской федерации 23. 00., 689.31kb.
- Факультет дополнительного образования, 54.13kb.
- На правах рукописи, 514.74kb.
- Секция «почвоведение» Кинетика поглощения гуминовых кислот угля проростками пшеницы, 2613.34kb.
- Модель оценки инвестиционного климата российских регионов в условиях неопределенности, 111.18kb.
- М. В. Ломоносова филологический факультет слово грамматика речь выпуск II сборник научно-методических, 97.35kb.
- На правах рукописи, 584.81kb.
- Московский государственный университет им. М. В. Ломоносова Факультет иностранных языков, 296.78kb.
Материальной основой выявления разнообразия, различных функций в жизни микроорганизма и возможности применения ТК и гликополимеров клеточных стенок в таксономии актиномицетов является знание структур этих соединений. В настоящей главе приведены сведения, касающиеся установления структур полимеров клеточных стенок актиномицетов, изученных в работе.
5.1. Структуры тейхоевых кислот клеточных стенок видов и подвидов рода Nocardiopsis
В данном разделе приведены структуры ТК клеточных стенок 29 штаммов, принадлежащих 9 видам и подвидам актиномицетов рода Nocardiopsis, установленные нами.
N. dassonvillei ssp. dassonvillei и N. dassonvillei ssp. antarctica. Подробное изучение структуры ТК клеточных стенок с получением и исследованием фосфорных эфиров и гликозида различными химическими методами, определение соотношений компонентов их составляющих, определение молекулярной массы ТК, а также ЯМР-спектроскопические исследования проводили на трех штаммах N. dassonvillei ssp. dassonvillei (ВКМ Ас-797Т, ВКМ Ас-773, IMRU 504), а также N. dassonvillei ssp. antarcticus ВКМ Ас-836T. Позднее аналогичным образом были исследованы ТК 15-ти изолятов из почв Сейшельских островов.
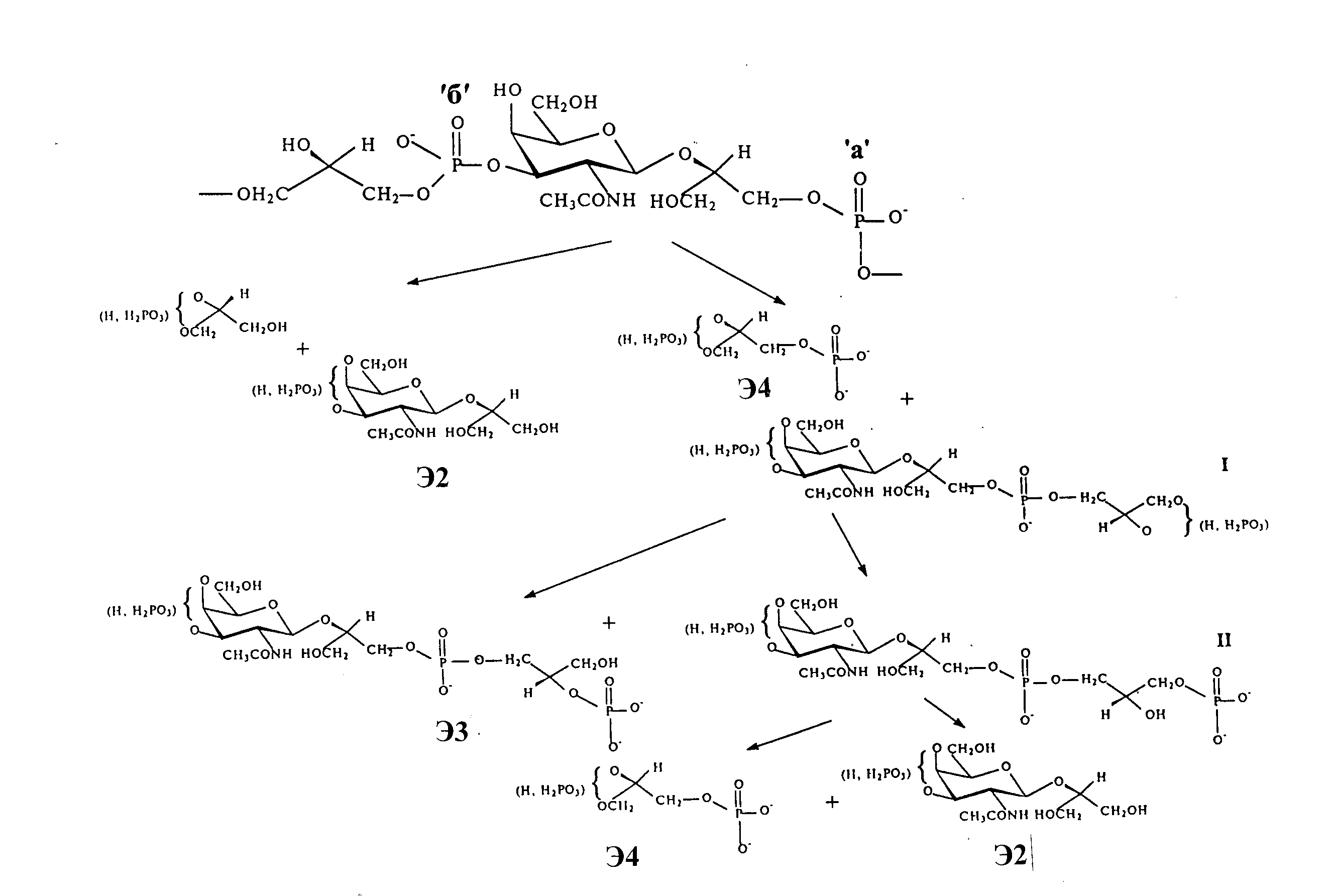
Рис. 1. Повторяющееся звено и схема щелочного гидролиза ТК клеточных стенок N. dassonvillei ssp. dassonvillei и N. dassonvillei ssp. аntarcticа. Возможные пути щелочного гидролиза обозначены ′a′ и ′б′
Кислотный гидролиз ТК привел к образованию моно- и бисфосфатов глицерина, галактозамина, глицерина, неорганического фосфора и фосфорного эфира 1 (Э1). Последний был идентифицирован как монофосфорный эфир галактозамина. Основным продуктом HF-деградации полимера был гликозид 1 (Г1), который оказался -GalpNAc-(1→2)-snGro. Наибольшая информация о структуре исследуемого полимера была получена при исследовании продуктов его щелочного гидролиза (рис. 1). При этом образовался ряд эфиров, основными среди которых были: Э2, идентифицированный как -GalpNAc-(1→2)-snGro-(3-P; быстро движущийся к аноду эфир Э3, который содержал два остатка глицерина, один N-ацетилгалактозаминильный остаток и три фосфатных группы [P-3/4)-GalpNAc-(1→2)- snGro-(3-P-1)-snGro-(2-P], а также моно- и бисфосфат глицерина (Э4). В работе рассмотрены пути щелочного гидролиза, имеющие место при небычной структуре полимера, что подтверждает вновь обнаруженную структуру (рис.1).
Независимо было проведено ЯМР спектроскопическое изучение препаратов ТК изучаемых организмов. В составе повторяющегося звена полимера найдены 2-ацетамидо-2-дезокси-β-D-галактопираноза с фосфатным остатком по гидроксилу при С3 и незамещенный остаток глицерина с неэквивалентными фосфатными группами и идентифицированы все сигналы этих остатков в спектре 13С-ЯМР (рис. 1). Оставшиеся три сигнала, несомненно, принадлежали еще одному остатку глицерина, алкилированному по гидроксилу при С2 и фосфорилированному по гидроксилу при С3. Об этом свидетельствовал слабопольный сдвиг сигнала при 80,20 м.д. (СН-группа согласно АРТ-спектру) и его расщепление в дублет, а также уширение пика при 65,55 м.д. и отсутствие расщепления или уширения пика при 62,15 м.д. (СН2-группы). В результате всех экспериментов была реконструирована структура ТК (рис. 1, 6 а). Все 19 изученных штаммов, принадлежащих виду N. dassonvillei ssp. dassonvillei (впоследствии N. antarcticus был переведен в N. dassonvillei ssp. аntarcticа) содержали в клеточной стенке около 20% ТК идентичной уникальной структуры, относящейся к новому IV типу (смешанная структура, Naumova et al., 2001). Молекулярная масса полимера около 6,4 кДа, что соответствует 11-13 повторяющимся поли(глицерофосфат-β-N-ацетилгалактозаминилглицерофосфатным) звеньям. ТК такой структуры дает необычные продукты щелочного гидролиза (рис. 1), включая так называемый фосфодиэфир Э3 (Тульская и др., 1992; Tul’skaya et al., 1993).
N. synnemataformans Ас-2518Т. Продукты кислотного и щелочного гидролизов клеточных стенок и препаратов ТК были аналогичны таковым для N. dassonvillei ssp. dassonvillei. Среди них был и характерный эфир Э3. Это позволило предположить, что препарат из клеточной стенки N. synnemataformans Ас-2518Т содержит ТК идентичную таковой из N. dassonvillei ssp. dassonvillei. Предположение было подтверждено ЯМР-спектроскопическими методами анализа. Однако анализ одномерного 31Р ЯМР-спектра и корреляционных пиков в двумерном 1Н,31Р HМQC спектре обнаружили отличия в структурных фрагментах, содержащих фосфор: -1)-snGro-(3-P-3)--GalpNAc-(1 и -1)-snGro-(3-P-4)--GalpNAc-(1.
Таким образом, в клеточной стенке N. synnemataformans Ас-2518Т обнаружены две ТК: основная – поли(глицерофосфат--N-ацетилгалактозаминилглицерофосфат), такая же как у N. dassonvillei ssp. dassonvillei и минорная – поли(глицерофосфат--N-ацетилгалактозаминилглицерофосфат), в которой фосфодиэфирная связь осуществляется по гидроксилам при С3 глицерина и С4 -N-ацетилгалактозамина, причём цепь не несёт никаких заместителей; ТК такой структуры (рис. 6 б) обнаружена впервые (Tul’skaya et al., 2007).
N. halotolerans Ас-2519Т. Профили кислотного и щелочного гидролизов клеточной стенки и препарата ТК из нее соответствовали таковым для N. synnemataformans Ас-2518Т. Кроме того, была идентифицирована пировиноградная кислота. Таким образом, можно было предположить, что и в данном случае имеем дело с ТК, подобной таковой из N. dassonvillei ssp. dassonvillei. Некоторую неясность вносило наличие пировиноградной кислоты. Локализовать фосфодиэфирные связи, а также место присоединения пировиноградной кислоты удалось лишь с помощью ЯМР-спектроскопических методов.
Характерной особенностью спектра ЯМР 13С препарата было наличие в нем пиков с химическими сдвигами 26,2 м.д. (СН3 группа согласно АРТ) и 174,2 м.д. (С=О), что с учетом сигнала при 100,2 м.д., принадлежащего четвертичному атому углерода (тест на число присоединенных протонов, АРТ, Patt and Shoolery, 1982), позволяло предположить наличие пируватных остатков в полимере. В спектре ЯМР 13С сигналы одного из остатков -GalpNAc имели химические сдвиги С4 и С6 отличные от соответствующего остатка со свободными гидроксилами при С4 и С6. Эти отличия были характерными для замещения остатка пируватом по С4 и С6 (Jansson et al, 1993), что позволяло локализовать пируватную группировку при соответствующих атомах углерода в части остатков -GalpNAc полимерной цепи препарата. Химический сдвиг 13С метильной группы пируватного остатка (26,2 м.д.) свидетельствовал об экваториальной ориентации метильной группы в шестичленном 4,6-ацетальном цикле (R-конфигурация ацетального центра). Анализ двумерных спектров ЯМР, включая спектр 1Н,31Р HМQC показал, что большая часть (90%) остатков -GalpNAc-4,6-R-Pyr имеют фосфатную группу по гидроксилу при С3, остальные остатки, находящиеся, по-видимому, на растущем конце цепи, несут при С3 свободный гидроксил. Помимо перечисленных структурных фрагментов в препарате обнаружены фрагменты с -GalpNAc, несущей фосфатные группы по гидроксилам при С4 и С3, но без пируватной группировки в последней. Приблизительное соотношение остатков с пируватом -Р-3)--GalpNAc-4,6-R-Pyr и без пирувата -Р-3)--GalpNAc, найденное по интегральным интенсивностям соответствующих сигналов в спектре ЯМР 13С, составляло 3,5 : 1. Соотношение остатков с фосфатной группировкой по гидроксилам при С3 и С4 -N-ацетилгалактозамина определено как 10,5 : 1.
Таким образом, в клеточной стенке N. halotolerans Ас-2519Т обнаружены две ТК. Основная поли(глицерофосфат--N-ацетилгалактозаминилглицерофосфат), с пировиноградной кислотой по гидроксилам при С4,6 галактозамина. ТК такой структуры найдена впервые. Минорная – соответствовала таковой из N. synnemataformans Ас-2518Т (рис. 6 в, Tul’skaya et al., 2007).
N. alba ВКМ Ас-1883Т, ВКМ Ас-1879 и ВКМ Ас-1884. Результаты изучения структур ТК трех штаммов актиномицетов вида N. alba были идентичны для всех трех штаммов за исключением некоторых количественных отличий. Кислотные гидролизаты препаратов содержали глицерин, рибит, фосфорные эфиры этих полиолов и глюкозамин, что позволило предположить присутствие нескольких ТК. На это указывали данные электрофоретического исследования препаратов: были обнаружены три фосфорсодержащие зоны с подвижностью: фракция I – mGroP 1,4; фракция II – mGroP 1,57; фракция III – mGroP 1,96. Очистку и разделение ТК, выделенных из обезжиренного мицелия, осуществляли методом ионообменной хроматографии на DEAE-Toyopearl 650M. Были получены три фракции, содержащие фосфор (рис. 2).
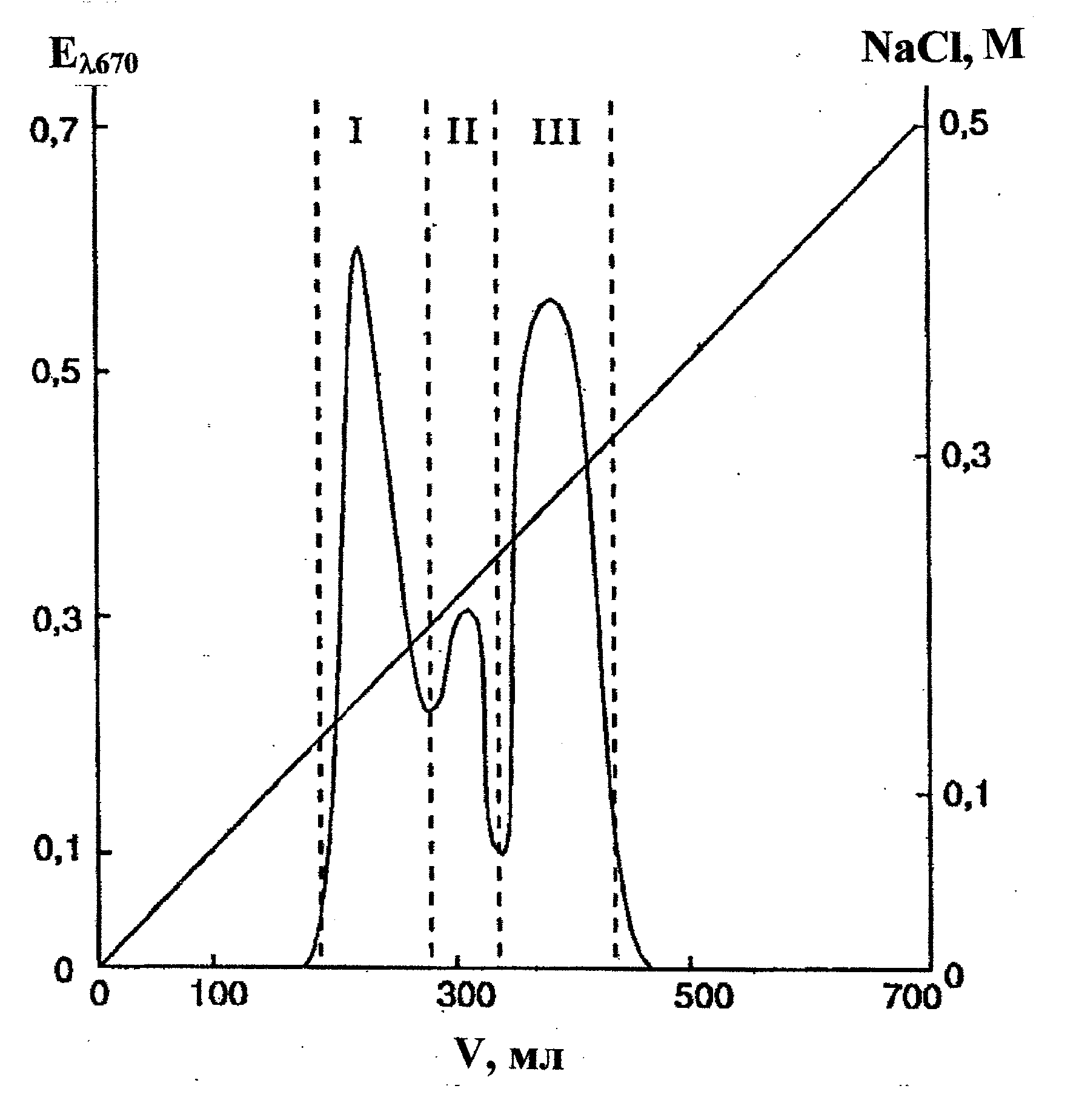
Рис.2. Ионообменная хроматография препарата ТК клеточной стенки N. alba Ас-1879 на DEAE Toyopearl 650M в линейном градиенте NaCl (00,5 М) в 50 мМ Tris-HCl-буфере, рН 7,2 (колонка 16.5х500 мм; скорость протока 2 мл/мин; объем фракции 4 мл); I, II, III фракции тейхоевых кислот
Фракция I, элюирована при 0,16–0,19 М NaCl. Продукты кислотной и щелочной деградации указывали на поли(рибитфосфатную) природу ТК1 без заместителей (табл. 1). При периодатном окислении ТК1 образовался формальдегид в эквимольном
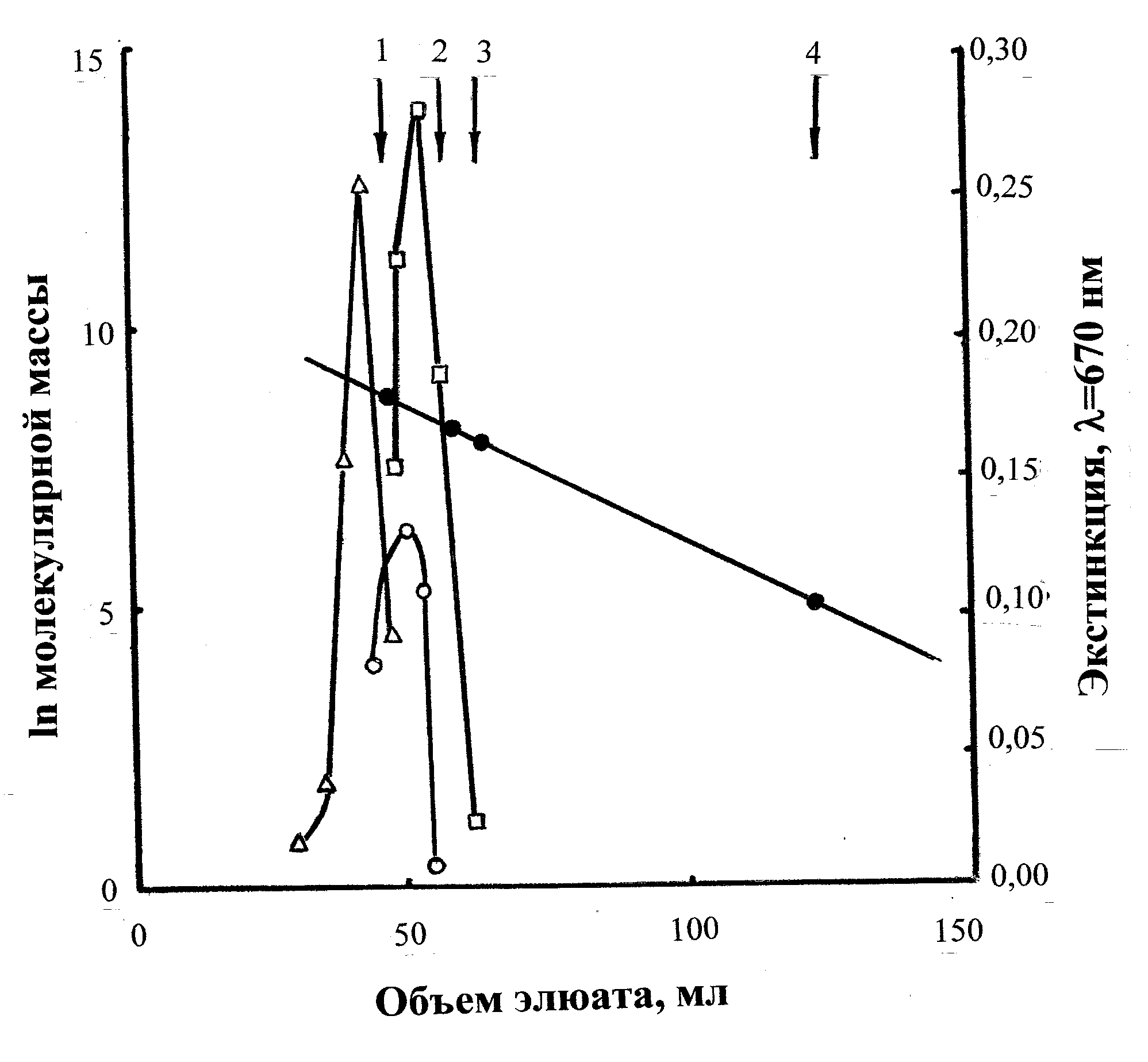
Рис. 3. Определение молекулярной массы ТК клеточной стенки N. alba (сефадекс G-50, колонка 9909,5 мм; объем фракции 2 мл). Стандартные вещества: (1) –ТК Streptomyces antibioticus, 7,0 кДа (Shashkov et al., 1979); (2) – ТК S. violaceus, 4,0 кДа (Наумова и др., 1969); (3) – ТК S. azureus, 3,3 кДа (Стрешинская и др., 1981); (4) – монофосфат глицерина; ○ – ТК1; Δ –ТК2; □ – ТК3
отношении к фосфору, что указывало на необычное положение фосфодиэфирной связи. Исходя из имеющихся данных о биосинтезе ТК [от соответствующего нуклеотида к растущей цепи переносится D-рибит-5-фосфат (Baddiley, 1972)], в образовании фосфодиэфирной связи должна участвовать гидроксильная группа при С5 рибита. Тогда вторая гидроксильная группа, участвующая в образовании фосфодиэфирной связи, находится при С3 рибита. Молекулярная масса полимера составила 5,6 кДа (рис. 3), соответственно, цепь полимера состояла из 26-27 рибитфосфатных звеньев. Предполагаемая структура подтверждена методами ЯМР-спектроскопии. Таким образом, ТК 1 представляла собой незамещенный 3,5-поли(рибитфосфат) и являлась новой структурой, рис. 6 ж, (Tul’skaya et al., 1995).
Фракция II, элюирована при 0,22 М NaCl. Профили кислотного и щелочного гидролизов фракции указывали на поли(глицерофосфатную) природу ТК2 (табл. 1), в состав которой в качестве заместителя входит глюкозамин. В HF-гидролизатах ТК2 обнаружен гликозид, идентифицированный как GlcpNAc-(1→2)-snGro. Учитывая структуру гликозида, а также факт образования при щелочном гидролизе полимера щелочестабильных фосфодиэфиров глицерина, был сделан вывод, что ТК2 является 1,3-поли(глицерофосфатом), в котором часть глицериновых остатков замещена N-ацетилглюкозамином. Молекулярная масса ТК2 составляла 7,6 кДа, что соответствует, исходя из мольного содержания компонентов полимера, 40-41 глицерофосфатному звену (рис. 3). Спектр 13С-ЯМР ТК2 был типичным для замещенного на 10% α-N-ацетилглюкозамином 1,3-поли(глицерофосфата), рис. 6 з, (Tul’skaya et al., 1995).
Фракция III, элюирована при высокой концентрации NaCl (~ 0,3 М). Это указывало на бόльший отрицательный заряд ТК3 из этой фракции, чем у ТК1 и ТК2 (рис. 2), что подтверждадено высокой подвижностью ТК3 в электрическом поле (mGroP 1,96). Продукты кислотного гидролиза свидетельствовали о поли(рибитфосфатной) природе ТК3 (табл. 1), а идентифицированная при этом пировиноградная кислота, видимо, являлась заместителем в молекуле изучаемой ТК. Устойчивость ТК3 к действию щелочи свидетельствовала об отсутствии свободных гидроксильных групп, соседних с фосфодиэфирными группами (Kelemen and Baddiley, 1961), а устойчивость к периодатному окислению указывала на отсутствие в полимере незамещенных гликольных группировок. Можно было предположить, что рибитные остатки замещены пировиноградной кислотой, связанной кетальной связью, которая стабильна в щелочных условиях (Thurow et al., 1975). Молекулярная масса ТК3 составляла 5,4 кДа, что соответствует примерно 18 повторяющимся звеньям (рис. 3).
ЯМР-спектроскопическое исследование подтвердило предполагаемую структуру: 1,5-поли(рибитфосфат) полностью замещенный по гидроксилам при С2,4 рибита кетально связанной пировиноградной кислотой (рис. 6 и). ТК такой структуры выявлена впервые (Tul’skaya et al., 1995).
Соотношения найденных ТК в клеточных стенках трех изучаемых штаммов, установленные при количественном определении глицерина и рибита в них с учетом полного замещения рибитных остатков пировиноградной кислотой в ТК3, разные. Является ли этот факт штаммовым признаком – предмет дальнейших исследований на большей выборке штаммов одного вида.
N. prasina ВКМ Ас-1880Т. В кислотных гидролизатах клеточной стенки и ТХУ-препарата обнаружены фосфорные эфиры глицерина и рибита, что могло свидетельствовать о присутствии нескольких ТК. Разделение и очистку ТК, выделенной из целого обезжиренного мицелия, осуществляли с помощью метода ионообменной хроматографии на DEAE-Toyopearl 650M. Были получены две фосфорсодержащие фракции.
ТК из фракции I (элюирована при 0,17 М NaCl) и фракции II (элюирована при 0,22 М NaCl) соответствовали таковым из клеточных стенок N. alba, что было подтверждено химическими и ЯМР-спектроскопическими методами исследования (рис. 6 ж, з). ТК1 представляла собой незамещенный 3,5-поли(рибитфосфат), но с бóльшей молекулярной массой − 9,4 кДа, что соответствует 41 рибитфосфатной единице. ТК2 являлась 1,3-поли(глицерофосфатом), на 10% замещенным α-N-ацетилглюкозамином и на 5% О-ацетильными остатками, последнее, также как и несколько мéньшая молекулярная масса (6,0 кДа, что соответствовало 33 глицерофосфатным единицам), отличало эту ТК от ТК2 из N. alba (Тульская и др., 2000).
N. composta ВКМ Ас-2520 и N. composta ВКМ Ас-2521T. Продукты кислотного и щелочного гидролизов клеточных стенок этих организмов, также как и препаратов ТК из них свидетельствовали о глицерофосфатной природе ТК (табл. 1), замещенной глюкозамином. Образовавшиеся при HF-гидролизе гликозид, идентифицированный как GlcpNAc-(1→2)-snGro, а при щелочном гидролизе фосфодиэфир глицерина с N-ацетилглюкозамином, указывали, что данные ТК являются 1,3-поли(глицерофосфатами), замещёнными глюкозамином, что было подтверждено ЯМР-спектроскопическими методами. По интегральной интенсивности сигналов концевых и срединных остатков длина 1,3-поли(глицерофосфатной) цепи была оценена в 10 единиц.
Итак, клеточные стенки N. compostа ВКМ Ас-2520 и N. compostа ВКМ Ас-2521T содержали единственную ТК – 1,3-поли(глицерофосфат), на 10% замещённый -N-ацетилглюкозамином (Tul’skaya et al., 2007).
N. metallica ВКМ Ас-2522T. В кислотных гидролизатах клеточных стенок и препарата ТК найдены фосфорные эфиры рибита, пировиноградная кислота, а также в небольшом количестве фосфорные эфиры глицерина. Это указывало на возможное присутствие нескольких ТК, что подтверждали данные электрофоретического исследования: обнаружены две фосфорсодержащие зоны с подвижностью I mGroP 0,93 и II mGroP 1,27. Препарат из клеточной стенки был подвергнут ЯМР-спектроскопическим исследованиям.
Основные сигналы спектра ЯМР 13С препарата были идентифицированы как принадлежащие 1,5-поли(рибитфосфату) с 2,4-пируват-кетальными заместителями. Минорные сигналы в спектре принадлежали полимеру с 1,3-поли(глицерофосфатными) цепями, где часть (30%) глицериновых остатков замещена по гидроксилу у С-2 остатками -GlcpNAc. Мольное соотношение основного и минорного полимеров оценено как 7,5 : 1.
Итак, клеточная стенка N. metallica ВКМ Ас-2522T содержала две ТК. Основная – 1,5-поли(рибитфосфат), каждая рибитфосфатная единица которого несёт 2,4-кетально связанную пировиноградную кислоту и минорная – 1,3-поли(глицерофосфат) на 30% замещённый -N-ацетилглюкозамином, рис. 6 з, и (Tul’skaya et al., 2007).
N. trehalosi ВКМ Ас-942. В продуктах кислотного гидролиза клеточной стенки и ТК из нее кроме фосфорных эфиров глицерина была обнаружена глюкоза. Полимер частично гидролизовался щелочью с образованием небольшого количества моно- и бисфосфатов глицерина. Молекулярная масса полимера составила около 8,0 кДа, что соответствует приблизительно 40 глицерофосфатным звеньям.
В 13С ЯМР-спектрах ТК идентифицированы все сигналы, характерные для 1,3-поли(глицерофосфата) на 60% замещенного β-глюкозильными остатками, рис. 6 д, (Стрешинская и др., 1998).
5.2. Структуры тейхоевых кислот клеточных стенок видов рода Glycomyces
В настоящем разделе приведены структуры ТК клеточных стенок 4-х штаммов, принадлежащих двум валидно описанным видам (Labeda et al., 1985) рода Glycomyces, установленные нами.
G. rutgersensis ВКМ Ас-1248. Профиль кислотного гидролиза клеточной стенки и ТК (табл. 1) соответствовал наличию поли(глицерофосфата), а обнаружение в гидролизатах глюкозы предполагало замещение остатков глицерина этим сахаром. ТК была полностью устойчива к щелочному гидролизу, что указывало на полное замещение полимера глюкозой. В продуктах HF-гидролиза идентифицирован гликозид Г1, определенный как α-глюкозилглицерин, с гликозидной связью по гидроксилу при С2 глицерина и С1 глюкозы. Молекулярная масса ТК составила около 6,0 кДа, что, учитывая структуру полимера, составляет 19-20 повторяющихся звеньев. Таким образом, предположительно ТК была 1,3-поли(глицерофосфатом) полностью замещенным α-глюкозой (такая конфигурация гликозидного центра глюкозы найдена впервые у актиномицетов) по гидроксилу при С2 глицерина, что было подтверждено методами ЯМР-спектроскопии (Тульская и др., 1993).
G. harbinensis ВКМ Ас-1247Т, G. harbinensis NRRL 16897 и G. harbinensis IFO 14487T. Качественный состав компонентов клеточных стенок всех трех штаммов был одинаков. В кислотных гидролизатах клеточных стенок и выделенных из них ТК были обнаружены фосфорные эфиры глицерина и глюкоза. В продуктах HF-гидролизе ТК всех трех штаммов обнаружено по два гликозида: Г1 – α-глюкопиранозил-(1→2)-глицерин и Г2 – α-глюкопиранозил-(1→1)-глицерин. Обнаружение двух гликозидов свидетельствовало о присутствии в клеточных стенках двух ТК (ТК1 и ТК2), имеющих одинаковый поли(глицерофосфатный) кор и одинаковые заместители – α-глюкопиранозу, которая присоединена к глицериновым остаткам по-разному. Фосфодиэфирную связь в полимерах локализовали с помощью ЯМР-спектроскопии. Таким образом, в трех штаммах G. harbinensis обнаружено по две ТК: ТК1 – 1,3-поли(глицерофосфат), полностью замещенный по гидроксилу при С2 глицерина остатками α-глюкозы; а также ТК2 – 2,3-поли(глицерофосфат) с остатками α-глюкозы по гидроксилу при С1 глицерина (Тульская и др., 1993; Потехина и др., 1998).
5.3. Структуры тейхоевых кислот клеточных стенок видов рода Nocardioides
В этом разделе представлены сведения о структурах ТК, обнаруженных нами у изученных представителей рода Nocardioides (Prauser, 1976).
N. albus ВКМ Ас-805Т. Продукты кислотного гидролиза клеточных стенок и препарата ТК из них свидетельствовали о наличии ТК глицерофосфатной природы (табл. 1), имеющей заместители (обнаружены галактоза, глюкоза и пировиноградная кислота). Отсутствие среди них дифосфата глицерина и обнаружение в щелочных гидролизатах лишь монофосфорного эфира глицерина (Э1) указывало на поли(гликозилглицерофосфатную) природу ТК (табл.1). Эфир Э1 состоял из монофосфата глицерина, галактозы, глюкозы и пировиноградной кислоты в эквимолярном количестве. Вероятно, Э1 являлся основным повторяющимся звеном ТК. Полная структура полимера была установлена ЯМР-спектроскопическими методами. Сигналы при 70,6-72,2 и 67,85 м.д. были типичными для резонанса С1 и С3 глицериновых остатков в спектре поли(гликозилглицерофосфатной) цепи с гликозильными заместителями при С1 глицерина (Naumova et al., 1990). Сигналы при 25,9 (СН3-С), 101,9 (О-С-О) и 174,7 м.д. (С=О) были идентифицированы как принадлежащие остатку пировиноградной кислоты, локализованному в положениях 4,6 пиранозы (Шашков и др., 1992). Сигналы при 22,0 и 176,7 м.д. принадлежали О-ацетильным группам. Сигнал малой интенсивности при 109,1 м.д. обнаруживал присутствие -галактозы в фуранозной конфигурации (Bock and Pedersen, 1983). Спектры выявили присутствие -галакто- и -глюкопираноз как главных углеводных компонентов полимера. Было определено также, что -галактофураноза является минорным сахарным компонентом полимера, соотношение -Galp и -Galf составляет 7:1 (рассчитано по интенсивности сигналов при 104,2 + 102,5 м.д. и 109,1 м.д.). Таким образом, основная повторяющаяся единица полимера имеет следующую структуру:
OAc(0,5)
2
-3)--D-Galp-(11)-snGro-(3-P-
4
-D-Glcp(4,6Pyr)-1
-галактопиранозильные остатки О-ацетилированы по гидроксилу при С2 примерно на 50%. Остаток -галактофуранозы, вероятно, является терминальным на растущем конце цепи полимера и служит сигналом для прекращения его роста. Возможность существования галактофуранозного -1,6-связанного олигомера на конце цепи подтверждается анализом ТК из клеточной стенки N. luteus другого вида этого рода. ТК указанной структуры обнаружена впервые (Шашков и др., 1999; Tul’skaya et al., 2003).
N. luteus ВКМ Ас-1246Т и 12 других штаммов с идентичной ТК. Профиль продуктов кислотного гидролиза клеточной стенки и ТК из неё указывал на наличие ТК поли(рибитфосфатной) природы с галактозой и пировиноградной кислотой в качестве заместителей (табл. 1). Среди продуктов HF-гидролиза ТК был выявлен гликозид Г1 и идентифицирован как галактозилглицерин. При щелочном гидролизе, кроме фосфорных эфиров рибита (табл.1), найдены эфиры Э1 (основной) и Э2 (минорный, подробно не изучен), имеющие одинаковый качественный состав. Э1 был монофосфатом галактозилрибита с пировиноградной кислотой. Локализация фосфодиэфирных связей и пировиноградной кислоты, наличие О-ацетильных групп (≈20%) при гидроксилах по С3 рибита, конфигурация гликозидной связи и ее положение установлены с помощью ЯМР-спектроскопии, кроме того, было показано наличие -1,6-связанного олигомера, состоящего ≈ из 6 остатков галактофуранозы (соотношение Galp:Galf составляло 3(5) : 1). Молекулярная масса ТК составила 8,6-8,9 кДа, что соответствовало 18-ти повторяющимся звеньям.
-1-Rbo-5-P-
4
-D-Galp(4,6 Pyr)-1
ТК данной структуры обнаружена впервые (Шашков и др., 2000 ; Tul’skaya et al., 2003):
«N. albus». ВКМ Ас-806. В клеточных стенках этого штамма с использованием химических и ЯМР-спектроскопических методов были обнаружены как минимум две ТК. ТК1 – такая же по структуре как и в N. luteus, однако соотношение Galp:Galf составляло 1 : 1, и ТК2 – полимер поли(рибитфосфатной) природы с рамнозой в качестве заместителя (Tul’skaya et al., 2003).
5.4. Структуры анионных полимеров клеточных стенок некоторых видов рода Streptomyces
К началу наших исследований наибольшее количество ТК было изучено именно у представителей рода Streptomyces (Наумова, Шашков, 1997), относящихся к различным филогенетическим и фенотипическим группам. В настоящей работе были исследованы представители близких видов этого рода.
S. castelarensis ВКМ Ас-832Т (ранее S. rutgersensis ssp. сastelarensis). В кислотных гидролизатах клеточной стенки и препарата анионных полимеров из нее обнаружен глицерин и его фосфорные эфиры, глюкозамин, лизин, галактоза. Разделение в электрическом поле препарата полимеров, выделенном из клеточной стенки, выявило две фосфорсодержащие зоны, что свидетельствовало о наличии как минимум двух ТК поли(глицерофосфатной) природы. Было предпринято дробное выделение полимеров из целого обезжиренного мицелия с последующим дробным осаждением 96%-ным этанолом и очисткой методом переосаждения в ледяной воде. Это позволило получить препараты, преимущественно содержащие ту или другую ТК. Дополнительную очистку ТК осуществляли методом ионообменной хроматографии на DEAE-Toyopearl 650M в линейном градиенте NaCl.
Препарат 1, имеющий электрофоретическую подвижность mGroP 1,2-1,3, при кислотном и щелочном гидролизах дал продукты, характерные для незамещенной глицеринтейхоевой кислоты 1,3-типа (табл. 1). Мольное соотношение фосфор – глицерин было 1 : 1. Следовало иметь ввиду присутствие в этом препарате незамещенного 2,3-поли(глицерофосфата), так как последний дает аналогичные результаты при его химических исследованиях, за исключением диглицеринтрифосфата при щелочном гидролизе. Вопрос был решен ЯМР-спектроскопическими методами.
Препарат 2, с электрофоретической подвижностью mGroP 0,9, в составе кислотных гидролизатов имел глицерин и его фосфорные эфиры, глюкозамин и лизин. HF-гидролиз препарата 2 привел к образованию двух гликозидов: Г1 – GlcpNAc-(1→2)-snGro и Г2 – GlcpNН-(1→2)-snGro и фрагмента цепи ТК – Lys-(1→2)-Gro. Эти данные в совокупности с результатами изучения продуктов щелочного гидролиза препарата 2, среди которых были найдены два фосфодиэфира глицерина с глюкозамином, причем лишь один из фосфодиэфиров был нингидрин положительным, привели к предположению, что ТК из этого препарата является 1,3-поли(глицерофосфатом) частично замещенным глюкозамином, только часть остатков которого ацетилирована. Молекулярная масса этой ТК составила 6,0 кДа, что соответствует ~25 глицерофосфатным единицам.
Независимо оба препарата были исследованы методом ЯМР-спектроскопии. В результате химическими и ЯМР-спектроскопическими исследованиями удалось установить, что клеточная стенка S. castelarensis ВКМ Ас-832Т содержит набор различных ТК. Минорные – незамещенные 1,3- и 2,3-поли(глицерофосфаты), основная – 1,3-поли(глицерофосфат), треть мономеров имеет по гидроксилам при С2 глицерина глюкозаминильные остатки, только часть которых N-ацетилирована. ТК такой структуры найдена впервые (Tul’skaya et al., 1991).
S. melanosporofaciens ВКМ Ас-1864Т, S. hygroscopicus ВКМ Ас-831Т, S. violaceusniger ВКМ Ас-583Т, S. endus ВКМ Ас-1331Т, S. endus ВКМ Ас-129. Продукты кислотного и щелочного гидролизов клеточных стенок и суммарных препаратов из них свидетельствовали (табл. 1) о присутствии 1,3-поли(глицерофосфата), а обнаруженные галактоза и глюкозамин – что ТК, замещена сахарными остатками. Электрофорез выявил три фракции, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизованы и исследованы отдельно.
Фракция 1 (mGroP 1,3-1,4) представляла собой, скорее всего, смесь свободных 1,3- и 2,3-поли(глицерофосфатных) цепей (Тульская и др., 1997), о чем свидетельствовали продукты ее кислотного и щелочного гидролизов (табл. 1). Фракция 2 (основная ТК, mGroP 0,82-0,9) – идентифицированы 1,3-поли(глицерофосфатные) цепи, частично замещенные α-глюкозамином, причем часть глюкозаминильных остатков N-ацетилирована в той или иной степени (кроме штамма Ас-1864Т, в ТК которого все глюкозаминильные остатки N-ацетилированы). В продуктах деградации основной ТК из S. hygroscopicus, S. endus Ас-1331Т и Ас-129, S. violaceusniger с помощью гидроксамовой реакции были обнаружены О-ацетильные остатки. Фракция 3 имела электрофоретическую подвижность mGroP 0,3 и окрашивалась реактивом Ишервуда в серый цвет. При кислотном гидролизе обнаружена галактоза, а также в следовом количестве продукты деградации ТК из фракции 2 – это свидетельствовало о том, что последняя не была основным компонентом этой фракции.
Суммарные препараты клеточных стенок каждого исследуемого стрептомицета были изучены методами ЯМР-спектроскопии. Эти исследования подтвердили предварительные предположения, основанные на химических методах. Таким образом, клеточные стенки исследуемых стрептомицетов содержали одновременно четыре анионных углеводсодержащих полимера. Три ТК: незамещенные 1,3- и 2,3-поли(глицерофосфаты) и 1,3-поли(глицерофосфат) с большей или меньшей степенью замещения остатками α-глюкозамина, часть которых N-ацетилирована (табл. 6). Четвертый – обнаруженный впервые в природе полимер Kdn, замещенный β-Galp, состоящий ~ из 20 мономерных звеньев (Тульская и др.. 2007а).
Итак, ТК данной группы стрептомицетов были аналогичны таковым у S. castelarensis ВКМ Ас-832Т, а в клеточных стенках последнего была также найдена галактоза, поэтому было предпринято повторное исследование препаратов полимеров этого штамма на предмет обнаружения полимера Kdn. В результате методами ЯМР-спектроскопии в препаратах из клеточной стенки S. castelarensis также был идентифицирован полимер Kdn той же структуры, что и у вышеупомянутых штаммов (Тульская и др.. 2007а).
S. sparsogenes ВКМ Ас-1744Т. Профили кислотного и щелочного гидролизов клеточной стенки и препарата ТК свидетельствовали (табл. 1) о присутствии полностью замещенной гликозильными заместителями поли(глицерофосфатной) цепи 1,3-типа. В качестве гликозильных заместителей были выявлены глюкозамин, галактозамин и глюкоза. Дополнительная информация была получена при изучении продуктов гидролиза ТК 47%-ной HF. Идентифицировано два соединения. Соединение 1 было идентично GlcpNAc-(1→2)-snGro, полученному нами ранее из ТК2 S. castelarensis. Соединение 2 содержало галактозамин и глюкозу. ЯМР-спектроскопические исследования препарата из клеточной стенки и соединения 2 позволили установить повторяющуюся единицу основной ТК:
β-D-Glcp-(1→3)-α-D-GalpNAc-(1→3)-β-D-GalpNAc-(1→6)-α-D-GlcpNAc-1
↓
2
-1)-sn-Gro-(3-P-
ТК такой структуры обнаружена впервые (Шашков и др., 1998). Электрофорез выявил присутствие минимум двух ТК в клеточной стенке стрептомицета: кроме основной ТК обнаружено минорное количество незамещенного 1,3-поли(глицерофосфата), что было подтверждено ЯМР-спектроскопическим исследованием. Молекулярная масса основной ТК составила 9,8 кДа, что соответствует приблизительно 11 повторяющимся звеньям.
Streptomyces sp. ВКМ Ас-2274 (=МБ-8). Продукты кислотного и щелочного гидролизов клеточной стенки и ТХУ-препарата указывали на присутствие 1,3-поли(глицерофосфатных цепей), табл. 1, а обнаружение галактозы, 3-О-метилгалактозы (мадурозы), глюкозамина предполагало, что либо эти сахариды являются заместителями в молекуле ТК, либо они образуют некий гликополимер. ТХУ-препарат в электрическом поле разделился на три фракции, которые были накоплены и исследованы отдельно.
Фракция 1 (минорная, mGroP 1,3). При кислотном гидролизе идентифицированы моно-, бисфосфаты глицерина и неорганический фосфат. Образование таких же продуктов, а также диглицеринтрифосфата при щелочном гидролизе могло свидетельствовать о том, что фракция 1– незамещенный 1,3-поли(глицерофосфат) (Kelemen and Baddiley, 1961). Фракция 2 (основная, mGroP 0,82). После кислотного гидролиза обнаруживались глицерин, его моно- и бисфосфаты, неорганический фосфат и глюкозамин. Изучение продуктов HF- (гликозид Г1) и щелочного гидролизов (фосфодиэфир Э1) привело к предположению, что ТК этой фракции – 1,3-поли(глицерофосфат), частично замещенный -N-ацетилглюкозамином. Фракция 3 (mGroP 0,56). Окрашивалась реактивом Ишервуда в серый цвет. Кислотный гидролиз привел к образованию, галактозы, 3-O-метилгалактозы, а также следовых количеств продуктов деградации ТК из фракции 2. Следовательно, ТК не являлась основным полимером этой фракции.
Суммарный препарат полимеров, а также фракции 2 и 3 исследовали ЯМР-спектроскопическими методами, кроме того, фракция 3 была подвергнута MALDI TOF масс-спектроскопическому анализу. В результате проведенных исследований оказалось, что клеточная стенка исследуемого стрептомицета содержит в своем составе две ТК. Основная – 1,3-поли(глицерофосфат), на 60% замещенный -D-N-ацетилглюкозамином; минорная – незамещенный 1,3-поли(глицерофосфат). Кроме того – олигомер 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислоты (Kdn), имеющий следующую структуру:
(-D-Galp3OMe) -D-Galp-1 1--D-Galp3OMe (-D-Galp)
9 9
-Kdn-(24)--Kdn
Кислый олигосахарид такой структуры обнаружен впервые (Shashkov et al., 2002).
Streptomyces sp. МБ-2, МБ-5, МБ-6, МБ-7, МБ-10. В кислотных гидролизатах клеточных стенок были идентифицированы рибит, его моно- и бисфосфаты, ангидрорибитфосфат, неорганический фосфат, ангидрорибит, глюкоза, галактозамин, пировиноградная кислота (для трех штаммов: МБ-2, МБ-5, МБ-6), а также неидентифицированное нингидрин-положительное соединение. Кислотный гидролизат суммарных препаратов из клеточных стенок этих стрептомицетов содержал тот же набор продуктов. Однако количество глюкозы было бόльшим, чем количество рибитфосфата во всех случаях, кроме МВ-5. Полученные данные однозначно свидетельствовали о наличии рибиттейхоевой кислоты с глюкозой в составе суммарных препаратов, и не исключали присутствия полимеров иного строения, в структуру которых также входит глюкоза. Таким образом, можно было предположить, что эти организмы содержат в клеточных стенках похожий набор анионных полимеров. Электрофорез суммарных препаратов из каждого организма в отдельности выявил несколько фракций, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (mGroP 1,3), стрептомицеты MB-2, MB-5, MB-6. Продукты кислотного гидролиза (табл. 1) свидетельствовали о том, что фракция 1, вероятно, является 1,5-поли(рибитфосфатом), несущим остатки пировиноградной кислоты. Предположение было подтверждено данными ЯМР-спектроскопического анализа. Фракция 2, (mGroP 0,9-1,1), все 5 стрептомицетов. Профили продуктов кислотного и щелочного гидролизов этой фракции указывали на поли(рибитфосфатную) природу ТК из нее. Образование при щелочном гидролизе фосфорного эфира, идентифицированного как глюкозилрибитфосфат, а при HF-гидролизе гликозида, определенного как глюкозилрибит, свидетельствовало о том, что полимером фракции 2, вероятно, являлся 1,5-поли(рибитфосфат), замещенный глюкозой, что было подтверждено ЯМР-спектроскопическими исследованиями. Фракция 3 (mGroP 0,45-0,52), для 4-х стрептомицетов, кроме МБ-10. Кислотный гидролиз привел к образованию галактозамина, а также неидентифицированного нингидрин положительного соединения, и, кроме того, следовых количеств продуктов деградации ТК из фракции 2. Структура полимера этой фракции была установлена методами ЯМР-спектроскопии для каждого организма. Это была тейхуроновая кислота: →4)-β-D-ManpNAcA-(1→3)-α-D-GalpNAc-(1→, найденная ранее (Шашков и др., 2001) у стрептомицетов. Фракция 4 (mGroP 0,34), для всех стрептомицетов, за исключением МВ-5. Окрашивалась реактивом Ишервуда в серый цвет, в кислотных гидролизатах этой фракции найдена глюкоза и неидентифицированное соединение, окрашивающееся азотнокислым серебром. Структура полимера этой фракции была расшифрована с помощью ЯМР-спектроскопических исследований. Им оказался полимер 3-дезокси-D-глицеро-D-галакто-нон-2-улопиранозоновой кислоты (Kdn), замещенный -глюкозой (Shashkov et al., 2000).
Итак, клеточные стенки 5-ти стрептомицетов содержали по два-четыре анионных углеводсодержащих полимера. Среди них ТК: 1,5-поли(рибитфосфат), разной степени замещения β-Glcp, встречающийся во всех изученных организмах; а также 1,5-поли(рибитфосфат), несущий кетально связанную по гидроксилам при С2-С4 рибита пировиноградную кислоту, который был обнаружен в клеточных стенках лишь трех (МБ-2, МБ-5, МБ-6) стрептомицетов. Для 4-х изученных организмов характерно наличие в клеточных стенках тейхуроновой кислоты. Клеточные стенки почти всех изученных стрептомицетов (кроме МБ-5) содержат полимер Kdn, замещенный β-Glcp (табл. 9, Тульская и др, 2003).
Streptomyces sp. ВКМ Ас-2534 (=Ив-219). Продукты кислотного гидролиза клеточной стенки и суммарного препарата полимеров указывали на присутствие ТК поли(рибитфосфатной) природы (табл. 1), видимо, с глюкозой и глюкозамином в качестве заместителей, а также неидентифицированного нингидрин положительного соединения. Электрофорез суммарного препарата привел к разделению на две фракции, которые были накоплены электофоретически, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (mGroP 1,10), минорная, содержала ТК рибитфосфатной природы, вероятно, несущей в качестве заместителей глюкозу и глюкозамин, о чем свидетельствовали продукты кислотного гидролиза (табл. 1). При аммонолизе фракции образовались лизин и амид лизина, последний, по-видимому, входил в структуру ТК. Изучение продуктов дефосфорилирования (HF-гидролиз) привело к обнаружению двух гликозидов, идентифицированных как: Г1 – глюкозилрибит; Г2 – N-ацетилглюкозаминилрибит. Можно было предположить, что полимер этой фракции представляет собой 1,5-поли(рибитфосфатную) ТК, отдельные рибитфосфатные остатки которой несут глюкозу, в то время как другие – замещены N-ацетилглюкозамином. Фракция 2 (mGroP 0,52), преобладающая, была проявлена реактивом Ишервуда в виде белого пятна на фореграмме. Кислотные гидролизаты этой фракции содержали лишь следовые количества продуктов деградации фракции 1, а также неидентифицированное нингидрин положительное соединение. Таким образом, ТК не являлась основным компонентом этой фракции.
Тип фосфодиэфирной связи, положение гликозильных заместителей и их конфигурация в ТК фракции 1, а также структура полимера из фракции 2 были определены с помощью ЯМР-спектроскопии.
Таким образом, было доказано, что клеточная стенка изучаемого фитопатогенного стрептомицета содержит два анионных углеводсодержащих полимера. Минорный полимер – ТК, 1,5-поли(рибитфосфатные) цепи которой несут по гидроксилам при С-2(4) рибита β-глюкопиранозу, однако некоторые рибитфосфатные звенья полимера замещены β-N-ацетилглюкозамином, нарушая тем самым его регулярность. Второй полимер, преобладающий, представлял собой тейхуроновую кислоту, повторяющейся единицей которой является дисахарид:
4)--D-Manp2,3NAcyA-(13)--D-GalpNAc-(1, где Acy – ацетил или L-Glu
Полимер такой структуры обнаружен впервые у грамположительных бактерий (табл. 9, Тульская и др., 2007б).
5.5. Тейхоевая кислота и полисахарид клеточной стенки Kineosporia aurantiaca ВКМ Ас-702Т.
К началу наших исследований имелись сведения (Евтушенко и др., 1984) о том, что клеточная стенка Kineosporia aurantiaca ВКМ Ас-702Т, представителя семейства Kineosporiaceae подпорядка Frankineae, содержит ТК глицерофосфатной природы. Однако структурные исследования последней, а также возможных других гликополимеров, имеющихся в ней, ранее не проводили.
В кислотных гидролизатах клеточной стенки и суммарного препарата из неё обнаружены галактоза и манноза, а также некоторое количество глицерина, его моно- и бисфосфатов, неорганический фосфат и глюкозамин. Электрофорез суммарного препарата обнаружил наличие двух фракций, которые были накоплены методом препаративного электрофореза, элюированы, лиофилизированы и исследованы отдельно.
Фракция 1 (минорная, mGroP 0,93) при кислотном гидролизе дала продукты, позволяющие предположить наличие глицеринтейхоевой кислоты, замещенной глюкозамином (табл. 1). Ценная информация о структуре ТК была получена при изучении фосфорных эфиров, полученных после щелочного гидролиза фракции 1, а также гликозидов, полученных после ее обработки 47%-ной HF. Полученные продукты гидролизов, изученные по схеме, приведенной для S. сastelarensis, оказались идентичными таковым для названного стрептомицета. Таким образом, следовало думать, что полимер из фракции 1 является 1,3-поли(глицерофосфатом) частично замещенным α-глюкозаминильными остатками, только часть которых N-ацетилирована. Это предположение было подтверждено ЯМР-спектроскопическими исследованиями. Фракция 2 (основная) была электронейтральна и проявлена на фореграмме AgNO3 в нейтральной области. При кислотном гидролизе найдены галактоза и манноза в соотношении ~ 1 : 2. Абсолютная конфигурация галактозы и маннозы определена методом ГЖХ после их превращения в ацетилированные (S)-октан-2-ил гликозиды сравнением с октан-2-ил D-гликопиранозами (Gerwig et al., 1979). Эти результаты показали, что данная фракция вероятнее всего содержит нейтральный полисахарид. Структура последнего была полностью расшифрована с помощью ЯМР-спектроскопии.
Моносахаридная последовательность в повторяющейся единице полисахарида установлена на основании анализа 1H, 1H ROESY и 1H, 13C HMBC спектров:
→3)-β-d-Galp-(1→6)-β-d-Manp-(1→4)-β-d-Manp-(1→3)-β-d-Galp-(1→4)-β-d-Manp-(1→4)-β-d-Manp-(1→.
Одинаковая D-конфигурация каждого из моносахаридных остатков подтверждена при определении гликозилирующих эффектов в 13C ЯМР спектрах полисахарида (Lipkind et al., 1988; Shashkov et al., 1988). Структура данного нейтрального полисахарида описана впервые (Tul’skaya et al., 2005).
Анализ собственных результатов и литературных данных указывает на широкое распространение тейхоевых кислот в клеточных стенках представителей порядка Actinomycetales: более 80% всех изученных нами к настоящему времени штаммов актиномицетов содержат эти полимеры, причем до 70% всех обнаруженных тейхоевых кислот составляют глицеринтейхоевые кислоты. Рибиттейхоевые кислоты менее распространены в клеточных стенках бактерий. И, наконец, тейхоевые кислоты, содержащие другие полиолы (эритрит, арабит, маннит, 6-О-метил-галактит) в коре полимера, выявлены у актиномицетов в редких случаях, рис. 4.
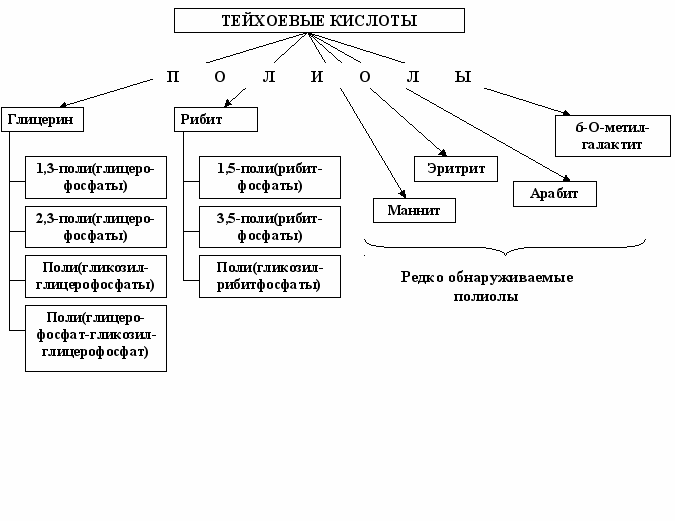
Рис. 4. Известные в настоящее время полиолы, входящие в состав тейхоевых кислот.
Заметим, что именно для глицеринтейхоевых кислот обнаружено наибольшее разнообразие (рис. 4.) в локализации фосфодиэфирных связей: 1,3- и 2,3-поли(глицеринфосфаты), поли(гликозилглицеринфосфаты), поли(глицеринфосфат-гликозилглицеринфосфаты). Недавно найден новый тип тейхоевых кислот: поли(ацилгликозилглицерофосфат), фосфодиэфирная связь в котором осуществляется по гидроксилу при С2 глицериновой кислоты, ацилирующей хиновозамин в коре полимера, и гидроксилу при С3 остатка глицерина (Козлова и др., неопубликованные данные).
Итак, глицеринтейхоевые кислоты наиболее широко распространены в природе, и среди них выявлено наибольшее разнообразие структур.
Интересные данные были получены в наших совместных работах с сотрудниками группы чл.-корр. РАН И.С.Кулаева (Кулаев и др., 1996; Степная и др., 1997, 2004). Бактерии с глицеринтейхоевой кислотой были практически не подвержены действию комплекса литических ферментов, тогда как наличие рибиттейхоевой и/или тейхуроновой кислот приводило к усиленному лизису микроорганизмов. Возможно, глицеринтейхоевые кислоты защищают микробную клетку от лизиса.
Являются ли глицеринтейхоевые кислоты наиболее значимыми для выживания микроорганизмов в их экологической нише по сравнению с другими тейхоевыми кислотами, в коре которых имеются другие полиолы, предмет дальнейших исследований.
