Химия Химия — наука о веществах, их превращениях и тех явлениях, которыми эти превращения сопровождаются. Вещество
| Вид материала | Документы |
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Утверждаю, 65.11kb.
- Программа «аналитическая химия» по направлению подготовки 020100 «Химия», 31.74kb.
- Программа кружка «Химия наука экспериментальная» на 2011-2012 учебный год Учитель химии, 227.56kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- План лекций по дисциплине «Токсикологическая химия» для студентов, 29.5kb.
- План лекций по дисциплине «Токсикологическая химия» для студентов IV курса специальности, 22.69kb.
- «Неорганическая химия», 1345.55kb.
Химическая кинетика
Уравнение Аррениуса (точное): k = A·exp(-Ea / RT). Уравнение Вант-Гоффа (грубое): v2 / v1 = (T2-T1) / 10. Экспериментальное определение Ea: по тангенсу угла наклона прямой на графике ln(K) от 1/T: Ea = R * tg(). Скорость параллельной реакции определяется скоростью самой быстрой реакции. Скорость последовательной реакции определяется скоростью самой медленной реакции. Катализ — процесс изменения скорости химической реакции. Не изменяет константу равновесия. G = const. Катализатор — ускоряющее реакцию вещество, не участвующее в превращениях. Действие катализатора основано на уменьшении энергии активации при образовании активированного комплекса. Гомогенный катализ: катализатор и реагенты находятся в одной фазе. Гетерогенный катализ: катализатор и реагенты находятся в разных фазах; реакция протекает на границе раздела фаз.
Растворы
Раствор — гомогенная (однофазная) система переменного состава двух и более компонентов. XY (поляризация) XY (ионизация) XY (сольватация) X/Y (дисс) X+YAX (растворённое) + S (AX)S A+S+ + X-S- — процесс сольватации. Способы выражения концентрации. Молярная концентрация [моль/л (М)]: вещества в растворе к объёму раствора. Моляльность [моль/кг]: вещества в растворе к массе растворителя. Молярная доля [%]: количество компонента в растворе к общему количеству компонентов. Массовая доля [%]: масса компонента к массе раствора (сколько граммов на 100 г раствора). Классификация. По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке. По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях)
По концентрации: Разбавленные (С 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?) По природе растворённого вещества: Электролиты (сильные ( = 1) и слабые ( < 30%)), = распавшихся / растворённых. Неэлектролиты. По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные. Условие образования идеального раствора: Hид = 0, S > 0, V = 0. Растворение — физико-химический, а не механический процесс. Сопровождается тепловым эффектом и резким изменением свойств растворителя. Особенности воды как растворителя. Вода — слабый электролит; КД = (aH+aOH-) / a(H2O). CH+COH- = KД · 55,5 = K. В случае электролитов K= aH+aOH-. pH = -lg (aH+). pH = 7: нейтральная; pH < 7: кислая; pH > 7: щелочная. Сольватация — процесс взаимодействия молекул/ионов растворённого вещества с р-рителем. Процесс сольватации в зависимости от природы растворённого вещества и растворителя может привести к поляризации, ионизации и (в пределе) к диссоциации молекул растворённого вещества. AX + S (AX)S A’S+ + X-S-. Процесс сольватации. Возможен, если HAX–S > HAX–AX или HAX–S > HS–S. Диссоциация — процесс распада растворённого вещества на свободные ионы под действием сольватации. Возможен, если HAX–S >> HAX–AX или HAX–S >> HS–S. Ассоциация — взаимодействие молекул/ионов растворённого вещества друг с другом (в чистых жидкостях и концентрированных растворах). Возможен, если HAX–S < HAX–AX или HAX–S < HS–S. Выводы. Состояние растворённого вещества в растворителе является основным фактором, определяющим свойства системы раствора. Одновременно в растворе могут находиться в равновесии все возможные формы, но возможны предельные случаи, когда в растворе находятся только ионы или только молекулы, если вещество — не электролит.
Растворы
Эбуллиоскопические и криоскопические свойства растворов. i (степеней свободы ТД системы) = число независимых компонентов системы – число фаз + 2. Смотрится по фазовой диаграмме воды. В тройной точке число фаз = 3. Закон Вант-Гоффа. Осмотическое давление P — давление, которое необходимо приложить к раствору с большей концентрацией, чтобы преодолеть транспортировку растворителя. Численно равно давлению, которое создало бы растворённое вещество, находясь в объёме раствора в газообразном состоянии при данной температуре. P = [ i ]CRT. Закон Рауля показывает зависимость давление пара растворителя от C: Для идеального раствора: Pнад раствором = p10 * x1. p10 — давление пара чистого растворителя; x1 — концентрация растворённого вещества. Для реального раствора: Pнад раствором = p10a10, а1 — активность растворённого вещества. Для неэлектролитов: Tкип = КэбСm; Tзам = КкрСm. Сm [моль/кг] — моляльная концентрация. Для реальных растворов: Tкип = iКэбСm; Tзам = iКкрСm. Изотонический коэффициент i = Tзам / кип(теор) / Tзам / кип(эксп) = P(теор) / P(эксп). i > 1: электролит; i = 1: неэлектролит; i < 1: ассоциат. Cm(эксп) = Ткип (эксп) / Кэб (в табл). Сm(эксп) > Сm(теор): электролит; Сm(эксп) = Сm(теор): неэлектролит; иначе ассоциат. Короче, для задач формула: i = Tзамерзания / (Ккр * Сm), где Ккр = 1,86. Среднеионный коэффициент активности ± = (++ * --)(+ * -). Активность электролита a = ··Cm ·±. Для задач активность электролита a = ± * * Cm. Ионная сила раствора I = Ѕ Cm(i)zi2. В задачах по I дают ±. ln ± = -A|z+ * z-|*IЅ . Константа А определяется свойствами растворителя. Закон Оствальда: Константа диссоциации КД = C·2 / (1 – ). Для слабых электролитов = (Кд/C)Ѕ. Также КД рассчитывается через активности по закону действия масс. Закон Оствальда: h = (Kг / C0)Ѕ, h — степень гидролиза, КГ — константа гидролиза.
Дисперсные системы и коллоидные растворы
Дисперсная система — гетерогенная система из двух и более фаз с сильно развитой поверхностью раздела. Дисперсионная среда (ДС) — вещество, образующее в дисперсной системе сплошную фазу. Фаза, распределённая в среде, называется дисперсной фазой (ДФ) (дисперсоидом). Коллоидные системы — системы с размером ДФ порядка 10-7 — 10-9 м. Классифицируются по агрегатному состоянию ДФ и ДС: Лиофильные коллоиды — коллоиды с высоким сродством ДФ и ДС. Нет чёткой границы фаз. Наиболее термодинамически устойчивы. Лиофобные коллоиды — с малым сродством ДФ и ДС. Резкая граница раздела фаз. Менее устойчивы. Адсорбция — процесс поглощения одного вещества поверхностью другого. Правило Пескова-Фаянса: ядро мицеллы адсорбирует из раствора преимущественно те ионы, которые входят в кристаллическую решётку ядра (или изоморфные им) и в растворе находятся в избытке. Заряд гранулы определяется как сумма зарядов потенциалообразующих ионов. Знак заряда гранулы равен знаку заряда потенциалообразующих ионов. Метод получения: 1) измельчение ДФ в ДС, 2) осаждение (конденсация) в результате обменных реакций, где выделяются труднорастворимые продукты. Пример образования мицеллы: 1) AgNO3 + KI AgI + KNO3 (получение частиц ДФ размером 10-7 — 10-9 м) 2) mAgI (ДФ) + nAgNO3 (ДС) {m[AgI]nAg+xNO3–}(n-x)+ (n-x)NO3–. Всё — мицелла, m[AgI] — ядро; nAg+xNO3– — адсорбционный слой, {m[AgI]nAg+xNO3–}(n-x)+ — гранула,
(n-x)NO3– — диффузионный слой. Устойчивость коллоидных систем — способность сохранять присущую им степень дисперсности. Агрегативная связана с наличием заряда одного знака у гранулы, что приводит к отталкиванию частиц и предотвращает их слипание. Кинетическая связана с постоянным броуновским движением частиц. Коагуляция — процесс слипания частиц. После коагуляции снижается устойчивость. Можно устроить коагуляцию, подействовав электролитом. Седиментация (осаждение) — выделение ДФ в виде осадка. Порог коагуляции (Спор) — наименьшая концентрация электролита, вызывающая коагуляцию. Cпор (Cэл * Vэл)/(Vзоля + Vэл); Cпор 1/z6, z — заряд коагулирующего иона. При коагуляции мицелл лиофильного коллоида происходит образование геля. Пример коагуляции:
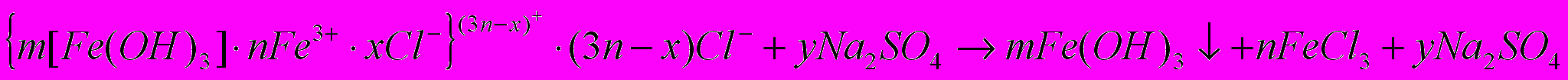 .
. 
Оптические свойства коллоидов: Эффект Тиндаля (конус) позволяет доказать наличие коллоида. Электрические свойства коллоидов обусловлены наличием заряда у гранулы. Электрофорез — направленное перемещение частиц в постоянном электрическом поле. Электроосмос — перемещение ДС через полупроницаемую перегородку в постоянном электрическом поле.
Кислотно-основные системы
Все химические системы по характеру протекающих в них реакций можно отнести либо к кислотно-основным, либо к окислительно-восстановительным.Теория Аррениуса: В чистом виде кислоты являются неэлектролитами. Кислоты становятся электролитами в воде. Водные растворы кислот изменяют окраску индикаторов. Водные растворы кислот вступают в следующие реакции: K2O + 2HCl 2KCl + H2O Na + H2Br H2 + 2NaBr (с активными металлами образуются соль и водород) Na2CO3 + HCl H2CO3 + Na2SO4 (с солями слабых кислот образуется слабая кислота) Основание — вещество, вступающее с кислотами в реакцию нейтрализации. Не объясняет ряд реакций (органические, аммиак). Теория Бренстеда-Лоури (протонная): Кислота — вещество, состоящее из молекул или ионов, являющихся донором протонов. Основание — вещество, состоящее из молекул или ионов, являющихся акцептором протонов. HCl (кислота) + H2O (основание) H3O+ (кислота) + Cl- (основание) Чем выше сродство к протону, тем сильнее основные свойства вещества. Самое высокое сродство у аммиака.
Протофильные вещества — с высоким сродством к протону. Протогенные вещества — с низким родством к протону (HF). Амфипротонные вещества — H2O, C2H5OH. HF (кислота) + C2H5OH (основание) + C2H5OH2 – (кислота) + F – (основание) Теория Льюиса (электронная): Кислота — вещество, принимающее электронные пары. Основание — вещество, отдающее электронные пары для образования химических связей. Основной механизм кислотно-основного взаимодействия — образование донорно-акцепторных связей. Участие протона не обязательно! (CH3)3N + BF3 (CH3)N : BF3. Реакция комплексообразования — кислотно-основное взаимодействие, в котором центральный атом – кислота Льюиса, а лиганды – основания Льюиса. Th4+ (кислота Льюиса) + 4CO32- (основание Льюиса) [Th(CO3)4]4-. (CO3)4 — лиганды.
Комплексные соединения
Комплексные соединения образуются в избытке электролита за счёт донорно-акцепторного взаимодействия. Условие образования комплекса: 1) избыток электролита, 2) возможность образовывать донорно-акцепторные связи между взаимодействующими молекулами, 3) наличие свободных орбиталей. Комплексообразование — процесс образования за счёт донорно-акцепторного взаимодействия устойчивого соединения, называемого комплексом. Типичные комплексообразователи и лиганды. Типичные комплексообразователи: d- и f-металлы: Cu, Fe2+, Fe3+, Co, Ni, Pf, Au, Ag, Eu, Ce, Th, U. Типичные лиганды: молекулы с неподелённой электронной парой: анионы, любые галогены: F –, OH –,CO32-, CN –, NO32-, …. Координационное число — число лиганд в комплексе. Часто бывает 4, 6, 8, 2. Вообще 2, ..., 12. Дентатность — число донорных атомов лиганд, непосредственно связанных с комплексообразователем. Строение комплексного соединения. K2[Cd(CN)4]. Внутренняя сфера — Cd(CN)4. Называется комплексом. Комплексообразователь — Cd2+. Лиганды — CN –. Заряд: -2. Заряд комплекса равен суммарному заряду внешней сферы с противоположным знаком. Взаимосвязь строения комплексов и гибридизации орбиталей комплексообразователей. Гибридные орбитали возникают в результате влияния лигандов на комплексообразователь и стремления к максимальному выигрышу энергии. Между КЧ КО, типом гибридизации и геометрией существует связь:Энергетический ряд лигандов:I < Cl < F < OH < C2O4 = H2O < NH3 < SO3 < NO2. [Co(H2O)6]2+: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. [Co(CN)6]4–: Co2+ [ ] Тип гибридизации: sp3d2 — октаэдрический. Комплексные соединения, имеющие в своём составе внутреннюю и внешнюю сферы, диссоциируют в водных растворах практически полностью, т. е. являются сильными электролитами. Причём диссоциация комплексных ионов идёт ступенчато (как диссоциация слабых электролитов). Для каждой ступени константа равновесия называется константой нестойкости. Общая константа нестойкости равна произведению ступенчатых констант нестойкости — характеристика прочности комплекса. Чем меньше Кн, тем прочнее комплекс. Разрушение комплексных соединений. Если ПК ионов комплексообразователя и осадителя больше, чем ПР осадка, то комплекс разрушается и выпадет осадок. Приближённая оценка: сравнение констант нестойкости комплекса и ПР предполагаемого осадка. Если КН << ПР, то разрушение не произойдёт. Классификация комплексных соединений: Содержащие молекулярные монодентатные лиганды: амино- и аквакомплексы. Бидентатные: [Th(C2O4)4]4- Внутрикомплексные: диглиценат меди Двойные соли не являются комплексами: KAl(SO4)2, NH4Fe(SO4)2. Соединения, сложные по своему составу, строение которых может быть объяснено с точки зрения двойных связей.
Электрохимические процессы
Окислительно-восстановительные реакции состоят из процессов окисления и восстановления. Окисление/восстановление — отдача/принятие электронов веществом. Окислитель/восстановитель — вещество, отдающее/принимающее электроны в реакции. Степень окисления — число электронов, смещённых от атома данного элемента или к атому данного элемента в соединении. Химический способ осуществления ОВР — непосредственная передача электронов от восстановителя к окислителю. В этом случае G < 0. Электрохимический способ осуществления ОВР. Отличается тем, что полуреакции пространственно разделены, т. е. хаотический перенос электронов преобразуется в направленный процесс переноса электронов от восстановителя через внешнюю цепь к окислителю и, как следствие этого, превращение химической энергии в электрическую. Электрохимические процессы протекают в окислительно-восстановительных (ОВ) системах, где происходят процессы превращения химической энергии в электрическую и наоборот. В основе всех ЭХП лежат процессы переноса заряженных частиц из одной фазы в другую, сопровождающиеся образованием ДЭС и разности потенциалов (электролит/электрод: электродного (ж/тв), контактного (тв/тв) и диффузионного (ж/ж)) на границе раздела фаз. Двойной электрический слой (ДЭС) — тонкий поверхностный слой из пространственно разделённых зарядов противоположных знаков, образующихся на границе раздела фаз. ДЭС образуется в результате: 1) Обмена ионами между металлом и раствором электролита. оложительные ионы из металла отрываются водой и переносятся в раствор. 2) Адсорбция ионов на поверхности электрода. 3) Выход электронов из кристаллической решётки электрода. Основные элементы электрохимической системы: Электроды (металлы, полупроводники) Электролиты с ионной проводимостью (раствор, расплав, твёрдое вещество) Граница раздела фаз (электролит | электрод).
Гальванические элементы
Проводник 1 рода — имеющий электронную проводимость. Проводник 2 рода — имеющий ионную проводимость (раствор). Электрод — проводник 1 рода, находящийся в контакте с ионным проводником. Электрод 1 рода — металл/неметалл, погружённый в раствор, содержащий ионы данного еталла/неметалла. Электрод 2 рода — металл, покрытый слоем труднорастворимой соли и погружённый в электролит, содержащий ионы этой соли. Гальванический элемент — электрохимическая система, в которой химическая энергия преобразуется в электрическую. Состоит из двух электродов, соединённых проводниками первого или второго рода в замкнутую цепь. Электродный потенциал — относительный равновесный электродный потенциал, измеренный по отношению к условной точке отсчёта ( одородного электрода = 0). 0 — относительный стандартный электродный потенциал по водородной шкале. Уравнение Нернста:
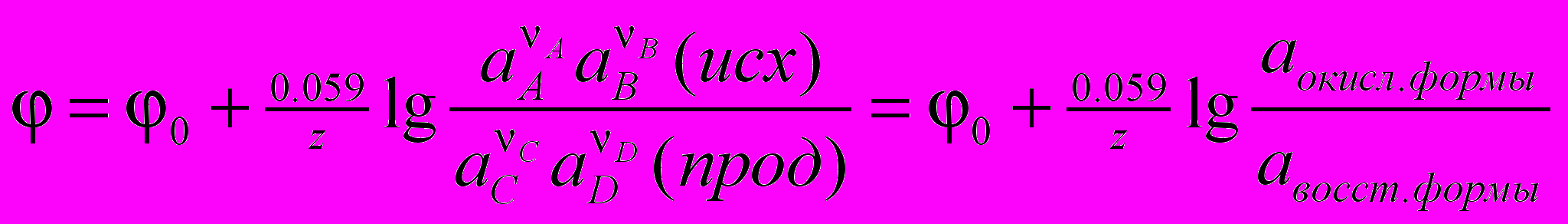 . ЭДС гальванического элемента E = катода – анода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: G = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: G < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.
. ЭДС гальванического элемента E = катода – анода = E0 + (1/z) * 0,059 * lg (aкатода / aанода). Связь ЭДС и энергии Гиббса: G = -nFE. Отсюда можно делать выводы относительно направления протекания реакций ОВР: G < 0: прямая реакция возможна. Правила записи гальванических элементов. В ГЭ ЭДС всегда > 0.Слева записывают электрод с меньшим потенциалом. Zn- (анод) | ZnSO4 || CuSO4 | Cu (катод) Типы гальванических элементов: Стандартные: Водородный электрод. (H+/H2) = 0. Всегда. Кислородный электрод. OH- | O2, Pt. 4OH- – 4e- O2 + 2H2O. = 1,277 – 0,059pH. Обратимые: ГЭ, в которых прямая токообразующая реакция и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Zn | ZnSO4 Электродные потенциалы не зависят от механизма образования двойного электрического слоя, а зависит от природы электрода и активности ионов, участвующих в электродной реакции. 0 — справочная величина (по водородной шкале). Чем больше 0, тем сильнее окислительные свойства. Внимание! Если один из электродов —стандартный водородный, то он записывается на первом месте: Pt, H2 | H+ || Cu2+ | Cu0, E > 0. Pt, H2 | H+ || Zn2+ | Zn0, E < 0.
Электролиз
Электролиз — процесс синтеза или разложения веществ с помощью электрического тока, О-В процесс, полуреакции которого осуществляются на отдельных электродах. В процессе электролиза катионы движутся к катоду, анионы — к аноду и на нём окисляются. Отличие от ГЭ: в ГЭ протекает самопроизвольный ОВ процесс, а при электролизе происходит процесс потребления электрической энергии. Перенапряжение () — величина дополнительного потенциала (напряжения) по сравнению с равновесным, необходимая для протекания электродного процесса с определённой скоростью. Для того, чтобы пошёл электролиз, величина приложенного напряжения должна превышать стандартную ЭДС. При равновесном в системе имеет место равновесие, электролиз не идёт. Электролиз возможен при условии, что Uэлектролиза = Eравновесн + . При электролизе перенапряжение представляет собой сумму катода и анода. кат смещает равновесный электродный потенциал в отрицательную сторону. анодн смещает равновесный электродный потенциал в положительную сторону. Скорость электролиза — величина тока через единицу поверхности электрода D [А/см2]. Факторы, влияющие на : природа, материал электрода, концентрация электролита, v D. Правило электролиза: при конкурирующих процессах на катоде в первую очередь выделяется тот электролит, потенциал которого больше, а на аноде — меньше. При электролизе растворов на катоде в первую очередь разряжаются те ионы, потенциал которых с учётом больше, а на аноде — меньше. Если анод – металл, то среди конкурирующих процессов необходимо учесть возможность растворения самого анода. При электролизе водных растворов галогенов на аноде выделяются в свободном виде галоген, а не кислород, т. к. их << (O2). разряда кислородосодержащих ионов с учётом перенапряжения больше 2,5 В, поэтому их водных растворов они не разряжаются на катоде. Большие величины перенапряжения выделения водорода при разряде на некоторых активных металлах используются для получения этих металлов из водных растворов. Пример: Электролит: KI, pH = 7. Катод: Cu, = (H2/Cu) = 0,7 V Анод: Cu, = (H2/Cu) = 0,7 V Характеристика электролита: KI K+ + I-. H2O H+ + OH-, pH = 7. Вероятные процессы на катоде и аноде: На катоде: 1)K+ + e- K0, = 0(K0/K) - (K/K0) = –2,7 – 0 = –2,7 V. 2) 2H2O + 2e- H2 + 2OH- (из стр. 100). = 0(H2/H+) - (H2/C?) = -0,4 V. 1 < 2 На катоде в первую очередь пойдёт процесс 2. На аноде: 3) 2I- – 2e I2, = 0(I2/I) + (I2) = 0,54. Пойдёт этот. 4) 2H20 – 4e O2 + 2H2, = 0(O2/O-2) + (O2/Cu) = 0,814 + 1,1 = 1,914 V. Уравнение электролиза (2) + (3): 2H2O + 2e + 2I- - 2e электролиз H2 + 2OH- + I2.
Коррозия металлов
Коррозия — разрушение металла (редко материала) в результате химического (электрохимического) воздействия. Химическая коррозия — разрушение металла под действием окислителей окружающей среды, если среда не электропроводна. Скорости химической коррозии зависит от скорости диффузии газа через поверхность плёнки к металлу, а также от встречной диффузии металла. Электрохимическая коррозия — процессы окисления и восстановления пространственно разделены. Возникает в химических средах с ионной проводимостью при наличии контакта разнородных металлов за счёт образования гальванических микроэлементов. При коррозии происходит анодное растворение металла за счёт катодного восстановления окислителя среды H+ (pH < 7) и O2?(pH 7) При коррозии скорость более активного металла возрастает, а менее активного — убывает. Процесс коррозии пойдёт амопроизвольно, если ок > аосст. Методы защиты о коррозии: Покрытие металлом: более активный металл является защитным для основного независимо от дефектов. Покрытие железа цинком. Zn – 2e Zn2+; 2H+ + 2e H2 Покрытие неметаллом: только при отсутствии дефектов.
