Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Структура lux-оперонов и механизмы регуляции типа quorum sensing у морских бактерий
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
Итоги исследований шаперонов с помощью бактериальных люцифераз.
Х Применение для анализа работы шаперонов в качестве модели бактериальных
люцифераз, гомологичных по аминокислотной последовательности, но значительно различающихся по термостабильности, оказалось весьма перспективным и в настоящее время принято во многих лабораториях мира.
- Показано, что рефолдинг термоинактивированных бактериальных люцифераз, являющихся гетеродимерами, происходит в клетке с участием шаперонов семейства Hsp70 (DnaKJE), HsplOO (ClpA, ClpB) и малых шаперонов sHspP (IbpAB).
- Показано, что термостабильные люциферазы характеризуются сравнительно низким уровнем DnaKJE-зависимого рефолдинга в отличие от термолабильных люцифераз, которые восстанавливают активность после термоинактивации практически до 100%.
Биосенсоры: применение lux-биосенсоров для детекции токсических агентов, антибиотиков, аутоиндукторов и других биологически активных веществ.
Проведённые в процессе выполнения диссератационной работы исследования, (в частности, клонирование набора генов, кодирующих люциферазы, и индуцируемых стрессовых промоторов) позволили сконструировать специфические, высокочувствительные /wx-биосенсоры. Выполнен ряд договоров и контрактов
30 хозяйственного назначения по темам, связанным с экологией, определением механизмов токсического воздействия веществ на бактериальную клетку, тестированием разрабатывающихся медицинских препаратов (доклиника) и др.
Lux-биосенсоры широко используются в работах по генетической инженерии и биотехнологии, а также для мониторинга окружающей среды. Lux-биосенсор - это бактериальная клетка, содержащая гибридную плазмиду, в состав которой встроены два основных элемента: регуляторный участок (промотор и оператор и, при необходимости, ген регулятор) и ген (гены)-репортер (рис. 25). В качестве генов-репортеров используются гены /wxCDABE, кодирующие люциферазу и редуктазу. В качестве регуляторных элементов используются различные индуцируемые промоторы, сформированные в процессе эволюции и специфически реагирующие на наличие в среде определенного вида химического вещества. Данная группа биосенсоров характеризуется как специфичностью, так и высокой чувствительностью, что определяется особенностью взаимодействия белка - рецептора (репрессора или активатора транскрипции) с химическим веществом. Сконструированы новые формы lux-биосенсоров, отличающиеся по основным параметрам (пороговая чувствительность и амплитуда ответа) от аналогов lux-биосенсоров, полученных зарубежными фирмами. В таблице приведены основные характеристики lux-биосенсоров, применяющихся для детекции токсикантов, экологического мониторинга и определения механизмов токсического воздействия на клетку. Пример временной зависимости активации люминесценции биосенсора Е.coli MG1655 pAlkA-lux в ответ на добавление токсиканта (ТУ-метил-Ж'-нитро-ТУ-нитрозогуанидина) приведён на рисунке 25.
Таблица. Основные характеристики lux-биосенсоров
Биосенсор E.coli: |
Токсический агент |
Промо тор |
Амплитуд а ответа |
Пороговая концентрация |
мин |
pArsR-lux |
As, Sb |
arsR |
500 |
10"uMAs |
30 |
pMerR-lux |
Hg,Cd |
merR |
500 |
10"10MHg |
30 |
pCopA-lux |
Cu,Ag |
сорА |
20-Си 30-Ag |
5xlO"7MCu; 2xlO"7MAg |
20 7 |
pTetR-lux |
тетрациклин |
tetA |
1000 |
0.5 нг/мл |
30 |
pColD-lux |
ДНК -повреждающие агенты: УФ, митомицин С, 4-НХО |
cda |
1000 |
10"9M митомицин С |
25 |
31
pAlkA-lux |
Алкилирующие агенты: МННГ, MMC, нитрозо-мочевина |
аША |
300 |
10"8M МННГ |
20 |
plbpA-lux |
этанол, температура, |
ibpA |
100 |
0,3% этанол |
20 |
пентахлорфенол |
10 мг/л пентахлорфено л |
10 15 |
|||
pFabA-lux |
тритон Х-100, фенол и его производные |
fabA |
3 |
0,2 мг/л тритон Х-100 |
30 |
pKatG-lux |
Н202 |
katG |
100 |
10"6М Н202 |
7 |
pSoxS-lux |
супероксид-анион |
soxS |
100 |
10"6М паракват |
15 |
NaAsO, |
 Связан
Связан
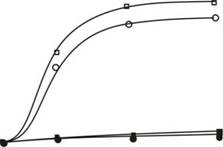
Рисунок 25. Схема специфического lux-биосенсора, сконструированного с применением репортерных генов luxCDABE, индуцируемого промотора ParsR и регуляторного arsR гена, реагирующего ионы мышьяка. Приведена зависимость интенсивности биолюминесценции биосенсора Е. coli (pArsR-lux) от концентрации ионов мышьяка (NaAs02). Пунктиром обзначена кривая инактивации люминесценции контрольных клеток, в которых гены luxCDABE находятся под контролем конститутивного промотора.
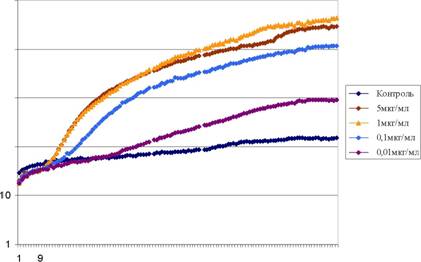
ремя, мин.
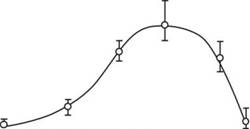
Рисунок 26. Клетки Е. coli МС1061 (pAlkA-lux) выращивали до ранней логарифмической фазы, добавляли к аликвотам (по 200 мкл) ТУ-метил-Ж'-нитро-ТУ-нитрозогуанидина до конечных концентраций 5, 1, 0,1,и 0,01 мкг/мл. Измеряли люминесценцию образцов в течение 2 часов. На графике показана зависимость люминесценции образцов от времени инкубации.
С помощью подобных биосенсоров впервые был исследован механизм токсического действия на клетку 1,1 -диметилгидразина (компонент ракетного топлива) (НДМГ) и наночастиц диоксида титана. Показано, что основная роль в токсическом действии этих агентов связана с образующимися активными формами кислорода (перекись водорода и су перокид-анион).
|
|
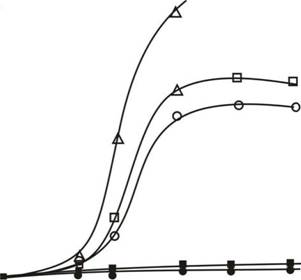
Рисунок 27. Зависимость интенсивности люминесценции клеток биосенсора Е. coli MG1655 pKatG-lux от времени инкубации (А) и от концентрации (В) в среде 1,1 диметилгидразина (НДМГ). () - контроль (о) - + НДМГ 3 мМ (d) - + перекись водорода 0,5 мМ (ж) - + каталаза, + НДМГ 3 мМ
На рисунках 27 и 28 представлены данные, свидетельствующие о том, что основное генотоксическое действие НДМГ на бактериальную клетку связано с образованием активных форм кислорода в процессе восстановления атмосферного кислорода. Добавление каталазы в икубационную среду полностью снимает как окислительный стресс (рис. 27 (А)), так и SOS -ответ бактериальных клеток (рис. 28)
|
90 120аа 150
Время, [мин]
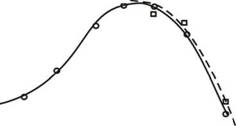
Рисунок 28. Кинетика индукции (усиления) биолюминесценции биосенсора Е. coli
MG1655 (pRecA-lux) в зависимости от времени инкубации с НДМГ (концентрация НДМГ
= 5 мкМ).
() - контроль
(о) - НДМГ 3 мМ
(d) - перекись водорода 0,5 мМ
(ж) - каталаза, + НДМГ 3 мМ
(?) - митомицин С 10" М
Однако токсическое действие НДМГ на живую клетку не ограничивается воздействием активных форм кислорода, возникающих в процессе окисления НДМГ в аэробных условиях. В процессе окисления возникают промежуточные формы окисленного НДМГ, в том числе, нитрозодиметиламин, который является алкилирующим агентом для ДНК. На рисунке 29 представлены данные по активации промотора PalkA как чистым НДМГ, так и продуктами его окисления, возникающими при обработке перекисью водорода. Показано, что чистый, не окисленный НДМГ, не обладает алкилирующим действием на ДНК. Восстановление атмосферного кислорода НДМГ с образованием перекиси водорода достаточно, чтобы возник SOS-ответ клетки, в первые, часы инкубации в растворе с НДМГ (рис 28). В случае если происходит более глубокое
34 окисление НДМГ в присутствии экзогенно добавленной перекиси водорода, возникают продукты окисления, которые были охарактеризованы как при помощи биосенсоров так и на хроматомасс-спектрометре. Показано, что продукты окисления НДМГ перекисью водорода обладают высокой алкилирующей способностью и вызывают активацию PaikA промотора (рис. 29). Максимальная амплитуда ответа биосенсора наблюдается в случае, когда концентрации НДМГ и перекиси водорода эквимолярны. Перекись водорода не вызывает индукцию PaikA промотора, так как не может являться алкилирующим агентом, и PaikA не индуцируется окислительным стрессом, однако в случае больших концентраций Н2О2 избыток перекиси водорода приводит к гибели клеток, уменьшая наблюдаемую биолюминесценцию.
Рисунок 29. Зависимость люминесценции Е. coli МС1061 (pAlkA-lux) от времени
инкубации в присутствии несимметричного диметилгидразина (НДМГ) и перекиси
водорода.
К клетками, coli МС1061 pAlkA-lux добавляли НДМГ 7,5 мМ и различные концентрации
окислителя - перекиси водорода (20; 10; 7.5; 5; 2.5; 1; 0.5 мМ). Измеряли люминисценцию
образцов в течение 4 часов.
Итоги прикладных исследований диссертационной шаботы.
- Сконструированы lux-биосенсоры, отличающиеся высокой чувствительностью чувствительность и амплитудой ответа, при этом специфично реагирующие на различные классы токсических и биологически активных веществ.
- С помощью lux-биосенсоров впервые был исследован механизм токсического действия на клетку 1,1 -диметилгидразина (компонент ракетного топлива) и
35 наночастиц диоксида титана. Показано, что основная роль в токсическом действии этих агентов связана с образующимися активными формами кислорода (перекись водорода и суперокид-анион).
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА