Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Структура lux-оперонов и механизмы регуляции типа quorum sensing у морских бактерий
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
22
 ч
ч
100 |
о
X 1-
о
к
S
я
X О)
я о
О)
X S
Рисунок 16. Зависимость интенсивности биолюминесценции (I, отн.ед.) клеток штаммов АВ1157 1оп+ и АВ1899 lonA, содержащих плазмиды pGST-LuxR и рОМ или pGST-CTD и рОМ, от времени инкубации. Отдельные колонии клеток, выросших на агаризованной среде при 37 С, переводили в LB и дважды отмывали центрифугированием, добавляли АИ 10" М. Затем клетки ресуспендировали в 200 мкл L-бульона и измеряли биолюминесценцию при комнатной температуре. WT LuxRа - АВ1157 (pGST-LuxR, рОМ) lon" LuxRа - АВ 1899 lonA (pGST-LuxR, рОМ) WT С-домена - АВ 1157 (pGST-CTD, рОМ) lon" С-доменаа - АВ 1899 lonA (pGST-CTD, рОМ)
Как видим, на рисунке 16, интенсивность биолюминесценции клеток АВ1899 lonA (pGST-LuxR, рОМ) быстро нарастает уже в течение первых 15 мин с момента добавления АИ, что указывает на наличие в клетках в момент начала индукции (0-минут) достаточного для активации Рг промотора /wx-оперона количества молекул LuxR. В тоже время, в клетках штамма АВ1157 (pGST-LuxR, рОМ) индукция транскрипции генов lux-оперона начинается лишь через 70 мин после добавления АИ (10" М), что объясняется деградацией белка LuxR протеазой Lon и подтверждает данные, приведённые для полного /wx-оперона A. fischeri на рисунке 10. В варианте, когда в клетки введена плазмида pGST-CTD, кодирующая С-домен белка LuxR, экспрессия /wx-генов, расположенных на плазмиде рОМ, не зависит от добавления АИ и наличия в клетках активной Lon протеазы. Следовательно, лишь цельный белок LuxR, но не его С-домен, является мишенью для Lon протеазы.
Для протеазы ClpXP также показано участие в негативной регуляции QS системы A. fischeri. Мутации по генам clpP и clpX снижают активационный барьер для
23 срабатывания QS системы A. fischeri, хотя и с меньшей эффективностью, по сравнению с мутацией в гене ????.
Итоги исследования роли шаперонов и протеаз в регуляции QS системы lux-оперона A. fischeri.
- Lon протеаза участвует в негативной регуляции экспрессии генов lux-оперона A. fischeri, снижая активность белка LuxR.
- Показано, что шаперонин GroEL/ES необходим для сборки нативного белка LuxR
- Показано, что химерный белок GST-LuxR при выделении эффективно связывается с белками GroEL и Lon
- Показано, что лишь цельный белок LuxR, но не его С-домен, является мишенью для Lon протеазы.
- Совокупность данных in vivo и соочистка белка GroEL с LuxR и его делетированными формами доказывают, что N-концевой домен белка LuxR является мишенью для GroEL шаперонина при фолдинге.
Исследование активности шаперонов с помощью бактериальных люцифераз.
Для формирования нативной структуры белковой молекулы как в процессе синтеза на рибосомах (фолдинг), так и при ренатурации денатурированных полипептидов (рефолдинг) требуется участие специальных белков-шаперонов. В настоящее время в бактериях Е. coli детально изучены четыре семейства шаперонов: Hsp60 (GroELS), Hsp70 (DnaK-DnaJ-GrpE), HsplOO (ClpA, ClpB) и малые шапероны sHsp (IbpAB) (Bukau В., Horwich A.L., 1998; Haiti F.-U., 1996; Ellis RJ. and Haiti F.U., 1999). Мы впервые применили для анализа работы шаперонов в качестве модели бактериальные люциферазы, гомологичные по аминокислотной последовательности, но значительно различающиеся по термостабильности.
Для этой цели были клонированы гены /wx-оперонов luxAB, кодирующих две субъединицы люциферазы, из геномов различных люминесцирующих бактерий A. fischeri, Photobacterium phosphoreum, Vibrio harveyi и P. luminescens. Анализ термоинактивации и рефолдинга люцифераз проведен как in vitro с использованием очищенных препаратов ферментов, так и in vivo в бактериальных клетках Е. coli, как дикого типа, так и несущих мутации по генам, кодирующим белки-шапероны.
24
|
|
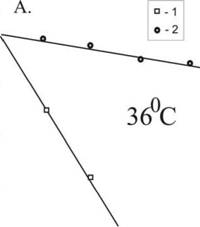
Рисунок 17. Кинетика термоинактивации бактериальных люцифераз in vivo. А. -Люциферазы P. phosphoreum (1) и A. fischeri (2), температура инактивации 36С; Б. -люциферазы A. fischer (1) /', V. harveyi (2) и P. luminescens (3), температура инактивации 43,5С. По оси ординат указана активность люциферазы (в процентах от исходного уровня), по оси абсцисс - время термоинактивации.
На рисунке 17 показана кинетика термоинактивации in vitro четырёх бактериальных люцифераз. Гены люцифераз были клонированы в клетках Е. coli из бактерий, различающихся по своему температурному оптимуму роста. Как видно из рисунка, наиболее термочувствительной оказалась люцифераза P. phosphoreum, что соответствует самому низкому температурному оптимуму роста психрофильных бактерий данного вида. Далее по возрастанию темостабильности следуют люциферазы A. fischeri, V. harveyi и P. luminescens.
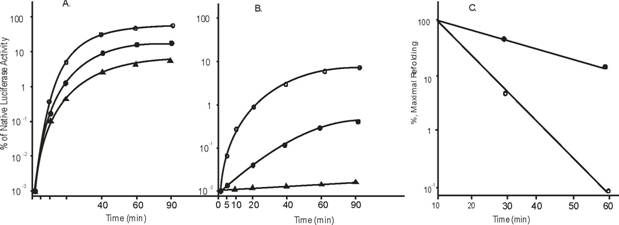
Данные по DnaKJE-зависимому рефолдингу тероминактивированных люцифераз in vivo представлены на рисунке 18. Наиболее полный рефолдинг (до 100 % от начальной активности) демонстрируют термочувствительные люциферазы. У более термостабильных люцифераз V. harveyi и P. luminescens восстановление активности достигает лишь 10-15%. Причём самая термостабильная люцифераза из P. luminescens обладает самым слабым рефолдингом. Эти данные совпадают с экспериментом, представленным на рисунке 20, где сравнивается эффективность рефолдинга (скорость и уровень) люцифераз из A. fischeri и P. luminescens в зависимости от времени инактивации люциферазы.
25
 Активность, %аа а
Активность, %аа а
0510 20
90аа 0 510 20 Время, мин
Рисунок 18. Кинетика рефолдинга термоинактивированных люцифераз в клетках E.coli. а-Люциферазы P. phosphoreum (круги) и A. fischeri (треугольники); б - V. harveyi (круги) и P. luminescens (треугольники). Светлые символы - рефолдинг в клетках штамма MG1644, тёмные символы в клетках штамма РК202 AdnaKJ. По оси ординат указана активность люциферазы (в процентах от исходного уровня), по оси абсцисс - время выдерживания образца при температуре, оптимальной для данного вида люциферазы (20 С -P. phosphoreum, 25С - A. fischeri, 28С - V. harveyi, 34С - P. luminescens).
С увеличением времени термоинактивации увеличивается количество необратимых белковых агрегатов в клетке, что приводит к уменьшению уровня и скорости рефолдинга термоинактивированных люцифераз. Однако наиболее круциально этот процесс идёт у термостабильных люцифераз: через 40-50 минут инактивации на 46 С рефолдинг не детектируется. В отличие от термостабильной люциферазы P. luminescens термолабильная люцифераза A. fischeri при тех же условиях инактивации сохраняет способность к рефолдингу и восстанавливает до 10% изначальной активности.
Кроме того на рисунках 18 и 19 представлены данные экспериментов по влиянию мутации в генах по шаперонам семейств Hsp70 (DnakJE) и HsplOO (ClpB). Показано, что мутация по гену dnaK полностью снимает способность люцифераз к рефолдингу, а мутация по гену вспомогательного шаперона ClpB, который по данным in vitro помогает комплексу DnaKJE дезагригировать белки, снижает рефолдинг до нескольких процентов от изначальной активности.26
Рисунок 19. Кинетика рефолдинга термоинактивированной люциферазы A. fischeri в клетках Е. coli SG20250 clpB (1) и CG22100 clpET (2). По оси ординат отложена активность люциферазы (в процентах от исходного уровня), по оси абсцисс - время инкубации образца при 25 С.
|
0 510аа 20 |
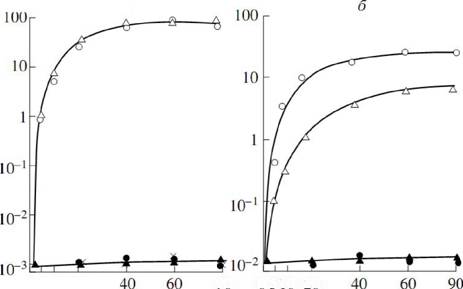
Рисунок 20. Зависимость рефолдинга тероинактивированных на 46 С люцифераз А fischeri (А) и P. luminescens (В) от времени инкубации клеток при 22С (о) - 15 мин инактивации() - 30 минут инактивации, (?) - 1 час инактивации. (С) - зависимость эффективности рефолдинга люциферазы A. fischeri () и P. luminescens (о) от времени инкубации клеток при 46 С
Белок семейства HSP100 - ClpA был описан в экспериментах in vitro как шаперон, защищающий белки от агрегации. Однако данных in vivo получить не удавалось.
Применение бактериальных люцифераз для исследования данного шаперона позволило
Рисунок 21. Зависимость уровня рефолдинга люциферазы A. fischeri от времени инкубации различных штаммов Е. coli MG1655 с плазмидой pF2 при 46 С. Штаммы: (?) - MG1655 фА+, () - MG1655 clpFy.cat, (О) - MG1655 clpKwkan.
Согласно данным, полученным в опытах in vitro, наличие IbpAB в смеси с белком-субстратом защищает белки от термоденатурации, снижая уровень агрегации, что фиксируется методом светорассеяния (Mogk A., et al.,2003). В нашей работе впервые было показано, что малые шапероны IbpAB оказывают влияние на рефолдинг термоинактивированных люцифераз также, как и белок семейства HsplOO ClpA, при пролонгированной инкубации на 46 С (рис. 22 и 23). Однако комплементировать недостаток ClpA белками IbpAB в клетке не удаётся. Клонированные на плазмиде гены ibpAB усиливают рефолдинг люцифераз при продолжительной (60 мин) термоинактивации до значений, превосходящих контрольные в штамме дикого типа (рис. 23), но не могут восстановить хоть сколько-нибудь значимо рефолдинг, сниженный в мутанте по гену clpA (рис. 24).
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА