Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Структура lux-оперонов и механизмы регуляции типа quorum sensing у морских бактерий
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
Влияние шаперонов и протеаз на QS систему lux-оперона A. fischeri
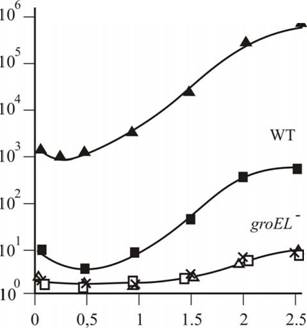
На рис. 10 приведены кривые зависимости интенсивности биолюминесценции (7) от концентрации (OD) клеток Е. coli SKB178 gro+ и мутантных по генам groEL и groES, содержащих гибридную плазмиду pF 1 с генами luxRICDABE V. fischeri. Клетки росли в среде LB при 28 С. В клетках, мутантных по генам groEL и groES интенсивность биолюминесценции значительно снижена. Введение в клетки мутантного штамма groE91 гибридной плазмиды pGroEL/GroES приводит к восстановлению интенсивности биолюминесценции (рис.10, кривая +pGroEL/ES), - превышение интенсивности биолюминесценции по сравнению с биолюминесценцией клеток groE определяется дозой гена. Следовательно, GroEL/GroES необходим для эффективной экспрессии генов lux-оперона V. fischeri.
I, отн. ед.
pGroELi
OD
Рисунок 10. Зависимость интенсивности биолюминесценции клеток Е. coli от OD. Клетки
(все используемые штаммы содержали плазмиду pFl с /wx-опероном A. fischeri)
инокулировали при начальной OD=0,01 и растили в среде LB с ампициллином (100
мкг/мл), в варианте +pGroESL с ампициллином и тетрациклином (15 мкг/мл) с аэрацией
при 28С.
17
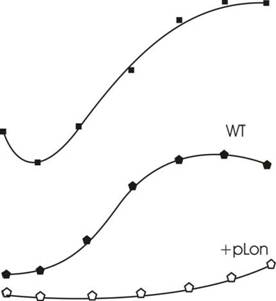
В отличие от GroEL/GroES, ATP-зависимая сериновая протеаза Lon участвует в
негативном контроле экспрессии /wx-оперона. АТФ - зависимая сериновая Lon - протеаза
играет важную роль в деградации неправильных и короткоживущих белков в клетке
(Gottesman S., 1999; Wickner S. et ah, 1999). Нами показано, что Lon - протеаза Е. coli
участвует в негативной регуляции транскрипции /wx-оперона A. fischeri, осуществляя
протеолиз белка LuxR. Интенсивность биолюминесценции клеток мутантного штамма
АВ1899 превышает примерно на три порядка таковую для АВ1157 (рис.11, кривые WT и
lon"). Введение плазмиды pBRlon с полноразмерным геном ????, кодирующим активную
Lon - протеазу, в клетки АВ1899 (рАС16) полностью снимает эффект мутации 1оп\
(рис. 11, кривая +pLon). Более того, лаг-период в кривой индукции люминесценции у
АВ1899 (рАС16, pBRlon) заметно увеличен по сравнению с таковым у штамма АВ1157
(рАС16), что может быть объяснено увеличением числа копий гена ???? в клетках с
плазмидой pBRlon. I, отн, ед.
6
lon
|
т |
18 Для получения белка LuxR in vitro была сконструирована гибридная плазмида на базе вектора pGEX-KG, несущая трансляционное слияние 5'-конца гена luxR с геном gst, кодирующим глутатион-Б-трансферазу (GST, мол. масса 26 кД). В результате аффинной очистки химерного белка GST-LuxR на колонке с глутатион-сефарозой с последующей детекцией изолированных белков методом масс-спектрометрии пептидов после трипсинолиза было показано, что GST-LuxR белок сопровождается при выделении GroEL белком (рис. 12). При выделении из мутантного штамма OFB111 groEL673 белок GST-LuxR сопровождался помимо полипептида GroEL также белком Lon. Полученные данные прямо доказывают, что GST-LuxR эффективно связывается с белками GroEL и Lon.
groEL673аа groEL97а WT

Рисунок 12. SDS-электрофорез в полиакриламидном геле (12%) белковой фракции клеток Е. coli (pGEX-LuxR), полученной в результате аффинной хроматографии на колонке с глутатион-агарозой. Дорожки:
1 -Е. coli OFBlllgraEL673;
2-Е. coligroEL97;
3-Е. coli SKB178 gro+;
4 - белки-маркеры.
Отметим, что согласно данным, представленным на рисунке 12, белок GroEL выделяется вместе с химерным белком GST-LuxR не только из клеток дикого типа, но и из мутантных по гену gro клеток. По-видимому, использованные в настоящей работе gro мутанты, выделенные СР. Georgopoulos и соавт. (Georgopoulos СР., et al.,1973) и относящиеся к группе миссенс-мутантов с одиночными аминокислотными заменами, не теряют способности связывать белки-мишени, но не могут вести их правильную сборку (фолдинг).
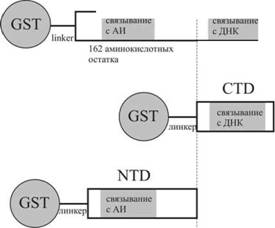
Белок LuxR состоит из двух доменов: С - концевой домен (88 аминокислотных остатков) определяет контакт белка с /wx-боксом в ДНК (ДНК - связывающий домен), a N-концевой домен (162 аминокислотных остатков) отвечает за связывание с АИ.
19
Так как LuxR состоит из двух доменов с различными функциями, было проведено сравнительное исследование влияния шаперонина GroEL на эффективность действия цельного LuxR и его С-домена в качестве активаторов транскрипции генов /wx-оперона A. fischeri в клетках Е. coli. Для этой цели использовались сконструированные гибридные плазмиды pGST-LuxR (GST слит с полноразмерным белком LuxR) или pGST-CTD (GST слит с С-концевым доменом белка LuxR) (рис. 13). Полученные конструкции характеризуются тем, что GST не мешает активности как полноразмерного LuxR (активирует промотор в АИ зависимой манере), так и С-концевого домена белка LuxR (открывает промотор независимо от концентрации АИ).
На рисунке 14 приведены кривые зависимости интенсивности биолюминесценции от времени инкубации клеток Е. coli SKB178 gro+ и OFB111 groEL673, содержащих плазмиду рОМ (содержит гены /wxCDABEG, промотором Рг, но без гена luxR) и плазмиду pGST-LuxR (GST слит с полноразмерным белком LuxR) или плазмиду pGST-CTD (продуцирует GST слитый с С - доменом белка LuxR). В такой комбинации отсутствует эффект положительной обратной связи, которая возникает при экспрессии с промотора Рг гена luxl, что позволяет прямо оценивать влияние мутаций в генах, кодирующих шапероны и протеазы, на активность LuxR и его делетированных форм.
&8 аминокислотных остатка |
 N-домен
N-домен
LuxR
С-донен
Рисунок 13. Структура конструкций химерных белков: GST-luxR (белок LuxR с глутатион-трансферазой), GST- CTD (С-концевой домен LuxR с глутатион-трансферазой) и GST-NTD (N-концевой домен LuxR с глутатион-трансферазой).
Как видно из рисунка 14, наличие в клетках Е. coli SKB178 gro+(рОМ) дополнительной плазмиды pGST-LuxR или pGST-CTD приводит к резкому увеличению интенсивности биолюминесценции в связи с активацией транскрипции генов /wxICDABE с промотора Рг. Мутация groEL673 резко снижает интенсивность биолюминесценции в бактериях, содержащих плазмиду pGST-LuxR. Однако, если в качестве активатора
20 транскрипции используется С - домен белка LuxR (плазмида pGST-CTD), то мутация groEL673 не влияет на экспрессию генов /wxICDABE. Данные, представленные на рисунке 14, указывают на то, что активность С - концевого домена белка LuxR не зависит от шаперонина GroEL/ES. Предполагается, что шаперонин GroEL/ES необходим для правильной сборки N- концевого домена.

н о
а-и ?
Рисунок 14. Влияние шаперонина GroEL на эффективность действия цельного LuxR и его С-домена в качестве активаторов транскрипции генов /wx-оперона A. fischeri.
Отдельные колонии клеток, выросших на агаризованной среде при 37 С, переводили в L-бульон и дважды отмывали центрифугированием, добавляли АИ 10" М. Затем клетки ресуспендировали в 200 мкл LB и измеряли биолюминесценцию.
groEL673 pLuxRа - OFB111 groEL673 (pGST-LuxR, pOM),
WT LuxRа - SKB178 gro+(pLuxR, pOM),
groEL673 С-домен - OFB 111 graEL673(pGST-CTD, pOM),
WT С-доменаа - SKB 178 gro+(pGST-CTD, pOM)
Для проверки этой гипотезы использовали гибридные плазмиды, кодирующие химерные белки GST-NTD (N-концевой домен, слитый с GST), GST-CTD и GST-LuxR (рис. 13). Была проведена очистка этих химерных белков с целью выяснить, с какими из них связывается GroEL при выделении с помощью аффинной хроматографии.
На рисунке 15 представлены данные SDS - электорофореза белковых фракций в 12% полиакриламидном геле. Белки GST-LuxR и GST-CTD и GST-NTD выделены с помощью аффинной хроматографии на колонке с глутатион агарозой. Как видно из рисунка 15, при аффинной очистке вместе с полноразмерным белком GST-LuxR и его N-доменом (GST-NTD) выделяется дополнительный белок (полоса в 60 кДа). Однако, при аффинной очистке С - домена белка LuxR (GST-CTD) эта полоса отсутствует.
21 Масс-спектрометрический анализ показал, что белок, выделенный из полосы 60 кДа, по составу и распределению пептидных фингер принтов согласно базе данных SWISS-PROT является шаперонином GroEL.
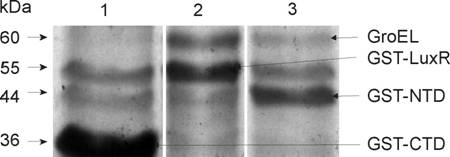
Рисунок 15. SDS-электрофорез в полиакриламидном геле (12%) белковой фракции, полученной в результате аффинной хроматографии на колонке с глутатион-агарозой. Белковую фракцию выделяли из клеток штаммов Е. coli TG-1 содержащих: pGST-CTD (дорожка 1), pGST-LuxR (дорожка 2) и pGST-NTD (дорожка 3) На дорожках 1 и 3 так же присутствует полоса глицерол - киназы (56,2 кДа), а на дорожке 1 и 2 полоса элонгационного фактора EF-Tu (43,3 кДа) (согласно масс-спектрометрическому анализу эти полосы соответствуют глицерол - киназе и элонгационному фактору EF-Tu). Эти белки сопровождают GST белок при мягких условиях отмывки.
Таким образом, было показано, что в условиях in vivo GroEL шаперонин связывается с полноразмерным LuxR и его N-доменом, но не связывается с С-доменом LuxR. Полученные данные доказывают, что N-концевой домен LuxR белка является мишенью для GroEL шаперонина при фолдинге. Можно сделать предположение, что GroEL шаперонин необходим для фолдинга только N-концевого домена белка LuxR. Достоверно показано, что С-концевой домен LuxR белка (88 аминокислот) не требует GroEL/ES шаперонин для фолдинга.
Для оценки действия Lon протеазы на LuxR и его С-домен гибридные плазмиды pGST-LuxR или pGST-CTD были введены в клетки штаммов Е. coli АВ1157 и Е. coli АВ1899 ????. Штаммы также содержали сенсорную плазмиду рОМ, позволяющую оценивать активность LuxR in vivo.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА