 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Рекомбинантные цитокины и цитокин-связывающие белки
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
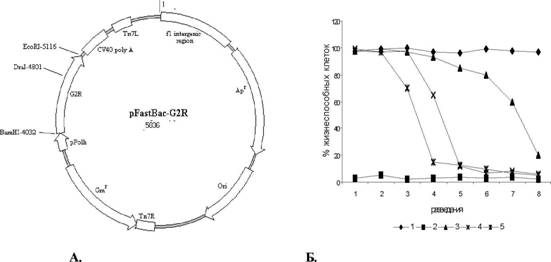
Рис. 17 А. Физическая карта плазмиды интеграции pFastBac-G2R. Б. Ингибирование цитопатического действия hTNF ростовой средой клеток Sf21, инфицированных рекомбинантными бакуловирусами. Кривые выживаемости клеток L929 в присутствии ростовой среды клеток Б21, инфицированных векторным баку ловиру сом (1), 50 E A hTNF и ростовой среды клеток Б21, инфицированных векторным баку ловиру сом (2), 50 ЕА hTNF и разведения (начиная 1:10 и последующие двукратные) ростовых сред клеток Sf21, инфицированных рекомбинантными бакуловирусами BTRI67, BTRgr90 и BTRz96 (3-5, соответственно). Каждая точка представляет среднее из трех измерений.
Полученные рекомбинантные бакуловирусы депонированы в музее ФБУН ГН - ВБ Вектор и имеют коллекционные номера VB-02, VB-03 и VB-01, соответственно.
Выделение рекомбинантных TNF-связывающих белков проводили методом хроматографии на аффинном носителе, представляющим иммобилизованный на акриламид-агарозном матриксе (ультрагель АсА 34) hTNF. Выход рекомбинантных вирусных белков составил 4.0-5.5 мг/л, 0.9-1.2 мг/л и 0.2-0.35 мг/л для VARV-CrmB, CPXV-CraiB и MPXV-CraiB, соответственно.
7.3 Изучение физико-химических свойств рекомбинантных ортопоксвирусных TNF-связывющих белков
Электрофоретический анализ полученных препаратов рекомбинантных белков VARV-CrmB, MPXV-CrmB и CPXV-CrmB в редуцирующих и нередуцирующих условиях, которые достигаются присутствием или
отсутствием 2-МЕ в пробах, представлен на рис.18А Молекулярная масса
31
афинноочищенных препаратов (в присутствии в пробах 2-МЕ), составляет 45-47 кДа (дорожки 1, 3, 5). Несовпадение наблюдаемых молекулярных масс с теоретически ожидаемыми, исходя из аминокислотного состава СгтВ-белков (например, для VARV-CrmB молекулярная масса должна составлять 38.2 кДа), позволяет предположить модификацию данных полипептидов гликозилированием. При отсутствии 2-МЕ в пробах, молекулярная масса VARV-CrmB (дорожка 6) соответствует димерной (90 кДа), а препараты MPXV-CraiB и CPXV-CraiB (дорожки 2 и 4) - мономерным (45-47 кДа) формам.
2-МЕа +-+-+-
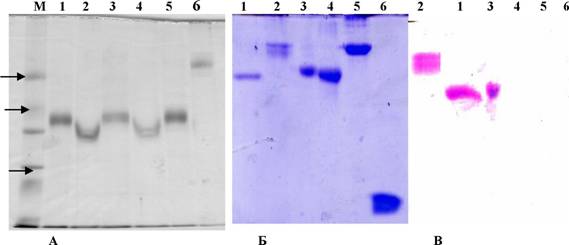
Рис. 18 А. Фракционирование CrmB-белков в 12%-ном SDS-ПААГ. Нагрузка - 1мкг на дорожку. Стрелками обозначено положение белков-маркеров молекулярного веса 75, 50 и 37 кДа. + или - обозначают присутствие или отсутствие 2-МЕ в пробах. Б и В. Гликозилирование белка VARV-CrmB. Рекомбинантный белок VARV-CrmB (дорожка 3) и белки-маркеры oti-кислый гликопротеин, фетуин, овальбумин, БСА и лизоцим в двух повторах (дорожки 1, 2, 4-6, соответственно) фракционировали электрофорезом в 12% SDS-ПААГ. Одну половину геля окрашивали краской Coomassie brilliant blue R250 (Б), другую - реагентами набора GelCodeR Glycoprotein Staining Kit (В), (образцы 1 и 2 нанесены зеркально).
Дифференциальное окрашивание белка VARV-CrmB и гликозилированных в различной степени белков-стандартов, фракционированных в SDS-ПААГ (рис. 18Б, В), подтверждает факт его гликозилирования.
32
На рис. 19 приведены результаты фракционирования 8 мкг VARV-CrmB в 8% SDS-ПААГ и вестерн-блот анализ с двумя видами поликлональных антител - AbosT-vARv-omB и AbvARv-crmB. При окрашивании Кумасси R250 выявляются высокомолекулярные, предположительно олигомерные, формы VARV-CrmB, что подтверждается результатом вестерн-блот анализа. Выявление олигомерных форм рекомбинантного белка в препаратах афинноочищенного VARV-CrmB вызвало необходимость определить его конформацию в нативном состоянии, т.е. в каком виде он синтезируется в клетках насекомых.
M
+ 2-МЕ

Кумасси R250а вестерн-блот
<-Ч2Ч- <-Ч1Ч-
Рис.аа 19а Фракционированиеа ва 8%а SDS-ПААГа рекомбинантногоа белка VARV-CrmBаа и
ВеСТерН-бОТ анаЛИЗ С ПОЛИКЛОНаЛЬНЫМИ аНТИТелаМИ AbvARV-CrmBаа (1) И AboST: VARV-CrmBаа (2).
Белки-маркеры молекулярных масс (М): 116 кДа (Я-галактозидаза), 88 кДа (БСА) и 45 кДа (овальбумин). + или - означает присутствие или отсутствие 2-МЕ в буфере для нанесения образцов. Стрелками указаны мономерные, димерные и олигомерные формы белка VARV-CrmB.
Для этого осветленный лизат инфицированных клеток насекомых фракционировали на колонке с биогелем А-0.5т. Полученные фракции исследовали в тесте ингибирования цитотоксического действия hTNF на клетки линии L929. Результаты этого эксперимента представлены на рис. 20.
TNF-нейтрализующая активность, ва основном,а определяется во фракциях,
33
соответствующих свободному объему колонки, и, следовательно, должна соответствовать олигомерным формам VARV-CrmB, молекулярная масса которых превышает 500 кДа. Минорная TNF-нейтрализующая активность определяется во фракциях белков с молекулярными массами 270 кДа и 90 кДа, что может соответствовать гексамерным и димерным формам VARV-CrmB.
о
00 (VI
H
? о
x
H
o
- c
K
Ш
o
0)
s
H
c O
0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0
со |
ABа С D E
u;u |
||
ж |
||
;; |
|аа : ж |
~ |
-- |
ж : |
~ |
-- |
o 't Iа * I .'а ^ |
/V |
o/МbJ* Oа Oа ц"" |
т- CDа т-Ю Юа CD |
CDа т- CDа т-а CD т-а CD t-а CM CMа СОа СО ж*а ж* |
CD т-а CDа т- CDа т-а CD
(D NNа Юа 00а О)а О)
1,2
н ?
0,8аа g m
s
0,6аа S
0,4
H
x
0,2
Номер фракции
Рис.аа 20а Гельфильтрацияа наа биогелеа А-0.5ша лизатоваа клетока насекомыха линииаа Sf21, инфицированных рекомбинантным бакуловирусом BVI67.
Колонку калибровали с помощью маркеров молекулярных масс, выход которых обозначен стрелками: А, 2000 кДа (голубой декстран); В, 440 кДа (ферритин); С, 232 кДа (каталаза);
D, 67 кДа (БСА); Е, 45 кДа (овальбумин). (---- ) - концентрация белков, ОП28о.
(____ ) - TNF-нейтрализующая активность, ОП550
Эффективность взаимодействия вирусных TNF-связывающих белков с hTNF изучали методом конкурентного твердофазного иммуноферментного анализа, с помощью которого оценили уровень связывания hTNF с собственными поликлональными антителами (АЬишО в присутствии различных количеств очищенных препаратов вирусных белков. Результаты, представленные на рис. 21, свидетельствуют о том, что вирусные белки ингибируют этот процесс, эффективность которого (% ингибирования) уменьшается в порядке: VARV-CrmB > CPXV-CrmB > MPXV-CrmB.
34
й |
р |
# |
70 g 60
1 |
50 40 I 30 i 20 sC 10 0
^
о
а |
ъ |
Ф |
а
Л |
N- |
А'
концентрации vTNF-BP, мкг/мл
l
nVARV-CrmB п CPXV-CrmB п VPXV-CrmB
Рис. 21 Ингибирование вирусными TNF-связывающими белками взаимодействия поликлональных антител АЬи-nf с hTNF.
7.4 Изучение биологических свойств ортопоксвирусных TNF-связывающих белков in vitro
Способностьа рекомбинантныха СгтВ-белковаа предотвращать
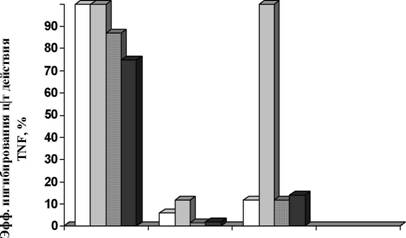
взаимодействие TNF или LTa с рецепторами эукариотических клеток исследовали по их способности нейтрализовать цитопатическое действие hTNF, MuTNF, RTNF, а также hLTa, используя клетки мышиных фибробластов линии L929 как мишени, а рекомбинантные белки VARV-, MPXV- и CPXV-CrmB как ингибиторы. В качестве отрицательного контроля использовали ?-интерферон-связыващий белок вируса натуральной оспы, также синтезированный в клетках насекомых и выделенный с помощью аффинной хроматографии (Непомнящих Т.С. и др., 2005). Как демонстрируют результаты, представленные в табл. 6 и на рис. 22, белок VARV-CrmB практически с одинаковой эффективностью ингибирует цитопатическое действие человеческого, мышиного и кроличьего TNF и лимфотоксина. MPXV-CrmB обладает наименее выраженным ингибирующим действием. CPVX-CrmB с наибольшей эффективностью ингибирует цитопатическое действие мышиного TNF.
35
Таблица 6
Концентрации белков СгтВ, обеспечивающие 50%-ное ингибирование цитокин-индуцированного лизиса клеток линии L929.
Цитокин 2 нг/мл |
VARV-CrmB (нг/мл) |
CPXV-CrmB (нг/мл) |
MPXV-CrmB (нг/мл) |
hTNF |
6.0 |
50.0 |
100.0 |
MuTNF |
5.9 |
5.9 |
50.0 |
RTNF |
7.0 |
50.0 |
400.0 |
hLTa |
7.7 |
43.0 |
300.0 |
 100
100
VARV-CrmB MPXV-CrmBа CPXV-CrmB
D hTNF D MuTNF BRTNF DLT-a
Рис. 22 Эффективность действия рекомбинантных CrmB-белков. Концентрация VARV-CrmB, обеспечивающая 50% защитный эффект от действия TNF (бхЦПДо ) на культуре клеток L929 (VARV-CrmB5о%), принята за 100%. Остальные значения рассчитаны по формуле: R-CrmBsoo/o/VARV-CrmBsoo/oX 100%, где R-CrmB - MPXV- и CPXV-CrmB, соответственно.
Для того, чтобы оценить потенциал белка VARV-CrmB как возможного TNF-антагониста, сравнили эффективность нейтрализации цитотоксического действия hTNF на клетки мышиных фибробластов L929 вирусного белка VARV-CrmB и ряда известных TNF-антагонистов (hTNFsRI, hTNFsRII, поликлональных антител к TNF, TNF-нейтральзующего МАК 195, препарата
36
Remicade). Величины ICso, при которых наблюдается 50% ингибирование цитотоксического действия hTNF, приведены в табл. 7.
Таблица 7
Эффективность нейтрализации in vitro цитотоксического действия hTNF различными TNF-
антагонистами (aTNF)
Препараты aTNF |
Отношение концентраций hTNF:aTNF при достижении ICS0 |
|
VARV-CrmB |
2 иг/мл : 4-8 нг/мл |
1:2-4 |
mAb МАК 195 |
2 нг/мл : 12-15 нг/мл |
1: 6-7.5 |
AbTNF |
2 нг/мл : 40-100 нг/мл |
1: 20-50 |
Remicade* |
2 нг/мл : 0.5-1 нг/мл * |
1 : 0.25-0.5 |
hTNFsRI |
2 нг/мл : 0.2-0.3 мкг/мл |
1: 100-150 |
hTNFsRI R&D Systems" (США) |
25 нг/мл : 30-60 нг/мл |
1:120-240 |
hTNFsRII |
2 нг/мл : 2-3.5 мкг/мл |
1: 1000-1750 |
hTNFsRII R&D Systems" (США) |
0.25 нг/мл : 0.2-0.6мкг/мл |
1: 800-2400 |
hTNFsRI/Fc Chimera R&D Systems" (США) |
0.25 нг/мл : 0.4-1 нг/мл |
1:1.6-4 |
hTNFsRII/Fc Chimera R&D Systems" (США) |
0.25 нг/мл : 4-16 нг/мл |
1:16-64 |
* Концентрация infliximab, входящего в препарат Remicade.
Курсивом обозначены данные, взятые из каталога фирмы R@D Systems" (США).
37
В табл. 7 указаны также значения IC50 для растворимых клеточных и химерных, содержащих Fc-иммуноглобулиновый домен (Bathon J.M. et al., 2000), рецепторов (hTNFsRI, II или hTNFsRI, II/Fc Chimera, соответственно), взятые из каталога фирмы R@D Systems (США). Хорошее соответствие экспериментально определенных в настоящей работе значений IC50 для TNFsRI и TNFsRII служит внутренним контролем и позволяет заключить, что эффективность ингибирования цитотоксического действия hTNF рекомбинантным белком VARV-CrmB in vitro соизмерима с активностью химерных рецепторов TNF и TNF-нейтрализующего моноклонального антитела mAb MAKI95, но несколько уступает активности препарата Remicadeо.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА