Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Рекомбинантные цитокины и цитокин-связывающие белки
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
препаратов рекомбинантного hGM-CSF приводит к истощению фракции CD14 -клеток и увеличению фракции CD83 -клеток, т.е. к появлению зрелых дендритных клеток.
Для изучения биологической активности рекомбинантного GM-CSF человека in vitro использовали мононуклеарные клетки костного мозга (КМ) больных с различными патологиями (цирроз, СКВ, ОЛЛ, лимфома). Как показывают данные, представленные в табл. 4, при добавлении рекомбинантного hGM-CSF (10 нг/мл) в метилцеллюлозную среду MethoCult GF Н4230 наблюдается образование гранулоцитарно-макрофагальных колоний мононуклеарными клетками (МНК) больных, а их количество соответствует числу колоний, формирующихся в полной среде, содержащей коммерческий riGM-CSF. В метилцеллюлозной среде MethoCult GF Н4230 без добавления riGM-CSF МНК колонии не формируют.
Таблица 4
Влияние rhGM-CSF на колониеобразующую способность мононуклеарных клеток КМ
пациентов с различными патологиями.
Патология |
MethoCult H 4434 (полная среда) |
MethoCult H 4230 Юнг rhGM- CSF, |
MethoCult H 4230 (без цитокинов) |
СКВ |
11,0 1.2 |
10,8 1,5 |
0 |
Цирроз |
30,0 1,9 |
22,5 1,0 |
0 |
ОЛЛ |
12,0 2,3 |
17,3 2,0 |
0 |
имфома |
2,5 0,3 |
2,5 0,6 |
0 |
Клетки КМ мышей (CBAxC57Bl/6)Fl |
0 |
0 |
0 |
MethoCultGF М3434 (полная среда) |
MethoCult М3231 Юнг rhGM- CSF |
MethoCult М3231 |
|
Клетки КМ мышей CBAxC57Bl/6)Fl |
18 3,2 |
0 |
0 |
Известно (Rasco J., Gough N. et al., 1994), что в отличие от G-CSF, GM-CSF обладает видовой биологической специфичностью и, в частности, hGM-CSF не оказывает пролиферативного эффекта на мышиные гемопоэтические клетки-предшественники. При добавлении исследуемого препарата hGM-CSF
24
(10 нг/мл) к метилцеллюлозной культуре клеток КМ мышей, не содержащей цитокины, не происходит образования каких-либо колоний, тогда как культивирование этих клеток в метилцеллюлозной среде, содержащей полный набор цитокинов, приводит к формированию стандартного набора колоний (табл. 4).
Результаты проведенного исследования свидетельствуют, что продукт экспрессии в E.coli синтетического гена gm-csf человека обладает функциональными свойствами GM-CSF человека и может использоваться для разработки технологии получения субстанции rhGM-CSF и отечественных лекарственных форм для нужд практического здравоохранения.
6. Экспрессия полусинтетического гена tnf мыши
В работах (Nedospasov С. A. et al., 1986; Semon D. et al., 1987) описана нуклеотидная последовательность локуса 17-ой хромосомы мыши, содержащая гены TNF и LT-a. Основная часть смысловых ко донов гена tnf мыши локализована в четвертом экзоне, а наличие в этой нуклеотидной последовательности сайтов узнавания эндонуклеаз рестрикции Xhol и EcoRI позволяют изолировать часть гена tnf мыши. Плазмида pGEM, содержащая фрагмент геномной ДНК мыши, соответствующий четвертому экзону, была любезно предоставлена С.А. Недоспасовым. XhoI/EcoRI(639 п.о.)-фрагмент этой плазмиды и синтетический BamHI/XhoI-адаптер, с помощью которого восстанавливается N-концевая часть зрелого TNF мыши, клонировали в полученной ранее плазмиде pDSpVl. Физическая карта плазмиды pMuTNF и структура адаптера представлены на рис. 14. В плазмиде pMuTNF полусинтетический ген tnf мыши находится в составе бицистронного оперона.
Рекомбинантными ДНК pMuTNF и pTNF311 (Коробко В.Г. и др., Патент РФ 1445193), в которой ген tnf человека (htnf) находится под контролем конститутивных промоторов Al и А2 фага Т7, трансформировали клетки E.coli SG20050 и АргТсг-трансформанты использовали для анализа уровня экспрессии генов #?? человека и мыши.
25
|
Ptipx2 Eco RI (143) |
gatcaattctatgctgcgtagctcttctcagaactcgagcgacaagccggttgctcatgttgttgctaaccatcaggttgaagaacagc
ttaagatacgacgcatcgagaagagtcttgagctcgctgttcggccaacgagtacaacaacgattggtagtccaacttcttgtcgagca5'
Рис.аа 14а Физическаяа картаа плазмидыа pMuTNFаа иа структураа синтетическогоа адаптера, использованного для конструирования полу синтетического гена Mutnf.
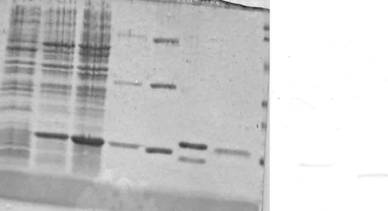
Результаты электрофоретического фракционирования в 12% SDS-ПААГ представлены на рис. 15А. По сравнению с контролем (дорожка 1) плазмиды pMuTNF (дорожка 2) и pTNF311 (дорожка 3) детерминируют синтез в клетках E. coli SG20050 полипептидов с молекулярной массой около 16 кДа. По данным денситометрии уровень экспрессии полусинтетического гена Mutnf составляет около 15% от суммарного белка клеток. Выделение рекомбинантного MuTNF проводили методом, разработанным для выделения рекомбинантного TNF человека (hTNF) из бактериальных клеток (Лебедев Л.Р. и др., 1995). Электрофореграммы индивидуальных белков представлены на рис. 15А. Рекомбинантный RTNF выделен по той же технологии из клеток E.coli SG20050, несущих плазмиду pRTNF, полученную В.В. Кравченко клонированием полусинтетического гена Rtnf в плазмиде pDSpVl. Результаты вестерн-блот анализа с поликлональными антителами к hTNF, приведенные на рис. 15Б, свидетельствуют, что MuTNF и RTNF практически не реагируют с этими антителами. Удельную активность рекомбинантных препаратов TNF определяли в цитотоксическом тесте на клетках мышиных фибробластов линии L929 относительно отраслевого стандарта OCO 42-28-212-93, оттитрованногоа поа препаратуа TNFаа 1740/58аа фирмыаа Celltechа (США).аа Она
26
составил 6x10,аа 3x10'аа и 1.5x10'аа MEаа дляаа hTNF,аа MuTNFаа иаа RTNF, соответственно.
hа M
1 2 3 Muа hа Rа IFN M Rаа Mu
|
Х
А.аа Б.
Рис. 15 Фракционирование в 12% SDS-ПААГ (А) и вестерн-блот анализ с поликлональными антителами к hTNF (Б) суммарных лизатов клеток E.coli SG20050 (1), E.coli SG20050, содержащих плазмиды pMuTNF (2) и pTNF311(3), индивидуальных белков MuTNF (Mu), hTNF (h), RTNF (R) и hIFNa-2b (IFN). M- Prestained SDS-PAGE Standards (Low Range, BioRad, США).
Из совокупности представленных данных следует, что предлагаемый способ экспрессии генов в составе полицистроных оперонов, имеющих сопряженную систему трансляции, в сочетании с эффективным транскрипционным контролем, позволяет достичь высокого уровня экспрессии целевых продуктов и открывает возможность создания высокоэффективных конститутивных штаммов-продуцентов биологически активных веществ.
7. Экспрессия генов поксвирусных TNF-связывающих белков в клетках насекомых и изучение свойств рекомбинантных белков
Вирусы рода Orthopoxvirus семейства Poxviridae являются опасными патогенами человека и животных, которые в процессе эволюции освоили различные молекулярные механизмы преодоления ранних неспецифических защитных реакций организма хозяина на вирусную инфекцию. Представители этого рода вирусов детерминируют синтез секретируемых белков -вироцепторов, которые функционируют как связывающие цитокины белки, блокируя, таким образом, их активность. Патогенность ортопоксвирусов для
27
человека уменьшается в ряду VARV-^MPXV-^CPXV и может быть связана с
функциональной активностью вироцепторов.
Ключевуюаа рольаа ваа координированииаа антивирусногоаа ответа,аа какаа и
функционирования иммуннойа системыа ва целом,а играета TNF.а Нарушение
контролируемойаа продукцииаа TNFаа играетаа критическуюаа рольаа ваа этиологии
развитияаа ряд заболеванийаа человека,аа такихаа какаа ревматоидныйаа артрит,
менингит, септическийаа шок,аа кахексия. Способностьаа вирусных белков
взаимодействовать с иммунной системой человека открывает перспективу их
использования для разработки лекарственных иммунокоррекционных средств.
Необходимыма предварительныма этапома такиха разработока является
сравнительное изучение физико-химических и биологических свойств
вирусных TNF-связывющих (СгтВ)-белков.
7.1 Сравнительный анализ аминокислотных последовательностей TNF-связывающих белков вирусов натуральной оспы, оспы коров и оспы обезьян
В геноме вируса оспы коров (CPXV) выявлены 5 рамок трансляции, в
той или иной степени гомологичных клеточному TNF-рецептору П-го типа
(TNFRII), и для продуктов генов сгтВ, crmC, crmD и сгтЕ показана TNF-
связывающая активность (Saraivб M., Alcami А., 2001). У вируса натуральной
оспы (VARV) изологом гена I4R CPXV, кодирующего белок СппВ, является
ген G2R, а у вируса оспы обезьян (MPXV) - ген J2R (Shchelkimov S.N. et al.,
2002).
Для 10-ти штаммов VARV, 22-х штаммов MPXV и 14-ти штаммов CPXV проведен анализ степени внутри- и межвидовой гомологии CrmB белков и его результаты, представленные в табл. 5, свидетельствуют о высокой степени гомологии этих белков.
Сравнительныйаа компьютерный анализаа аминокислотных
последовательностей СгтВ-белков, проведенный для штаммов VARVIND-1967 (Х67117) и VARVGAR-1966 (Х70841), MPXVZAI-1996-1-16 (AF380138)аа иаа MPXVCON-2003-358аа (DQ011154)аа относительноаа штамма
28
CPXVGRI-1990аа (X94355),а результатыа которогоа представленыа на рис.16, выявляет несколько видоспецифичных аминокислотных замен.
Таблица 5 Гомология CrmB белков VARV, CPXV и MPXV
Вид ортопоксвирусов |
CPXV |
VARV |
MPXV |
MPXV |
82 - 92% |
84 - 96% |
99 - 100% |
VARV |
82 - 91% |
98 -100% |
|
CPXV |
85 - 100% |
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
pR-GRI J2R-ZAI J2R-CNG G2R-IND G2R-GAR
mksvlysyilflsciiingfdiaphapsngkckdneynrhnlcclscppgtyasrlcdsk m|svlysyilflsciiingi dlaphapsngkckdneyrsrnlcclscppgtyasrlcdsk mIsvlysyilflsciiingi diaphapsngkckdneyrsrnlcclscppgtyasrlcdsk
MKSVLYIIYTLFLSCTTTNGffDBffpIMpBNGKCKDfflEYIJIRHNLCCLSCPPGTYASRLCDSK MKSVLYбзYILFLSCIIINGRDglpglP@NGKCKDбlEYбgRHNLCCLSCPPGTYASRLCDSK
JTT JTT JTT JTT JTT |
CECAPGYYCLL CECSPGYYCLL CECSPGYYCLL CECSPGYYCLL CECSPGYYCLL |
TNTNTQCTPCGSGTFTSRNNHLPACLSCNGRCDSNQVETRSCNTTHNII
CNTTHN^I CNTTHN^I |
TNTЧqctpcgs|tftshnnhl|aclscngrcdsnqvetrsc|ntthnf:i tntЧqctpcgs|tftshnnhl|aclscngrcdsnqvetrs tnt Ч qctpcgsgtftsrnnhlpaclscngrclflsnqvetrs tnt Ч qctpcgsgtftsrnnhlpaclscngrclflsnqvetrs
CNTTHN^I
kgssgckacvsqtkcgigygvsghtstgdwcspcglgtyshtvssadkcepvpsntfny kgssgcHc|s|tkcgigygvsgytstgdvicspcgpgtyshtvsstdkcepvtsntfny
KGSSGcIcIsItKCGIGYGVSGYTSTGDVICSPCGPGTYSHTVSSTDKCEPvIsNTFN' КСССКАСУСТКСС1СУСУСНТЕсОУ1СРСс1зСТУНТУАОКСЕРУРТГ№ KGSSGCKACVSQTKCGIGYGVSGHTS^GDVICSPCGбзGTYSYTVSSTDKCEPVPpнSSNН
IDVEINLY IDVEINLY IDVEINLY IDVEIJJLY IDVEIJJLY |
IDTS IDTS IDTS IDTS IDTS |
PVN pvk |
:trttttglsesistseltitmnhkdcdpvfrdgyfsvlnkvatsg :trttttglsesistseltitmnhkdcdpvfraeyfsvlnзvatsg :trttttglsesistseltitmnhkdcdpvfraeyfsvlnзvatsg :trttttglsesiб1tseltitmnhб1dcбб1pvfreeyfsvlnkvatsg :trttttglsesiб1tseltitmnhб1dcбб1pvfreeyfsvlnkvatsg
KVC
FFTGENRY()N FFTGENRY()N FFTGENRY()N FFTGENRYON FFTGENRY()N |
IS TSK TS IS IS |
tlnfeikcnnkdssskqltktknddgimphsetvtlvgdclssvd
|ctlnfeikcnnkdssskqltktkn|dt-imp|hsetvtlvgdclssvd
КТ( |
ictlnfeikcnnkdssskqltktknpt-imphsetvtlvgdclssvd
ctlnfeikcnnk@ssiзkqltkgknddg|jm@hsetvtlagdclssvd
ctlnfeikcnnk@ssiзkqltkgknddg|бm@hsetvtlagdclssvd
IYILYSNTNTQDYETDTISYHVGNVLDVDSHMPGSCDIHKLITNSKPTRFL* 351
IYILYSNTNTQDYETDTISYH|GNVLDV|SHMP|SCDIHKLITNSCNPTHL* 34 8
IYILYSNTNTQDYETDTISYHMGNVLDVJSHMP|SCDIHKLITNSQNPTHL* 34 8
IYILYSNTNgQDYETDTISYJgVGNVLDlgDSHMPGSCNIHKPITNSKPTRFL*аа 34 9
IYILYSNTNgQDYETDTISYJgVGNVLDlgDSHMPGSCDIHKLITNSKPTRFL*аа 34 9
Рис. 16 Анализ аминокислотных последовательностей CrmB-белков.
Сравнение аминокислотных последовательностей проводили с помощью программы CLUSTAL W(1.82); для анализа сигнальных последовательностей использовали программу SignalP; поиск потенциальных сайтов гликозилирования проводили с помощью программы NetNGlyc. Серым и черным цветами обозначены видопецифичные (относительно белка CPXV-CrmB) аминокислотные замены белков MPXV-CrmB и VARV-CrmB, соответственно. Потенциальные сайты N-гликозилирования заключены в рамку. Вертикальными линиями обозначены потенциальные сайты отщепления сигнальных пептидов.
Такая видоспецифичность может являться причиной различий конформации и характера гликозилирования белковых молекул, что, в свою
29
очередь,а будета обуславливать различияа физико-химических,
иммунологических и биологических свойств ортопоксвирусных СгтВ-белков.
Выделение природных белков СгтВ в количествах, необходимых для изучения их физико-химических и биологических свойств, невозможно как по чисто техническим причинам, так и в силу сложности организации работ с особо опасными вирусами натуральной оспы и оспы обезьян. Результатом экспрессии генов СгтВ-белков в клетках E.coli оказалась продукция нерастворимых, биологически неактивных продуктов (Ryazankina O.I. et al., 1998). Для получения рекомбинантных белков, свойства которых максимально соответствовали бы природным аналогам, использовали эукариотическую бакуловирусную систему экспрессии Bac-to-Bac (Luckуw V.A. et al., 1993).
7.2 Конструирование рекомбинантных бакуловирусов, продуцирующих СгтВ-белки Методом ПЦР, используя в качестве матрицы Xhol-P фрагменты из созданных
ранее клонотек фрагментов ДНК VARV (Щелкунов С.Н. и др., 1992), MPXV
(Shchelkimov S.N. et al, 1998) и CPXV (Shchelkimov S.N. et al, 2001), a также
ген-специфические праймеры, получали фрагменты, размером 1081, 1080 и
1088 п.о., содержащие кодирующие последовательности генов G2R, J2R и I4R
соответствующихаа вирусов.аа Полученныеаа ПЦР-фрагментыаа клонировалиаа в
плазмидеаа интеграцииаа pFastBac,аа физическаяаа карт плазмидыаа интеграции
pFastBac-G2Rаа представлен наа рис.аа 17А.аа Ваа клеткахаа E.coliаа DHlOBacаа в
результате сайт-специфической транспозиции плазмид интеграции в бакмиду
bMON14272а получилиа рекомбинантныеаа бакмидыа bMON14272-G2R,
bMON14272-J2R и bMON14272-I4R. После трансфекции бакмидами
bMON14272-G2R,аа bMON14272-J2Rа иа bMON14272-I4Rа клетока насекомых
линииаа S f21аа отобралиа рекомбинантныеаа бакуловирусыа BTRI67,а BTRz96аа и
BTRgr90.аа Полученныеаа рекомбинантныеаа бакуловирусыаа детерминируютаа в
клеткахаа S f21аа синтезаа иаа секрециюаа ваа культуральнуюаа средуаа субстанций,
ингибирующих цитотоксический эффект TNF на клетках L929 дозозависимым
образом, как это показано на рис. 17Б.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА