Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Рекомбинантные цитокины и цитокин-связывающие белки
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
1234а 567аа 89 10
11аа 12а 13 14
|
.:
жж .ж
ааа .."
**^..
![]()
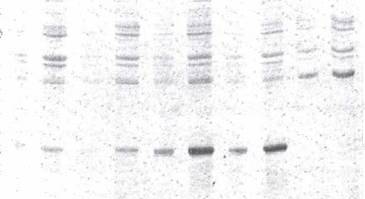
Рис. 8 Фракционирование суммарных лизатов клеток E.coli SG20050\p95/2WN(9, 10), E.coli SG20050\nlFm (1, 2), E.coli SG20050/p38МIFN (3, 4), E.coli SG20050\p381/2IFN (5 -8), E.coli SG20050\p28OIFN (11, 12) и E.coli SG20050\p28O/2IFN (13, 14) в 12% SDS-ПААГ. Положение интерферона a-2b указано стрелкой.
Уровень синтеза интерферона, детерминируемый плазмидой p95/2IFN, гораздо ниже, чем у вариантов, содержащих одну копию гена -pIF6/8 и p381IFN, а варианты p381/2IFN и p280/2IFN значительно превышают возможность своих аналогов с одной копией гена. Полученные результаты свидетельствуют, что сигнал инициации трансляции,аа расположенныйаа междуаа двумяаа генамиаа ifna-2b,
17
функционирует только в случае эффективной трансляции предыдущего цистрона.
Таблица 2
Относительные уровни синтеза интерферона в клетках E.coli SG20050, содержащих плазмиды рГРб/8, p381IFN, p280IFN, p381/2IFN и p280/2IFN
Плазмида |
Промотор |
Количество копий гена |
Содержание IFNoc-2b, % от суммарного клеточного белка* |
pIF6/8 |
Pviii |
1 |
11 |
p381IFN |
Pviii |
1 |
10 |
p280IFN |
(Ptrp)2 |
1 |
30 |
p95/2IFN |
Plac |
2 |
<1 |
p381/2IFN |
Pviii |
2 |
32 |
p280/2IFN |
(Ptrp)2 |
2 |
60 |
* культивирование в 5 мл среды LB
4. Выделение продукта экспрессии искусственного гена ifna-2b из клеток E.coli и анализ его структуры
Внутриклеточнуюа локализациюа продукта экспрессииа искусственного
ген ifna-2bаа определяли,аа разделяяаа послеаа ультразвуковойаа дезинтеграции
растворимую и нерастворимую в физиологической буферной системе фракции
клеточных белков. Экстракцию IFNoc-2b из лтелец включения проводили 7.5
M солянокислым гуанидином (рис. 9А). Методом ВЭЖХ на широкопористом
носителе Полисил ОДС-300 гуанидинхлоридную фракцию IFNoc-2b
дочищали до практически гомогенного состояния (рис. 9Б, дорожка II) и такой
препарат использовали для структурных исследований.
Установлено, что аминокислотный состав исследуемого полипептида
соответствуетаа теоретическиаа ожидаемому,аа N-концевымаа остаткомаа является
цистеин, а последовательность пяти N-концевых аминокислот C-D-L-P-QЧ
соответствует структуре лейкоцитарного интерферона человека (рис. 4). N-
концевые аминокислотные остатки пептидов, образующихся при гидролизе
исследуемого полипептида бромцианом (лейцин, аргинин, изолейцин, лизин и
цистеиноваяа кислота),а соответствуюта структуреа IFNoc-2bа (рис.а 4).
Исчерпывающий гидролиз полипептида карбоксипептидазами А и В, а также
карбоксипептидазой P показал, что образующаяся смесь аминокислот также
18
соответствует С-концевой структуре IFNa-2b. Удельная активность препарата (фракция II), определенная по подавлению цитопатического действия вируса энцефаломиокардита мышей на культуре клеток легкого эмбриона человека Л-68, составила IO8 ME.
А.а Б.
3а 4 |
I II
|
*"~
* _ -аа й
^БЦГ^??-A
1 5.1444
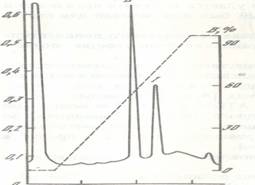
Рис. 9 Выделение IFNa-2b. А. Электрофоретический анализ фракций выделения продукта экспрессии синтетического гена ifna-2b в E.colм. 1 - суммарный лизат клеток E.colм SG2005Ц\p280/2IFN; 2 - супернатант после ультразвуковой дезинтеграции клеток; 3, 4 -осадок и супернатант после обработки буфером PB S с 6М мочевиной, соответственно; 5 -супернатант после обработки фракции 3 солянокислым гуанидином (7.5М) в буфере PBS.
Б. Хроматография IFNa-2b на широкопористом обращено-фазовом носителе Полисил ОДС-300 (колонка 2.3x40 мм). Элюцию белков проводили градиентом смеси ацетонитрила, изопропанола и воды (3:1:1) в 50% муравьиной кислоте. Электрофоретический анализ белковых фракций, соответствующих пикам I и II представлен на дорожках I и П.
Проведенный химический и биологический анализ структуры и свойств
продукта экспрессииа синтетическогоа генаа ifna-2bа свидетельствуета оа его
соответствииа природномуа аналогу,аа аа высокийа уровеньа синтезаа целевого
рекомбинантного белка в разработанной экспрессионной системе позволяет
создать штамм-продуцент, пригодный для внедрения в производство.
5. Конструирование штамма E.colм - продуцента рекомбинантного интерферона человека
Плазмида pIF16,а прототипом которой является плазмида p280/2IFN,
содержит тандем генов ifna-2b под транскрипционным контролем тандема
промотороваа триптофановогоаа оперон (????2)5аа ноаа терминирующийаа кодон
первого гена ifna-2b и инициирующий кодон второго гена ifna-2b разнесены
19
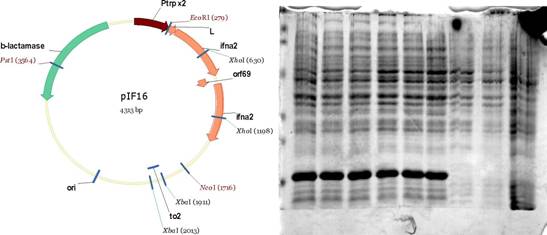
путем встройки синтетического цистрона orf69, как это представлено на рис. 7. На рис. 10А приведена физическая карта плазмиды pIF16.
Плазмидой pIF16 трансформировали компетентные клетки E.coli SG20050 и суммарные лизаты клеток анализировали электрофорезом в 12% SDS-ПААГ (рис. 10Б). Содержание целевого белка в 1мл (10 кл/мл) культуры E.coli SG20050/nW\6, определенное методом РИА, составляет 250-300 мкг, и не менее 2-5 10 ME, определенное по подавлению цитопатического действия вируса энцефаломиокардита мышей на культуру клеток легкого эмбриона человека Л-68. Штамм E.coli SG20050/pIF16 депонирован в ВКПМ, коллекционный номер В-5809.
На основе этого штамма-продуцента в ФБУН ГН - ВБ Вектор разработан способ получения субстанции интерферона альфа-2Ь (патент РФ №2123010, 1998), а ЗАО Вектор-Медика выпускает несколько видов лекарственных форм (Реаферон-ЕС, Реаферон-ЕС Липинт, Инфагель, Лайфферон).
M <- pIF16 J><-p2S0/2WJ><--E.coliSG20050J>
А. Б.
Рис.10 А. Физическая карта плазмиды pIF16. Б. Фракционирование в 12% SDS-ПААГ суммарных лизатов клеток E.coli SG20050/pIF16, E.coli SG20050/p280/2ПFl<\ и E.coli SG20050 в 12% SDS-ПААГ. M - Prestained SDS-PAGE Standards (Low Range, BioRad, США).
Универсальностьа предложенного способаа конструирования
экспрессионных плазмид проверялась путем экспрессии в составе
20
искусственных бицистронных оперонов синтетического гена gm-csf человека и полусинтетического гена tnf мыши.
6.а Экспрессиягенагранулоцитарно-макрофагалъного
колониестимулирующего фактора человека в клетках E.coli
Синтетический ген gm-csf человека клонировали по ВатН-сайту плазмиды pDS280, получая плазмиду p280GM, в которой ген GM-CSF находится в составе бицистронного оперона под контролем тандема промоторов триптофанового оперона E.coli. Физическая карта плазмиды p280GM представлена на рис. 11 А.
Рекомбинантной ДНК p280GM трансформировали клетки E.coli SG20050 и АргТсг-трансформанты использовали для анализа уровня экспрессии синтетического гена. Результаты электрофоретического фракционирования суммарных лизатов клеток в 12% SDS-ПААГ представлены на рис. 11Б. По данным денситометрии плазмида p280GM детерминирует синтез целевого продукта, составляющий не менее 15% от суммарного белка клетки.
1а 2а Mа 2а 1
|
|
ЬФ
A.аа Б.аа В.
Рис. 11 А. Физическая карта плазмиды p280GM. Б. Фракционирование в 12% ПААГ лизатов клеток E.coli SG20050/p280GM (1) и E.coli SG20050 (2). M - маркеры молекулярных масс белков: укороченный hLTa (144 а.о., 16.2 кДа) и лизоцим (14.3 кДа).
B.аа Вестерн-блот анализ с поликлональными антителами к GM-CSF человека (Sigma,
США).
На рис.а 11В приведены результаты вестерн-блот анализа с поликлональнымиа антителами к GM-CSFа человека.а Единственный
полипептид,аа реагирующийаа саа антителами,а -а полипептидаа саа молекулярной массой около 16 кДа.
Штамм E.coli SG20050/p280GM депонирован во ВКПМ как штамм-продуцент GM-CSF человека под коллекционным номером В-6613. Используя описанную процедуру выделения рекомбинантного iGM-CSF (Belew M. et al., 1994) из бактериальных клеток, включающую получение "телец включения", солюбилизацию, ренатурацию и хроматографические процедуры (гельфильтрацию, адсорбционную и ионообменную хроматографии), получены образцы субстанции GM-CSF человека (рис. 12). Выход рекомбинантного белка при таком способе выделения составляет около 2 мг из 2 г клеточной биомассы.
+аа ^............. ^ ^-Ч+-Ч^

А. Б.
Рис. 12. Фракционирование в 12% SDS-ПААГ препаратов рекомбинантного GM-CSF человека в присутствии (+) и отсутствии (-) 2-меркаптоэтанола (2-ME). А. Выделение 2005 г (10 мг/дорожка); Б. Выделение 1996г. (10, 5 и 1 мкг/дорожка).
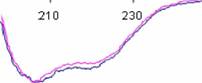
Конформационную идентичность этих препаратов с рекомбинантными h- и MuGM-CSF бактериального происхождения (рис. 13А) подтвердили путем измерения спектров кругового дихроизма (КД-спектров) на спектрополяриметре JASCO J-600. Результаты анализа представлены на рис. 13Б.
22
1,5
|
 0,5
0,5
0.5
Oаа V |
1Н
- -L-
jjf
250 |
ЪЙ----- E^----- II3----- ESi---- Й1]
270
2Э0
310
33
1,5
Рис. 13 А. КД-спектры препаратов hGM-CSF и MuGM-CSF (Wingfмeld P. et al., 1988).
Б. КД-спектры препаратов hGM-CSF-1996 (1) и hGM-CSF-2005 (2). Ось абсцисс - длина волны [?, нм]. Ось ординат - молекулярная эллиптичность [?, град см моль" ].
Полученные препараты сравнивали по их способности генерировать популяции дендритных клеток прилипающими мононуклеарными клетками венозной крови человека. Результаты представлены в табл. 3.
Таблица 3 Фенотипические маркеры ДК, генерированных в присутствии различных препаратов
GM-CSF (40 нг/мл)
Доноры |
Препараты ГМ-КСФ |
% CD14+ клеток |
% CD 83+ клеток |
1 |
hGM-CSF-1996 |
48 |
13 |
hGM-CSF-2005 |
41 |
58 |
|
hGM-CSF (Sigma) |
35 |
18 |
|
2 |
hGM-CSF-1996 |
31 |
22 |
hGM-CSF -2005 |
20 |
4 |
|
hGM-CSF (Sigma) |
43 |
30 |
|
3 |
hGM-CSF-1996 |
29 |
52 |
hGM-CSF-2005 |
40 |
46 |
|
hGM-CSF (Sigma) |
28 |
46 |
Можно видеть, что клеточные ответы на препараты рекомбинантного hGM-CSF сопоставимы. По данным работы Leplina О.Y. et al. (1997), 80-90% прилипаюших к пластику моноцитов имеют фенотип CD14 CD83". Добавлениеаа ка моноцитамаа какаа коммерческого,аа така иаа экспериментальных
23
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА