Реферат по химии на тему "Вода"
| Вид материала | Реферат |
- Реферат на тему: «Вода. Структура и необычные свойства», 638.3kb.
- Исследовательская работа по химии на тему: «Чистая вода. Какая она?», 219.61kb.
- Реферат По дисциплине: «Инженерные сети» на тему: водоснабжение, 311.35kb.
- Тематика творческих работ слушателей криппо по: химии формирование здорового образа, 1160.03kb.
- Ю. В. Ходаков сборник задач и упражнений по химии для средней школы учебное пособие, 2321.54kb.
- Отчёт о выполнении плана мероприятий по проведению Международного дня водных ресурсов, 73.27kb.
- Реферат ученика 8 «Б» класса Иванова Николая на тему: Некоторые сведения о воде, 212.53kb.
- Реферат по физике т е м а: тепловые свойства воды, 113.04kb.
- Реферат по химии на тему: «Неметаллы», 140.25kb.
- Реферат по химии на тему: «Явления изомерии в органической и неорганической химии., 369.26kb.
Реферат по химии на тему "Вода" |  |
 |
Вода.^Общая характеристика.
Нахождение в природе.Вода - самое распространенное на земле вещество. Поверхность нашей планеты на 71 % покрыта водой. Но эти огромные ресурсы не пригодны для питья: 97 % всех вод Земли засолены; лишь 1 % - пресная вода; 2 % - это ледники.
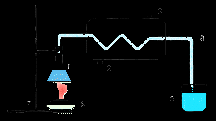
Вода - самый необходимый источник жизни для всего живого. Вода содержится в животных и растениях. Человек на 70 % состоит из воды ( а огурец аж на 97 % ). ^ Способы очистки.1) Получение дистиллированной воды.Чтобы очистить воду, от растворенных в ней веществ, применяют перегонку или дистилляцию.
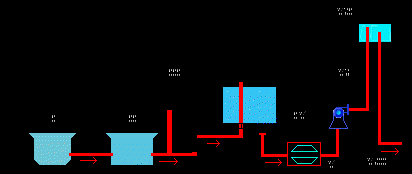
Сначала воду испаряют, при этом растворенные вещества оседают на стенках; затем пар конденсируют на холодном предмете. Дистиллированная вода не содержит растворенных веществ и потому широко применяется в науке и медицине. Большие количества дистиллированной воды получают в перегонных кубах. ^ 2) Очистка воды от взвешенных в ней веществ и микроорганизмов.Схема водоочистительной станции.
Природная вода всегда содержит примеси. В зависимости от целей ее использования применяют различные способы очистки. Если нужна чистая вода, без растворенных веществ и взвесей, применяют дистилляцию. Для питья можно использовать фильтрованную и хлорированную воду. Ее сначала отстаивают в специальных бассейнах ( для того, чтобы осели взвешенные вещества ), а затем фильтруют через слой песка. Очищенную от нерастворенных веществ, воду обрабатывают хлором или озоном, иногда ультрафиолетовыми лучами, чтобы убить вредные микробы. ^ Физические свойства.Вода-самое распространенное на Земле вещество, но многие загадки воды до сих пор не разгаданы. Нам известно, что чистая ( дистиллированная ) вода-безцветная, безвкусная жидкость. Не пахнет, не проводит электроток. Имеет очень большую удельную теплоемкость (4200 Дж/кгoC), а потому используется в системах охлаждения и т.п. Плавится и кристаллизуется при 0oC), кипит при 100oC (кстати, Цельсий изобрел свою шкалу, основываясь на физических свойствах воды ! Он принял промежуток между температурами плавления и кипения воды = 100. Потом он разделил этот промежуток на 100 частей и принял каждую часть равной 1oC). Максимальная плотность воды равна 1000 кг/м3(1 г/см3) (при 4oC, а не при 0oC - это одна из странностей поведения воды. Лед имеет меньшую плотность, чем незамерзшая вода, и поэтому он не опускается на дно реки, а лежит на поверхности. Вот несколько свойств воды, которые были открыты в последнее время. В жаркий летний день по озеру снуют водомерки. Они каким-то чудом удерживаются на поверхности, не проваливаясь вглубь. Здесь все дело в поверхности натяжения. Молекулы воды интенсивно притягиваются друг к другу и создают на поверхности воды как-бы пленку. Лапки водомерки имеют большую площадь и поэтому удерживаются на поверхности, т.е. на этой пленке. Чай тоже можно налить выше краев стакана, благодаря тому же поверхностному натяжению. Чем чище вода ( т.е. чем меньше инородных молекул вклинено между молекулами воды ), тем прочнее эта пленка. В лабораториях удалось получить столбик чистой воды диаметром 2,5 см. Для разрыва этого столбика потребовалось 900 кг. И это еще не предел очистки воды: ученые подсчитали, что если очистить воду полностью, то тогда столбик воды такого же диаметра выдержит 95 тонн. По поверхности абсолютно чистого озера можно было бы ходить, кататься на коньках ! Еще один феномен тщательно прорабатывался 40 лет назад. Речь идет о двигателях на ... горячей воде. Если в прочном, герметически закрытом сосуде нагревать определенные количества воды до температуры 374oC, то вода так и не превратится в пар. Почти в 3 раза уменьшится плотность; давление повысится до 225 атмосфер, но ... Это теперь, по существу, не вода, а взрывчатое вещество, 1 кг которого по силе равен 50 гр тола. Вот если к такому сосуду присоединить сопло реактивного двигателя, то вода мгновенно вскипит, а из сопла вырвется струя пара со скоростью 1300-1500 м/с. Каждый килограмм пара в течение секунды создаст тягу в 130-150 кг. Двигатели на воде являются экологически чистыми, но подогревать ( теплоемкость 4200Дж/кгoC ) очень хлопотно. Феноменом является наличие памяти у воды. Если воду подвергать воздействию малых магнитных полей, то в паровых котлах, чайниках снижается количество накипей, люди чувствуют себя гораздо лучше, растения развиваются быстрее ... Эффект сохраняется около 6 часов. В лабораториях исследуют это свойство воды. При воздействии на воду магнитного поля начинают изменятся электропроводность, прозрачность, вязкость. Вода реагирует на магнитные бури и солнечные вспышки. Есть гипотезы о спиновой памяти воды (атомы в воде, как маленькие тумблеры, запоминают свое направление вращения, то есть атомы при изменениях внешнего поля меняют направление вращения ). Вообще вода - очень таинственная жидкость. ^ Химические свойства.Вода вступает в реакцию с очень многими веществами. Примеры некоторых реакций воды с различными веществами: 1. Вода вступает в реакцию с простыми веществами а) с активными ( с щелочными ( I период таблицы Менделеева ) и щелочно-земельными ( II период таблицы Менделеева ). При этом образуется щелочь и водород. Реакция замещения: 2 Li + 2 HOH = 2 LiOH + H2 ( литий + вода -> гидроксид лития + водород ) б) с некоторыми металлами. При этом продукты реакции различны. Реакция замещения: С + H2O = H2 + CO ( углерод + вода -> водород + оксид углерода (II) ) 2. Вода вступает в реакцию со сложными веществами. а) с оксидами щелочных и щелочно-земельных металлов. При этом получаются щелочи. Реакция соединения: CaO + HOH = Ca(OH)2 ( оксид кальция + вода -> гидроксид кальция ) б) с оксидами почти всех металлов, с образованием кислот. Реакция соединения: SO3 + H2O = H2SO4 ( оксид серы (VI) + вода -> серная кислота ) 3. Вода под действием тока разлагается на водород и кислород. На этом основан анализ воды - метод определения состава вещества путем его разложения. Реакция разложения: 2 H2O = 2 H2 + 2 O2 ( вода -> водород + кислород ) ^ Применение водыРоль воды в нынешней науке и технике очень велика. Вот только часть областей применения воды. 1. В сельском хозяйстве для полива растений и питания животных. 2. В химической промышленности для получения кислот, оснований, органических веществ. 3. В технике для охлаждения, в паровых двигателях. 4. В металлургии для выплавки металлов. 5. В медицине для приготовления лекарств. В термоядерных реакторах для задержки нейтронов применяется тяжелая или сверхтяжелая вода (D2O, T2O соответственно; D - дейтерий, Т - тритий; это изотопы водорода). Бурное развитие всех отраслей промышленности может повлечь за собой недостаток пресной воды. Чтобы изготовить 1 кг бумаги, требуется 100 л воды; чтобы вырастить корову требуется 100 л в сутки. Расход воды на одного городского жителя - около 40 литров в сутки. Экономисты посчитали, что все фабрики и заводы России " выпивают " за минуту целую реку Волгу. И это неудивительно. На производство одной тонны металла идет 500 тонн воды, на производство одной тонны капрона в 7-8 раз больше. Чтобы избежать " водяного голода ", ученые предлагают опреснять воды Мирового океана. И сейчас по всей Земле строят дистилляционные установки для получения пресной воды. Есть и другие способы опреснения воды: замораживание; воздействие электротока; полупроницаемые мембраны, поры которых пропускают лишь мелкие молекулы воды, а молекулы солей задерживают; и т.д. |