«Синтез и свойства ортофосфорной кислоты» Физические свойства
| Вид материала | Документы |
СодержаниеХимические свойства. Органические фосфаты. Получение ортофосфорной кислоты. |
- Гоу впо «чгпу им. И. Я. Яковлева» Михайлова, 91.51kb.
- Тема урока: Сера, ее физические и химические свойства, 107.64kb.
- Алюминий, его физические и химические свойства, 54.07kb.
- Тема: «циклопарафины: строение, свойства, применение», 55.94kb.
- Лесничая марина Владимировна синтез и свойства ag(0)-, Au(0)-содержащих нанокомпозитов, 308.79kb.
- Николаева Мария Андреевна, доктор технических наук, профессор, заведующий кафедрой, 367.89kb.
- Задачи: а Обучающие: Рассмотреть положение элементов-неметаллов в Периодической системе, 208.56kb.
- Схема-конспект №6 ч. 1 Заготовка к схеме-конспекту №6 ч. 2 для учащихся на бумажном, 114.13kb.
- Урок химии в 9 классе. Тема: «Оксиды азота», 68.76kb.
- Тема урока: Алюминий, его физические и химические свойства, 110.49kb.
«Синтез и свойства ортофосфорной кислоты»
Физические свойства
О
















1,57 Å
1,57 Å
1,0 Å
1,0 Å
1,52 Å



 ртофосфорная кислота - бесцветные кристаллы, быстро расплывающиеся на воздухе, температура плавления + 42,5 С. Структура молекулы H3PO4 с учётом водородных связей представлена на рис. 1.
ртофосфорная кислота - бесцветные кристаллы, быстро расплывающиеся на воздухе, температура плавления + 42,5 С. Структура молекулы H3PO4 с учётом водородных связей представлена на рис. 1. 
-атомы фосфора

-атомы кислорода
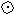
-атомы водорода
1,58 Å
Рис. 1.
Фосфорная кислота образует гидрат H3PO4*0,5H2O , плавящийся при +29,32С.
На рис. 2 представлена фазовая диаграмма H3PO4*0,5H2O и H3PO4 .
Температура, К°
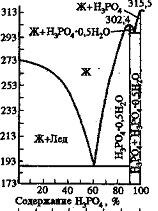
Рис. 2.
Другие физические свойства ортофосфорной кислоты представлены в таблице:
| Свойство | tпл., °С | Плотность, г/см3 | H0обр, кДж/моль |
| Значение | 42,5 | 1,88 | -1283 |
Фосфолеум (жидкий фосфорный ангидрид, суперфосфорная кислота) – это продукт, образующийся при взаимодействии избытка Р4О10 и фосфорной кислоты. Он включает в себя кислоты, содержащие от 72,4 % до 88,6% Р4О10 и представляет собой равновесную систему состоящую из орто -, пиро-, триполи-, тетраполи- и других фосфорных кислот. При разбавлении фосфолеума водой выделяется значительное количество тепла, и полифосфорные кислоты переходят в ортофосфорную.
^ Химические свойства.
Ортофосфорная кислота - сильная по I-ой ступени, средней силы по II-ой и очень слабая по III-ей (K1=0,752*10-2, К11=7,99*10-8, К111=4,8*10-13). Она взаимодействует с некоторыми металлами, их оксидами и гидроксидами:
2H3PO4+Mg=Mg(H2PO4)2+H2
2H3PO4+3CaO=Ca3(PO4)2+3H2O
H3PO4+3NaOH=Na3PO4+3H2O
Фосфорная кислота образует три типа солей - средние, одно- и двухзамещённые, например, Ca3(PO4)2 – средняя, CaHPO4 – двухзамещённая, Ca(H2PO4)2 – однозамещённая.
Большинство средних фосфатов мало растворимо в воде: растворимы фосфаты щелочных металлов, кроме лития, а также ортофосфат аммония. Соли типа MIIHPO4, где М= Be, Mg, Ca, Sr, Ba, Mn, Zn, Cd, Sn, Pb, Fe, Co, Ni, Cu и другие растворимы в воде значительно лучше средних фосфатов этих металлов (некоторые из этих солей известны только в виде кристаллогидратов). Соли типа MIII(H2PO4)2 с теми же катионами растворимы ещё лучше: среди них практически нет нерастворимых.
Другие отличительные черты ортофосфорной кислоты - её нелетучесть и низкая окислительная способность. Именно поэтому с помощью H3PO4 можно получать бромо- и йодоводород:
H3PO4+3KI=K3PO4+3HI
H3PO4+3KBr=K3PO4+3HBr,
и некоторые другие летучие кислоты, например, HNO3, HCl, HF.
При нагревании выше 150оС ортофосфорная кислота переходит в пирофосфорную, при нагревании до 300 С в вакууме в метафосфорную:
2H3PO4=H4P2O7+H2O
H3PO4=HPO3+H2Oю
Реакция ортофосфорной кислоты с оксидами молибдена и вольфрама приводит к образованию сложных гетерополикислот:
H3PO4+12WO3=H3[PW12O40] .
Подобные реакции используются в аналитической химии для обнаружения фосфора, молибдена и вольфрама.
При анодном окислении фосфорной кислоты может быть получена пероксофосфорная кислота H3PO3(O22-):
H3PO4+H2O= H3PO3(O22-)+H2
Эта кислота, подобно пероксосерной кислоте [кислоте Каро, H2SO3(O22-)] постепенно разлагается на пероксопирофосфорную H4P2O6(O22-):
2H2SO3(O22-)=H2S2O6(O22-)+H2O+O2 - Разложение пероксосерной кислоты
3H3PO3(O22-)=H4P2O6(O22-) +H2O+O2 +H3PO4 - Разложение пероксофосфорной кислоты.
H4P2O6(O22-) – очень сильный окислитель, по окислительной способности близкий к пероксодисерной кислоте.
Фосфорная кислота может давать соли не только с металлами, но и с некоторыми неметаллами - бором, йодом:
B2O3+2H3PO4==2BPO4+3H2O,
HIO2+H3PO4(IO+)H2PO4+H2O.
Однако и сама фосфорная кислота под действием других очень сильных кислот может стать основанием:
H3PO4+HClO4P(OH)4++ClO4-
H3PO4+H2SO4P(OH)4++HSO4-.
^ Органические фосфаты.
Фосфорная кислота способна образовывать сложные эфиры со спиртами, к примеру, моноэтилфосфат C2H5OP(O)(OH)2:
H3PO4+C2H5OH= C2H5OP(O)(OH)2+H2O
Но такой метод синтеза фосфатов не очень удобен из-за необходимости в высоких температурах и низком давлении. Поэтому тот же моноэтилфосфат проще получать по реакции:
2H2O+POCl3+C2H5OH= C2H5OP(O)(OH)2 +3HCl (промышленный метод).
Вместо спирта может использоваться фенол, вместо оксида-трихлорида фосфора-фосфорный ангидрид.
Такие эфиры, как трифенилфосфат получают добавлением POCl3 к феноляту натрия, растворённому в углеводороде, или простым кипячением фенола с POCl3.
_ ОNa


3 + POCl3 (PhO)3PO + 3NaCl
Многие органические фосфаты имеют важнейшее биологическое значение – аденозинтрифосфат (АТФ), фосфоенолпируват-карбоксилаза (ФЕП) и другие.
^ Получение ортофосфорной кислоты.
В промышленности фосфорную кислоту получают двумя способами: термическим и экстракционным.
Термический способ получения фосфорной кислоты даёт наиболее чистую кислоту. Он заключается в следующем:
- Сжигание (окисление) элементарного фосфора в избытке воздуха.
P4+5O2=P4O10 .
- Гидратация и абсорбция Р4О10 .
- Конденсация фосфорной кислоты.
- Улавливание тумана из газовой фазы.
Существует два способа окисления фосфора: окисление паров (в промышленности используется крайне редко) и окисление жидкого фосфора в виде капель или пленки. Вторую стадию получения термической фосфорной кислоты – гидратацию Р4О10 –осуществляют абсорбцией кислотой (или водой), либо взаимодействием паров Р4О10 с парами воды.
Р4О10 + 6H2O=4H3PO4.
Гидратация происходит через стадию образования полифосфорных кислот xH2O*yP4O10 . Состав и концентрация кислоты зависят от температуры и парциального давления паров воды.
Все стадии термического метода могут быть совмещены в одном аппарате, кроме улавливания тумана фосфорной кислоты. Этот процесс всегда проводят в отдельном аппарате.
В зависимости от принципа охлаждения паров существует три способа производства термической фосфорной кислоты: испарительный, циркуляционно-испарительный и теплообменно-испарительный. Промышленный аппарат для производства циркуляционно-испарительным методом термической фосфорной кислоты приведён на рис. 3:
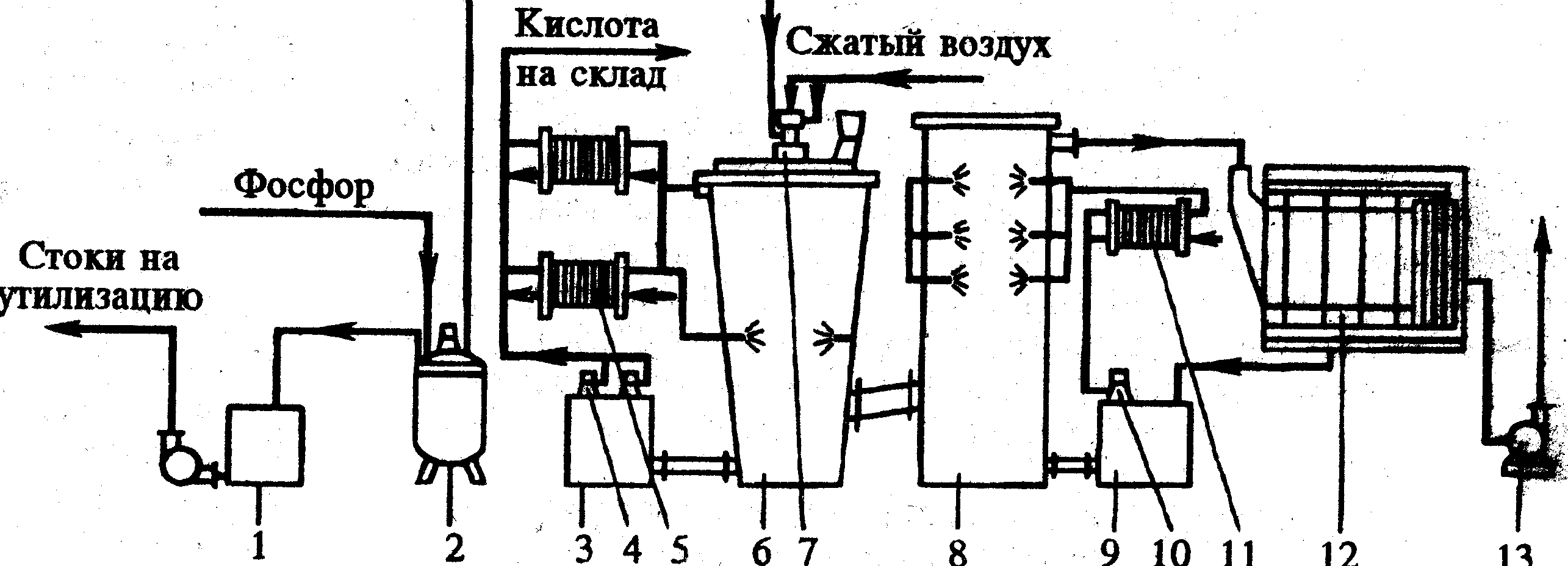 | 1-сборник кислой воды 2-хранилище фосфора 3,9- циркуляционные насосы 4,10 – погружные насосы 5,11- пластинчатые теплообменники 6-башня сжигания 7-фосфорная форсунка 8-башня гидратации 12-электрофильтр 13-вентилятор. |
Рис.3.
Экстракционный способ получения фосфорной кислоты более экономичен. Он основан на разложении природных фосфатов кислотами - серной, изредка соляной или азотной:
Ca3(PO4)2+3H2SO4+mH2O = 3CaSO4* mH2O+ 2H3PO4 ,
Ca5(PO4)3F+5H2SO4 +nH3PO4+mH2O==(n+3)H3PO4+5CaSO4* mH2O+HF.
В лаборатории фосфорную кислоту получают окислением красного фосфора концентрированной азотной кислотой по уравнению:
P+5HNO3=H3PO4+5NO2+H2O.
Библиографический список
- Ван Везер. Фосфор и его соединения. М: Иностранная литература, 1962. – 684 с.
- .Химическая энциклопедия. – М.: Большая российская энциклопедия, 1998. Т.5. С. 124-162.
- Лидин Р.С., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ. М.: Химия, 2000. – 480 с.
www.chemist.by.ru
