План лекции Острое воспаление. Определение. Общая схема острого воспаления Основные функции медиаторов острого воспаления
| Вид материала | Лекции |
СодержаниеПротuвовоспалuтельным действuем Протuвовоспалительные цитокины Кинины. Резкое падение артериального давления, коллапс. Фактор некроза опухолей альфа. |
- Методические рекомендации для студентов к практическим занятиям по патологической анатомии, 223.24kb.
- Тематический план практических занятий по патологической анатомии для студентов, 179.36kb.
- Методическая разработка по хирургии для студентов IV курса медицинского факультета, 49.72kb.
- Международная научная конференция «Фундаментальные и прикладные аспекты воспаления», 27.32kb.
- Молекулярные механизмы воспаления, 1115.65kb.
- Цитокины и медиаторы: от местного воспаления к генерализованному процессу, 271.75kb.
- Пролиферативное воспаление, 38.56kb.
- Воспаление среднего уха (отит), 15.59kb.
- Общая схема исследования функции и построения её графика, 23.15kb.
- План лекции: > Классификация ибс. Понятие острого коронарного синдрома (окс). Диагностические, 41.64kb.
Общая патофизиология.
Лекция для студентов 3-го курса медицинского факультета. Специальности:»лечебное дело», «стоматология»
Воспаление
(этиология и патогенез отдельных видов воспалительного процесса)
- План лекции
1. Острое воспаление. Определение. Общая схема острого воспаления
- Основные функции медиаторов острого воспаления
- Цитокины. Функции цитокинов в очаге острого воспаления. Механизмы блокады воспалительного очага
- Этиология и патогенез генерализованного воспаления. Патологическое действие медиаторов и цитокинов воспаления при генерализации воспалительного процесса
- Синдромы полиорганной недостаточности и гиперметаболизма. Септический шок
- Этиология и патогенез хронического воспаления. Гранулематозное воспаление
2. Определение понятия «Воспаление»
Воспаление - это сформировавшаяся в процессе эволюции защитно-приспособительная реакция организма, направленная на локализацию, уничтожение и/или удаление из организма патогенного агента и характеризующаяся явлениями альтерации, экссудации и пролиферации.
Следует обратить внимание на три составляющие части этого определения.
Во-первых, воспаление как реакция сформировалась в процессе эволюции. У низших организмов прообразом воспаления является внутриклеточное пищеварение. Когда организмы усложнились, способность к внутриклеточному пищеварению осталась лишь у отдельных клеток, а факторы, сопутствующие внутриклеточному пищеварению, стали участвовать в реакции клетки, органа, ткани на любой чужеродный агент независимо от того, будет он подвергаться внутриклеточному перевариванию или нет. В ходе эволюции процесс, когда-то обеспечивавший питание низкоорганизованных существ, превратился в реакцию организма на чужеродный агент.
Во-вторых, воспаление исполняет защитно-приспособительную роль и направлено на локализацию, уничтожение и/или удаление из организма вредоносного фактора. Однако поскольку воспаление сопровождается повреждением тканей, эта защитная реакция имеет и патологический характер. Поэтому чрезвычайно важно знать механизмы воспаления, с тем, чтобы на определенном этапе его развития поддерживать эту реакцию, а на других этапах бороться с ней, если она грозит обширным и глубоким повреждением тканей и органов.
В-третьих, для воспаления характерно сосуществование трех проявлений: альтерации (повреждение тканей), экссудации (накопление в тканях жидкости) и пролиферации (разрастание клеточных и тканевых элементов). Воспаление - это единственная реакция организма, в которой всегда присутствуют эти три компонента вместе.
В зависимости от того, какой компонент преобладает в воспалительной реакции, воспаление подразделяют на альтеративное (главное проявление - повреждение ткани), экссудативное (в воспалительном очаге имеется выраженный выпот) и пролиферативное (на первый план выступают процессы размножения клеток).
3. Соотношение компонентов острого воспаления
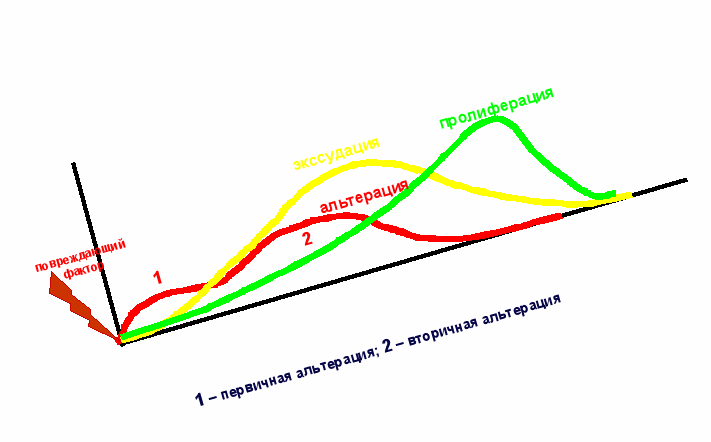
В приведенном выше определении воспаления было указано, что воспаление характеризуется явлениями альтерации, экссудации и пролиферации. Именно эти три стадии воспаления, накладывающиеся друг на друга и сменяющие одна другую, принято считать основными этапами развития острого воспалительного процесса. Следует учесть, что пусковым моментом для начала каждой из этих трех стадий является повреждение ткани экзогенным или эндогенным повреждающим фактором. Так, например, практически сразу после альтерации ткани на периферии воспалительного очага можно наблюдать явления пролиферации, а явления экссудации начинают проявляться в самом начале вторичной альтерации. Однако каждая из стадий достигает максимума развития в различное время и именно это обстоятельство позволяет говорить об определенной сменяемости стадий воспалительного процесса.
В дальнейшем, разбирая особенности патогенеза воспаления, мы будем соотносить и привязывать отдельные звенья патогенеза к основным стадиям воспаления, а именно – к альтерации, экссудации и пролиферации. Следует указать, что этому правилу следуют и большинство патологов и клиницистов при описании воспалительного процесса.
В стадии альтерации выделяют две взаимосвязанные фазы: фаза первичной альтерации и фаза вторичной альтерации. Первичная альтерация возникает в результате непосредственного действия на ткань повреждающего фактора. При этом часть клеток разрушается самим повреждающим фактором, а часть повреждается в большей или меньшей степени за счет развившейся непосредственно после повреждения локальной гипоксией, которая обусловлена ишемией ткани (активный нейрогенный спазм, как поврежденных сосудов, так и сосудов, находящихся в непосредственной близости от участка повреждения). Гипоксический некробиоз клеток, прежде всего, сказывается на состоянии их мембран: плазматической мембраны и внутриклеточных мембран. Повреждение плазматической мембраны приводит к нарушению разделения ионов между протоплазмой клеток и внеклеточной средой. В результате в клетках происходит накопление ионов Na+, а вслед за ними - и воды, и ионов Са++. Повышенная гидратация клеток способна в конечном итоге вызвать их осмотический взрыв, а повышенное поступление ионов Са++ в их протоплазму активирует мембранные фосфолипазы и запускает процесс образования продуцентов арахидоновой кислоты – значимых медиаторов воспаления. С другой стороны, повреждение внутриклеточных мембран может так же привести к необратимому повреждению клеток. Особенно опасно повреждение мембран лизосом и митохондрий. Гидролитические ферменты, содержащиеся в лизосомах, выходят в цитоплазму и вызывают разрушение веществ, входящих в состав
цитоплазмы и клеточных органелл. Клетки лизируются («самоперевариваются») и фермен-
ты лизосом (протеазы, липазы, гликозидазы, фосфатазы) выходят в межклеточную среду, нанося повреждение и другим близлежащим клеткам. Повреждение митохондрий резко на-
рушает энергообмен клеток, тормозится процесс окислительного фосфорилирования, снижается синтез АТФ. Энергетическое голодание клеток так же способно привести к их гибели. Кроме того, повреждение митохондрий нарушает утилизацию ими жирных кислот и,
при определенных условиях, стимулировать образование в митохондриях активных ки-
слородных радикалов – активных форм кислорода (АФК), повреждающее воздействие на клетки которых хорошо известно.
Гипоксия и, следующий за нею, гипоксический некробиоз клеток повреждают не только такие клеточные органеллы как лизосомы и митохондрии. Разрушается цитоскелет клеток, гладкий и шероховатый эндоплазматический ретикулум, другие клеточные органеллы.
Подведем некоторые итоги. Первичная альтерация – это повреждение и гибель клеток в результате непосредственного воздействия на ткань любого повреждающего фактора. В результате этого процесса в межклеточную среду выходят или образуются в ней многочисленные биологически активные вещества, способные сами по себе, уже в условиях прекращения действия повреждающего фактора, продолжать разрушать клетки и другие межклеточные структуры. Иначе говоря, вслед за первичной альтерацией начинает развиваться вторая фаза альтерации – вторичная альтерация.
Большинство биологически активных веществ как разрушающих клетки и межклеточные структуры, так и участвующих в регуляции воспалительного процесса в целом, выделяются, активируются и начинают осуществлять свое действие именно во время развития вторичной альтерации. Эти биологически активные вещества получили название медиаторов воспаления.
4. Функции медиаторов острого воспаления
4.1. Функции клеточных медиаторов
| Медиатор/Функция | Вазоди- латация | Про- ница- емость | Хемо- таксис | Опсо- низа- ция | Боль |
| Гистамин | + | + | _ | _ | + |
| Серотонин | + | + | _ | _ | _ |
| Эйкозаноиды (производные арахидоновой кислоты) | + | + | + | _ | _ |
| Лизосомные ферменты | _ | + | _ | _ | _ |
| | | | | | |
| | | | | | |
4.2. Функции плазменных медиаторов
| Медиатор/Функция | Вазоди- лата- ция | Про- ница- емлсть | Хемо- таксис | Опсони- зация | Боль |
| Кинины плазмы (брадикинин) | + | + | _ | _ | + |
| Фракции комплемента (3b, 5a) | _ | + | + | + | _ |
Существует достаточно много классификаций медиаторов воспаления. В качестве примера приведем следующие классификации медиаторов: по их химическому строению, по скорости включения в процесс воспаления, по принципу действия – прямому или опосредованному (в первом случае медиатор участвует в регуляции воспалительного процесса как непосредственно действующее вещество, во втором – является источником высвобождения или образования некоего другого медиатора). Однако наиболее традиционной и часто применимой патологами и клиницистами является разделение медиаторов на две группы: медиаторы клеточные и медиаторы гуморальные (или плазменные).
Медиаторы, относящиеся к первой группе, появляются в очаге воспаления или при разрушении соответствующих клеток, или секретируются (выделяются) ими в результате воздействия на них повреждающего фактора или определенных биологически активных веществ. Медиаторы второй группы образуются в плазме крови (поэтому они и называются «плазменными») в ходе некоторых биохимических процессов, которые инициируются рядом факторов воспаления.
Характерной чертой всех клеточных медиаторов является то, что они образуются практически сразу же после воздействия на ткань повреждающих факторов воспаления и действуют локально, то есть непосредственно в зоне контакта повреждающего фактора с тканью.
Образование гуморальных (плазменных) медиаторов происходит через определенный промежуток времени после воздействия повреждающего фактора (каждой биохимической реакции требуется время для ее завершения). Кроме того, гуморальные медиаторы, за счет их образования в плазме крови, обладают более системным действием, чем клеточные медиаторы. (Продолжение лекции смотри на следующей странице).
5. Цитокины и воспаление
5.1. Основные принципы цитокиновой регуляции в очаге воспаления
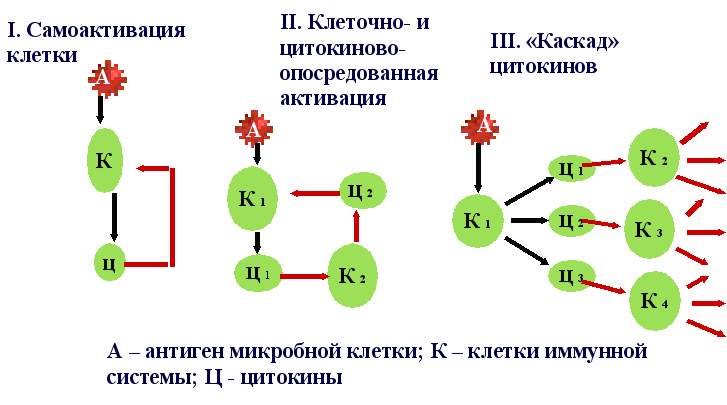 5.2. Классификация и свойства цитокинов
5.2. Классификация и свойства цитокиновПомимо указанных выше медиаторов воспаления, значительную роль в развитии и регуляции воспалительной реакции играют цитокины – низкомолекулярные 6елки (полипептиды или гликополипептиды с молекулярным весом 5-30 кДа), лишенные антигенной специфичности и являющиеся посредниками межклеточных взаимоотношений при воспалении, формировании иммунного ответа организма, гемопоэзе и ряде других межклеточных и межсистемных взаимодействий. Цитокины нельзя отнести и к клеточным медиаторам воспаления, и к гуморальным. Они занимают особую «нишу» в регуляции воспаления.
Несмотря на весьма значительные функциональные различия цитокинов, их о6ъединяют несколько важных признаков. Так, для цитокинов характерна функциональная взаимозаменяемость. Кроме того, при участии в регуляционных процессах цитокины способны к синергuзму uлu к антагонизму. Некоторые цитокины могут индуцировать синтез других цитокинов, активируя для этого соответствующие клетки иммунной системы. Все цитокины обладают коротким периодом действия.
Существует несколько классификаций цитокинов. Однако наиболее обоснованной нам видится следующая:
- Интерлейкuны (IL). В настоящее время описано 18 видов (от IL-1 до IL-18) интерлейкинов.
- Колонuестuмулuрующuе факторы (CSFs). Эти цитокины являются факторами роста гемопоэза (лимфопоэза, монопоэза, гранулопоэза).
- Интерфероны (IFNs). Интерфероны активируют естественные клетки-киллеры, инги6ируют репродукцию вирусов и могут участвовать в генерации ряда других цитокинов, активируя соответствующие клетки иммунной системы.
- Факторы некроза опухолей (TNFs). Из многочисленных функций этих цитокинов следует выделить их способность противостоять инфекционному началу и о6ладание противоопухолевой активностью.
- Хемокuны. Основной функцией многих цитокинов, входящих в эту группу, является стимуляция хемотаксиса практически всех клеток иммунной системы.
Как и каждая классификация, приведенное выше разделение цитокинов на некие функционально однородные группы - весьма условно. Так, интерлейкины 3, 7 и 11, помимо выполнения других функций, участвуют в гемопоэзе, а интерлейкины 8 и 16 о6еспечивают хемотаксис нейтрофилов, Т-лимфоцитов, 6азофилов и эозинофилов.
Оценивая роль цитокинов в воспалительном процессе, следует указать на одну важную особенность этих межклеточных посредников. В настоящее время можно выделить две группы цитокинов, одна из которых обладает провоспалuтельным действuем, а другая - протuвовоспалuтельным.
Провоспалuтельным действuем обладают интерлейкины 1, 6, 8, 12, 17, 18, гамма-интерферон, факторы некроза опухолей альфа и бета, фактор гемопоэза GM-CSF.
^ Протuвовоспалuтельным действuем обладают инги6итор интерлейкина 1 - IL-1ra, интерлейкин 10, трансформирующий фактор роста - бета (TGFb), интерфероны альфа, бета и дельта.
Провоспалительные эффекты цитокинов связаны с их возможностями активировать клетки иммунной системы, способствовать их дифференцировке, стимулировать выработку иммуноглобулинов, обеспечивать адгезию и хемотаксис фагоцитов. С другой стороны, чрезмерная активность провоспалительных цитокинов, недостаточное действие их инги6иторов и антагонистов может приводить к значительной деструкции тканей, росту альтерации. Не6лагоприятна роль провоспалительных цитокинов и при развитии хронического воспаления.
^ Протuвовоспалительные цитокины ограничивают развитие воспалительного процесса. Так, IL-1ra инги6ирует действие интерлейкина 1; интерлейкин 10 инактивирует макрофаги; TGF-b подавляет активность клеток - естественных киллеров, снижает пролиферацию В- и Т-лимфоцитов, инги6ирует макрофагальный киллинг внутриклеточных паразитов; интерфероны альфа, 6ета и дельта, в противоположность гамма-интерферону, обладают противовоспалительной активностью.
При не осложненном течении воспалительного процесса про- и противовоспалительные цитокины как 6ы уравновешивают друг друга, действуя на 6лаго организма. Смещение же этого 6аланса в лю6ую сторону может привести только к разрастанию патологии: мощной альтерации тканей или же к длительному, вяло текущему хроническому воспалению, зачастую осложняющемуся аутоиммунными процессами.
В заключение следует указать, что ряд цитокинов (интерлейкины 1 и 6, фактор некроза опухолей альфа, гамма-интерферон) являются эндогенными пирогенами, т.е. веществами, вызывающими лихорадочную реакцию, как правило, сопровождающую воспаление.
(Продолжение лекции смотри на следующей странице)
6. Общая схема патогенеза воспалительного процесса
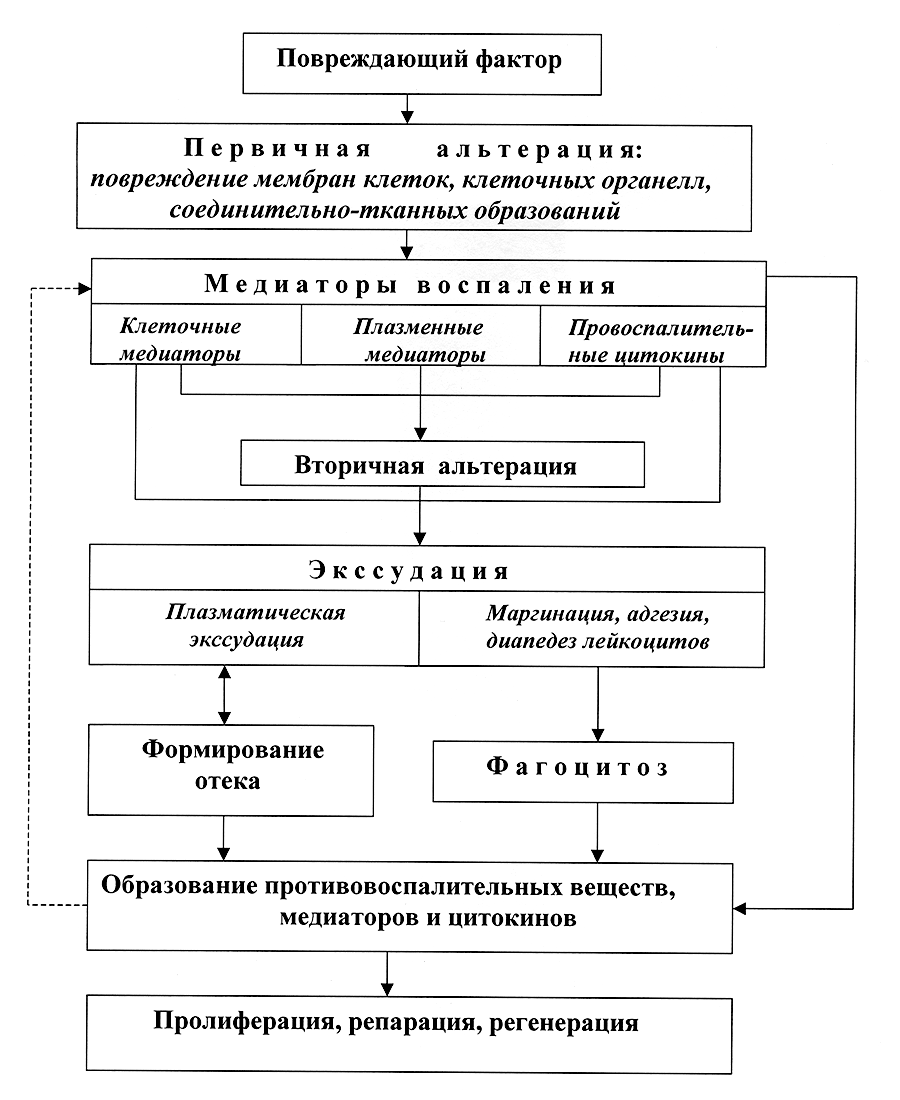
Схема демонстрирует в обобщенно-модульном виде этапность протекания острого воспаления от момента воздействия на ткань повреждающего фактора и до завершения процессов пролиферации, репарации и регенерации. В целом, схема не требует дополнительных комментариев. Необходимо, однако, напомнить, что стадии острого воспаления не просто сменяют одна другую, но накладываются друг на друга и могут достигать максимума развития почти одновременно (как это, например, происходит со стадиями вторичной альтерации и экссудации). В свою очередь стадия пролиферации начинает формироваться задолго до окончания стадии экссудации. На схеме активирующие влияния указаны сплошными стрелками, а тормозящие – стрелками пунктирными.
- Этиология и патогенез генерализованного воспаления
7.1. Общее представление о генерализованном воспалении
Генерализованное воспаление означает, что в воспалительный процесс вовлекается весь организм, все его среды и большинство органов и систем. Однако, организм реагирует и на местный воспалительный процесс, только эта реакция не является чрезмерной, а ее последствия относительно легко устранимы, без их перерастания в тяжелую системную патологию. Так, например, периферическое (местное) воспаление "ощущается" в костном мозге с первого часа возникновения процесса и в кровь поступает находящийся "в резерве" пул гранулоцитов. Однако, несмотря на общий характер этой реакции, сам воспалительный очаг развивается локально в том или ином органе, в той или иной ткани. Более того, ткани имеют определенную типовую ячейку на территории, которой развивается воспалительная реакция. Эта ячейка - гистион, то есть функционально - структурная единица ткани, включающая в себя клетки, волокнистые образования, основную субстанцию, нервные волокна и их окончания, микроциркуляторное русло и лимфатические пути. Все эти компоненты гистиона оказываются втянутыми в воспаление и повреждаются в его динамике. Но только – элементы гистиона, или нескольких гистионов.
Все меняется, если мы встречаемся с ситуацией, при которой в силу определенных причин (о них мы поговорим позднее) патогенная флора, медиаторы и цитокины воспаления в больших количествах вырываются за пределы воспалительного очага и системно распространяются по организму. Возникает генерализованный воспалительный процесс, бороться с которым значительно сложнее, чем с острым воспалением, имеющим локальный характер. Прежде чем мы перейдем к описанию патогенеза генерализованного воспаления, нам необходимо рассмотреть те факторы, которые препятствуют распространению воспалительного процесса на организм в целом.
7.2. Механизмы блокады воспалительного очага
При локальном остром воспалении патогенные микроорганизмы, продукты распада, образующиеся в очаге воспаления, не должны распространяться за пределы этого очага, так как в противном случае воспаление может принять генерализованный характер со всеми вытекающими отсюда последствиями. Нужно обязательно указать и еще на одно обстоятельство: многие медиаторы воспаления, выполняющие в очаге воспаления важную защитную, саногенетическую функцию, выйдя за его пределы, становятся вредоносными агентами, нанося очень серьезные, а иногда – и смертельные повреждения организму.
На «барьерную» функцию местного воспаления указывали многие патологи и клиницисты. Особенно подробно они описаны в работах известного русского патолога И.В.Давыдовского, который указывал на такие барьерные факторы воспаления как замедление венозного оттока, стаз, воспалительный отек, фибринообразование и тромбообразование, формирование лейкоцитарный вала, формирование гранулем, пиогенной мембраны при абсцессах, образование капсул вокруг очага хронического воспаления и ряд других аналогичных явлений.
От каких же повреждающих агентов защищается организм барьерной функцией воспаления?
Во-первых, это сами возбудители септического воспаления – патогенные микробы. Распространение их по организму может вызвать такое тяжелейшее патологическое состояние, как сепсис.
Во-вторых, это продукты распада поврежденных клеток и тканей. Большинство из весьма токсичны. Следует иметь в виду, что продукты распада клеток и тканей образуются не только при септическом, но и при асептическом воспалении, когда речь не идет о присутствии в очаге воспаления патогенных организмов, а сами поврежденные клетки и ткани образовались в результате другого патологического процесса, например, инфаркта органа.
В-третьих, это сами медиаторы воспаления и, в их числе, цитокины.
Рассмотрим, каким же влиянием на организм, его органы и системы обладают медиаторы воспаления и провоспалительные цитокины, в том случае если они прорывают барьер острого воспалительного очага.
7.3. Патогенное системное действие медиаторов и цитокинов
Определенные сведения о функциях цитокинов и медиаторов в очаге острого воспаления, благодаря которым осуществляется локализация и разрешение этого процесса, было уже описано выше. Однако ряд особенностей медиаторов и цитокинов, проявляющихся за пределами воспалительного очага, в случае их прорыва в системное кровообращение, позволяет говорить об их мощном патогенном воздействии на организм. Приведем лишь несколько примеров этого патогенного воздействия.
Гистамин. Угнетение деятельности синусного узла сердца, возможные провокации фибрилляции желудочков.
^ Кинины. Резкое падение артериального давления, коллапс.
Фактор некроза опухолей альфа. Активизация общего коагуляционного потенциала крови, усиление продукции эндотелиоцитами прокоагулянтных факторов, прямое токсическое действие на клетки сосудистых эндотелиоцитов, подавление липолитической активности крови, подавление усвоения глюкозы клетками и тканями, развитие лихорадки (включая ее гиперпиретическую форму).
Интерлейкин 1. Повышение прокоагулянтной активности эндотелия сосудов, повышение чувствительности клеток и тканей к действию фактора некроза опухолей альфа, подавление липолитической активности крови, развитие лихорадки (включая ее гиперпиретическую форму).
Интерлейкин 2. Уменьшение системного сосудистого сопротивления, снижение артериального давления, провокация проявлений сердечной недостаточности.
Интерлейкин 12. Стимуляция агрегации тромбоцитов, повышение тромбообразования, усиление отрицательных инотропных влияний на миокард, понижение артериального давления, ухудшение мозгового кровообращения.
Лейкотриены D4 и Е4. Ухудшение коронарного кровотока и сократимости миокарда.
Тромбоксан А2. Ускорение агрегации тромбоцитов, усиление тромбообразования, бронхоспазм и спазм сосудов мозга.
Простагландин I2. Снижение артериального давления за счет мощной вазодилатации.
Комплемент (фракция С5а). Уменьшение сосудистого сопротивления, падение артериального давления.
Если суммировать приведенные данные, то можно сказать, что системное действие основных медиаторов и цитокинов заключается в следующем:
- повышение тромбообразования;
- отрицательные инотропные влияния на сердце, провокации аритмий, вплоть до фибрилляции желудочков;
- снижение сосудистого сопротивления, падение артериального давления;
- нарушения мозгового кровообращения;
- отрицательное влияние на метаболизм глюкозы;
- снижение липолитических свойств крови.
Понятно, что при выходе в системное кровообращение указанных медиаторов и цитокинов в количествах, превышающих объемы их проникновения при развитии локального острого воспаления, могут быть спровоцированы серьезные патологические состояния, вплоть до развития ДВС-синдрома, тяжелой неспецифической стресс-реакции и шока. К сожалению, именно эти явления и наблюдаются при развитии генерализованного воспаления.
7.4. Этиология генерализованного воспаления
Обобщая этиологические факторы, приводящие к генерализованному воспалению или, как его часто называют клиницисты, «синдром системного воспалительного ответа - ССВО» (в английской аббревиатуре – SIRS –Sistemic Inflammatory Response Syndrome) можно указать, что в 10% случаев – это массивная механическая травма, мощная кровопотеря, а также тяжелые обширные ожоги. В 90% случаев ССВО – результат инфекционной атаки на организм, то есть то, что называется сепсисом.
Этиология определяет патогенез этих состояний. В первом случае организм просто не способен локализовать очаг воспаления из-за его обширности. Иначе говоря, с самого начала массивной альтерации воспаление приобретает характер генерализованного, а цитокины и медиаторы воспаления вследствие того, что они выделяются в огромных количествах, немедленно начинают оказывать свое общепатогенное действие.
В случае инфекционной атаки в обобщенном виде события могут развиваться в нескольких вариантах.
Во-первых, инфекцией может быть поражен организм с достаточно ослабленной по тем или иным причиной иммунной защитой. В этом случае прорыв инфекции из первичного очага обусловлен повреждением местных звеньев иммунной системы (ослабление микро- и микроцитоза, например, из-за недостаточного энергообеспечения процессов фагоцитоза, а также за счет развития апластических процессов в регионарных лимфатических узлах).
Во-вторых, инфекция может поразить представителя популяции, ранее не встречавшейся с этой инфекцией. Так стремительно, с септическим «пожаром» развивались некоторые инфекции (сифилис, туберкулез, корь) среди представителей индейских племен в Северной Америке и племен, населяющих тихоокеанские острова, где до открытия их европейцами эти инфекции не были известны.
В-третьих, - и это наиболее часто встречающаяся ситуация, сепсис развивается благодаря многократному поступлению в системный кровоток антигенных структур микроорганизмов, их экзо- и эндотоксинов. Естественно, что и в этом случае определенную «вину» так же несут механизмы местной иммунной защиты. (Продолжение лекции смотри на следующей странице).
7.5. Патогенез генерализованного воспаления
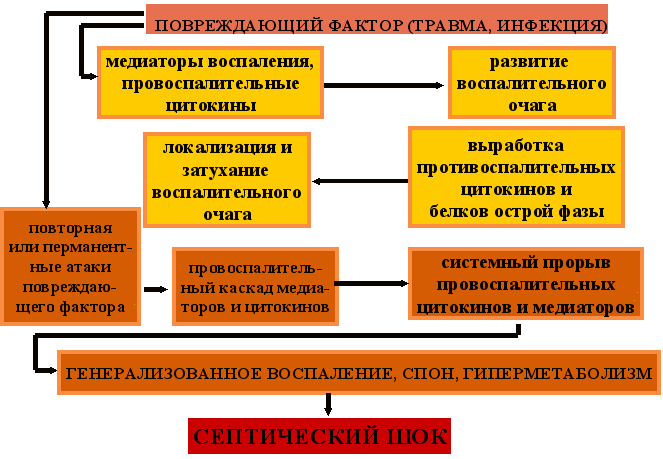



Остановимся подробнее на механизмах развития генерализованного воспаления (ССВО), когда его причиной является многократное (или постоянное) поступление в системный кровоток продуктов инфекционной атаки. При этом в развитии генерализованного воспаления можно выделить несколько стадий:
- В ответ на инфекцию происходит локальное выделение медиаторов и цитокинов. Воспаление пока еще протекает по принципу острого местного процесса. Местным иммунным системам определенное время удается держать воспалительный процесс под контролем.
- Если на этом этапе местной реакции не удается локализовать и уничтожить патогенный агент, выделение медиаторов и цитокинов нарастает, они, пока в малых количествах, проникают в системный кровоток. Развивается острофазовая реакция, острофазовые белки и противовоспалительные цитокины держат под контролем интенсивность воспалительного процесса. На некоторое время воспалительный и противовоспалительный процесс уравновешивают друг друга.
- Если и при этих условиях жизнедеятельность микроорганизмов в первичном очаге не подавлена, и продукты инфекционной атаки продолжают поступать в системный кровоток, выработка провоспалительных цитокинов превышает возможности противовоспалительных систем, начинается их деструктивное воздействие на органы и ткани организма, а очаги воспаления возникают в отдаленных от первичного локуса местах. Развивается процесс, который в клинике получил название «синдрома полиорганной недостаточности – ПОН». К сожалению, в значительном числе случаев ПОН может закончиться септическим шоком и гибелью организма.
7.6. Синдром полиорганной недостаточности (СПОН)
Термин «синдром полиорганной недостаточности - СПОН» прочно утвердился в медицинской литературе в начале 80-х годов, когда клиницисты вообще, и реаниматологи, в частности, убедительно показали, что выпадение функций трех или более органов и систем пациента, как правило, ассоциируется с крайне неблагоприятным исходом.
В большинстве случаев СПОН является исходом генерализованного воспаления (или ССВО) и представляет собой тяжелую неспецифическую стресс-реакцию организма в ответ на мощное экзогенное воздействие, сопровождающееся недостаточностью двух или более его функциональных систем с преобладанием симптомов той или иной органной дисфункции. Развитие СПОН носит характер стремительно развивающейся, обвальной патологии органов и систем организма, в основе которой, как правило, лежит серьезное расстройство микроциркуляции, развитие острого респираторного дистресс-синдрома, печеночной и почечной недостаточности, резкого нарушения функции сердечно-сосудистой системы.
7.7. Синдром гиперметаболизма («аутоканнибализма»)
Чрезвычайно важным патологическим фактором, значительно осложняющим течение СПОН, является развитие синдрома гиперметаболизма (аутоканнибализма) организма. По своей сути гиперметаболические изменения должны были бы нести защитный характер, привлекая на помощь организму последние запасы энергетических субстратов. Однако в случае развития СПОН гиперпотребности организма в различных субстратах для адаптации к повышенным затратам энергии сочетаются с толерантностью тканей к этим же субстратам. В результате организм впустую тратит последние запасы энергии. При развитии гиперметаболизма скорость обмена веществ по сравнению с основным обменом увеличивается в два и более раз, значительно возрастает потребность организма в кислороде, развивается отрицательный азотистый баланс и происходит накопление углекислого газа.
Значительно страдают все виды обменов.
Метаболизм глюкозы протекает в условиях возрастания толерантности клеток к глюкозе на фоне гиперпродукции ее гепатоцитами, резко увеличивается глюконеогенез, для обеспечения которого происходит мобилизация аминокислот из миоцитов и висцеральных клеток.
Метаболизм белков смещается в сторону распада белковых субстанций, используемых в целях глюконеогенеза. Развивается отрицательный азотистый баланс.
Активизируется и липолиз на фоне снижения липогенеза, утилизации жирных кислот тканями и уменьшения активности липопротеинлипазы.
Следствием развития синдрома гиперметаболизма является не только множественная органная дисфункция, но и белково-энергетическая недостаточность с последующей кахексией (если, конечно, последняя успевает развиться до гибели организма).
(Продолжение лекции смотри на следующей странице)
7.8. Патогенез септического шока
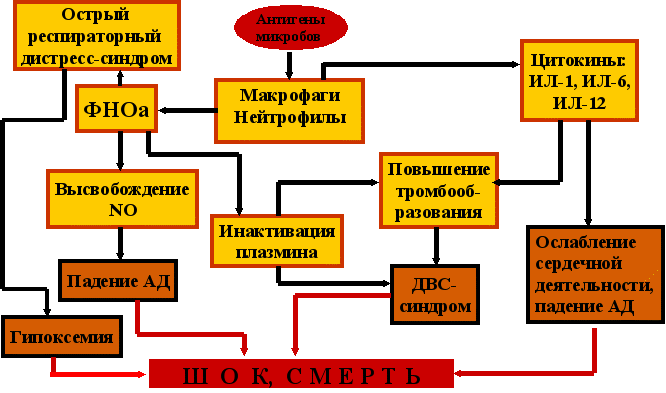
СПОН на своей терминальной стадии завершается развитием шока (в случае инфекционной природы генерализованного воспаления – септическим шоком).
В развитии септического шока ведущую роль играют цитокины и медиаторы воспаления «вырвавшиеся» за пределы первичного воспалительного очага. Можно выделить четыре основных направления патогенного воздействия медиаторов и цитокинов на органы и системы организма.
Во-первых, это их повреждающее воздействие на эндотелий сосудов и альвеолярный эпителий. В легких повреждение альвеолярного эпителия значительно затрудняет диффузию кислорода через альвеолярно-капиллярную мембрану и резко снижает выработку сурфактанта. В результате развивается острый респираторный дистресс-синдром, приводящий к прогрессирующей кислородозависимой гипоксемии.
Как это уже было указано ранее, многие цитокины стимулируют тромбообразование, которое при их системном действии способно вылиться в развитие синдрома диссеминированного свертывания крови (ДВС-синдром). Вряд ли стоит дополнительно объяснять всю тяжесть патологического состояния, которое сопровождает возникновение этого синдрома.
Во-вторых, медиаторы воспаления и цитокины (в частности, ФНОа) способствуют гиперпродукции клетками эндотелия сосудов оксида азота (NO), молекулы которого обладают мощным сосудорасширяющим эффектом.
Действие оксида азота на сосуды дополняется третьим основным патогенным эффектом цитокинов – их влиянием на сердечную мышцу, которое проявляется аритмиями и ослаблением сократительной способности миокарда.
Сочетание всех этих повреждающих факторов в большинстве случаев приводит к гибели организма.
Таков, к сожалению, весьма вероятный итог генерализации воспалительного процесса и развития «цитокиновой бури» в организме, который не смог локализовать первичный воспалительный очаг.
- Хроническое воспаление
8.1. Этиология и патогенез хронического воспаления
Можно указать три основные варианта перехода острого воспалительного процесса в хронический.
Во-первых, это происходит в том случае, когда патогенные микроорганизмы в процессе острого воспаления не могут быть уничтожены и/или выведены из макроорганизма и продолжают в нем персистировать. Такое развитие событий может наблюдаться, например, при заболеваниях туберкулезом или бруцеллезом.
Во-вторых, источником хронического воспаления могут быть неорганические вещества, которые в силу различных причин не метаболизируются и не выводятся из организма, что, например, происходит при развитии силикоза или длительном сохранении в организме инородных тел (скажем, при «забытом» в организме после операции тампоне).
В-третьих, причиной хронического воспаления может стать аутоиммунный процесс, возникший в результате длительного нахождения в организме и не устраненного при аллергических атаках аутоантигена (например, системная красная волчанка, хронический атопический дерматит).
Какова бы не была этиология хронического воспаления, в целом, этот процесс выглядит как длительно протекающая альтерация и экссудация на фоне вяло развивающийся пролиферации с ее исходом в фиброплазию.
Хроническое воспаление характеризуется инфильтрацией воспалительного очага активированными макрофагами и лимфоцитами, которые непрерывно пролиферируют и перерождаются в эпителиоидные клетки или, сливаясь между собой (как это происходит с макрофагами), образуют гигантские многоядерные клетки Пирогова-Лангханса. Длительная пролиферация лимфоцитов и макрофагов поддерживается своеобразным циклическим процессом, в основе которого лежит взаимная активация этих мононуклеаров соответствующими цитокинами. Так, лимфокины γ-интерферон и интерлейкин-4 активируют макрофаги, а, последние, в свою очередь, выделяя такие цитокины как фактор некроза опухолей и интерлейкины 1 и 6, активирую лимфоциты, и способствуют их пролиферации и трансформации в эпителиоидные клетки.
8.2. Морфогенез хронического воспаления

Морфологически картина хронического воспаления чаще всего представлена гранулематозными образованиями - узелками диаметром 1 – 2 мм, состоящими из оболочки (лимфоциты, макрофаги, эпителиоидные клетки, гигантские клетки Пирогова-Лангханса) и очагом казеозного некроза в центре. Кроме того, в центре грнулемы могут находиться инородные тела или бактериальные клетки.
При определенных обстоятельствах очаг хронического воспаления может трансформироваться в абсцесс или язву. Последняя трансформация характерна для поверхностно расположенных очагов воспаления.
И образование гранулем, и возникновение абсцесса, окруженного пиогенной мембраной, - это своеобразная, саногенетическая реакция организма в ответ на длительное существование в нем патогенного раздражителя, попытка изолировать его и предупредить системное распространение продуктов хронического воспаления. Однако морфологические изменения, возникающие в тканях и органах при хроническом воспалении, не могут не влиять на функции органа и организма в целом. Именно поэтому, любые проявления хронизации воспалительного процесса обязательно требуют врачебного вмешательства и соответствующей терапии или хирургического воздействия.
Пиогенная инфекционная грнулема слизистой рта

