Цитокины и медиаторы: от местного воспаления к генерализованному процессу
| Вид материала | Документы |
- Цитокины и старение, 135.73kb.
- 1. Понятие финансово-экономической основы местного самоуправления, 200.54kb.
- План лекции Острое воспаление. Определение. Общая схема острого воспаления Основные, 241.55kb.
- Международная научная конференция «Фундаментальные и прикладные аспекты воспаления», 27.32kb.
- Методические рекомендации для студентов к практическим занятиям по патологической анатомии, 223.24kb.
- Цитокины в современном комбинированном лечении некоторых злокачественных опухолей 14., 736.48kb.
- Тематика курсовых работ по гражданскому процессу. Виды гражданского судопроизводства, 16.25kb.
- Методические указания по выполнению курсовых работ по уголовному процессу, 66.37kb.
- Программа по гражданскому процессу (арбитражному процессу) для государственных экзаменов, 484.23kb.
- Мозга. Медиаторы, 59.63kb.
Цитокины и медиаторы:
от местного воспаления к генерализованному процессу
Со времен Гиппократа, Цельса и Галена мы привыкли расценивать воспаление как один из ведущих, «ключевых» патологических процессов. За полтора истекших столетия патологами и клиницистами проведены тысячи и тысячи исследований и наблюдений, написаны многие десятки монографий, руководств и учебников. Конечно, наши знания о природе и сущности воспаления во многом вышли за пределы представлений об этом процессе, постулированных Р.Вирховым и Ю.Конгеймом, однако, даже в наши дни мы можем во многом согласиться с мнением Ю.Конгейма, изложенном в его известной книге «Общая патология», в которой он написал: «…все старания ныне установить всеобъемлющую гипотезу для объяснения сущности воспалительных изменений мне кажутся бесплодными». И дело здесь не только в недостатке наших знаний о тонких – клеточных и молекулярных механизмах воспалительного процесса. Крайне противоречива, если так можно сказать, сама «философия» воспаления. Вспомним хорошо известное определение воспаления: «Воспаление – это сформировавшаяся в процессе эволюции защитно-приспособительная реакция организма, направленная на локализацию, уничтожение или удаление из организма патогенного агента и характеризующаяся явлениями альтерации, экссудации и пролиферации». Уже в нем заложена явная противоречивость этого процесса. В самом деле – если воспаление – это защитно-приспособительная реакция, следовательно, в нем, как и в любой другой защитно-приспособительной реакции, достаточно много от физиологии нормального организма. Все три признака воспаления – альтерацию, экссудацию и пролиферацию мы можем постоянно наблюдать в организме, не переносящем какой либо патологии. Клетки организма постоянно гибнут (т.е. альтерируются) как путем некроза, так и апоптоза, проницаемость капилляров и венул (это, фактически, экссудация) меняется в достаточно широких пределах, а без пролиферации и, далее, регенерации в нормальном организме тем более обойтись невозможно. Однако, воспаление – это и явная патология. Мы хорошо помним четыре классических признака воспаления, впервые описанные Цельсом: rubor, tumor, calor, dolor (краснота, опухоль, жар и боль). Гален добавил к ним и еще один – functio laesa – расстройство функции. Все они свидетельствуют о явном неблагополучии: о повреждении, разрушении, нарушении нормальной деятельности органов и тканей, пораженных воспалением. Начиная знакомится с различной патологией в клиниках внутренних болезней, хирургии, акушерства и гинекологии, студентам постоянно приходится встречаться и заучивать множество терминов, имеющих один и тот же латинский суффикс «i t i s» - воспаление какого либо органа или системы, а в обыденной жизни без употребления терминов «фарингит», «бронхит», «аппендицит», «гепатит» и прочих «ит» не обходится, пожалуй, ни один разговор.
Однако, давайте оставим тему о месте, сочетании и противопоставлении физиологического и патологического в воспалительном процессе. Обратимся к другой диалектической загадке, содержащейся в приведенном выше определении воспаления. Речь пойдет о местном и общем в воспалении, о локализации и генерализации этого процесса. Вернемся к определению воспаления. Из него явствует, что задача этой защитно-приспособительной реакции (точнее – задача организма) локализовать, а затем уничтожить или удалить из организма патогенный агент. Но это отнюдь не «задача» патогенного агента. Он «заинтересован» в прямо противоположном: распространиться, захватить как можно больший плацдарм – орган, систему, наконец, весь организм. Это, безусловно, верно по отношению к септическому воспалению, но даже применительно к его асептической форме мы найдем много похожего – достаточно вспомнить патогенез таких патологических процессов как инфаркт, атеросклероз или аутоаллергию.
Да, действительно, организм прилагает огромные усилия, чтобы локализовать воспалительный очаг. Он строит свои преграды и барьеры. О «барьерной» роли воспаления много писал известный русский патолог И.В.Давыдовский, подразумевая под барьерными факторами отек, стаз, замедление венозного оттока из очага воспаления, лейкоцитарный вал, образование гранулем, пиогенных мембран, наконец, роль региональных лимфоузлов. И дело здесь не только в том, что само по себе распространение инфекта опасно для организма: может возникнуть не один, а множество очагов воспаления. Значительно опаснее другое – в очаге воспаления, в этом биологическом и биохимическом «котле» кипят, катализируя друг друга, медиаторы и цитокины, идет активный фагоцитоз, «гремят кислородные взрывы», «плавят» клетки и ткань ферменты лизосом. Содержимое воспалительного «котла» смертельно опасно для организма в целом. Выход за пределы воспалительного очага медиаторов, ферментов и цитокинов крайне не желателен, так как они способны за счет аутокатализации и возникновения каскадных реакций сделать «очагом воспаления» и отдельный орган, и целый организм. Чтобы предотвратить эти крайне не желательные для организма последствия, очаг воспаления (зона альтерации, входные ворота инфекции) отгораживается от организма всеми теми барьерными факторами, о которых мы уже говорили. Таким образом устанавливается и биологическая и информационная блокада очага воспаления, так как молекулы любых веществ (медиаторов, цитокинов, ферментов), исходящих из очага, можно расценивать не только как некое действующее начало, но и как носителей определенной информации.
С другой стороны, и сам организм на время в значительной степени становится не способным воздействовать на очаг воспаления. Изолированная микроциркуляторная система воспалительного очага крайне неохотно пропускает к себе различные сигнальные молекулы (гормонов, медиаторов), а нервные влияния на сосуды в очаге сведены к минимуму за счет развития нейропаралетической стадии артериальной гиперемии и, в последующем, венозной гиперемии. Это явление было впервые описано еще в 1893 году польским патологом Р.Клеменсиевичем, который писал: «…в развитии воспаления неврогенный фактор в момент максимума исчезает, уступая место явлениям со стороны самих сосудов». Изложенное, конечно, не нужно воспринимать таким образом, что при развитии воспаления организм как бы остается в стороне от этого явления. Хорошо известно, что при возникновении даже относительно небольшого воспалительного очага повышается температура тела, увеличивается СОЭ, возникает лейкоцитоз. Однако при местном воспалении эти явления можно уподобить лишь «отдаленному эху» процесса. Кардинальных изменений в деятельности органов и систем организма не происходит. Возникает ощущение, что в период развития местного воспалительного процесса организм как бы «заинтересован» отгородиться и забыть об относительно небольшом местном патологическом процессе, не вмешиваться регуляторно в этот процесс, предоставить локальным, и, подчеркнем, - гораздо более древним регуляторным системам, самим бороться с патологией. В целом, регуляторную автономность местного воспаления можно расценивать как некую типовую регуляторную реакцию организма, которую, кстати, мы уже имели возможность наблюдать при развитии определенной патологии висцеральных органов и систем.
Такова логика патогенеза местного воспаления. Оставим на время ее в стороне. Основная цель нашей лекции заключается в том, чтобы рассмотреть ситуацию, при которой по тем или иным причинам барьер вокруг воспалительного очага нарушается, его информационная блокада исчезает, и волны воспалительного процесса одна за другой накатываются на организм. Местное воспаление становиться генерализованным, то есть превращается в процесс смертельно опасный для всего организма.
Мы начнем рассматривать это явление с оценки биологических особенностей и действия на клетки и ткани сигнальных молекул воспаления – медиаторов и цитокинов.
Что же такое «медиаторы воспаления»?
Все медиаторы воспаления принято делить на две группы: клеточные медиаторы и гуморальные (плазменные) медиаторы. Кроме того, по времени их выделения в процессе воспаления медиаторы можно разделить на первичные, вторичные и третичные. Эта, последняя классификация медиаторов относительна, так как о «первичности» или «вторичности» медиаторов можно говорить только применительно к пику их выделения в определенный период воспаления. Так, например, первичные медиаторы в максимальных объемах выделяются в период первичной и вторичной альтерации. Но в определенных объемах все медиаторы выделяются и действуют на протяжении всех стадий воспалительного процесса. Классификация основных медиаторов воспаления представлена на Рис.1.
| Происхождение медиаторов. «Пик» выделения медиаторов | Клеточные | Гуморальные (плазменные) |
Первичные | ГистаминСеротонин Вещество Р Лизосомальные ферменты | |
Вторичные | Эйкозаноиды (простагландины, простациклины, лейкотриены, тромбоксан А2) | Белки системы комплемента |
Третичные | | Компоненты калликреин-кининовой системы (брадикинин) |
Рис. 1. Классификация медиаторов воспаления
Не смотря на то, что наше основное внимание будет обращено к специфике действия медиаторов и цитокинов в случае возникновения генерализованного воспаления, есть необходимость хотя бы коротко обсудить биологическое действия медиаторов воспаления в процессе развития острого местного воспаления, так как мы должны уяснить кардинальные различия их функционирования при этих патологических процессах.
Гистамин. Этот медиатор синтезируется и гранулируется в тучных клетках (лаброцитах) и в базофилах. Описано существование гистамина в трех формах: связанный, лабильный и свободный гистамин. Связанный гистамин может освобождаться только при разрушении клетки-носителя, лабильный высвобождается при действии на тучные клетки либераторов гистамина (например. лизосомальных ферментов), вызывающих их дегрануляцию. Свободный гистамин содержится в органах и тканях лишь в незначительном количестве.
Так как тучные клетки располагаются в непосредственной близости от микрососудов, эффекты гистамина сказываются, прежде всего, именно на них. Расширение сосудов осуществляется за счет действия гистамина на Н1 и Н2 гистаминорецепторы. В стадию артериальной гиперемии гистамин обеспечивает повышенный приток крови к очагу воспаления за счет раскрытия прекапиллярных сфинктеров, расширения капилляров и, особенно, посткапиллярных венул. Второе важное направление действия гистамина – повышение проницаемости микрососудов за счет увеличения подвижности эндотелиальных клеток, их округления и, вследствие этого, появления промежутков между ними. Помимо этого гистамин стимулирует фагоцитоз, усиливает хемотаксис фагоцитов и митогенез лимфоцитов. Следует указать, что все эти эффекты имеют место только при высокой концентрации гистамина в тканях. В низкой концентрации гистамин обладает противовоспалительным действием, так как через Н2 гистаминорецепторы угнетает способность тучных клеток и базофилов к дегрануляции и уменьшает подвижность нейтрофильных лейкоцитов.
Серотонин. Депонируется в тромбоцитах и тучных клетках кожи. При разрушении клеток-носителей серотонин через серотонинергические рецепторы расширяет микрососуды и увеличивает их проницаемость. Кроме того, серотонин способствует тромбообразованию преимущественно в посткапиллярных венулах.
Вещество Р. Синтезируется в телах афферентных нейронов и с ортоградным аксонным током переносится к сенсорным окончаниям, где и освобождается при возбуждении соответствующих рецепторов. Вещество Р способствует вазодилятации и дегрануляции тучных клеток и базофилов (то есть косвенно влияет на выделение гистамина). Этот медиатор способен вызывать так называемое «нейрогенное» воспаление при раздражения ноцицепторов кожи и выделения вещества Р из афферентных окончаний по принципу аксон-рефлекса.
Эйкозаноиды. В очаге воспаления эти производные арахидоновой кислоты синтезируются под влиянием фосфолипазы А2, лизирующей фосфолипиды мембран клеток и становится особенно активной при избытке ионов Са++, которые в больших количествах освобождаются из погибших клеток.
Одним из эйкозаноидов являются простагландины. Функции их весьма обширны. Так простагландины группы Е вызывают расширение сосудов, потенциируя действие гистамина и серотонина, обладают хемотаксическим действием по отношению к поли- и мононуклеарам крови. На стадии же пролиферации про стагландины этой группы усиливают синтез коллагена фибробластами. Участвуя в сложных взаимоотношениях с рядом цитокинов, простагландины этой группы возбуждают лихорадочную реакцию.
Другие производные арахидоновой кислоты – это лейкотриены (фракции В4, С4, D4, Е4). При развитии воспаления лейкотриены повышают сосудистую проницаемость, увеличивают активность клеток – естественных киллеров. Побочным и весьма неприятным эффектом действия лейкотриенов является их влияние на гладкую мускулатуру внутренних органов. В частности, лейкотриены вызывают бронхоспазм.
Значительную роль в развитии воспалительной реакции играют белки системы комплемента. В зоне воспаления белки активированной системы комплемента вызывают дегрануляцию тучных клеток, обеспечивают хемотаксис лейкоцитов, участвуют в лизисе микробных клеток и поврежденных тканевых элементов при осуществлении реакции антиген-антитело.
Основное место среди группы третичных медиаторов занимают компоненты калликреин-кининовой системы.
Учитывая, что основной функцией представителей калликреин-кининовой системы является вазодилятация, увеличение проницаемости микрососудов и алгогенное действие, остановимся лишь на описании одного, но наиболее мощного вазоактивного представителя этой системы – брадикинине.
Брадикинин – это нонапептид, обеспечивающий вазодилятацию и повышение проницаемости микрососудов за счет высвобождения под его действием из эндотелиальных клеток эндотелиального релаксирующего фактора и простациклина, которые уже непосредственно расслабляют гладкую мускулатуру прекапиллярных артериол. Кроме того, брадикинин в значительно большей степени обладает алгогенными свойствами, чем гистамин, серотонин и вещество Р.
Поврежденный эпителий микрососудов, клетки крови на пике воспалительного процесса выделяют и еще большую группу биологически активных веществ, которые также могут быть условно отнесены к группе медиаторов воспаления и носят обобщающее название – цитокины. Учитывая чрезвычайно важную роль цитокинов в регуляции воспалительного процесса, с ними необходимо познакомится более подробно.
Цитокины – это низкомолекулярные белки (вес 5 – 50 kDa), вырабатываемые преимущественно активированными клетками иммунной системы, лишенные специфичности и являющиеся медиаторами межклеточных коммуникаций при иммунном ответе, гемопоэзе и воспалении.
В настоящее время выделяют пять основных групп цитокинов:
- интерлейкины (Interleukins – Ils);
- колониестимулирующие факторы (Colony-stimulating factors – CSFs);
- интерфероны (Interferons – IFNs);
- факторы некроза опухолей (Tumour necrosis factors – TNFs);
- хемокины (Chemokines).
Образование фракций комплемента
С3 С3а + С3b

Образование комплекса
«мембранной атаки»
С5+С6+С7+С8+С9
Фагоцитоз
Проницаемость
сосудов
Хемотаксис
Лизис клетки
В О С П А Л Е Н И Е








 Практически все из перечисленных групп цитокинов принимают участие в воспалительном процессе. Они синтезируются в очаге воспаления преимущественно макрофагами в ответ на повреждение тканей.
Практически все из перечисленных групп цитокинов принимают участие в воспалительном процессе. Они синтезируются в очаге воспаления преимущественно макрофагами в ответ на повреждение тканей. В настоящее время известно более ста цитокинов. Одним из первых (в начале 40-х годов) был описан цитокин, который по данным исследователей вызывал кахексию и снижение веса. В последствии он был идентифицирован как «фактор некроза опухолей альфа» (TNF). В 50-е годы был описан другой цитокин – интерферон, который получил свое название из способности «интерферировать», то есть препятствовать размножению вирусов. Под названием «эндогенный пироген» был описан интерлейкин 1 (ИЛ-1). Таким образом, первоначально многие цитокины были изучены как вещества, оказывающие какое-либо одно, но ярко выраженное действие на организм. О других функциях цитокинов информация собиралась, и, скажем в скобках, собирается и до сих пор.
В нашей же лекции мы остановимся на цитокинах, роль которых наиболее выражена в регуляции воспалительного процесса. Это интерлейкины 1 и 6, фактор некроза опухолей и некоторые другие цитокины. Совместно с медиаторами воспаления цитокины на местном уровне ответственны за все этапы воспаления – альтерацию, экссудацию и пролиферацию. Описать действие и происхождение всех воспалительных цитокинов в этом разделе было бы весьма сложно, так как только одних интерлейкинов насчитывается более 20.
Наиболее полное о происхождении и функциях одного из наиболее изученных цитокинов дает Рис. 2. Из него видно, что цитокин интерлейкин 1 (ИЛ-1, ключевой цитокин регуляции воспалительного процесса), вырабатывается активированными макрофагами (моноцитами), астроцитами, нейирофильными лейкоцитами, эндотелиоцитами. Активация происходит при контакте макрофагов и других иммуннокомпетентных клеток с продуктами жизнедеятельности микробных клеток или с веществами, образующимися при распаде поврежденных тканей.

Интерлейкин-1

В-лимфоциты
фибро-
бласты
Т-лимфоциты
Выработка
белков
острой
фазы
Выработка
антител
Пролиферация
фибробластов
Выработка
лимфо-
кинов
Выработка
интерлей-
кина-2
(ИЛ-2)












Лихорадка

Рис. 2. Эффекты действия цитокина интерлейкин-1 (ИЛ-1)
Другой цитокин, играющий чрезвычайно важную роль в развитии воспаления, - фактор некроза опухолей действительно способен уничтожать опухолевые клетки. Он же, действуя на эндотелиальные клетки микрососудов, заставляет их синтезировать молекулы адгезии, обеспечивающие прилипание лейкоцитов к эндотелию сосудов, что облегчает их дальнейший переход через сосудистую стенку.
Очень важно, что цитокины, являясь сигнальными молекулами, способны передавать сигнал от одной иммунокомпетентной клетке к другой и обеспечивать выработку ею новых цитокинов воспаления. Это так называемый «цитокиновый каскад». Пример «цитокинового каскада» демонстрирует Рис.3.








Ант

ИЛ-1
ИЛ-2

ИЛ-2

А
А




А



ИЛ-6


Рис. 3. «Каскад цитокинов», обеспечивающий взаимодействие
Т и В лимфоцитов (Ант – антиген; А – антитела)
Остановимся еще на нескольких важных функциях цитокинов в процессе развития воспалительного процесса. Это выработка белков острой фазы воспаления, про- и противовоспалительная функция цитокинов и их участие в развитии лихорадки. Следует указать, что эти функции медиаторы и цитокины осуществляют как в процессе развития местного острого воспаления, так и в извращенном виде при генерализации воспалительного процесса.
Цитокины и лихорадка. Известно, что некоторые цитокины являются эндогенными пирогенами, то есть веществами, способными воздействуя на терморецепторы гипоталамуса, вызывать лихорадочную реакцию. Рассмотрим этот процесс подробнее.
Досконального представления о функциях всех цитокинов и их роли в лихорадочной реакции мы пока не имеем. Ясно одно – один цитокин может влиять на другой, делая его участником той или иной биологической реакции. Цитокины могут индуцировать и более удаленные комедиаторы, фебрильной и воспалительной реакции, например, участвовать в выработке простагландинов или фактора активации тромбоцитов. Все это весьма затрудняет определение функций цитокинов in vivo. Тем не менее, участие цитокинов в развитии лихорадочной реакции можно считать доказанным. Экзогенные пирогены, содержащиеся в мембране и протоплазме микробных клеток, активируют клетки макроорганизма, обладающие фагоцитарной активностью (в основном, макрофаги), которые в свою очередь принимают участие в выработке таких цитокинов как интерлейкин 1, фактор некроза опухолей и интерферон. Эти цитокины участвуют в выработке и активации интерлейкина 6 – основного медиатора, воздействующего на терморецепторы, расположенные в преоптической области переднего гипоталамуса. Возможно и прямое действие интерлейкина 6, выработанного макрофагами, на терморецепторы. Цитокины понижают чувствительность тепловых терморецепторов и повышают чувствительность холодовых. В результате нормальная температура внутренней среды организма начинает восприниматься как пониженная. Увеличивается теплопродукция, уменьшается теплоотделение. Температурный баланс организма устанавливается на новом, более высоком уровне, т.е. возникает лихорадка. Подъем температуры тела на чрезмерно высокий уровень включает обратную термозависимую связь, благодаря чему активность фагоцитов (макрофагов) в отношении выработки цитокинов снижается, что, в свою очередь, уменьшает интенсивность лихорадки.




















Рис. 4. Схема развития лихорадочной реакции
(по Ph. Mackowiak)
Существует и еще одна гипотеза происхождения лихорадки. Взаимодействие между цитокинами и их рецепторами в преоптической области гипоталамуса активирует фосфолипазу А2, благодаря которой из мембран клеток высвобождается арахидоновая кислота, метаболитом которой является простагландин Е2 , небольшая липидная молекула которого свободно проходит через гематоэнцефалический барьер. По мнению некоторых исследователей именно простагландин Е2 и является основным раздражителем терморецепторов преоптической зоны гипоталамуса. Общая схема, иллюстрирующая роль цитокинов в индуцировании лихорадки, представлена на Рис. 4.
Цитокины как индукторы белков острой фазы. В патофизиологии и клинике принято называть реакцию организма, следующую непосредственно вслед за альтерацией и направленную на восстановление гомеостаза организма, «реакцией острой фазы воспаления», а ряд биологически активных веществ, вырабатывающихся в этот период, «белками острой фазы». Схема, иллюстрирующая механизмы, лежащие в основе выработки белков острой фазы, представлена на Рис. 5.
К числу факторов, способных индуцировать реакцию острой фазы, относятся бактериальные и, в меньшей степени, вирусные инфекции, травмы, ожоги, злокачественные новообразования, тканевые инфаркты, воспалительные состояния. Реакция острой фазы включает такие клинические признаки и симптомы как сонливость, анорексию, изменения синтеза белков плазмы и синтеза некоторых гормонов.
Однако, прежде всего, острофазовая реакция характеризуется изменениями концентрации в плазме крови некоторых секреторных белков, вырабатываемых гепатоцитами при действии на печень цитокинов и некоторых гормонов. При этом основными индуктороми синтеза острофазных белков считается интерлейкин 1, интерлейкин 6, интерлейкин 11, гамма-интерферон, фактор некроза опухолей. Белки острой фазы, число которых весьма велико (более 20) разделяются на две группы: позитивные острофазные белки (концентрация их в плазме крови в процессе развития острофазовой реакции увеличивается в сотни и тысячи раз) и негативные острофазовые белки (их концентрация в плазме крови в процессе развития острофазовой реакции не изменяется, или даже уменьшается по сравнению с нормой).
ГИПОТАЛАМУС
ГИПОФИЗ
НАДПОЧЕЧНИКИ
ЛИХОРАДКА
ГЛЮКОРТИКОИДЫ
ИНТЕРЛЕЙКИН -1
ФАКТОР НЕКРОЗА ОПУХОЛЕЙ

БЕЛКИ ОСТРОЙ ФАЗЫ







- ИНТЕРФЕРОН

ОНКОСТАТИН М
ИНТЕРЛЕЙКИН 6
ИНСУЛИН
ИНТЕРЛЕЙКИН 11


Рис. 5. Схема регуляции синтеза белков острой фазы в печени
 угнетающие влияния
угнетающие влиянияОдной из основных функций острофазовых белков является модуляция воспалительной реакции и регенерации тканей. К «главным» белкам острой фазы относят С-реактивный белок и сывороточный амилоид А, концентрация которых в плазме крови после повреждения (воспаление, травма) в течение 6 – 8 часов возрастает в 100 – 1000 раз. С-реактивный белок способен связывать широкий спектр лигандов-компонентов микроорганизмов, токсинов, частиц поврежденных тканей, препятствуя тем самым их распространению. Кроме того, продукты такого взаимодействия активируют комплемент по классическому пути, стимулируя процессы фагоцитоза и элиминации вредных продуктов. С-реактивный белок может взаимодействовать с Т-лимфоцитами, фагоцитами и тромбоцитами, регулируя их функции в процессе воспаления. По видимому, белки острой фазы и некоторые пирогенные цитокины связаны между собой регуляционной обратной связью. Так С-реактивный белок вызывает увеличение синтеза фактора некроза опухолей макрофагами.
Следует указать, и это очень важно для рассмотрения проблемы участия цитокинов и медиаторов в процессе развития генерализованного воспаления, что С-реактивный белок обладает выраженными противовоспалительными функциями. В частности, он способен снижать высвобождение провоспалительных цитокинов из моноцитов, блокировать высвобождение фактора некроза опухолей из лейкоцитов, ингибировать выработку тромбина и предохранять целостность сосудистого эпителия от альтерирующего воздействия на него медиаторов и цитокинов.
Сывороточный амилоид А способен усиливать адгезивность и хемотаксис фагоцитарных клеток и лимфоцитов. Кроме того, сывороточный амилоид А участвует в окислении липопротеинов низкой плотности и, тем самым, обладает антиатерогенным действием.
Таким образом, белки острой фазы при развитии местного острого воспаления регулируют его развитие, не допуская чрезмерной альтерации тканей, а при генерализации этого процесса тормозят его распространение за счет своей противовоспалительной активности.
Про- и противовоспалительные цитокины. Оценивая роль цитокинов в воспалительном процессе, следует указать и еще на одну важную особенность этих межклеточных посредников. В настоящее время можно выделить две группы цитокинов, одна из которых обладает провоспалительным действием, а другая – противовоспалительным.
К первой группе относятся интерлейкины 1,6,8,12,17,18, гамма-интерферон, факторы некроза опухолей альфа и бета, фактор гемопоэза GM-CSF.
Противовоспалительным действием обладают ингибитор интерлейкина 1,интерлейкин 4, интерлейкин 10, растворимые рецепторы к провоспалительным цитокинам.
Провоспалительные эффекты цитокинов связаны с их возможностями активировать клетки иммунной системы, способствовать их дифференцировке, стимулировать выработку иммуноглобулинов, обеспечивать адгезию и хемотаксис фагоцитов. С другой стороны, чрезмерная активность провоспалительных цитокинов, недостаточное действие их ингибиторов и антагонистов может приводить к значительной деструкции тканей, росту альтерации.
Противовоспалительные цитокины ограничивают развитие воспалительного процесса. Так ингибитор интерлейкина 1 подавляет действие этого провоспалительного цитокина, интерлейкин 10 инактивирует макрофаги, подавляет активность клеток – естественных киллеров, снижает пролиферацию В- и Т-лимфоцитов, ингибирует макрофагальный киллинг внутриклеточных паразитов. Растворимые рецепторы к провоспалительным цитокинам связывают эти клеточные посредники и не дают им возможности продолжить свое воздействие на иммунокомпетентные клетки.
Как мы убедимся в дальнейшем, особенно важна роль противовоспалительных цитокинов в предупреждении генерализации воспалительного процесса.
Определенные сведения о функциях цитокинов и медиаторов в очаге острого воспаления, благодаря которым осуществляется локализация и разрешение этого процесса, было уже сказано выше. Однако ряд особенностей медиаторов и цитокинов, проявляющихся за пределами воспалительного очага, в случае их прорыва в системное кровообращение, позволяет говорить об их мощном патогенном воздействии на организм. Приведем лишь несколько примеров этого патогенного воздействия.
Гистамин. Угнетение деятельности синусного узла сердца, возможные провокации фибрилляции желудочков.
Кинины. Резкое падение артериального давления, коллапс.
Фактор некроза опухолей альфа. Активизация общего коагуляционного потенциала крови, усиление продукции эндотелиоцитами прокоагулянтных факторов, прямое токсическое действие на клетки сосудистых эндотелиоцитов, подавление липолитической активности крови, подавление усвоения глюкозы клетками и тканями, развитие лихорадки (включая ее гиперпиретическую форму).
Интерлейкин 1. Повышение прокоагулянтной активности эндотелия сосудов, повышение чувствительности клеток и тканей к действию фактора некроза опухолей альфа, подавление липолитической активности крови, развитие лихорадки (включая ее гиперпиретическую форму).
Интерлейкин 2. Уменьшение системного сосудистого сопротивления, снижение артериального давления, провокация проявлений сердечной недостаточности.
Интерлейкин 12. Стимуляция агрегации тромбоцитов, повышение тромбообразования, усиление отрицательных инотропных влияний на миокард, понижение артериального давления, ухудшение мозгового кровообращения.
Лейкотриены D4 и Е4. Ухудшение коронарного кровотока и сократимости миокарда.
Тромбоксан А2. Ускорение агрегации тромбоцитов, усиление тромбообразования, бронхоспазм и спазм сосудов мозга.
Простагландин I2. Снижение артериального давления за счет мощной вазодилятации.
Комплемент (фракция С5а). Уменьшение сосудистого сопротивления, падение артериального давления.
Если суммировать приведенные данные, то можно сказать, что системное действие основных медиаторов и цитокинов заключается в следующем:
- повышение тромбообразования;
- отрицательные инотропные влияния на сердце, провокации аритмий, вплоть до фибрилляции желудочков;
- снижение сосудистого сопротивления, падение артериального давления;
- нарушения мозгового кровообращения;
- отрицательное влияние на метаболизм глюкозы;
- снижение липолитических свойств крови.
Понятно, что при выходе в системное кровообращение указанных медиаторов и цитокинов в количествах, превышающих объемы их проникновения при развитии локального острого воспаления, могут быть спровоцированы серьезные патологические состояния, вплоть до развития ДВС-синдрома, тяжелой неспецифической стресс-реакции и шока. К сожалению, именно эти явления и наблюдаются при развитии генерализованного воспаления.
Для того чтобы не путаться в терминологии, укажем, что клиницисты часто называют генерализованное воспаление «синдромом системного воспалительного ответа - ССВО» (в английской аббревиатуре – SIRS –Sistemic Inflammatory Response Syndrome).
Обобщая этиологические факторы, приводящие к генерализованному воспалению или ССВО, можно указать, что в 10% случаев – это массивная механическая травма мощная кровопотеря, а также тяжелые обширные ожоги. В 90% случаев ССВО – результат инфекционной атаки на организм, то есть то, что называется сепсисом.
Этиология определяет патогенез этих состояний. В первом случае организм просто не способен локализовать очаг воспаления из за его обширности. Иначе говоря, с самого начала массивной альтерации воспаление приобретает характер генерализованного, а цитокины и медиаторы воспаления вследствие того, что они выделяются в огромных количествах, немедленно начинают оказывать свое общепатогенное действие.
В случае инфекционной атаки в обобщенном виде события могут развиваться в нескольких вариантах.
Во-первых, инфекцией может быть поражен организм с достаточно ослабленной по тем или иным причиной иммунной защитой. В этом случае прорыв инфекции из первичного очага обусловлен повреждением местных звеньев иммунной системы (ослабление микро- и микроцитоза, например, из-за недостаточного энергообеспечения процессов фагоцитоза, а также за счет развития апластических процессов в регионарных лимфатических узлах).
Во-вторых, инфекция может поразить представителя популяции, ранее не встречавшейся с этой инфекцией. Так стремительно, с септическим «пожаром» развивались некоторые инфекции (сифилис, туберкулез, корь) среди представителей индейских племен в Северной Америке и племен, населяющих тихоокеанские острова, где до открытия их европейцами эти инфекции не были известны.
В-третьих, - и это наиболее часто встречающаяся ситуация, сепсис развивается благодаря многократному поступлению в системный кровоток антигенных структур микроорганизмов, их экзо- и эндотоксинов. Естественно, что и в этом случае определенную «вину» так же несут механизмы местной иммунной защиты.
Остановимся подробнее на механизмах развития генерализованного воспаления (ССВО), когда его причиной является многократное (или постоянное) поступление в системный кровоток продуктов инфекционной атаки. При этом в развитии генерализованного воспаления можно выделить несколько стадий:
- В ответ на инфекцию происходит локальное выделение медиаторов и цитокинов. Воспаление пока еще протекает по принципу острого местного процесса. Местным иммунным системам определенное время удается держать воспалительный процесс под контролем.
- Если на этом этапе местной реакции не удается локализовать и уничтожить патогенный агент, выделение медиаторов и цитокинов нарастает, они, пока в малых количествах, проникают в системный кровоток. Развивается острофазовая реакция, острофазовые белки и противовоспалительные цитокины держат под контролем интенсивность воспалительного процесса. На некоторое время воспалительный и противовоспалительный процесс уравновешивают друг друга.
- Если и при этих условиях жизнедеятельность микроорганизмов в первичном очаге не подавлена, и продукты инфекционной атаки продолжают поступать в системный кровоток, выработка провоспалительных цитокинов превышает возможности противовоспалительных систем, начинается их деструктивное воздействие на органы и ткани организма, а очаги воспаления возникают в отдаленных от первичного локуса местах. Развивается процесс, который в клинике получил название «синдрома полиорганной недостаточности – ПОН». К сожалению, в значительном числе случаев ПОН может закончиться септическим шоком и гибелью организма.

Рис. 6. Патогенез генерализованного воспаления
Патогенез синдрома полиорганной недостаточности и септического шока мы и рассмотрим в заключительной части нашей лекции.
Термин «синдром полиорганной недостаточности - СПОН» прочно утвердился в медицинской литературе в начале 80-х годов, когда клиницисты вообще, и реаниматологи, в частности, убедительно показали, что выпадение функций трех или более органов и систем пациента, как правило, ассоциируется с крайне неблагоприятным исходом.
В большинстве случаев СПОН является исходом генерализованного воспаления (или ССВО) и представляет собой тяжелую неспецифическую стресс-реакцию организма в ответ на мощное экзогенное воздействие, сопровождающееся недостаточностью двух или более его функциональных систем с преобладанием симптомов той или иной органной дисфункции. Развитие СПОН носит характер стремительно развивающейся, обвальной патологии органов и систем организма, в основе которой, как правило, лежит серьезное расстройство микроциркуляции, развитие острого респираторного дистресс-синдрома, печеночной и почечной недостаточности, резкого нарушения функции сердечно-сосудистой системы.
Чрезвычайно важным патологическим фактором, значительно осложняющим течение СПОН, является развитие синдрома гиперметаболизма (аутоканнибализма) организма. По своей сути гиперметаболические изменения должны были бы нести защитный характер, привлекая на помощь организму последние запасы энергетических субстратов. Однако в случае развития СПОН гиперпотребности организма в различных субстратах для адаптации к повышенным затратам энергии сочетаются с толерантностью тканей к этим же субстратам. В результате организм впустую тратит последние запасы энергии. При развитии гиперметаболизма скорость обмена веществ по сравнению с основным обменом увеличивается в два и более раз, значительно возрастает потребность организма в кислороде, развивается отрицательный азотистый баланс и происходит накопление углекислого газа.
Значительно страдают все виды обменов.
Метаболизм глюкозы протекает в условиях возрастания толерантности клеток к глюкозе на фоне гиперпродукции ее гепатоцитами, резко увеличивается глюконеогенез, для обеспечения которого происходит мобилизация аминокислот из миоцитов и висцеральных клеток.
Метаболизм белков смещается в сторону распада белковых субстанций, используемых в целях глюконеогенеза. Развивается отрицательный азотистый баланс.
Активизируется и липолиз на фоне снижения липогенеза, утилизации жирных кислот тканями и уменьшения активности липопротеинлипазы.
Следствием развития синдрома гиперметаболизма является не только множественная органная дисфункция, но и белково-энергетическая недостаточность с последующей кахексией (если, конечно, последняя успевает развиться до гибели организма).
СПОН на своей терминальной стадии завершается развитием шока (в случае инфекционной природы генерализованного воспаления – септическим шоком).
В развитии септического шока ведущую роль играют цитокины и медиаторы воспаления «вырвавшиеся» за пределы первичного воспалительного очага. Можно выделить четыре основных направления патогенного воздействия медиаторов и цитокинов на органы и системы организма.
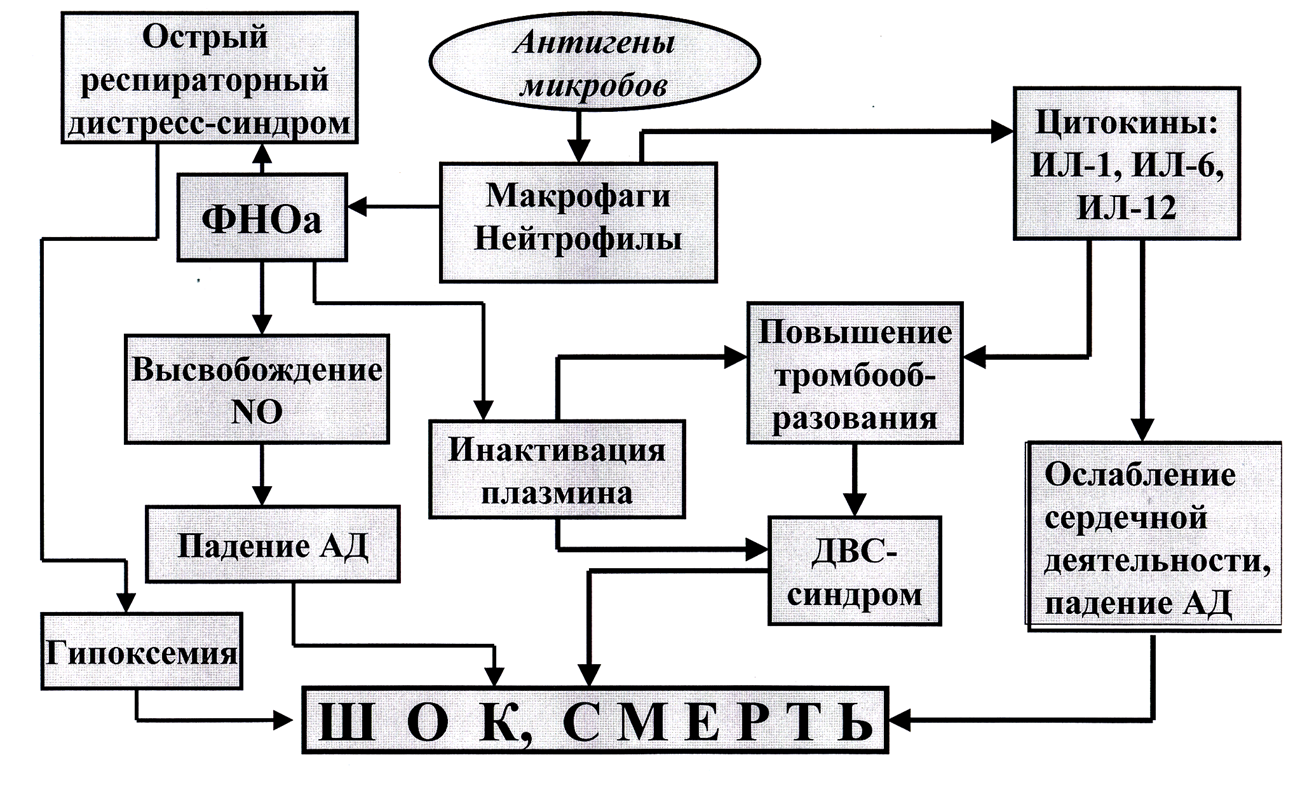
Рис. 7. Патогенез септического шока
Во-первых, это их повреждающее воздействие на эндотелий сосудов и альвеолярный эпителий. В легких повреждение альвеолярного эпителия значительно затрудняет диффузию кислорода через альвеолярно-капиллярную мембрану и резко снижает выработку сурфактанта. В результате развивается острый респираторный дистресс-синдром, приводящий к прогрессирующей кислородозависимой гипоксемии.
Как это уже было указано ранее, многие цитокины стимулируют тромбообразование, которое при их системном действии способно вылиться в развитие синдрома диссеминированного свертывания крови (ДВС-синдром). Вряд ли стоит дополнительно объяснять всю тяжесть патологического состояния, которое сопровождает возникновение этого синдрома.
Во-вторых, медиаторы воспаления и цитокины (в частности, ФНОа) способствуют гиперпродукции клетками эндотелия сосудов оксида азота (NO), молекулы которого обладают мощным сосудорасширяющим эффектом.
Действие оксида азота на сосуды дополняется третьим основным патогенным эффектом цитокинов – их влиянием на сердечную мышцу, которое проявляется аритмиями и ослаблением сократительной способности миокарда.
Сочетание всех этих повреждающих факторов в большинстве случаев приводит к гибели организма.
Таков, к сожалению, весьма вероятный итог генерализации воспалительного процесса и развития «цитокиновой бури» в организме, который не смог локализовать первичный воспалительный очаг.
