Клинико-генетическая характеристика больных с преждевременной недостаточностью яичников 14. 00. 01. акушерство и гинекология
| Вид материала | Автореферат |
- «Научный центр акушерства, гинекологии и перинатологии имени академика В. И. Кулакова», 455.15kb.
- Сравнительная характеристика клинико-лабораторных и спектроскопических данных при различных, 231.26kb.
- Клинико-генетическая характеристика преэклампсии 03. 00. 15 Генетика 14. 00. 01- акушерство, 260.13kb.
- Дифференцированный подход к лечению больных с различными клиническими фенотипами синдрома, 1067.56kb.
- Клинико-морфологическая характеристика изменений эутопического и эктопического эндометрия, 417.6kb.
- Синдром гиперстимуляции яичников в программе экстракорпорального оплодотворения. Клиническое, 882.52kb.
- Макарищев Алексей Яковлевич клиническое значение сосудистого эндотелиального фактора, 770.69kb.
- Реализация репродуктивной функции при синдроме поликистозных яичников и перитонеальном, 457.62kb.
- Примерная программа наименование дисциплины «акушерство и гинекология» Рекомендуется, 499.66kb.
- Ооловна акушерские и перинатальные исходы у беременных с хронической фетоплацентарной, 304.06kb.
На правах рукописи
ГАБИБУЛЛАЕВА ЗУЛАЙХАТ ГАБИБУЛЛАЕВНА
КЛИНИКО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ С ПРЕЖДЕВРЕМЕННОЙ НЕДОСТАТОЧНОСТЬЮ ЯИЧНИКОВ
14.00.01. – акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2008
Работа выполнена в Федеральном государственном учреждении «Научный центр акушерства, гинекологии и перинатологии имени В.И. Кулакова» в отделении гинекологической эндокринологии и в Государственном учреждении «Медико-генетический научный центр» Российской академии медицинских наук в лаборатории эпигенетики.
^ Научные руководители:
доктор медицинских наук Марченко Лариса Андреевна
доктор биологических наук Немцова Марина Вячеславовна
Официальные оппоненты:
доктор медицинских наук,
профессор ^ Назаренко Татьяна Алексеевна
(ФГУ «НЦАГиП им. В.И. Кулакова)
доктор медицинских наук,
профессор Петрин Александр Николаевич
^ (ГОУ ВПО МГМСУ)
Ведущее учреждение: Российский университет дружбы народов
Защита диссертации состоится 16 сентября 2008 г. в 14.00 ч. на заседании диссертационного совета Д 208.125.01 при ФГУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова»
Адрес: 117997, Москва, ул. Академика Опарина, д. 4
С диссертацией можно ознакомиться в библиотеке ФГУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова»
Автореферат разослан 2008 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук Калинина Елена Анатольевна
^ СПИСОК СОКРАЩЕНИЙ
ДГАС - дегидроэпиандростерон сульфат
ЛГ - лютеинизирующий гормон
МЕ - международные единицы
НЦ АГиП - научный центр акушерства, гинекологии и перинатологии
ПНЯ - преждевременная недостаточность яичников
ПССГ - половой стероидсвязывающий глобулин
Т-тестостерон
Т3- трийодтиронин
Т4 – тироксин
ТГ-тиреоглобулин
ТПО-тиреопероксидаза
ТТГ - тиреотропный гормон
УЗИ - ультразвуковое исследование
ФСГ - фолликулостимулирующий гормон
CDC - центр контроля и профилактики заболеваний
Е2 – эстрадиол
F- кортизол
HLA - главный комплекс гистосовместимости
R – коэффициент Спирмена
RR- относительный риск
SXCI – неслучайная (избирательная) инактивация хромосомы Х
XCI – случайная инактивация хромосомы Х
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Преждевременная недостаточность яичников (ПНЯ) - это симптомокомплекс, характеризующийся вторичной аменореей, симптомами гипоэстрогении и повышением уровня гонадотропинов (ФСГ, ЛГ) у женщин в возрасте до 40 лет [Lamp T., 2000, Nippita T.A., Baber R.J. 2007]. Проведенные эпидемиологические исследования указывают на тесную связь данного заболевания с возрастом. Так у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10 000, а в возрасте от 30 до 40 – 1:1000 [Beck-Peccoz P., Persani L. 2006; Goswami D., Conway G.S. 2007,]. ПНЯ встречается у 10-28% пациенток с первичной аменореей, у 4-18% женщин с вторичной аменореей [Lamp T., 2000; Nobuhiro S., Stephanie A., Rajkovic A., 2007]. Частота ПНЯ в популяции составляет около 1% [Kathryn J.,Wendy W.J. 2006].
Причины ПНЯ гетерогенны и могут быть представлены генетическими, ферментативными, аутоиммунными, инфекционно-токсическими, ятрогенными и психологическими факторами, дефектами в структурах гонадотропинов, а также их сочетанием [Santoro N., 2003; Bione S., 2000; Conway G.S., 2007].
Для нормального функционирования яичников необходимо отсутствие структурных нарушений в обеих хромосомах Х. Основным участком, обеспечивающим нормальную деятельность яичников, является локус Xq13. Гены, ответственные за развитие ПНЯ, обозначают как POF1 и POF2. Они располагаются на участках хромосом Xq21.3-q27, Xq26.1-q27 и Xq13.3-q21.1 соответственно [Krauss C. M., 1987; Powel C. M., 1994]. Полная или частичная делеция в коротком или, чаще, в длинном плече хромосомы Х приводит к развитию первичной или вторичной яичниковой аменореи. Несмотря на представленные в последние годы описания различных генов-кандидатов, лежащих в основе ПНЯ, до настоящего времени генетическая концепция формирования этой патологии не ясна. Во многом это обусловлено тем, что большинство авторов изучают отдельные гены, ответственные за развитие и функционирование яичников. Исследователи анализируют показатели у представительниц определенных национальностей, поэтому результаты нельзя экстраполировать на женщин русской популяции. Клиническая значимость целесообразности проведения у этой категории больных генетических исследований подтверждается проведенными в 2005 и 2006 годах Национальным институтом детского здоровья и развития человека (NICHD) и Центром CDC ряда симпозиумов, на которых обсуждалась роль премутации гена FMR1 в воспроизводстве и ее связь с репродукцией человека [Michael D., Wittenberger M.D, 2007]. У женщин со спорадическими формами ПНЯ частота премутации гена FMR1 колеблется от 0,8 до 7,5%, а при семейных формах заболевания она достигает 13% [Conway G.S.,1998; Bussani C., 2006]. Большинством исследователей признано, что ген FMR1 ассоциирован с истощением яичников [Bretherick, M.R. Fluker, 2005; Sullivan A.K., Marcus M., 2005]. В тоже время существует противоположная точка зрения [Kenneson A., Cramer D.W., 1997]. В литературе описано более 128 пациенток с полной мутацией гена FMR1 и сохраненной функцией яичников [Murray A., Ennis S., 2000].
Случайная инактивация хромосомы Х (XCI) относится к общебиологическому процессу. Однако в ряде случаев происходит неслучайная (избирательная) инактивация хромосомы Х (SXCI) одного из родителей, которая не ассоциируется с развитием какой-либо видимой патологии. Частота неслучайной инактивации хромосомы Х (SXCI) в популяции оценивается 1,5-3,5% [Gale et. al., 1997; Plenge et. al., 1997; Lanasa et. al., 1999]. В последние годы изучена связь неслучайной инактивации хромосомы Х с преждевременным истощением яичников. Ее частота при данной патологии колеблется от 20 до 54,2% и зависит от национальной принадлежности изучаемой популяционной группы [Sato K., Uehara S., et. al., 2004г.].
Все выше изложенное указывает на необходимость широкомасштабного молекулярно-генетического обследования россиянок для получения национальной базы данных о частоте распространенности премутации гена FMR1 и неслучайной инактивации хромосомы Х. Несмотря на актуальность проблемы и широкую распространенность данной патологии, в настоящее время не разработана тактика ведения больных с ПНЯ в зависимости от выявленных хромосомных и генных нарушений, не изучены ранние прогностические критерии формирования ПНЯ, а также особенности клинического течения заболевания при семейных и спорадических формах заболевания. Представленные данные позволили сформулировать цель и задачи нашего исследования.
^
Цель исследования
Определить роль наследственной патологии в генезе ПНЯ и разработать ранние прогностические критерии формирования заболевания.
^ Задачи исследования:
- Определить долю больных с яичниковой аменореей в структуре обращаемости в гинекологические отделения НЦА ГиП за 10 лет и выявить среди них больных с идиопатической формой ПНЯ.
- Изучить соотношение спорадических и семейных случаев ПНЯ и проанализировать клиническое течение заболевания у больных с хромосомными (патология кариотипа) и молекулярно-генетическими формами заболевания.
- Исследовать кариотип у больных с ПНЯ и определить долю структурных аберраций хромосомы Х.
- Определить частоту неслучайной инактивации хромосомы Х (SXCI) у больных с ПНЯ.
- Выявить представленность премутации гена FMR1 у больных с ПНЯ.
- На основании полученных клинико-лабораторных данных разработать структуру причин, приводящих к ПНЯ, и выявить долю идиопатической формы заболевания.
- Разработать прогностические критерии формирования преждевременной недостаточности яичников.
^ Научная новизна
Представлены основные причины истощения фолликулярного пула у больных с ПНЯ на основании комплексного системного подхода с использованием «больших» критериев диагностики аутоиммунной формы ПНЯ, современных методов оценки овариального резерва и расширенной панели генетических исследований (цитогенетическое исследование, SXCI и премутация гена FMR1).
Выделены наиболее прогностически значимые гормональные и генетические маркеры, характеризующие анатомо-функциональное состояние яичников, и установлена их роль в раннем прогнозировании формирования ПНЯ.
Изучено соотношение спорадических и семейных форм ПНЯ, уточнены особенности клинического течения заболевания у пациенток с молекулярно-генетическими причинами. Впервые представлены данные о преимущественном носительстве у этой группы больных HLA генотипа DRB1*11 в сочетании с аутоиммунным тиреоидитом.
У каждой четвертой больной выявлена SXCI. Премутация гена ^ FMR1 обнаружена в 1,5% случаев при спорадической форме ПНЯ. Прослежена связь между увеличением числа CGG-повторов в гене FMR1 в пределах «серой зоны» от 40 до 50 копий и формированием ПНЯ.
Модифицирована формула Faddy для определения предполагаемого возраста воздействия повреждающего фактора на яичник.
Данными о выявленных структурных аберрациях хромосомы Х и мутациях, сцепленных с хромосомой Х, дополнены прогностические критерии формирования ПНЯ.
^ Практическая значимость
Расширен алгоритм обследования больных с ПНЯ: в традиционный гормональный мониторинг, HLA-генотипированию, ультразвуковую и гормональную диагностику овариального резерва включены молекулярно-генетические маркеры, сцепленные с патологией хромосомы Х – цитогенетическое исследование, выявление SXCI и премутации гена FMR1.
На основании анализа результатов обращаемости в гинекологические отделения НЦА ГиП изучена структура гипергонадотропных аменорей, показана высокая распространенность преждевременной недостаточности яичников среди больных с другими формами вторичных аменорей.
Установлено, что среди основных причин, способствующих формированию ПНЯ, хромосомные (патология кариотипа) и молекулярно-генетические нарушения составляют 32,1%. Низкий уровень мозаицизма и «недостаточность генов» хромосомы Х в виде моносомии или полисомии у 5,6% больных встречается с одинаковой частотой. Молекулярно-генетические причины, ассоциированные с преждевременным истощением фолликулярного пула яичников, у 25% больных представлены SXCI. Частота выявления SXCI не ассоциирована с возрастом пациенток и семейными формами заболевания. Премутация гена FMR1 выявляется крайне редко (1,5%).
Дополнены и уточнены ранние прогностические критерии формирования ПНЯ, к которым следует относить аномалии кариотипа, выявление SXCI, увеличение CGG- повторов в гене FMR1, включая «серую зону», носительство DRB1*01, DRB1*03, DQB1*0501, DQB1*0302 аллелей, преждевременную недостаточность яичников у матерей наших пациенток, аутоиммунный тиреоидит и олигоменорею с менархе, перенесенные эпидемический паротит и краснуху. Носительство у каждой второй пациентки HLA генотипа DRB1*11, указание на позднее менархе, наличие аутоиммунного тиреоидита, редкое до дебюта заболевания наступление спонтанных беременностей, являются преимущественными факторами риска формирования генетических форм ПНЯ.
^
Положения, выносимые на защиту
1. В структуре гипергонадотропных аменорей преждевременная недостаточность яичников встречается у каждой пятой больной. Для больных с преждевременной недостаточностью яичников характерна наследственная предрасположенность с более ранним (на 9 лет) дебютом заболевания у сибсов. При спорадической форме заболевания истощение фолликулярного аппарата развивается достоверно раньше, чем при семейной форме. Перенесенные в период пубертата вирусные инфекции оказывают отсроченное повреждающее воздействие на яичник.
2. Преждевременная недостаточность яичников относится к мультифакториальной патологии, в генезе которой значительная роль принадлежит молекулярно-генетическим и/или аутоиммунным нарушениям. Генетические причины представлены в основном хромосомной патологией (патология кариотипа) и мутациями генов, локализованных на хромосоме Х.
3. При выявлении факторов риска формирования преждевременной недостаточности яичников с целью своевременной реализации репродуктивной функции и повышения качества жизни еще на доклиническом этапе развития заболевания показано динамическое мониторирование овариального резерва с использованием гормональных (ФСГ, Е2, ингибин В) и инструментальных (эхография яичников) методов обследования. Наличие достоверных маркеров его снижения требует раннего назначения заместительной гормональной терапии.
^ Апробация работы
Основные положения диссертации и результаты работы доложены на конгрессе «Современные технологии в диагностике и лечении гинекологических заболеваний» (Москва, 2007) и IX Российском научном форуме «Мать и дитя» (Москва, 2007). Работа обсуждена на клинической конференции сотрудников отделения гинекологической эндокринологии ФГУ «НЦ АГиП им. В.И.Кулакова Росмедтехнологий» 06.03.08. и заседании апробационной комиссии ФГУ «НЦ АГиП им. В.И.Кулакова Росмедтехнологий» 24.03.08.
Внедрение результатов исследования в практику
Комплексное обследование, включающее использование иммунологических и молекулярно-генетических методов исследования у пациенток с ПНЯ внедрены в клиническую практику работы отделения гинекологической эндокринологии и научно-поликлинического отделения ФГУ «НЦ АГиП им. В.И.Кулакова Росмедтехнологий». Материалы диссертации используются при чтении лекций по гинекологической эндокринологии.
По теме диссертации опубликовано 13 научных работ.
^ Структура и объем диссертации
Диссертация изложена на 164 страницах компьютерного текста; состоит из введения и 5 глав (обзор литературы, материалы и методы исследования, клиническая характеристика больных, результаты собственных исследований, обсуждение полученных данных), а также выводов, рекомендаций для внедрения в практику здравоохранения и списка литературы. Работа иллюстрирована 23 таблицами и 12 рисунками. Использованная литература включает 20 источников на русском и 208 на английском языках.
^ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
В соответствии с поставленной целью и задачами исследования в ходе выполнения работы проанализированы 36 180 историй болезней пациенток, проходивших лечение в гинекологических отделениях НЦ АГиП с 1994 по 2003г, а также обследовано 199 женщин, у 72 из которых в возрасте от 18 до 40 лет (средний возраст 34,2±1,3 года) диагностирована ПНЯ.
Группы контроля были представлены:
- 97 женщинами русской национальности - доноров крови, для
исследования возможных ассоциаций ПНЯ с системой HLA-II
класса;
- 15 здоровыми фертильными женщинами аналогичной возрастной
группы;
- 15 женщинами в постменопаузе.
Критерии включения в исследование: возраст женщин от 18 до 40 лет, уровень ФСГ 40 МЕ/л в двух определениях, отсутствие самостоятельных менструаций 6 и более месяцев.
Критерии исключения из исследования: первичная гипергонадотропная аменорея, тяжелые наследственные заболевания (галактоземия, блефарофимоз), ятрогенные причины гипергонадотропной аменореи (операции на яичниках, химиотерапия, лучевая терапия).
Пациенток обследовали с использованием комплекса современных и наиболее информативных методов исследования. Общеклиническое обследование проводили по стандартной схеме, используемой в НЦ АГиП, предусматривающей тщательное изучение семейного анамнеза, объективное гинекологическое исследование, клинический анализ крови. Уровни гормонов (ФСГ, ЛГ, ТТГ, Е2, тестостерона, ингибинов В, ПССГ, F, ДГАС, 17-ОП, Т3, Т4 СВ) определяли методом ИФА с помощью соответствующих тест-систем на автоматическом анализаторе «Cobar Core II». Аутоантитела к антигенам яичника определяли методом непрямого иммуноферментного анализа (ELISA), к антигенам щитовидной железы – методом ИФА по стандартной методике. Распределение антигенов главного комплекса гистосовместимости (HLA) II класса изучали методом ПЦР. Кариотип исследовали по методу Seabright. Неслучайную инактивацию хромосомы Х определяли с помощью метилчувствительной количественной флуоресцентной полимеразной цепной реакции (МЧ-КФ-ПЦР). Для определения числа копий гена FMR1 (премутация FRAXA) использовали метод метил-специфической ПЦР. Исследование генов SRY, AMG для определения участков Y–хромосомы проводили методом мультилокусной ПЦР. Анализ популяционного состава лимфоцитов (CD3+, CD4+, CD8+, CD16+, CD19+) проводили на проточном цитофлуориметре фирмы «Becton Dickenson» с использованием меченных ФИТЦ антител к поверхностным антигенам мононуклеарных клеток периферической крови. Иммуноглобулины классов А, G, M в сыворотке венозной крови определяли методом радиальной иммунодиффузии по Манчини (1966). Трансвагинальное ультразвуковое исследование органов малого таза проводили на аппарате «Aspen» («Acuson», США). УЗИ щитовидной и молочных желез выполняли на том же аппарате при помощи мультичастотного линейного датчика (8-10 МГц). Лапароскопию проводили с использованием инструментальной техники фирмы «Carl Storz». Производили гистологическое исследование биоптата ткани яичников. Для оценки качества жизни пациенток использовали анкету MENQOL (Hilditch J.R., 1996).
С целью купирования дефицита половых гормонов назначали заместительную гормональную терапию: 2 мг эстрадиол валерата и 10 мг медроксипрогестерона ацетата в циклическом непрерывном режиме в течениие 12 мес (препарат дивисек, «Орион Фарма», Финляндия). Пациенткам с манифестной формой гипотиреоза (22,2%) назначали терапию L- тироксином в дозе 1,6-1,8 мкг/кг.
Статистическая обработка данных выполнена на компьютере PC IBM (США) с помощью электронных таблиц «Microsoft Excel» и пакета прикладных программ «Statistica for Windows» v. 7.0, StatSoft Inc. (США).
^ Результаты исследования и их обсуждение
На первом этапе работы ретроспективно была изучена частота представленности различных клинических форм ПНЯ среди гинекологических заболеваний у пациенток, обратившихся в НЦ АГиП за десятилетний период (с 1994 по 2003 г). Просмотрено 36 180 историй болезни и отобраны документы 249 пациенток в возрасте до 40 лет, с уровнем ФСГ 40 МЕ/л и выше, отсутствием самостоятельных менструаций 6 месяцев и более.
Диагноз дисгенезии гонад был верифицирован у 108 девочек, синдром постовариоэктомии - у 97 больных и преждевременная недостаточность яичников - у 44 пациенток. Таким образом, доля больных с первичной и различными формами вторичной яичниковой недостаточности составила 0,7%. Структура гипергонадотропной аменореи в 43% случаев была представлена различными формами дисгенезии гонад, в 39%- синдромом постовариоэктомии и в 18%-преждевременной недостаточностью яичников. Полученные нами данные соответствуют международным показателям, согласно которым больные с ПНЯ в структуре вторичных аменорей составляют от 10 до 20% случаев [Conway G.S., Goswami D., 2007].
На втором этапе работы проведено проспективное клинико-лабораторное обследование 72 пациенток с ПНЯ (средний возраст 34,2±1,3 года, средняя продолжительность заболевания 5,2±0,4 года, возраст дебюта заболевания -28,7±1,2 года).
При тщательном изучении семейного анамнеза у 23 (31,9%) матерей наших пациенток отмечено несвоевременное выключение функции яичников. У 11/23 (15,3%) матерей преждевременная недостаточность яичников возникла в возрасте до 40 лет, при этом средний возраст выключения функций яичников у матерей составил 38,4±1,4 года, а у дочерей 29,7±2,6. У 12/23 (16,7%) матерей отмечена ранняя менопауза (до 45 лет). В этом случае средний возраст выключения функций яичников у матерей составил 42,2±0,2 года, а у дочерей 32,8±3,4. Возраст истощения фолликулярного аппарата у дочерей (сибсов), согласно нашим данным, опережал возраст начала заболевания их матерей (пробандов) в среднем по группе на 9,1±1,9 года (p<0,05).
При анализе особенностей клинического течения заболевания и антропометрических показателей у пациенток с семейными и спорадическими формами ПНЯ нами не было найдено статистически значимых различий. Однако для пациенток со спорадической формой ПНЯ характерен более молодой возраст дебюта заболевания 23,4±1,8 года по сравнению с семейным вариантом 31,2±3,3 года (р<0,05).
При изучении преморбидного фона у 52,8% больных с ПНЯ обращал на себя внимание высокий инфекционный индекс (более 3 инфекций в детском возрасте) (Богданова Е.А., 2000). При этом частота перенесенной краснухи (43,1%) и эпидемического паротита (55,6%) в 3 и 1,7 раза соответственно, превышала популяционные данные. Возможно, девочки, переболевшие эпидемическим паротитом, параллельно бессимптомно переносили диффузный оофорит, при котором в результате ускоренного апоптоза в яичнике произошла преждевременная утрата фолликулярных структур с исходом в фиброз. Нами проведена модификация расчета по формуле Faddy, на основании которого, зная возраст прекращения менструальной функции, можно рассчитать предположительный возраст воздействия на яичник повреждающего агента: Х=(у-27)*0,6+14, где Х - возраст воздействия повреждающего агента, у - возраст выключения функций яичников. Согласно полученным нами результатам средний возраст выключения функций яичников у наших пациенток составил 28,7± 1,2 года, следовательно, возраст воздействия повреждающего фактора можно представить формулой Х=(28,7-27)*0,6+14, где Х= 15±0,7 года. Из анамнеза известно, что 98,7% наших пациенток в этом возрасте сталкивались с различной вирусной инфекцией, что еще раз подтверждает значимость преморбидного фона в генезе ПНЯ. Выше представленные расчеты показывают, что от момента воздействия повреждающего фактора до дебюта заболевания проходило около 13 лет.
Из перенесенных экстрагенитальных заболеваний обращает на себя внимание значительная частота заболеваний аутоиммунного генеза. Из 72 больных у 3 пациенток (4,2%) синдром истощения яичников сочетался с ревматоидным артритом, у 10 (13,9%) – с аутоиммунным тиреоидитом, у 2 (2,8%) – с витилиго, у 1 (1,4%) – с миастенией, у 1 (1,4%) – с эозинофильным геморрагическим гранулематозным васкулитом. Таким образом, нами выявлено частое сочетание ПНЯ с аутоиммунными заболеваниями как эндокринного, так и неэндокринного генеза.
При анализе характера менструальной функции у пациенток с ПНЯ было установлено, что возраст менархе в целом по группе составил 13,1±1,3 года, при этом у 83,3% больных менструации были регулярными. Нарушения по типу олигоменореи с менархе отмечены у 16,7% больных. У большинства больных в начале заболевания прогрессировали задержки менструаций. Внезапное прекращение менструаций происходило крайне редко (в 8,3% случаев).
При анализе характера репродуктивной функции было установлено, что у 28 (38,9 %) из 72 пациенток с ПНЯ имели в анамнезе роды, аборты и самопроизвольные выкидыши. Среди нерожавших пациенток аборты встречались у 9/72 (12,5%). Таким образом, до начала заболевания фертильность была сохранена у 37/72 (51,4%) женщин с ПНЯ, т.е. практически у каждой второй пациентки.
К моменту проведения исследования длительность заболевания по группе составила 5,6±1,2 года, возраст начала заболевания - 26,8±1,6 года, возраст дебюта нарушений ритма менструаций приходился на 28,7±2,2 года.
Вазомоторные и эмоционально-вегетативные проявления в виде жалоб на приливы «жара», сердцебиение, повышенную утомляемость отмечены у 76,4% больных. Выраженность симптомов дефицита половых гормонов согласно индексу Куппермана (14,1±1,7 балла) и по оценке качества жизни с помощью анкеты MENQOL (вазомоторные симптомы 10,2±1,9, психологические симптомы 26,5±5,2, физическая сфера 32,4±6,43, сексуальная сфера 7,9±1,7 балла) расценивалась как среднетяжелая.
В процессе дальнейшего этапа обследования было проведено гормональное, иммунологическое и ультразвуковое исследование.
Средний уровень ЛГ и ФСГ у больных с ПНЯ значительно превышал нормативные показатели для женщин репродуктивного возраста, составляя 89,4±5,5 и 105,5±4,7 МЕ/л, соответственно. Концентрация эстрадиола была значительно ниже нормативных показателей ранней фолликулярной фазы у женщин с регулярными менструациями и составила 75,3±6,1 пмоль/л, при этом у 48/72 (66,7%) пациенток уровень эстрадиола не превышал 70 пмоль/л и в среднем составил 51,6± 11,4 пмоль/л. Полученные результаты согласуются с данными литературы (Doldi N., 1998; Falsetti L., 1999). Следует отметить, что в среднем по группе у женщин с ПНЯ уровень тестостерона составил 0,9±0,1 нмоль/л, а у 61,1% больных варьировал от 0,1 до 0,9 нмоль/л (среднее значение 0,54±0,03 нмоль/л), что расценивается как стойкое гипоандрогенное состояние. Концентрация ДГАС у пациенток с ПНЯ также была достоверно снижена по сравнению с группой контроля (4,9±0,5 против 8,3±2,1 нмоль/л), но при этом оставалась в пределах нормы. Уровни остальных гормонов (кортизол, 17-ОП, ПССГ) достоверно не отличались от показателей контрольной группы.
Нами изучена роль ингибинов В у больных с ПНЯ. В ходе исследования выявлено, что концентрация ингибина В снижена более, чем в 7,6 раз (10,4±1,13 пг/мл) по сравнению с его содержанием у женщин с сохраненным ритмом менструаций (80,1±12,0 пг/мл, р<0,05), что достоверно свидетельствует о снижении овариального резерва и подтверждается полученными нами данными эхографии и гистологического исследования биоптата яичников.
В сыворотке крови 72 больных с ПНЯ методом ELISA мы определили аутоантитела к яичниковому антигену. Результат считался положительным при уровне аутоантител выше 11Е/мл. Аутоантитела к яичниковому антигену были выявлены нами у 11 из 72 пациенток, т.е. в 15,2% случаев.
Антитела к ТПО выявлены у 22,7% больных с ПНЯ, антитела к ТГ – у 27,8% обследованных. Антитела к ТПО и ТГ одновременно присутствовали у 16,6% женщин с ПНЯ, что совпадает с данными отечественных и зарубежных авторов [Александрова Н.В., 2006; Moraes R.M., Blizzard R.M., 1992]. Следует особо подчеркнуть, что повышенный уровнь антитиреоидных антител не позволяет ставить знак равенства в отношении развития у этих больных аутоиммунного тиреоидита. Согласно «большим» диагностическим признакам аутоиммунный тиреоидит был подтвержден у 10 (13,9%) наших пациенток (ТТГ 7,1±1,2 мМЕ/л и Т4св 4,0-12,3 нмоль/л). Манифестная форма гипотиреоза (одновременное повышение ТТГ и снижение Т4 св.) была у 16 из 72 пациенток, что составляет 22,2%. Субклиническая форма гипотиреоза (повышение уровня ТТГ в сочетании с нормальным уровнем Т4св. в крови) обнаружена у 4/72 (5,6%) пациенток. Следовательно, у 27,8% пациенток с ПНЯ выявлены существенные изменения функции щитовидной железы.
У больных с ПНЯ выявлена тенденция к повышению содержания СD3+, CD4+ (Т-лимфоцитов-хелперов) по сравнению группой контроля (р<0,05), при нормальных значениях концентрации CD8+ (Т-лимфоцитов киллеров/супрессоров) и иммунорегуляторного индекса (CD4+/CD8+). Относительное содержание естественных киллеров (CD16+), В-лимфоцитов (CD19+) и сывороточных иммуноглобулинов у женщин с ПНЯ было достоверно ниже, чем у женщин в контрольной группе (р<0,05).
Анализ распределения HLA II класса у 60 (83,3%) пациенток с ПНЯ свидетельствует о том, что различия в распределении аллелей гена DRB1 у больных с ПНЯ наиболее выражены для аллелей DRB1*01 и DRB1*03. Частота аллеля DRB1*01 у больных с ПНЯ составила 28,3%, аллеля DRB1*03 - 30,0%, что достоверно выше результатов, полученных в группе контроля (13,4 и 14,4% соответственно) (р<0,05). Показатель относительного риска (RR) равнялся 2,11, и 2,08, соответственно.
В распределении аллелей гена DQB1 также выявлены различия. С наибольшей частотой у больных с ПНЯ встречались аллели DQB1*0302 (21,7%) и DQB1*0501 (31,7%) - в контрольной группе 11,3 и 17,5%, соответственно (р<0,05). Для аллеля DQB1*0302 показатель RR составил 2,16, а для аллеля DQB1*0501 – 1,81.
При трансвагинальной эхографии органов малого таза средний объем правого яичника у пациенток с ПНЯ составил 1,9±0,3 см3 (1,8×1,2×1,7 см3), левого – 1,8±0,2 см3 (1,7×1,2×1,6 см3). По данным S. Kupesic и A. Kurjak (1997), у пациенток с преждевременной менопаузой объем яичников существенно снижен и не превышает 2 см3.
У пациенток с ПНЯ яичниковые аутоантитела и дополнительные маркеры аутопроцесса, к которым относятся изменения в субпопуляции Т-лимфоцитов, ассоциированные с другими неэндокринными заболеваниями и эндокринопатиями аутоиммунной природы, подтвержденные определенными аллельными вариантами HLA II класса, позволили нам утверждать об аутоиммунном генезе ПНЯ у 15,2% больных. Эти изменения были обнаружены на фоне сниженного овариального резерва, который подтверждался высоким уровнем гонадотропинов (ФСГ 105,5±4,7 МЕ/л), резким снижением уровня ингибина В (10,4±1,13 пг/мл) и уменьшением объема яичников менее 2см3.
Таким образом, генез заболевания оставался неясным у 84,8% больных, что явилось основанием для расширения панели исследования с целью выявления возможных хромосомных и генных дефектов.
Нормальный женский кариотип выявлен у 68 пациенток (94,4%). Низкий уровень мозаицизма при кариотипировании был обнаружен у двух больных (2,8%) (46,ХХ/45,Х/47,ХХХ; 46,ХХ/45,Х/47,ХХХ/48,ХХХХ). В одном случае (1,4%) обнаружен моносомный вариант кариотипа 45,Х. Эта пациентка имела характерный фенотип и отвечала всем лабораторным критериям синдрома Шерешевского-Тернера. Уровень ФСГ был равен 121,0 МЕ/л; Е2- 48,0 пмоль/л; Т-0,4 нмоль/л; ТТГ-4,3 мМЕ/л; Т3- 1,0 пмоль/л; Т4св- 24,2 пмоль/л; АТ к ТТГ-3646,0 МЕ/л; АТ к ТРО-29,7 МЕ/л. У нее выявлены ультразвуковые признаки аутоиммунного тиреоидита, кроме того она страдала тяжелыми пороками сердца и почек. В тоже время в отличие от классической формы заболевания у данной пациентки до 30 лет наблюдался регулярный ритм менструаций.
Помимо варианта моносомии нами описан второй в мире случай полисомии по хромосоме Y, аналогичной синдрому Клайнфелтера у женщины с функционирующими до 24 лет яичниками. Цитогенетическое исследование и FISH анализ лимфоцитов свидетельствовали о наличии у этой больной в 98,1% клеток XXY хроматина и в 1,9% клеток XY хроматина. При анализе генов SRY, AMG методом ПЦР показал отсутствие у нее SRY гена, что позволяет предполагать развитие из бипотенциальной гонады нормальной яичниковой ткани у пациентки с кариотипом 47,XXY. Данный казуистический случай, по- видимому, можно объяснить отсутствием у пациентки SRY гена, ответственного за развитие тестикул по мужскому типу при наличии в кариотипе хромосомы Y. При двусторонней биопсии яичников выявлены гистологические структуры яичниковой ткани - белые тела, свидетельствующие о ранее имевших место овуляциях, утолщенная белочная оболочка, отсутствие примордиальных фолликулов. Отсутствие SRY гена позволило нам сохранить гонады этой пациентке. По данным литературы, риск развития тестикулярных опухолей при наличии хроматина Y не превышает 5-6% [Пищулин А.А., 1999; Ahmed S.F., 2000] и связан с клиническими проявлениями вирилизации или феминизации. У данной пациентки признаков вирилизации не выявлено, уровень тестостерона составлял 1 нмоль/л.
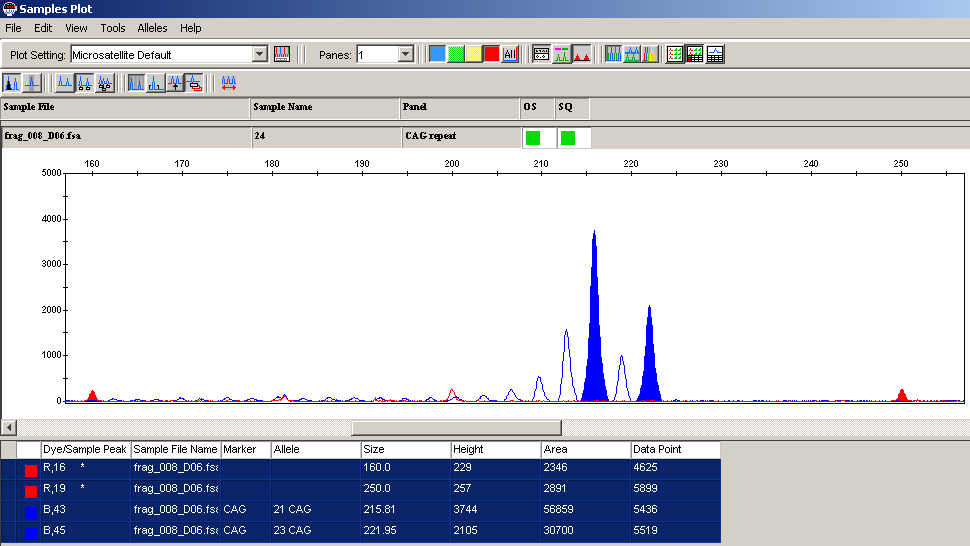
Одной из наиболее важных для поддержания функционирования яичников областей на хромосоме Х является локус Xq13, ассоциированный с набором генов, обозначаемых как POF2. В этой же области предположительно находится центр инактивации хромосомы Х (XCI). Исключив женщин с аберрациями хромосомы Х, мы определили Х-инактивационный статус у 68 пациенток с нормальным кариотипом. При этом только 60 женщин (87,0%) были гетерозиготны (информативны) по полиморфизму CAG-повтора гена андрогенного рецептора и могли быть включены в исследование. Для оценки неслучайной инактивации хромосомы Х (SXCI) мы использовали пороговый уровень, классифицируемый как ≥70% (рис.1). Частота случаев SXCI у обследованных нами женщин с ПНЯ составила 25,0%, в то время как в популяции, по данным Gale et. al., 1997; Plenge et. al., 1997; Lanasa et. al., 1999, этот показатель находится в пределах от 1,5-3,5%. Полученные нами результаты в 7,5 раз превышают данные популяции.
а) Аллель 21(CAG)
Аллель 23(CAG)



в) Метилированный аллель 21(CAG)
Неметилированный аллель 23(CAG)
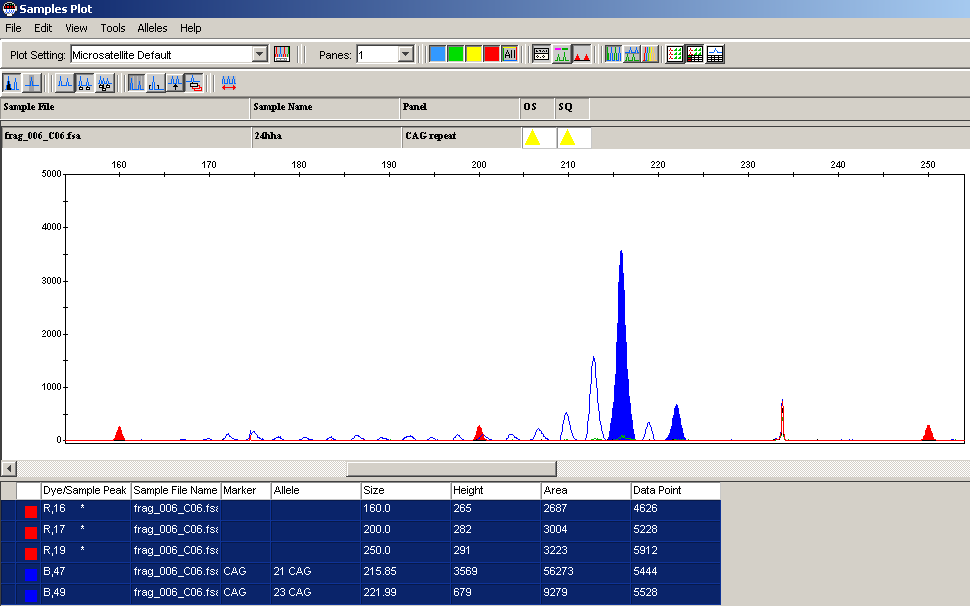
Рис.1. Амплификация с нативной геномной ДНК в норме (а) и при неслучайной инактивации хромосомы Х (SXCI) (в).
Основываясь на данных о возможном повышении частоты SXCI с возрастом, мы рассмотрели возраст пациенток с выявленной SXCI и по группе в целом (35,1±1,9 и 34,2±1,3 года; р>0,05), при этом достоверных статистических различий не выявлено. Частота SXCI при семейных формах составила 20% (3/15), при спорадических формах ПНЯ – 80% (12/15), р<0,05. Таким образом, представленность неслучайной инактивации хромосомы Х не ассоциируется с возрастом и семейными формами ПНЯ и является результатом генетических нарушений, которые избирательно инактивируют хромосому Х и приводят к недостаточному функционированию генов, задействованных в формировании и развитии адекватного фолликулярного пула яичников.
Изучение более мелких делеций хромосомы Х, приводящих к развитию ПНЯ, позволило выявить локус Xq26-28 как место расположения гена FMR1, мутации которого также могут отвечать за преждевременное выключение функции яичников [Bates A., Howard P.J., 1990]. Однако в процессе многочисленных исследований стало очевидно, что снижение фолликулярного резерва сопряжено только с частичной (пре) мутацией этого гена [Conway G.S., Hettiarachchi S., 1995]. Для выявления премутации гена FMR1, нами изучены образцы крови 68 пациенток. В популяции у женщин с сохраненной функцией яичников среднее число CGG - повторов в гене FMR1 составляет от 29 до 30. Более 50 копий CGG-повторов при гетерозиготном носительстве нами выявлено только в одном случае и было представлено соотношением аллельных вариантов 32/51 (рис.2). Таким образом, премутация гена FMR1 обнаружена в 1,5% случаев у пациентки со спорадической формой заболевания, что указывает на вариант нестабильной генной мутации хромосомы Х. Полученные нами данные соответствуют результатам других исследователей, в которых при спорадических вариантах ПНЯ частота премутации гена FMR1 составляла от 0,8 до 7,5% [Bussani C., Papi L., 2004]. У остальных 67 больных, как со спорадическими, так и с семейными формами ПНЯ в 9,8% случаев число CGG - повторов в гене FMR1 колебалось от 40 до 50, что согласно данным международных исследований, попадает в так называемую «серую зону», которая ассоциирована с повышенным риском развития ПНЯ. Выявление носительниц дупликации нуклеотидной последовательности в пределах «серой зоны» приобретает особую значимость, так как у их потомства в последующих поколениях крайне высок риск формирования пре- и полной мутации гена FMR1.


Рис.2. Премутация гена FMR1
Таким образом, на основе проведенных нами молекулярно-генетических исследований структура причин приводящих к ПНЯ представлена в 5,6% случаев хромосомными аномалиями (патология кариотипа), в 26,5% - молекулярно-генетическими (SXCI, премутация гена FMR1) и в 15,2% случаев аутоиммунными нарушениями. На долю идиопатической формы ПНЯ приходится 52,7%.
Согласно нашим данным десятикратное повышение уровней ФСГ, ЛГ, низкий уровень Е2, семикратное снижение уровня ингибина В, а также низкие показатели Т и объем яичников менее 2 см3 свидетельствуют об уже свершившемся истощении фолликулярного аппарата яичников. Именно поэтому данные показатели нельзя использовать в качестве прогностических критериев формирования ПНЯ.
От воздействия на яичник повреждающего агента до его полного истощения, рассчитанного с помощью представленной выше формулы Faddy, проходит в среднем около 13 лет. Это позволяет на доклиническом уровне осуществить программу вмешательства, направленную на своевременную реализацию репродуктивной функции и повышении качества жизни больных с ПНЯ. Однако для этого необходимо четко знать факторы риска и ранние прогностические критерии, предвещающие наступление преждевременной менопаузы.
Как показали наши исследования, среди факторов риска формирования ПНЯ можно назвать: ПНЯ у матерей пациенток (R=8,33), аутоиммунный тиреоидит (R=4,5) и олигоменорею с менархе (R=3,6), перенесенный эпидемический паротит (R=2,88) и краснуху (R=2,82), носительство DRB1*01, DRB1*03, DQB1*0501, DQB1*0302 аллелей HLA- II класса (R=2,11, 2,08, 1,81, 2,16 соответственно), обнаружение которых требует обязательного проведения генетических исследований, включающих кариотипирование, выявление неслучайной инактивации хромосомы Х и премутации гена FMR1. К преимущественным факторам риска, указывающим на генетическую природу ПНЯ, следует относить позднее менархе, редкое наступление спонтанных беременностей до дебюта заболевания, носительство DRB1*11 аллеля (у каждой второй пациентки), наличие аутоиммунного тиреоидита.
Всем 72 пациенткам с ПНЯ для купирования ранних, а в ряде случаев и поздних симптомов дефицита половых гормонов назначалась заместительная гормональная терапия препаратом, содержащим 2 мг эстрадиол-валерата и 10 мг медроксипрогестерона ацетата (дивисек). После 12 мес лечения дивисеком индекс Куппермана снизился с 14,1±1,7 до 4,9±1,4 балла (p<0,05). Показатели качества жизни по результатам анкеты MENQOL улучшились, что проявилось снижением вазомоторных симптомов с 10,2±1,9 до 2,0±0,3 балла, психологических симптомов с 26,5±5,2 до 12,9±3,2 балла и сглаживанием нарушений в физической (с 32,4±6,4 до 14,1±2,5 балла) и сексуальной сферах (с 7,9±1,7 до 2,3±1,4 балла). Полученные нами данные свидетельствовали об адекватном восполнении дефицита половых гормонов и подтверждались результатами гормональных исследований: уровень ЛГ снизился почти в 2 раза (с 89,4±5,5 до 50,5±10,8 МЕ/л) р<0,05, ФСГ – более чем в 2 раза (с 105,5±4,7 до 46,4±9,5 МЕ/л) р<0,05. Одновременно с падением содержания гонадотропинов уровень Е2 вырос в 3,3 раза (с 75,3±6,1 до 250,2±32,1 пмоль/л) р<0,05. На фоне терапии мы добились также повышения уровня тестостерона примерно на 20% (с 0,9±0,1 до 1,2±0,4 нмоль/л) p<0,05.
В нашем исследовании манифестная форма гипотиреоза выявлена у 16 (22,2%), а субклиническая - у 4 (5,6%) пациенток. Основываясь на рекомендациях как отечественных, так и зарубежных эндокринологов о восполнении дефицита тиреоидных гормонов L-тироксином, лечение было назначено только 16 пациенткам с манифестной формой заболевания в дозе 1,6-1,8 мкг/кг. Во всех случаях нам удалось добиться нормализации уровня ТТГ и установления эутиреоидного состояния у больных с ПНЯ (ТТГ 3,3±0,5 мМЕ/л).
Таким образом, в процессе проведенного нами исследования причины ПНЯ уточнены в 47,3% случаях (из них молекулярно-генетические нарушения - 26,5%, хромосомные - 5,6%, аутоиммунная форма - 15,2%). На долю идиопатической формы заболевания приходится 52,7%. Проведенная нами работа способствовала выделению наиболее значимых факторов риска, предвещающих развитие преждевременной недостаточности яичников, знания о которых на доклиническом этапе развития заболевания позволяет проводить программу вмешательства, направленную на своевременную реализацию репродуктивной функции и повышение качества жизни.
ВЫВОДЫ
- Больные с первичной и различными формами вторичной яичниковой аменореи составляют 0,7% от общего числа госпитализированных пациенток в гинекологические отделения НЦ АГиП за десятилетний период. Структура гипергонадотропной аменореи при этом представлена различными формами дисгенезии гонад-43%, синдромом постовариоэктомии-39%, преждевременной недостаточностью яичников - 18%.
- Семейные формы ПНЯ встречаются у каждой третьей больной. Истощение фолликулярного аппарата у сибсов наступает на 9,1±1,9 года раньше, чем у пробанда. У пациенток со спорадической формой ПНЯ дебют заболевания приходится на более молодой возраст (23,4±1,8 года) по сравнению с семейным вариантом (31,2±3,3 года).
- Возраст воздействия повреждающего агента на яичник у больных с ПНЯ рассчитывается по модифицированной формуле Faddy: Х=(у-27)×0,6+14, где у - возраст наступления вторичной аменореи. У больных с ПНЯ в среднем по группе он составляет 15±0,7 года.
- Преждевременная недостаточность яичников в 5,6% случаев обусловлена различными хромосомными аномалиями (патологией кариотипа), среди которых низкий уровень мозаицизма (46,ХХ/45,Х/47,ХХХ; 46,ХХ/45,Х/47,ХХХ /48,ХХХХ) встречается в 2,8%, анэуплоидия по половым хромосомам – «недостаточность генов» хромосомы Х в виде моносомии (45,Х) – в 1,4% и полисомия (47,ХХY) – в 1,4% случаев.
- Доля женщин с неслучайной инактивацией хромосомы Х при ПНЯ составляет 25%, что в 7,5 раз превышает популяционный показатель. Неслучайная инактивация хромосомы Х у каждой четвертой больной косвенно свидетельствует о молекулярно-генетических нарушениях хромосомы Х. Частота неслучайной инактивации хромосомы Х не ассоциируется с возрастом больных и семейными формами заболевания.
- Премутация гена ^ FMR1 (32/51 CGG-повторов в гене FMR1), обнаруженная в 1,5% случаев при спорадической форме ПНЯ, указывает на вариант нестабильной генной мутации хромосомы Х. Увеличенное число CGG- повторов в гене FMR1 от 40 до 50 в пределах «серой зоны» выявлено у 9,8% больных со спорадической и семейной формами заболевания.
- Структура причин приводящих к ПНЯ представлена в 5,6% случаев хромосомными аномалиями (патология кариотипа), в 26,5% молекулярно-генетическими (XCI, премутация гена FMR1) и в 15,2% аутоиммунными нарушениями. На долю идиопатической формы ПНЯ приходится 52,7%.
- Прогностическими критериями формирования ПНЯ являются: ПНЯ у матерей пациенток (RR=8,33), аутоиммунный тиреоидит и олигоменорея с менархе (RR=8,33), перенесенные эпидемический паротит (RR=2,88) и краснуха (RR=2,82), носительство DRB1*01 (RR=2,11), DRB1*03 (RR=2,08), DQB1*0501 (RR= 1,81), DQB1*0302 (RR=2,16) аллелей HLA- II класса, при выявлении которых показано проведение генетического скрининга, включающего определение кариотипа, исследование неслучайной инактивации хромосомы Х и премутации гена FMR1. На развитие генетических форм ПНЯ указывают позднее менархе, редкое до дебюта заболевания наступление спонтанных беременностей, носительство DRB1*11 аллеля HLA- II класса (у каждой второй пациентки), наличие аутоиммунного тиреоидита.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При сборе семейного анамнеза у пациенток с подозрением на формирование ПНЯ необходимо уделять особое внимание возрасту выключения функции яичников у представительниц 1 и 2-й степени родства, как со стороны матери, так и со стороны отца (мама, бабушка, тетя, двоюродная сестра).
- В связи со значимостью преморбидного фона в генезе развития ПНЯ необходимо выяснять перенесенные в пубертате вирусные инфекции (эпидемический паротит и краснуха), а также аутоиммунные заболевания эндокринного и неэндокринного генеза (тиреоидит, коллагенозы, миастения и т.д.).
- Для установления возраста воздействия повреждающего агента на яичник рекомендуется использовать модифицированную формулу Faddy: Х=(у-27)×0,6+14, где у - возраст наступления вторичной аменореи.
- Для диагностики клинического варианта преждевременной недостаточности яичников кроме стандартных методов обследования, включавших оценку гипоталамо-гипофизарно-тиреоидно-яичниковой системы необходимо исследовать фенотип главного комплекса гистосовместимости II класса, оценить популяционный состав Т и В клеточных звеньев иммунной системы, определить аутоантитела к антигенам яичника и кариотип, а также выявить неслучайную инактивацию хромосомы Х и премутацию гена FMR1.
- К преимущественным факторам риска развития генетических форм ПНЯ относятся: позднее менархе, редкое до дебюта заболевания наступление спонтанных беременностей, носительство DRB1*11 аллеля HLA- II класса (у каждой второй пациентки), наличие аутоиммунного тиреоидита.
- Хромосомные формы ПНЯ могут быть представлены низким уровнем мозаицизма (46,ХХ/45,Х/47,ХХХ; 46,ХХ/45,Х/47,ХХХ /48,ХХХХ), численными нарушениями половых хромосом в виде моносомии (45,Х) и полисомии (47,XXY). Молекулярно-генетические формы включают неслучайную инактивацию хромосомы Х и премутацию гена FMR1.
- При неслучайной инактивации хромосомы Х (SXCI) риск рождения больного сына составляет 50%, а риск рождения больной дочери равен нулю. В половине случаев она может быть гетерозиготной носительницей SXCI, которая фенотипически может проявляться преждевременным выключением функций яичников. Пациенткам с ПНЯ и молекулярно-генетическими нарушениями показана пренатальная диагностика (биопсия хориона) для определения половой принадлежности плода.
- У носительниц премутации гена FMR1 с 56 - 59 CGG-повторами риск рождения больного сына (с синдромом Мартина - Белл) составляет 7%, дочери - 3,5%. Этот показатель увеличивается с увеличением числа CGG-повторов. При 100 повторах риск рождения больного сына составляет 50%, дочери - 25%, в связи, с чем пренатальную диагностику следует проводить более чем при 100 повторах.
^ СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Особенности распределения антигенов HLA II-класса у больных с идиопатической формой преждевременного выключения функции яичников [Текст] / Л.А. Марченко, Г.В. Тагиева, З.Г.Габибуллаева, Г.Т.Сухих // II Российский конгресс по Гинекологической эндокринологии и Менопаузе. материалы конгресса.–М., 2004.- С. 29.
- Current principles of diagnosis of premature ovarian failure [Текст] / Л.А. Марченко, А.И. Гус, Г.В. Тагиева, З.Г. Габибуллаева // The 6th Congress on Womens’s Health&Disease. материалы докладов.-2005.-P. 107.
- Ведение пациенток с преждевременным выключением функций яичников [Текст] / Л.А. Марченко, Н.В. Александрова, А.И. Гус, З.Г. Габибуллаева, Г.В. Тагиева // Лечащий врач.-М.,-2005.-№10-С.28-34.
- Принципы диагностики преждевременного выключения функции яичников [Текст] / Л.А. Марченко, А.И. Гус, Г.В. Тагиева, З.Г. Габибуллаева // Мать и дитя: материалы VII Рос. науч. форума.- М.,-2005.-С.318.
- Прогностические критерии формирования преждевременной недостаточности яичников [Текст] / Л.А. Марченко, Н.В. Александрова, З.Г. Габибуллаева, Л.Б. Бутарева, Н.Д. Фанченко // Практическая гинекология: от новых возможностей к новой стратегии. материалы конгресса. -М.-2006.–С. 313.
- Неслучайная инактивация хромосомы Х в генезе формирования преждевременной яичниковой недостаточности [Текст] / Л.А. Марченко, Д.В. Залетаев, З.Г. Габибуллаева, Д.С. Михайленко // Мать и дитя: материалы VIII Рос. науч. форума.- М., - 2006.-С. 453.
- Преждевременная недостаточность яичников как фактор риска формирования урогенитальных расстройств [Текст] / З.Г. Габибуллаева, Н.В Александрова // Расстройства мочеиспускания у женщин. материалы V Всероссийской конференции. -М.,- 2006.- С.35.
- Роль неслучайной инактивации хромосомы Х в формировании преждевременной недостаточности яичников [Текст] / Л.А. Марченко, Д.В. Залетаев, З.Г. Габибуллаева, Д.С. Михайленко //Гинекология.-М.,- 2006.-Том8, №3-С.40-42.
- Генетическая гетерогенность преждевременного истощения яичников и наследственные факторы ранней менопаузы (обзор литературы) [Текст] / Л.А Марченко, Д.В. Залетаев, З.Г. Габибуллаева, Д.С Михайленко // Проблемы репродукции. -2007.-Том13, № 1, С.6-13.
- Представленность генетических, хромосомных и семейных форм преждевременного выключения функции яичников [Текст] / Л.А. Марченко, З.Г. Габибуллаева, Д.С. Михайленко, Е.Б. Кузнецова, М.В. Немцова // Мать и дитя: материалы IX Рос. науч. форума.-М.,-2007.-С.461–462.
- Сочетание эндометриоза и преждевременной недостаточности яичников: казуистика или закономерность? [Текст] / Л.А. Марченко, Л.Б. Бутарева, З.Г. Габибуллаева, Г.И. Табеева // Современные технологии в диагностике и лечении гинекологических заболеваний. материалы конгресса. -М.,- 2007.-С.240–242.
- Генетические и хромосомные факторы в генезе формирования преждевременной недостаточности яичников [Текст] / Л.А. Марченко, З.Г. Габибуллаева, Г.И. Табеева // Современные технологии в диагностике и лечении гинекологических заболеваний. материалы конгресса.-М.,-2007.С.576 – 578.
- Клинико-лабораторные варианты течения преждевременной недостаточности яичников [Текст] / Л.А. Марченко, З.Г. Габибуллаева, Г.И. Табеева, Л.Б. Бутарева, Н.А. Чернышова // Репродуктивное здоровье: материалы II международного конгресса по репродуктивной медицине.-М.,- 2008.-С.211 – 213.
