Конспект лекций «материаловедение»
| Вид материала | Конспект |
- Конспект лекций по теме: «Материаловедение» для специальности 120100 "Технология, 104.18kb.
- Конспект лекций по теме: «Материаловедение» для специальности 120100 "Технология, 5022.76kb.
- Е. в конспект лекций «материаловедение» ч. 1 конспект, 33.7kb.
- Конспект лекций «материаловедение», 137.13kb.
- Конспект лекций 2008 г. Батычко В. Т. Административное право. Конспект лекций. 2008, 1389.57kb.
- Конспект лекций 2010 г. Батычко Вл. Т. Муниципальное право. Конспект лекций. 2010, 2365.6kb.
- Конспект лекций «материаловедение», 123.26kb.
- Конспект лекций 2011 г. Батычко В. Т. Семейное право. Конспект лекций. 2011, 1718.16kb.
- Конспект лекций 2011 г. Батычко Вл. Т. Конституционное право зарубежных стран. Конспект, 2667.54kb.
- Конспект лекций «материаловедение», 197.98kb.
© СЗТУ кафедра МТМиП, Шадричев Е.В конспект лекций «МАТЕРИАЛОВЕДЕНИЕ» ч.1
Глава 5. ДИАГРАММЫ СОСТОЯНИЯ ДВОЙНЫХ СПЛАВОВ1
В предыдущей теме отмечалось, что в технике используют в основном не чистые металлы, а сплавы различного назначения - конструкционные, инструментальные, с особыми свойствами.
При сплавлении компонентов в зависимости от их природы в сплавах могут образовываться различные кристаллические (твердые) фазы - например, твердые растворы и (или) химические соединения. Причем сплавы одних и тех же компонентов, но различного химического состава (процентного содержания компонентов) могут быть однофазными или двухфазными. Более того, в сплавах, состоящих из одних и тех же двух фаз, их кристаллы могут комбинироваться в различные структурные составляющие, отличающиеся размерами, формой и взаимным расположением зерен. И все эти структурные факторы влияют на свойства сплавов (см. примеры в главе 4).
Сведения о структуре сплавов могут быть получены при анализе диаграмм состояния, которые являются графической формой описания фазовых равновесий (состояний) в сплавах различного химического состава при различных температурах.
Таким образом, можно считать, что диаграммы состояния - «красная нить материаловедения», связывающая воедино состав, структуру и свойства сплавов (см. Введение).
При дальнейшем изучении курса станет очевидным важное практическое значение диаграмм состояния, позволяющих прогнозировать свойства сплавов, определять оптимальные технологии и режимы их обработки.
^ 5.1. ДИАГРАММЫ СОСТОЯНИЯ И ПРАВИЛО ФАЗ ГИББСА
Сплав компонентов А и В данного химического состава в зависимости от температуры может быть жидким или твердым, а будучи твердым - находиться в различном фазовом состоянии. С другой стороны, фазовое состояние может изменяться при неизменной температуре в зависимости от концентрации компонентов (химического состава) в сплавах данной системы (А-В). Для описания фазовых равновесий (а, соответственно, и фазовых превращений) в сплавах различного состава при различных температурах используют диаграммы фазового равновесия, или диаграммы состояния.
Под состоянием понимают наличие тех или иных фаз в сплаве данного состава при определенной температуре. Таким образом, переменными, определяющими состояние сплава, являются температура и химический состав (давление считается неизменным, равным атмосферному).
Число переменных, которые можно независимо изменять без изменения числа фаз Ф в системе из К - компонентов, дается правилом фаз Гиббса
С = К – Ф + 1. (5.1)
В этом выражении С - число независимых переменных или число степеней свободы или вариантность системы. Если, например, С=0 - система нонвариантная, что значит, что ни температуру, ни состав нельзя изменить без того, чтобы не изменилось число фаз, находящихся в равновесий, т. е. не нарушилось бы равновесие. Такой тип равновесия имеет, в частности, место в процессе кристаллизации (или плавления) химических элементов (чистых металлов) - однокомпонентных систем. Действительно, в этом случае С=1-2+1=0, обе степени свободы - температура и состав «заморожены». Отсюда следует хорошо известный, наблюдаемый экспериментально факт, что кристаллизация (плавление) химических элементов происходит при постоянной температуре, По
НЕТ СТР. 60
стых компонентов и возможно большего числа сплавов промежуточного состава. Для определения критических точек обычно используют результаты термического анализа - экспериментального построения кривых охлаждения (нагрева). Критические точки - это точки перегиба на кривых охлаждения (результат выделения (или поглощения) скрытой теплоты фазового превращения).
Покажем это на примере построения диаграммы для случая неограниченной растворимости компонентов в твердом состоянии. Условия, при которых такая растворимость возможна, обсуждались в разделе 4.2.1.
На рис. 5.2 показаны кривые охлаждения чистых компонентов (А и В) и трех сплавов - твердых растворов различного состава - 25, 50 и 75 % В (содержание компонента А=100 % - % В). Вид кривых охлаждения определяется правилом фаз (см. рис. 5.1). Критические точки (обозначены цифрами) переносятся на диаграммное поле в соответствии с химическим составом сплавов и компонентов. Соединяются между собой точки, одинаковые по физическому смыслу. В данном случае - это точки начала кристаллизации, образующие линию ликвидус, выше которой все сплавы находятся а жидком состоянии (Ж), и точки конца кристаллизации, образующие линию солидус, ниже которой все сплавы находятся в твердом состоянии. В рассматриваемом случае все сплавы в твердом состоянии представляют собой твердые растворы переменного состава. Между линиями ликвидус и солидус - двухфазная область Ж+ .
Р
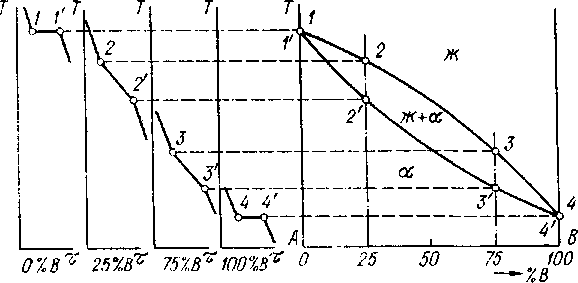
Рис. 5.2. Термический метод построения диаграмм состояния (случай неограниченной растворимости компонентов в жидком и твердом состояниях)
Из этого частного примера наиболее простой диаграммы состояния двойных сплавов можно сделать общий вывод, справедливый для диаграмм состояния любого вида: линии диаграмм состояния - это линии фазовых превращений, разделяющие области существования различных фаз.
В предыдущей главе говорилось о том, что свойства фаз переменного состава (например, твердых растворов) зависят от их химического состава, а свойства двухфазных сплавов определяются в первую очередь относительными количествами этих фаз. Поэтому надо уметь определять химический состав фаз и их относительные количества.
^ 5.3. ОПРЕДЕЛЕНИЕ ХИМИЧЕСКОГО СОСТАВА ФАЗ
Химический состав фазы - это процентное содержание в ней компонентов сплава. В однофазных областях диаграммы состояния (в твердой или жидкой Ж, рис. 5.3, а), т. е. при тех температурах, где весь объем сплава занимает какая-то одна фаза, ее химический состав, естественно, совпадает с составом самого сплава. Например, в сплаве, содержащем 25 % В, химический состав фазы при любой температуре ниже линии солидус будет 25 % В (и 75 % А).
В двухфазной области, например, в сплаве состава X при температуре Тх атомы компонентов А и В распределены как в твердой фазе, так и жидкой.
Для определения химического состава фаз в двухфазной области необходимо через точку, характеризующую состояние сплава (она лежит на пересечении координат температура - состав сплава, т. е. точка а на рис. 5.3, а), провести горизонталь (изотерму) до пересечения с линиями, ограничивающими данную двухфазную область. Проекции точек пересечения на ось абсцисс диаграммы показывают составы соответствующих фаз: точка b' - состав фазы , точка с' - состав фазы Ж2.
Э
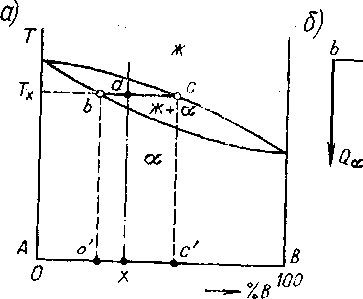 та методика определения химического состава фаз вытекает из правила фаз Гиббса (5.1). Действительно, в двухкомпонентном сплаве (К=2) в двухфазной области (Ф=2), С=1, т. е. имеется лишь одна независимая переменная. Это значит, что выбор одного из параметров (например, температуры Тх) предопределяет величину другого (химический состав фаз: b и с).
та методика определения химического состава фаз вытекает из правила фаз Гиббса (5.1). Действительно, в двухкомпонентном сплаве (К=2) в двухфазной области (Ф=2), С=1, т. е. имеется лишь одна независимая переменная. Это значит, что выбор одного из параметров (например, температуры Тх) предопределяет величину другого (химический состав фаз: b и с).Рис. 5.3. Определение химического состава и относительных количеств фаз в двухфазной области (а); (6) - схема, поясняющая определение относительных количеств фаз с помощью правила отрезков (правило рычага)
Отсюда следует также, что например, при Т=Тx в решетке компонента А может раствориться максимум b (точнее b'} атомов компонента В, или, другими словами, точка b показывает предельно возможное содержание компонента В в фазе при Т =Тх. То же и при других температурах - линия солидус на рис. 5.3,а показывает состав твердой фазы, а линия ликвидус - жидкой фазы, которые могут находиться в равновесии при данной температуре.
Другими словами, линии диаграмм состояния - это не только линии фазовых превращений, но и линии предельной растворимости компонентов.
^ 5.4. ОПРЕДЕЛЕНИЕ ОТНОСИТЕЛЬНЫХ КОЛИЧЕСТВ ФАЗ В
ДВУХФАЗНОИ ОБЛАСТИ («ПРАВИЛО ОТРЕЗКОВ»)
Изотерма, соединяющая составы фаз, находящихся в равновесии при данной температуре (аb при Т = Тx), называется конодой.
Конода используется для определения относительных количеств фаз в двухфазной области (в однофазной - количество данной фазы равно 100 %).
Отрезки коноды между точкой, задающей состояние сплава (точка а, рис. 5.3, а), и точками, определяющими составы фаз, находящихся в равновесии (точки b и с), обратно пропорциональны количествам этих («прилегающих») фаз – Q и Qж, т. е.
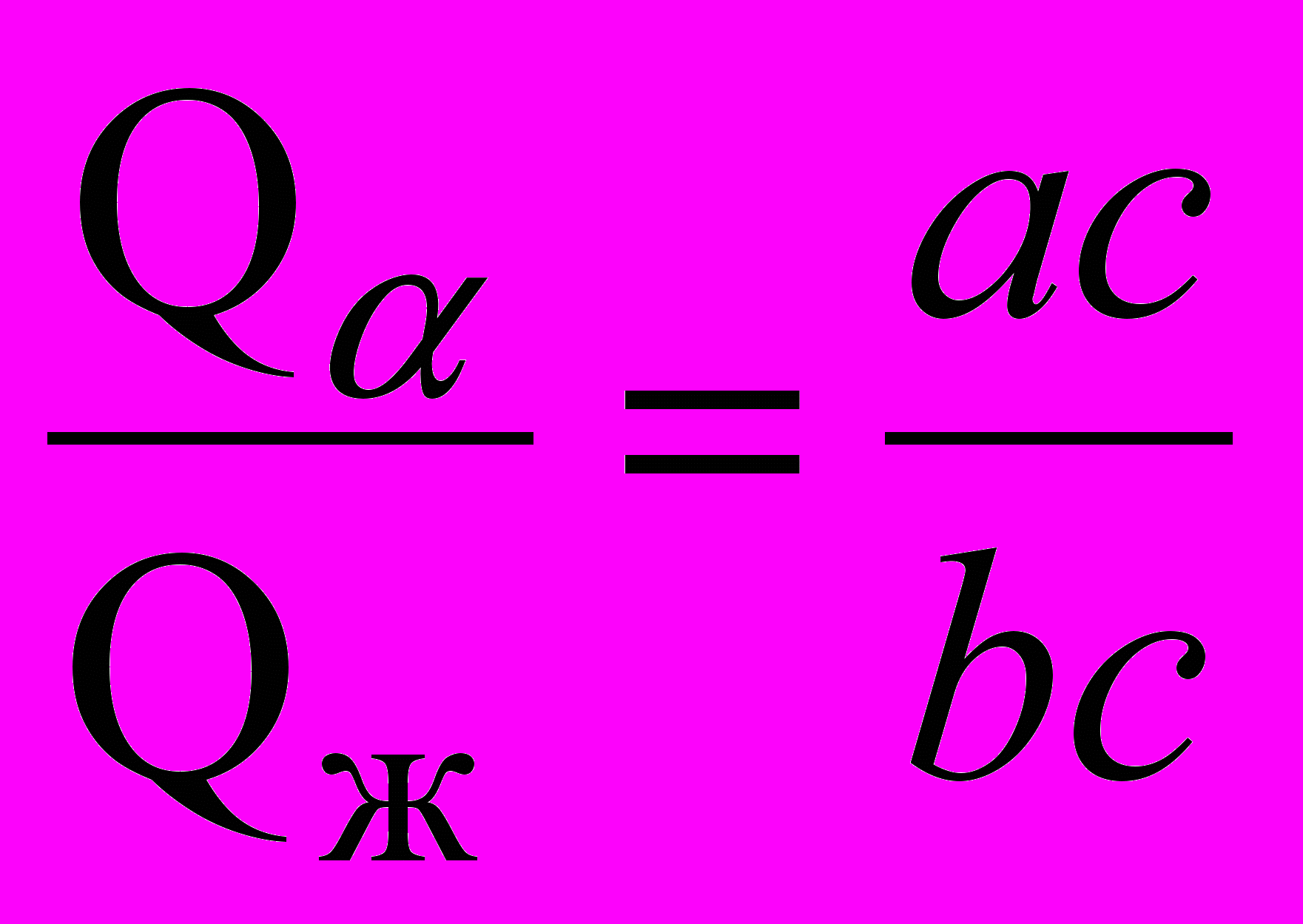 . (5.2)
. (5.2)Эта методика определения относительных количеств фаз называется правилом отрезков или правилом рычага, так как соответствует условию равновесия рычага, показанного на рис. 5.3, б.
Учитывая, что Q+Qж=100 % соотношение (5.2) можно записать в виде
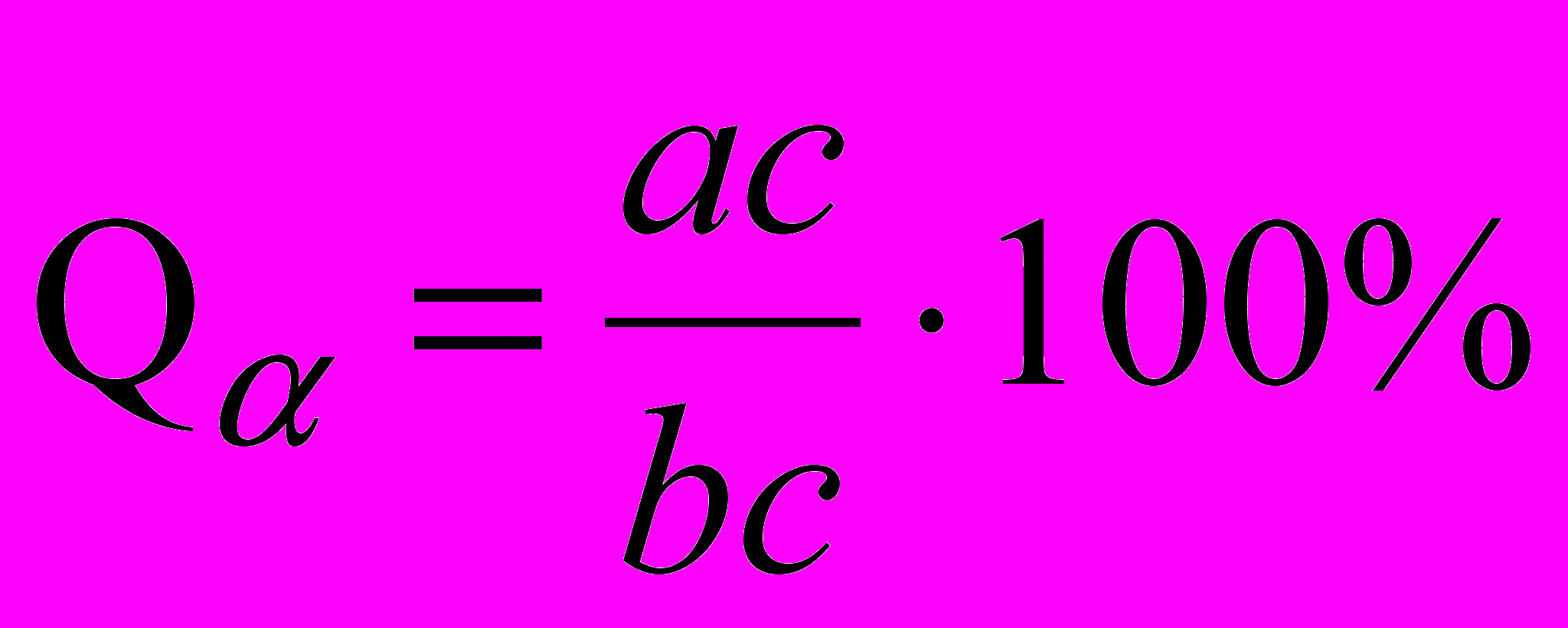 ;
; 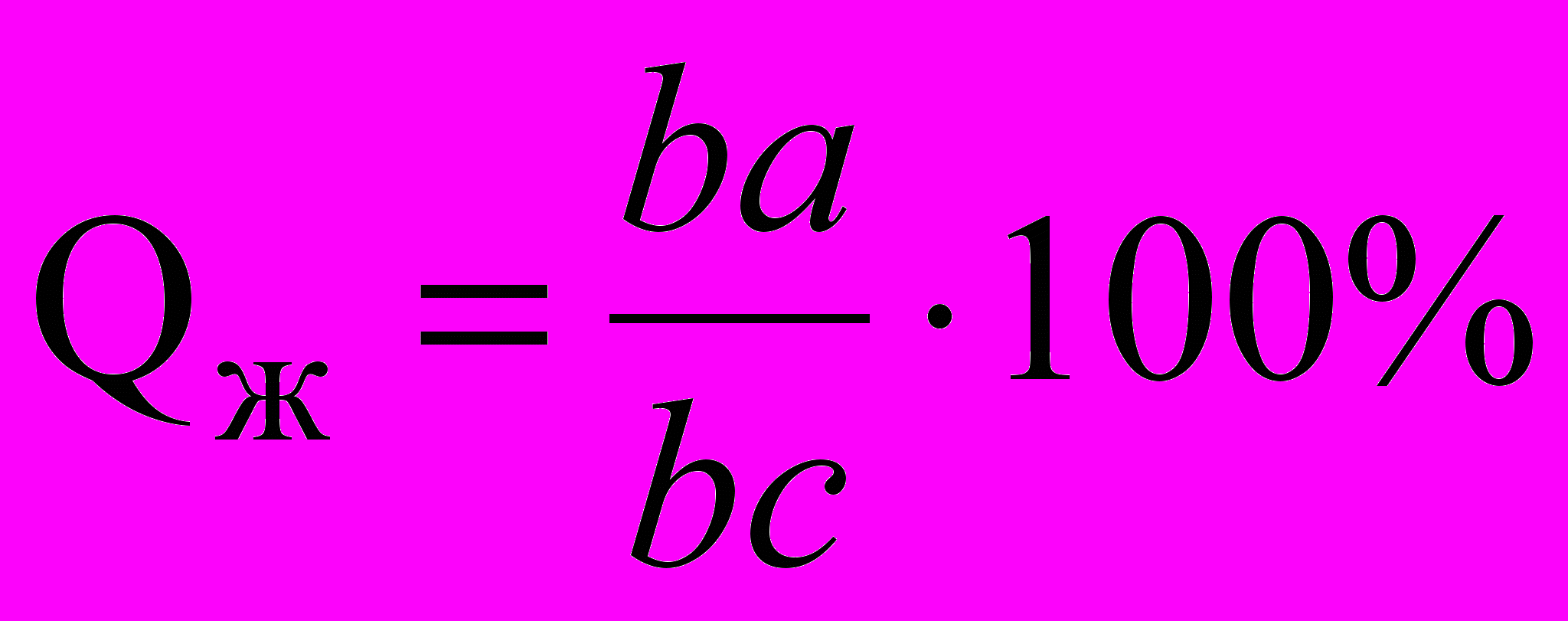 . (5.3)
. (5.3)^ 5.5. ДИАГРАММА СОСТОЯНИЯ СПЛАВОВ С ОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ (ДИАГРАММА С ЭВТЕКТИКОЙ)
Рассмотренная выше диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии, как и другой крайний случай диаграммы, когда компоненты абсолютно не растворяются друг в друге, относительно редко встречаются на практике. Наиболее распространен вариант ограниченной взаимной растворимости компонентов в твердом состоянии.
Пусть, для определенности, компонент ^ В, частично растворяясь в решетке А в твердом состоянии, образует твердый раствор , причем предел растворимости возрастает с повышением температуры. Компонент А, в свою очередь, ограниченно растворяясь в В, образует твердый раствор , причем предел растворимости не меняется с температурой.
Очевидно, что в этом случае на диаграмме состояния ниже линии солидус должны быть две однофазные области и , а между ними, т. е. за пределами растворимости компонентов, - двухфазная область +. Тогда при кристаллизации сплавов, принадлежащих к двухфазной области, возможно одновременное выпадение кристаллов и из жидкой фазы Ж. Этому случаю соответствует нонвариантное равновесие, так как, согласно правилу фаз (5.1), С=2-3+1=0. Т. е. равновесие между указанными фазами определённого состава имеет место при фиксированной температуре. Значит на диаграмме состояния должна быть система линий типа
Д
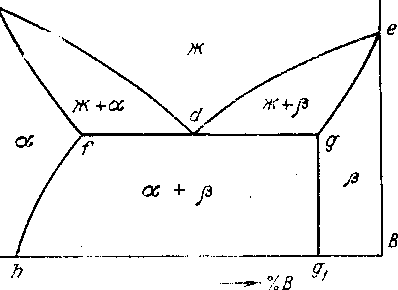 ействительно, диаграмма состояния для рассматриваемого случая имеет вид, показанный на рис. 5.4.
ействительно, диаграмма состояния для рассматриваемого случая имеет вид, показанный на рис. 5.4.Рис. 5.4. Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (диаграмма с эвтектикой)
Диаграммы подобного вида типичны для многих металлических сплавов (или, по крайней мере, являются составной частью реальных диаграмм этих сплавов). Поэтому ниже будет дан достаточно подробный анализ этой диаграммы.
Главная цель анализа диаграмм состояния заключается в том, чтобы установить все возможные типы структур, которые могут иметь сплавы различного состава в данной системе. Для этого необходимо выяснить, какие превращения происходят в сплавах различного состава при их медленном (чтобы успели завершиться диффузионные процессы образования фаз) охлаждении из жидкого состояния до комнатной температуры.
И
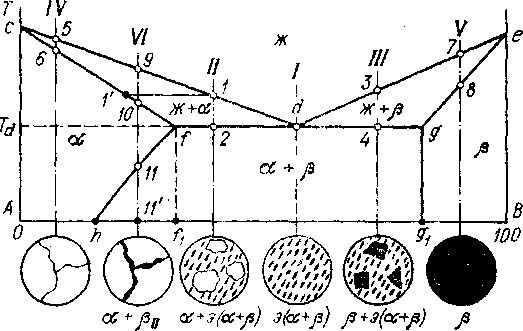 з дальнейшего будет ясно, что в рассматриваемом случае (рис. 5.4) достаточно проанализировать превращения в шести типовых сплавах, отмеченных на диаграмме штрих-пунктирными вертикалями (рис. 5.5). Там, где эти вертикали пересекают линии диаграммы происходят фазовые превращения, т. е. точки пересечения - это критические точки сплавов различного состава. Они обозначены на рис. 5.5, арабскими цифрами. Поставленная задача будет выполнена, если под каждой из шести вертикалей мы сможем схематически нарисовать микроструктуру (реально она изучается с помощью оптического микроскопа) соответствующего сплава.3
з дальнейшего будет ясно, что в рассматриваемом случае (рис. 5.4) достаточно проанализировать превращения в шести типовых сплавах, отмеченных на диаграмме штрих-пунктирными вертикалями (рис. 5.5). Там, где эти вертикали пересекают линии диаграммы происходят фазовые превращения, т. е. точки пересечения - это критические точки сплавов различного состава. Они обозначены на рис. 5.5, арабскими цифрами. Поставленная задача будет выполнена, если под каждой из шести вертикалей мы сможем схематически нарисовать микроструктуру (реально она изучается с помощью оптического микроскопа) соответствующего сплава.3Рис. 5.5. Анализ диаграммы состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
Итак, рассматриваем кристаллизацию сплавов различного состава.
Сплав I. Видно, что этот сплав особенный, так как линии ликвидус (cde) и солидус (cfdge) сходятся здесь в одной точке d. Следовательно, и начало, и конец кристаллизации будут происходить при одной и той же температуре, соответствующей т. d (Тd). При этом будут постоянными и составы участвующих в кристаллизации фаз. Действительно, если считать, что т. d принадлежит одновременно областям cdf и edg, то из правила определения химического состава фаз (см. раздел 5.3) можем заключить, что в сплаве I при Т-Тd в равновесии находятся три фазы: жидкая, состава т. d (Жd), твердый раствор , состава т. а (f) и твердый раствор , состава т. g (g). То есть имеет место нонвариантное равновесие (С=0), о чем говорилось в начале этого раздела. Это трехфазное равновесие ,может сохраняться при Т=Тd бесконечно долго, так как свободные энергии жидкой Fж и твердых фаз F+ здесь одинаковы (Тd соответствует равновесной температуре Т0 на рис. 2.1). При понижении температуры свободная энергия F+< Fж, равновесие нарушается, жидкость затвердевает в смесь фаз и :
Жd охл f + g. (5.4)
Реакция (превращение) такого типа называется эвтектической, а образующаяся смесь твердых фаз определенного состава - эвтектикой.4
Сплав I, имеющий эвтектический состав (т. й), называется эвтектическим сплавом. Его структура - эвтектика - Э(+). Эвтектика представляет собой мелкодисперсную смесь кристаллов двух фаз, поскольку кристаллизация происходит при постоянной и достаточно низкой температуре, когда из жидкости одновременно выпадает множество кристалликов, возможностей роста которых ограничены.
Сплав II. В т. 1 из жидкости начинают выпадать первые кристаллы твердого раствора . Их состав отвечает т. ^ 1' (см. правило определения состава фаз, раздел 5.3). При дальнейшем понижении температуры до т. 2 развивается процесс кристаллизации, т. е. увеличивается количество фазы , уменьшается количество жидкой фазы (Ж), из которой образуются кристаллы. При этом химический состав фазы а изменяется по линии 1'f, а фазы Ж - по линии 1d. В сказанном можно убедиться, проводя коноды при различных температурах в интервале т. 1 - т. 2. Вблизи т. 2 (подошли к ней вплотную, но еще не пересекли ее) сплав состоит из кристаллов состава т. f(f) в количестве Q=2d/fd (см. «правило отрезков», раздел 5.4) и жидкой фазы состава т. d (Жd) в количестве Qж= f2/fd.
При пересечении эвтектической горизонтали (fdg) вся эта жидкость (Qж), достигшая эвтектического состава (т. d), превращается в эвтектику (+), согласно реакции (5.4). Поэтому окончательная структура сплава II состоит из эвтектики (в количестве, равном Qж) и избыточных5 кристаллов (в количестве Q , образовавшихся в интервале температур т. 1 - т. 2.
Аналогичную структуру +э(+) имеют все доэвтектические сплавы (состав в интервале f-d).
Если «алгоритм» формирования структуры доэвтектических сплавов понятен, то нетрудно будет смоделировать структуру за эвтектических сплавов (состав в интервале d-g), к которому принадлежит сплав III.
Эти сплавы также имеют две структурные составляющие: избыточные кристаллы , выпавшие из жидкости между линиями de и dg, и эвтектику, образовавшуюся из последних порций жидкости, когда сплавы при охлаждении пересекают эвтектическую горизонталь.
Кристаллизация сплава IV заканчивается в т. 6 образованием однофазной структуры твердого раствора . Такая же структура у всех сплавов в интервале составов 0-h. Аналогично сплавы, расположенные правее т. g1 (например, сплав V) имеют однофазную структуру твердого раствора .
Кристаллизация сплава VI начинается в т. 9 - выпадают первые кристаллы . В т. ^ 10 этот процесс заканчивается и до т. 11 сплав имеет однофазную структуру. При температуре, соответствующей т. 11, содержание компонента В в растворе определяется т. 11'. При дальнейшем понижении температуры предел растворимости уменьшается (по линии fh). Поэтому ниже т. 11 раствор уже не может содержать то количество В, которое определяется т. 11'. Вследствие этого избыток компонента В выделяется по границам зерен а в виде кристаллов богатой компонентом В фазы, т. е. кристаллов (эти кристаллы называются вторичными (II) в отличие от первичных кристаллов , выпадающих непосредственно из жидкости). В результате при комнатной температуре сплав VI имеет структуру +II, причем содержание компонента В в фазе отвечает т. h.
Аналогичный процесс выделения вторичных кристаллов II из фазы имеет место и в доэвтектических сплавах. Однако эти выделения микроскопические, как правило, не обнаруживаются, так как «затушевываются» мелкодисперсной эвтектикой.
Подчеркнем, что выделение вторичных кристаллов обусловлено тем, что предельная растворимость компонентов в твердом состоянии уменьшается с понижением температуры. Поскольку растворимость компонента А в В в нашем случае не меняется с температурой (линия gg1), то выделения вторичных кристаллов из фазы не происходит.
Количество кристаллов II в структуре сплавов, состав которых принадлежит интервалу h-f1 невелико (максимальное количество равно отношению hf1/hg1), однако если они имеют повышенную твердость и хрупкость, то могут существенно повлиять на свойства сплавов (об этом подробнее в разделе 5.8).
Таким образом, задача выполнена - прослежены процессы кристаллизации сплавов различного состава и установлены все типы структур, которые могут иметь сплавы в данной системе. Таких структур шесть (рис. 5.5). Следует обратить внимание на сплавы, расположенные между точками h и g1. Видно, что все эти сплавы при комнатной температуре состоят из двух фаз - и , но их структуры различны, т. е. эти две фазы образуют разные структурные составляющие. В сплавах VI, II, III, по две структурных составляющих, а в сплаве I - только одна (эвтектика), хотя она и сформирована из двух фаз. Многообразие структур этих сплавов обусловлено тем, что в процессе кристаллизации они пересекают линии диаграммы, соответствующие различным фазовым превращениям. Например, сплав VI, не пересекающий эвтектическую горизонталь (fdg), не содержит эвтектики в структуре.
5.6. О ДИАГРАММАХ СОСТОЯНИЯ СПЛАВОВ,
КОМПОНЕНТЫ КОТОРЫХ ОБРАЗУЮТ УСТОЙЧИВЫЕ
^
ХИМИЧЕСКИЕ СОЕДИНЕНИЯ
Если при сплавлении компонентов А и В при некоторой их взаимной концентрации образуется устойчивое химическое соединение состава АпВт, то на диаграмме состояния оно изображается вертикалью. Эта вертикаль делит диаграмму на части, каждую из которых можно анализировать независимо, считая одним из компонентов это соединение. То есть система А-В разбивается на две независимые системы: А-АпВт и АпВт-В. Конкретный вид такой диаграммы зависит от характера физико-химического взаимодействия компонентов в этих двух подсистемах, т. е. от возможности их взаимного растворения, образования между собой соединений и т. п.
Если, например, АпВт в твердом состоянии растворяется в А, а А в АпВт не растворим и не растворимы взаимно АпВт и В, то соответствующая диаграмма состояния имеет вид, показанный на рис. 5.6.
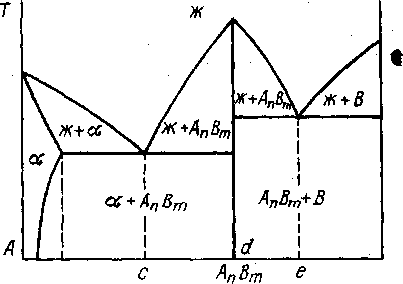
Рис. 5.6. Диаграмма состояния сплавов, компоненты которых образуют устойчивое химическое соединение АпВт
Учитывая сказанное выше и подробный анализ диаграммы, проведенный в предыдущем разделе (см. рис. 5.5), можем легко установить окончательную структуру сплавов в системе, представленной на рис. 5.6:
| Интервал по хим. составу: | о-а | а-b | b-с | c | c-d | d-e | e | e-100 |
| Структура: | | +АпВтII | +Э1 | | АпВт+Э1 | АпВт+Э2 | Э1(АпВт+В) | В+Э2 |
5.7. ДИАГРАММАХ СОСТОЯНИЯ СПЛАвОв,
^ иСПЫТЫВАЮЩИХ ПЕРИТЕКТИЧЕСКОЕ ПРЕВРАЩЕНИЁ
В разделе 5.5 был рассмотрен случай нонварйантного эвтектического превращения - затвердевания жидкости в смесь двух твердых фаз, происходящего при постоянной температуре и фиксированных составах фаз. Другой пример нонвариантного превращения имеет место, когда жидкая фаза реагирует с ранее выпавшими кристаллами, в результате чего образуется новая твердая фаза. В этом случае, как и при эвтектическом превращении, С=К-Ф+1=2-3+1=0, т. е. температура и составы реагирующих фаз постоянны. Такое превращение называется перитектическим.
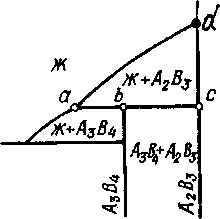
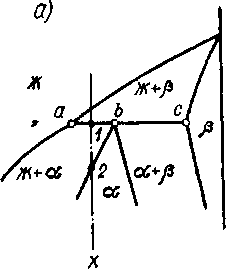
Рис. 5.7. Участки диаграмм состояния сплавов, испытывающих перитектическое превращение: а - кристаллизация твердого раствора в результате перитектического превращения Жа+аb; б – кристаллизация неустойчивого химического соединения А3В4 в результате превращения перитектического типа Жа+ А2В3 А3В4
Участок диаграммы для сплавов, испытывающих перитектическое превращение, показан на рис. 5.7, а. Видно, что в сплаве состава т. b при пересечении перитектической горизонтали (аbс) происходит перитектическое превращение
Жа + cохл b, (5.5)
Для получения однофазной а структуры необходимо, чтобы относительные количества реагирующих фаз (Qж и Q) и удовлетворяли соотношению Qж/Q=bc/ab. В сплавах из интервала a-b это отношение нарушаётся из-за избытка жидкой фазы, например, в сплаве состава X Qж/Q=1c/a1>bc/ab. Поэтому в этих сплавах в результате перитектического превращения сохраняется часть жидкой фазы:
Жа + cохл b + Жа, (5.6)
и кристаллизация заканчивается лишь при дальнейшем охлаждении до т.^ 2.
В сплавах из интервала b-с при перитектическом превращении в избытке находятся кристаллы , поэтому кристаллизация заканчивается согласно реакции
Жа + cохл b +c (5.7)
На рис. 5.7, б показан участок диаграммы, где компоненты А и В образуют два химических соединения различного состава - А3В4 и А2В3. Видно, что соединение А2В3 при нагревании до температуры плавления (т. d) расплавляется, переходит непосредственно в жидкую фазу. Такие соединения называются устойчивыми. Соединение А3В4 при нагреве до т. b разлагается на жидкую фазу и кристаллы А2В3. Такие соединения называются неустойчивыми. Видно, что кристаллизация неустойчивого химического соединения происходит по перитектической реакции:
Жа + А2В3охл А3В4 (5.7)
В сплавах, расположенных левее и правее перитектической точки b, в результате перитектического превращения остаются избыточные фазы Ж или А2В3 соответственно (по причине, обсужденной выше).
Подводя итог сказанному в предыдущих разделах, отметим, что любые сложные реальные диаграммы состояния состоят из «типовых блоков», умение анализировать которые позволяет расшифровать диаграмму в целом. Рассмотренные выше диаграммы состояния и являются такими блоками.
^ 5.8. О ПРАКТИЧЕСКОМ ЗНАЧЕНИИ ДИАГРАММ СОСТОЯНИЯ
В главе 4 подчеркивалось, что свойства сплавов в первую очередь зависят от их фазового состояния, т. е. от типа (и, конечно, количества и свойств) фаз, из которых они состоят. Из предыдущих разделов данной темы следует, что вид диаграмм состояния также зависит от того, какие фазы образуются при сплавлении компонентов. Отсюда, между видом диаграмм состояния и свойствами сплавов должна существовать определенная связь.6
Многочисленные исследования приводят к зависимостям, показанным на рис. 5.8. При неограниченной растворимости компонентов в твердом состоянии (рис. 5.8, а) зависимость свойств от химического состава сплавов в данной системе (А-В) имеет криволинейный характер с экстремумом, приходящимся примерно на равное соотношение компонентов. Это обусловлено тем, что увеличение количества атомов компонента В в решетке компонента А (т. е. в твердом растворе а) приводит к росту внутренних напряжений, что сопровождается повышением прочности в, твердости НВ, электросопротивления и снижением пластичности - все это подробно обсуждалось в разделе 4.3.
В случае изоморфных компонентов, которым присуща неограниченная взаимная растворимость компонентов в твердом состоянии (см. раздел 4.2.1), твердый раствор а, содержащий более 50 % компонента В, можно рассматривать как твердый раствор А в В. Тогда дальнейшее увеличение концентрации В в сплаве эквивалентно снижению концентрации А в решетке В - при этом происходит уменьшение внутренних напряжений, соответственно снижается прочность и твердость, повышается пластичность.
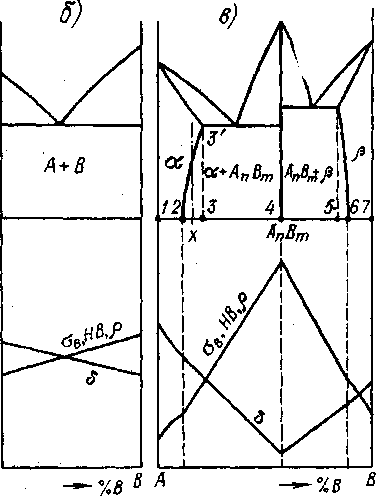 Рис. 5.8. Связь между свойствами сплавов и видом их диаграмм состояния
Рис. 5.8. Связь между свойствами сплавов и видом их диаграмм состоянияВ гетерогенных сплавах, состоящих из смеси различных фаз, свойства в зависимости от состава меняются по линейному закону (рис. 5.8,б). Такая зависимость объясняется тем, что каждая фаза имеет свои индивидуальные неизменные свойства, а свойства смеси фаз (сплава) определяются их относительными количествами (см. раздел 4.3, в частности формулы (4.4) и (4.5)). Количество же каждой фазы линейно изменяется с изменением состава сплава («правило отрезков», раздел 5.4).
При образовании химического соединения происходит резкое, экстремальное изменение свойств, так как такой сплав качественно (типом решетки, свойствами) отличается от исходных компонентов (см. разделы 4.2.2 и 4.3). Поэтому на зависимостях свойств от состава при концентрации компонентов, соответствующей образованию химического соединения, наблюдается острый экстремум - переломная точка (рис. 5.8, в; в отличие от плавного изменения свойств при образовании твердых растворов - рис. 5.8, а). В остальных частях сложной диаграммы (рис. 5.8, в) свойства изменяются согласно рассмотренным выше закономерностям для сплавов - твердых растворов и механических смесей (т. е. рис. 5.8, а, б).
Таким образом, из рис. 5.8 следует, что знание диаграмм состояния позволяет прогнозировать свойства сплавов. Это имеет огромное значение при разработке сплавов с заданными свойствами.
Например, если требуется создать сплав для проволочного электронагревателя (или сопротивления - резистора), необходимо выбрать такие компоненты, которые неограниченно растворяются друг в друге в твердом состоянии (это можно сделать, воспользовавшись справочной литературой по диаграммам состояния; в настоящее время опубликовано несколько тысяч диаграмм состояния различных компонентов). Сплавив такие компоненты примерно в одинаковых количествах, получим сплав - твердый раствор, обладающий максимальным электросопротивление (рис. 5.8,а). Поскольку твердые растворы обладают высокой пластичностью, они хорошо поддаются обработке давлением, т. е. элемент электросопротивления может быть изготовлен в виде проволоки или ленты.
Многие химические соединения также обладают высоким электросопротивление (рис. 5.8, в), но низкая пластичность не позволяет обрабатывать их давлением. В этом случае элементы электросопротивления можно изготавливать методами порошковой металлургии.
Этот примёр показывает, что знание диаграммы состояния дает возможность предусмотреть и технологию изготовления изделий (полуфабрикатов) из сплавов различного состава. Приведем еще один пример на эту тему.
Известно, что сплавы, содержащие в структуре эвтектику,7 обладают хорошими литейными свойствами, в частности высокой жидкотекучестью (заполняемостью формы), так как их кристаллизация происходит при постоянной и наиболее низкой температуре в данной системе (раздел 5.5). Поэтому по технологическими свойствам сплавы, в процессе кристаллизации испытывающие эвтектическое превращение (состав в интервале 3-4 и 4-5, рис. 5.8,в), следует отнести к группе литейных, а сплавы со структурой твердого раствора (интервал 1-3 и 5-7) - к группе обрабатываемых давлением (деформируемых). Если при этом мы говорим о различии свойств сплавов с одинаковым фазовым составом (например, сплавы из интервала 2-3 и 3-4 состоят из фаз и АпВт), то, очевидно, что это обусловлено особенностями их строения - структуры.
В предыдущих разделах мы убедились в том, что формирование окончательной структуры сплавов различного состава также определяется видом диаграммы состояния. Например, при медленном охлаждении сплавов, принадлежащих интервалу 2-3 (рис. 5.8, в), вторичные кристаллы химического соединения (АпВт) располагаются обычно по границам зерен твердого раствора а (см. раздел 5.5). Так как кристаллы химических соединений обладают повышенной хрупкостью, то такая структура может приводить к растрескиванию металла при пластическом деформировании. Это ограничивает круг сплавов, обрабатываемых давлением, составами 1-2, или чуть правее т. 2, где количество АпВт минимально. И, если продолжить разговор о сплавах из интервала 2-3, то здесь диаграмма состояния дает еще один важный пример своей полезности.
Действительно, если сплав из интервала 2-3 (например, состава X; рис. 5,8, в) нагреть выше линии предельной растворимости (^ 2-3) до однофазного а состояния, а затем охладить быстро (закалить), то кристаллы АпВт не успеют образоваться, и при комнатной температуре сохранится однофазная структура . Полученный закалкой твердый раствор будет пересыщен компонентом В (так как его количество X выше равновесной концентрации 2), т. е. неравновесным. Поэтому при длительной выдержке, особенно если несколько нагреть такой сплав (такая термообработка называется старением), диффузионные процессы приведут к выделению мелких частиц твердой фазы АпВт. Эти частицы, создавая препятствия скольжению дислокаций, повышают твердость и прочность сплава (см. раздел 4.3).
Таким образом, все сплавы, на диаграммах состояния которых имеются линии, указывающие на изменение растворимости в твердом состоянии (типа линии 2-3' на рис. 5.8, в), принципиально могут быть упрочнены путем закалки и старения.8
По-видимому приведенных примеров достаточно, чтобы убедиться в исключительно важном практическом значении диаграмм состояния. В дальнейшем, при изучении конкретных сплавов, круг этих примеров будет расширен. Следует, однако, остановиться на некоторой ограниченности рассмотренных закономерностей, связывающих свойства сплавов с видом диаграмм состояния (рис. 5.8).
Во-первых, диаграммы состояния не дают полных сведений о всех деталях структуры сплавов, например, в зависимости от реальных условий кристаллизации сплав данного состава с одними и теми же структурными составляющими может иметь различный размёр зерна и, соответственно, различные свойства.
Во-вторых, сами диаграммы состояния и указанные закономерности строго относятся к сплавам, находящимся в равновесном состоянии. На практике сплавы используются в состояниях, которые, как правило, не достигают истинно равновесного. Это происходит либо в силу специфики технологических процессов (высокие скорости нагрева и охлаждения, быстрота производимых операций), либо осуществляется специально для получения необходимых свойств, например, при закалке (см. выше).
Однако при длительной выдержке в процессе эксплуатации или при последующей термической обработке (например, старении, см. выше) неравновесные сплавы стремятся к равновесному, устойчивому состоянию.9 В этих условиях диаграммы состояния позволяют предвидеть направления, в которых должны изменяться структура и свойства сплавов.
Таким образом, диаграммы состояния имеют исключительно важное значение, так как дают сведения о структуре и свойствах сплавов. Диаграммы состояния можно считать основным инструментом теоретического и прикладного материаловедения. Поэтому умение анализировать, «читать» диаграммы состояния является одним из главных условий успешного освоения основ материаловедения.
Этой важной темой, позволяющей закономерно связать химический состав и структуру сплавов с их свойствами, завершается учебное пособие. В нем даны фундаментальные сведения о строении и свойствах сплавов, составляющие основу металловедения.10
Знание рассмотренных здесь представлений и закономерностей необходимо для изучения структуры и свойств конкретных промышленных сплавов.
1 В главе 4 (см. примечание к стр. 49) приведено обоснование того, что основы теории строения сплавов будут рассмотрены на примере двухкомпонентных (двойных) сплавов.
2 В дальнейшем для сокращения записи будем считать, что точки, определяющие составы фаз, - это точки пересечения изотермы с границами двухфазной области (т. е. b и с на рис. 5.3, а).
3 Чтобы не делать еще одного рисунка, окончательные сплавов уже приведены на рис. 5.5.
4От греческого слова, означающего в переводе «легко плавящийся». Действительно, из рис. 5.5 видно, что эвтектическая температура (равная Тd) самая низкая температура плавления в данной системе.
5 Избыточные, т. е. те кристаллы , которые присутствуют в структуре сплава помимо кристаллов , содержащихся в эвтектике. Избыточные кристаллы кристаллизуются в широком интервале температур (т. 1 - т. 2), поэтому более крупные, чем кристаллы эвтектики.
6 Изучение этой связи положено Н. С. Курнаковым в основу физико-химического анализа.
7 Именно такими являются хорошо известные литейные сплавы - чугуны и силумины, которые будут обсуждаться при дальнейшем изучении курса.
8 Типичным примером таких сплавов является дуралюмин, упрочнение которого термической обработкой подробно рассматривается в курсе «Материаловедение».
9 Вспомним, что такое состояние характеризуется минимумом свободной энергии (глава 2).
10 Стремление к доступности изложения материала (обязательное для учебной литературы, предназначенной студентам, обучающимся без отрыва от производства) может отражаться на строгости интерпретации отдельных вопросов. При необходимости более детального изучения соответствующих разделов программы следует обратиться к основным учебникам по курсу «Материаловедение» (или «Металловедение»):
