Опорный конспект лекций Основные понятия, термины, законы, схемы Для студентов заочной и дистанционной форм обучения
| Вид материала | Конспект |
- Учебно-методическое пособие для студентов заочной, вечерней и дистанционной форм обучения, 2226.88kb.
- Краткий конспект лекций Кемерово 2002 удк: 744 (075), 1231.26kb.
- Конспект лекций для студентов заочной формы обучения по дисциплине " Организация производства", 16.36kb.
- Конспект лекций для студентов специальности 080110 «Экономика и бухгалтерский учет, 1420.65kb.
- Конспект лекций по курсу "Начертательная геометрия и инженерная графика" Кемерово 2002, 786.75kb.
- Конспект лекций для студентов всех специальностей дневной и заочной формы обучения, 1439.07kb.
- Конспект лекций по дисциплине "политэкономия" для студентов 050107 заочной формы обучения, 908.57kb.
- Конспект лекций для студентов специальности "Автоматизированное управление технологическими, 90.52kb.
- Конспект лекций по курсу "Информатика и использование компьютерных технологий в образовании", 1797.24kb.
- Методические указания по разработке разделов дипломного проекта (работы) для студентов, 311.09kb.
6. Гидросфера
Гидросфера – водная оболочка Земли, совокупность океанов, морей, водных объектов суши (реки, озера, болота водохранилища), подземных вод, включая запасы воды в твердой фазе (ледники, снежный покров); одна из геологических оболочек нашей планеты. Гидросфера Земли представляет собой единую водную оболочку, основным компонентом которой является химическое соединение H2O . Гидросфера – это глобальная открытая система, а вода в ней – самое распространенное на Земле вещество.
Вода – единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). H2O – соединение с ковалентным типом химической связи.
Вода представляет собой бесцветную прозрачную жидкость, без запаха, обладающую рядом аномальных физико-химических свойств:
– высоким поверхностным натяжением и зависящим от него значительным капиллярным поднятием, что обеспечивает питание растений по корневым системам;
– высокими температурами замерзания и кипения;
– удельные энтальпии испарения и плавления H2O (в расчете на 1г) выше, чем у большинства веществ;
– плотность воды в жидком состоянии больше плотности льда, поэтому лед плавает на поверхности воды, и природные водоемы не промерзают до дна.
Эти аномальные свойства воды объясняются существованием в ней водородных связей, которые связывают молекулы H2O в газообразном, жидком и в твердом состояниях.
^ Природная вода
Природная вода – это раствор многих веществ, в том числе солей, газов, а также веществ органического происхождения, некоторые из них находятся во взвешенном состоянии. В большинстве случаев природная вода имеет атмосферное происхождение (дождевая вода), реже – глубинное (конденсация паров, поднимающихся из недр Земли)
Существует несколько классификаций химического состава природных вод.
В гидрохимии компоненты химического состава природных вод делятся на шесть групп:
1. Главные ионы (макрокомпоненты): K+, Na+, Mg2+ , Ca2+ , Cl- , SO42- , HCO3- , CO32- .
2. Растворенные газы: O2, N2, H2S, NH3, CH4 и др.
3. Биогенные вещества (продукты жизнедеятельности организмов), главным образом, неорганические соединения азота и фосфора.
4. Растворенные органические вещества (РОВ), т.е. органические формы биогенных элементов. Эта группа включает практически все классы органических соединений.
5. Микроэлементы. В эту группу входят все металлы, кроме главных ионов, а также анионы.
6. Бактерии и микроорганизмы.
Классификация, предложенная Л.А.Кульским, основана на фазовом состоянии и дисперсности примесей, содержащихся в воде.
^ Примеси первой группы – образования, попадающие в воду вследствие эрозии слагающих ложе водоема пород и смыва с поверхности почв. Они представляют собой нерастворимые в воде суспензии, планктон и бактерии, кинетически неустойчивые и находящиеся во взвешенном состоянии благодаря гидродинамическому воздействию водного потока.
^ Примеси второй группы – гидрофильные органические и минеральные коллоидные частицы, вымываемые водой из грунтов, а также нерастворимые и недиссоциированные формы гумусовых веществ, детергенты и вирусы, которые по своим размерам близки к коллоидным частицам.
^ Примеси третьей группы – молекулярно- растворимые вещества: органические соединения, растворимые газы и т.п.
Примеси четвертой группы – вещества, диссоциирующие на ионы.
Из природных вод человек чаще всего сталкивается с так называемыми поверхностными природными водами.
Характеристика веществ, находящихся в водах поверхностных источников во взвешенном состоянии:
| Взвешенное вещество | Характеристика | |
| Размер частиц, мм | Время осаждения частиц на глубину 1 м | |
| Коллоидные частицы | 2٠10-4–1٠10-6 | 4 года |
| Тонкая глина | 1٠10-3–5٠10-4 | 0,5-2 мес |
| Глина | 27٠10-4 | 2 сут |
| Мелкий ил | 1٠10-2–5٠10-3 | 4-18 ч |
| Ил | 5٠10-2–27٠10-3 | 10-30 мин |
| Песок мелкий | 0,1 | 2,5 мин |
| Песок средний | 0,5 | 20 с |
| Песок крупный | 1,0 | 10 с |
За счет антропогенной деятельности в химический состав природных вод можно внести еще одну разновидность – это токсичные загрязняющие вещества: тяжелые металлы, нефтепродукты, хлорорганические соединения, синтетические поверхностно-активные вещества, фенолы и т.д. При хлорировании природной воды в ней могут также образоваться диоксины.
^ Качество природной воды
Показатели качества природной воды обычно подразделяют на физические (температура, цветность, взвешенные вещества, запах, вкус и др.), химические (жесткость, активная реакция, окисляемость, сухой остаток и др.), биологические (гидробионты) и бактериологические (общее количество бактерий, коли-индекс и др.)
Критерий качества воды может быть представлен следующим образом:
С ПДК,
где С – обнаруженная концентрация, мг/дм3; ПДК – предельно-допустимая концентрация, мг/дм3.
Если в питьевой воде обнаружено несколько веществ с одинаковым лимитирующим признаком вредности, то для них критерий качества воды имеет вид :
С1 / ПДК1 + С2 / ПДК2 + ... Сn / ПДКn 1 ,
где С1, С2, ... Сn – обнаруженные концентрации веществ 1, 2 .... n, мг/дм3; ПДК1, ПДК2 ... ПДКn – предельно-допустимые концентрации веществ 1, 2 .... n, мг/дм3.
В настоящее время число установленных ПДК для водных объектов различного назначения составляет около 2000 (для атмосферного воздуха около 500, а для почвы более 100).
В качестве интегральной характеристики загрязненности поверхностных вод используют классы качества воды.
Различают 7 классов качества воды: I класс - очень чистые воды, II класс - чистые, III класс - умеренно-загрязненные, IV - загрязненные, V - грязные, VI - очень грязные, VII - чрезвычайно грязные. Отнесение к классу качества проводится по величине "индекса загрязненности воды" (ИЗВ) - комплексного показателя, характеризующего сумму нормированных (отнесенных к ПДК) среднегодовых значений концентраций загрязняющих веществ.
^ Цветность (окраска) обусловлена присутствием в природных водах гумусовых и дубильных веществ, белково- и углеводоподобных соединений, жиров, органических кислот и других органических соединений. Кроме того, окраска воды может быть вызвана присутствием в ней соединений железа, сточных вод некоторых производств, “цветением” воды.
Мутность характеризуется наличием в воде взвешенных частиц песка, глины, ила, планктона, водорослей и др.
^ Водородный показатель (pH). Природные воды по величине pH обычно классифицируют на: кислые с pH от 1 до 3, слабокислые с pH от 4 од 6, нейтральные с pH около 7, слабощелочные с pH от 8 до 10 и щелочные с pH от 11 до 14.
^ Сухой остаток характеризует содержание в воде в основном примесей неорганического происхождения. Представляет собой остаток от выпаривания известного объема нефильтрованной воды, высушенный при температуре 110°С до постоянной массы.
^ Хлориды и сульфаты присутствуют во всех природных водах обычно в виде солей кальция, магния, и натрия.
Железо и марганец в поверхностных водах обычно встречаются в виде органических и минеральных комплексных соединений, либо в виде коллоидных и тонкодисперсных взвесей.
^ Окисляемость воды обусловливается присутствием в ней органических и некоторых легкоокисляющихся неорганических соединений (железо (II), сульфиты, сероводород и др.).
^ Азотсодержащие вещества (ионы аммония, нитриты, нитраты) чаще всего образуются в природной воде в результате окислительно-восстановительных процессов с участием сероводорода, гумусовых веществ и др., либо в результате разложения белковых соединений.
^ Химические процессы в гидросфере
Гидросфера – глобальная открытая система, стабильность которой тем выше, чем больше разнообразие составляющих её компонентов. Опасность разбалансировки такой системы, нарушение равновесия и стабильности возникает тогда, когда существенно изменяется химический состав или физико-химические параметры на входе и, соответственно, продукция на выходе.
^ Особенности химических процессов в гидросфере
К особенностям химических процессов в гидросфере можно отнести:
1. Многообразие форм химических соединений: присутствуют все классы органических и неорганических веществ;
2. Влияние гидролиза на химические процессы и участие в них гидратированных молекул и ионов;
3. Участие в химических процессах водорослей и бактерий.
В гидросфере протекают разнообразные химические и физико-химические процессы. Рассмотрим некоторые из них.
1. Химические реакции в водных растворах, в основном ионообменные и окислительно-восстановительные.
2. Испарение и растворение газов на поверхности раздела воздух-вода. Например, растворение газов O2, N2, CO2, H2S и NH3 в природной воде.
3. Сорбционные процессы, т.е. процессы, адсорбции, абсорбции и десорбции, обычно протекающие с участием органических соединений и способствующие самоочищению природных вод.
4. Фотолиз – фотохимические превращения, протекающие в природных водах под воздействием УФ-излучения Солнца при участии свободных радикалов и возбужденных частиц.
^ Примеры химических процессов в гидросфере
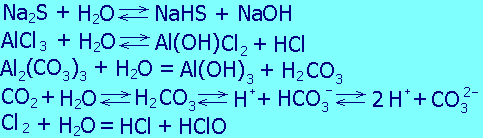
ъ
