Серёгин кирилл викторович синтез аналогов тимидина, модифицированных по 3’-положению
| Вид материала | Автореферат |
- Синтез модифицированных природных хлорофиллов и изучение их свойств для бинарных методов, 503.72kb.
- Подъячев кирилл Викторович, 134.77kb.
- Синтез, химические превращения биологически активных функционализованных ( O, n )гетеро-1,3-диенов, 601.42kb.
- Методы модификации полимерных материалов углеродными наноструктурами, 35.19kb.
- Анализа и синтеза у дошкольников с нарушениями речи. Нарушение речи является распространенным, 68.85kb.
- Новая синтез-программа в Храме Культуры, 46.39kb.
- Истец Форманчук Кирилл Викторович Представитель Семенов Сергей Николаевич Ответчик:, 56.77kb.
- Установка «кирилл и мефодий» на нет-буки ученика, 7.04kb.
- Серегин Сергей Борисович и о. директора по персоналу ООО «ук «Группа «газ» и Свешников, 31.12kb.
- 2 нейронные семиотические системы, 174.78kb.
На правах рукописи
СЕРЁГИН КИРИЛЛ ВИКТОРОВИЧ
СИНТЕЗ АНАЛОГОВ ТИМИДИНА,
МОДИФИЦИРОВАННЫХ ПО 3’-ПОЛОЖЕНИЮ.
02.00.10 – Биоорганическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва – 2007
Работа выполнена на кафедре Биотехнологии Московской государственной академии тонкой химической технологии имени М.В.Ломоносова
Научный руководитель:
Академик РАМН
доктор химических наук, профессор Швец Виталий Иванович
Официальные оппоненты:
доктор химических наук, профессор Преображенская Мария Николаевна
кандидат химических наук, доцент Брагина Наталья Александровна
Ведущая организация:
Государственный научный центр по антибиотикам
Защита состоится «___»_______2007г. в __часов на заседании Диссертационного Совета Д 212.120.01 при Московской государственной академии тонкой химической технологии им.М.В.Ломоносова по адресу: 119571, Москва, пр. Вернадского, д.86.
С диссертацией можно ознакомиться в библиотеке МИТХТ им.М.В.Ломоносова.
С авторефератом диссертации можно ознакомиться на сайте www.mitht.ru
Автореферат разослан «__»_______2007г.
Ученый секретарь Диссертационного Совета,
кандидат химических наук,
старший научный сотрудник Лютик А.И.
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.1
Актуальность работы. Сегодня весьма остро стоит задача поиска эффективных методов лечения различных вирусных и онкологических заболеваний. Основным направлением в ее решении является поиск высокоэффективных биологически активных агентов среди соединений различных классов. В ряду этих соединений важное место занимают нуклеозидные аналоги различной структуры.
В настоящее время существует большое число разнообразных нуклеозидных препаратов, направленных на борьбу с различными вирусами или тормозящих развитие разных форм злокачественных новообразований. К таким нуклеозидам относятся, например, 3'-азидо-3'-дезокситимидин (ретровир, AZT), 2',3'-дидезокси-3'-тио-L-рибоцитозин (ламивудин), которые давно применяются для лечения СПИДа как ингибиторы RT HIV, нуклеозидный аналог 1-N-(рибофуранозил-1-ил)-1,2,4-триазол-3-карбоксамид (рибавирин), который обладает широким спектром противовирусной активности, арабиноцитозин (цитарабин), который применяется при лечении лейкемии и многие другие. К сожалению, при использовании подобных препаратов на практике был выявлен ряд ограничений. При длительном их применении наблюдается развитие вирусной резистентности, и продолжительное лечение или введение их в высоких дозах может вызывать ряд тяжелых побочных эффектов, что связано с недостаточно высокой селективностью действия имеющихся препаратов. Например, длительное лечение ретровиром вызывает угнетение деятельности костного мозга, приводящее к анемии, оказывает отрицательное воздействие на печень. Поэтому поиск новых более эффективных биологически активных соединений в ряду нуклеозидных аналогов и разработка новых подходов к их синтезу остается весьма актуальной задачей.
Работа является частью научных исследований, проводимых на кафедре биотехнологии МИТХТ им. М.В.Ломоносова в рамках госбюджетной темы №1Б-5-856 «Синтез новых фармакологически активных веществ, изучение их биологических свойств и методов направленного транспорта с целью создания противоопухолевых, противовирусных, антипаркинсонических средств», а также по грантам президента РФ по поддержке ведущих научных школ №НШ-2329.2003.4 и №РИ-112/001/609.
Цель работы.
1. Разработка нового эффективного метода синтеза АМТ для получения его в количествах, достаточных для проведения работ по его модификации.
2. Разработка новых методов введения алкильных и ацильных заместителей по 3'-аминогруппе АМТ, методов введения 3'-уреидной и тиоуреидной групп, а также методов получения 3'-гидразидных и 3'-N-нитрозопроизводных АМТ.
3. Получение серии новых производных АМТ с использованием как известных, так и вновь разработанных методик.
^ Научная новизна. Разработан эффективный метод синтеза АМТ путем восстановления 3'-азидогруппы AZT с помощью HCOONH4 на Pd/C. Синтезированы серии новых 3'-N-алкильных, ацильных, 3'-уреидо- и 3'-тиоуреидо-производных АМТ. Разработаны синтезы двух производных АМТ нового типа с 3'-гидразидной и 3'-N-нитрозогруппами. Разработан новый метод введения изотиоцианогруппы по 3'-положению тимидина с использованием CSCl2.
^ Практическая значимость работы. Получено и охарактеризовано 24 новых соединения, из которых два относятся к новым типам аналогов тимидина. Все эти соединения могут быть использованы как субстраты в биологическом скрининге при поиске активных противовирусных и противоопухолевых препаратов. Показана применимость методов алкилирования, ацилирования и введения уреидной и тиоуреидной групп применительно к АМТ и его 5'-OH защищенным производным. Получен новый аминирующий агент на основе гидроксиламина, который может в дальнейшем использоваться в различных реакциях прямого аминирования.
Полученные соединения исследуются на наличие противовирусной и противоопухолевой активности.
Положения, выносимые на защиту.
1. Разработка эффективного метода получения АМТ.
2. Алкилирование 3'-аминогруппы АМТ с помощью реакций Михаэля и восстановительного алкилирования.
3. Получение серии 3'-N-ацильных производных АМТ с ацильными заместителями различного типа с помощью хлорангидридов карбоновых кислот и с применением конденсирующего агента.
4. Синтез 3'-дезокси-3'-изотиоцианотимидина и использование его для получения тиоуреидных производных. Использование АМТ, изоцианатов и изотиоцианатов для введения уреидной и тиоуреидной группы по 3'-положению тимидина.
5. Разработка метода введения N-нитрозогруппы по 3'-поло-жению тимидина.
6. Разработка метода введения гидразидной группы по 3'-поло-жению тимидина с помощью реакции прямого аминирования АМТ.
Публикации. Материалы работы изложены в 5 публикациях, в том числе 2 статьях и 4 тезисах докладов на Всероссийских и Международных конференциях.
^ Апробация работы. Основные результаты работы представлены на молодежной научной школе-конференции по органической химии «Актуальные проблемы органической химии» (Новосибирск, 2003), III-ем Московском международном Конгрессе «Биотехнология: состояние и перспективы развития» (Москва, 2005), Международной конференции по химии гетероциклических соединений «Кост 2005» (Москва, 2005).
^ Структура и объем диссертации. Диссертационная работа состоит из введения, обзора литературы, экспериментальной части, выводов и списка литературы. Работа изложена на ____ страницах, содержит ____ рисунков и ____ таблиц. Список литературы включает ____ источников.
^ РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ.
1. Эффективный синтез 3'-амино-3'-дезокситимидина.
Для синтеза всех полученных нами производных в качестве исходного соединения был выбран 3'-амино-3'-дезокситимидин (1, рис. 1, R=H), поэтому необходимо было получать его в значительных количествах. Для этого нужно было найти эффективный метод синтеза АМТ и его 5'-защищенных аналогов.
В настоящее время существуют два основных подхода к синтезу АМТ. В первом из них в качестве исходного соединения используется тимидин, в 3'-положение которого после ряда превращений вводится фталимидная группа. После аминолиза фталимидной группы метиламином освобождается 3'-аминогруппа. Согласно второму, чаще всего применяемому, подходу 3'-аминогруппа вводится через восстановление в одну стадию 3'-азидогруппы AZT или его 5'-защищенных производных. Использование первого метода непривлекательно из-за многостадийности процесса и невысокого общего выхода целевого продукта. Второй подход включает лишь одну стадию, а исходный 3'-азидо-3'-дезокситимидин в настоящее время является коммерчески легко доступным и относительно недорогим соединением. Поэтому нами был выбран подход, основанный на восстановлении 3'-азидогруппы.
Существует несколько методик восстановления 3'-азидогруппы AZT, которые заключаются в каталитическом восстановлении водородом на Pd/C, восстановлении SnCl2, н-Bu3SnH и NaBH4, трифенилфосфином и различными тиолами. Все эти методики либо дают невысокий выход продукта восстановления, либо связаны с трудоемкими процессами выделения целевого родукта. Так, например, продукт восстановления дитиотриэтолом был получен с выходом 96%, но для его отделения от продукта окисления тиола необходима колоночная хроматография. Это неудобно при рутинном синтезе и получении аминотимидина в больших количествах.
Поэтому нами была разработана новая эффективная методика восстановления AZT, как защищенного по 5'-положению, так и со свободной 5'-гидроксильной группой. Нами было осуществлено каталитическое восстановление 3'-азидогруппы на Pd/C с использованием HCOONH4 в качестве восстановителя (рис. 1). Следует отметить, что восстановление протекает с почти количественным выходом, и процедура выделения была сведена к фильтрованию реакционного раствора через слой силикагеля для удаления остатков катализатора и избытка HCOONH4.
Рисунок 1.
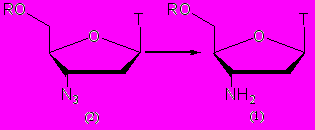
Эффективность методики была продемонстрирована на 5'-неза-щищенном AZT. Затем показана ее применимость к 5'-защищенным производным AZT с защитными группами алкильного, ацильного и силильного типа. При восстановлении производных с ацильными и силильными защитными группами (1а)-(1г), (1ж) были достигнуты выходы, близкие к количественными. Для производных же с тритильными защитными группами (1д), (1е) выходы были несколько ниже (70-80%), что, вероятно, обусловлено частичным отщеплением этих групп в условиях реакции (табл. 1). Время протекания реакции составило от 2 часов для незащищенного AZT (1а) до 2 суток для 5'-O-TBDPS-защищенного исходного соединения (1ж).
Таблица 1. Выходы на стадии восстановления азидогруппы
| № | R | Выход, % |
| 1а | H | 98 |
| 1б | Ацетил | 95 |
| 1в | Пивалоил | 97 |
| 1г | Бензоил | 97 |
| 1д | Тритил | 76 |
| 1е | 4,4'-диметокситритил | 71 |
| 1ж | Трет-бутил-дифенил | 98 |
Структура всех продуктов восстановления (1а)-(1ж) была подтверждена с помощью 1Н-ЯМР-спектроскопии. Значения химических сдвигов протонов соответствовали значениям, известным для подобных соединений.
АМТ и его 5'-защищенные производные использовались нами в дальнейшем при проведении модификаций по 3'-положению в качестве базовых соединений. Полученные типы производных представлены на рисунке 2.
Рисунок 2.
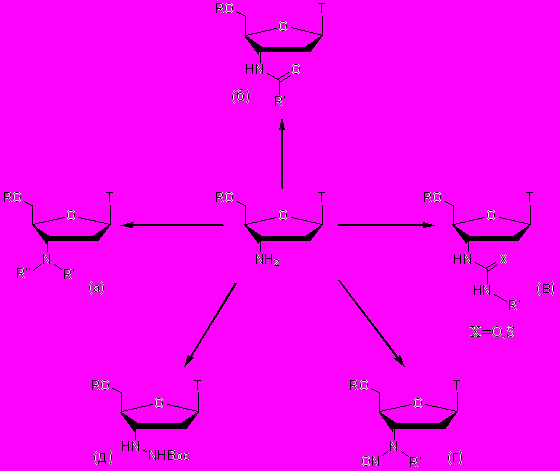
Нуклеозидные аналоги тимидина типов (а), (б) и (в) до сих пор мало изучались. Нами был расширен спектр таких производных и разработаны новые методы их получения. Производные (г) и (д) были нами получены впервые и представляют собой новые типы аналогов тимидина.
2. Синтез 3'-N-алкильных производных 3'-амино-3'-дезокситимидина.
Трифосфат АМТ известен как эффективный ингибитор RT HIV и RT AMV. Существует предположение, что для сохранения у производных АМТ активности, которой обладает трифосфат АМТ, необходимо, чтобы экзоциклический азот по 3'-положению сохранял основность, свойственную алифатическим аминам. Единственной модификацией, для которой выполняется это условие, является алкилирование 3'-аминогруппы.
Имеется ограниченное количество методов получения 3'-N-алкильных производных АМТ из-за сложностей, связанных с проведением этой модификации. При прямом алкилировании АМТ или его 3'-имино-фосфинового производного алкилгалогенидами всегда протекает побочная реакция алкилирования по N-3 гетероциклического основания, что приводит к низкому выходу целевого продукта. При замещении 3'-сульфонатных групп или 3'-галогенидов различными алкиламинами идет конкурентная реакция элиминирования с образованием 2',3'-дидегидро-2',3'-дидезокси производного. При этом продукт элиминирования может быть единственным продуктом реакции. Наиболее эффективными методиками введения алкильного заместителя по 3'-аминогруппе являются восстановительное алкилирования и реакция Михаэля. До сих пор с помощью этих реакций было получено небольшое количество производных АМТ и эффективность протекания этих реакций с АМТ изучена недостаточно.
Для получения дополнительных сведений о восстановительном алкилировании нуклеозидов нами были синтезированы 3'-N-изопропильное (3) и 3'-N-бензильное (4) производные АМТ (рис. 3), которые ранее уже были получены с помощью NaBH4. Впервые нами была продемонстрирована эффективность использования NaB(OAc)3H для восстановительного алкилирования АМТ, вместо применявшегося ранее NaBH4. Такая замена не привела к уменьшению выхода продуктов алкилирования, а процедура выделения для изопропиламинового производного была сведена к промыванию реакционной массы водным раствором поташа. Для выделения бензиламинового производного необходима была дополнительная колоночная хроматография.
Рисунок 3.

Алкилирование АМТ субстратами Михаэля ранее проводилось только с N-этилмалеимидом. Для демонстрации эффективности реакции Михаэля при использовании других субстратов, мы применили в качестве алкилирующих агентов этиловый эфир акриловой кислоты и диметиловый эфир итаконовой кислоты. Этим путем были синтезированы 4 новых производных АМТ (рис. 4).
Присоединение этилакрилата протекало в течение 12 часов в этаноле с нагреванием при кипении. Выход продукта алкилирова-ния (5) составил 95%.
Для проведения повторного алкилирования были необходимы более жесткие условие, возможно, это связано со стерическими затруднениями. Продукт диалкилирования АМТ (6) был получен в кипящем изопропаноле в присутствии каталитического количества КОН. Выход продукта составил 85%.
Рисунок 4.
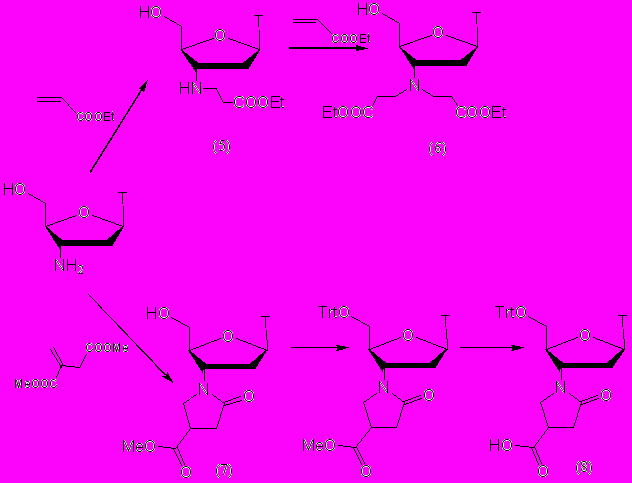
Присоединение диметилового эфира итаконовой кислоты происходило с менее прогнозируемым результатом. Продукт присоединения по α-метилиденовой группе оказался неустойчивым и самопроизвольно циклизовался в пятичленный лактам (7), который был выделен с выходом 85% (рис. 4). Далее этоксикарбонильную группу лактама переводили в карбоксильную метанольным раствором КОН с образованием пирролидонкарбоксилатного производного АМТ (8). Перед этой стадией для облегчения процесса выделения карбоксилатного производного (8) 5'-гидроксильную группу защищали тритильной группой, и соединение (8) было выделено подкислением реакционного раствора уксусной кислотой.
Структуры полученных алкильных производных (5)-(8) были подтверждены с помощью 1Н-ЯМР-спектроскопии. Их спектральные данные соответствуют данным известных 3'-N-алкильных производных АМТ.
3. Синтез 3'-N-ацильных производных 3'-амино-3'-дезокситимидина.
Впервые 3'-N-ацильные производные АМТ были синтезированы давно. Несмотря на это, число работ, в которых упоминается об 3'-N-ацилировании АМТ невелико. Были получены N-формильное и N-ацетильное производные, а также ряд N-ацильных производных, в которых с помощью ацилирования вводили спейсер для флуоресцентной метки, а сам нуклеозид использовали как терминирующий субстрат при секвенировании ДНК. Очевидно, что число полученных до сих пор N-ацильных производных АМТ невелико, и влияние этой модификации на свойства нуклеозида раскрыто недостаточно. Поэтому для установления взаимосвязи структура/биологическая активность мы расширили спектр таких аналогов, применив ряд современных методов N-ацилирования на данном субстрате.
В своей работе мы использовали хлорангидриды карбоновых кислот и конденсирующий агент ВОР. С помощью этих соединений нами были получены две серии новых 3'-N-ацильных производных АМТ.
С помощью хлорангидридов 5'-защищенный АМТ был проацилирован несколькими алифатическими карбоновыми кислотами (рис. 5). Для защиты 5'-гидроксильной группы мы использовали TBDPS-защитную группу. Ее выбор обусловлен возможностью удаления ее в нейтральных условиях и высокой липофильностью, которая упростила процедуру выделения продукта Время протекания реакции в зависимости от ацилирующего агента составило от суток до двух (табл. 2).
Рисунок 5.
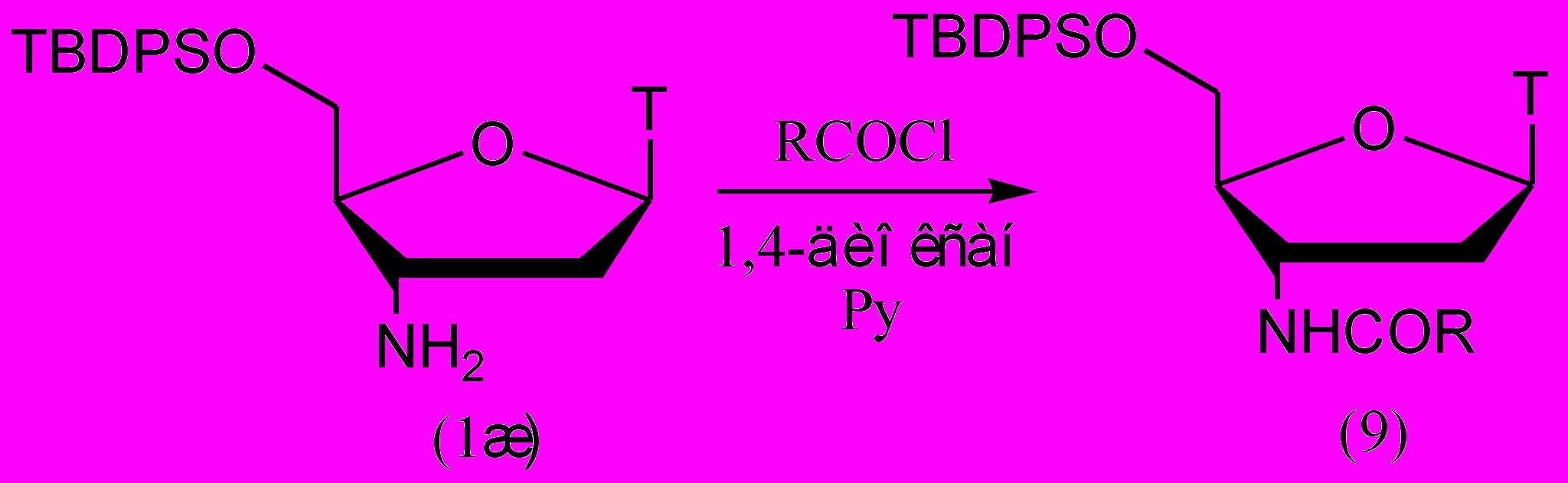
Таблица 2. Выходы продуктов в реакции ацилирования 5'-O-TBDPS-AMT хлорангидридами карбоновых кислот
| № | Кислота | Время реакции, ч | Выход, % |
| 9а | Циклопропанкарбоновая | 20 | 18 |
| 9б | Метоксиуксусная | 45 | 61 |
| 9в | Масляная | 20 | 69 |
Эффективность ацилирования АМТ хлорангидридами была также продемонстрирована нами на хлорангидридах сульфокислот. До сих пор были известны лишь два 3'-сульфамидных производных (мезиламидное и производное сульфаминовой кислоты). Таким образом, синтетические подходы для получения 3'-сульфамидных производных АМТ изучены мало.
Вышеупомянутые сульфамидные производные были получены с помощью хлорангидридов алифатических сульфокислот. Мы впервые использовали для сульфонилирования АМТ хлорангидриды ароматических и гетероароматических сульфокислот и получили два новых производных 2-тиофенсульфо- (10А) и 4-метокси-фенилсульфокислот (10б) (табл. 3). Для упрощения процедуры выделения продукта на 5'-гидроксильную группу также устанавливали гидрофобную TBDPS-защитную группу, хотя сульфохлориды менее активны, чем хлорангидриды карбоновых кислот, и поэтому защита первичной гидроксильной группы от сульфонилирования не нужна. Из-за меньшей активности ароматических сульфохлоридов реакция с (10б) протекала при 60ºС (рис. 6).
Рисунок 6.
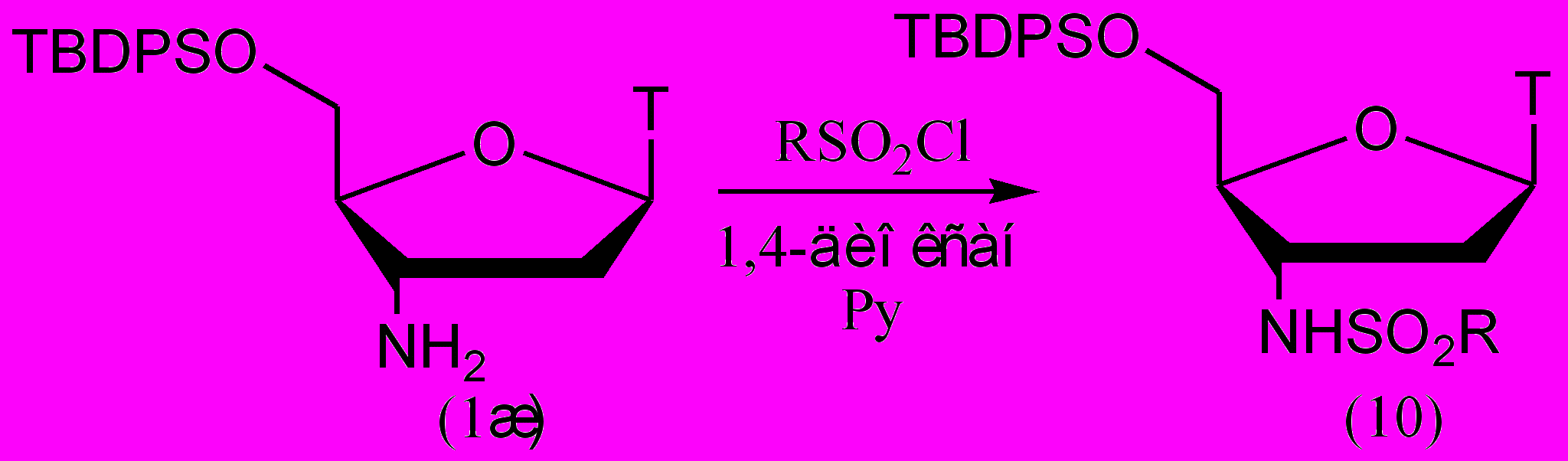
Таблица 3. Выходы продуктов сульфонилирования
| № | Сульфокислота | Время реакции, ч | Выход, % |
| 10а | 2-тиофен | 20 | 66 |
| 10б | 4-Метоксифенил | 48 | 44 |
При синтезе пептидов для образования пептидной связи широко применяется конденсирующий ВОР-реагент. В нуклеозидной химии для N-ацилирования ВОР-реагент ранее не использовался.
Рисунок 7.
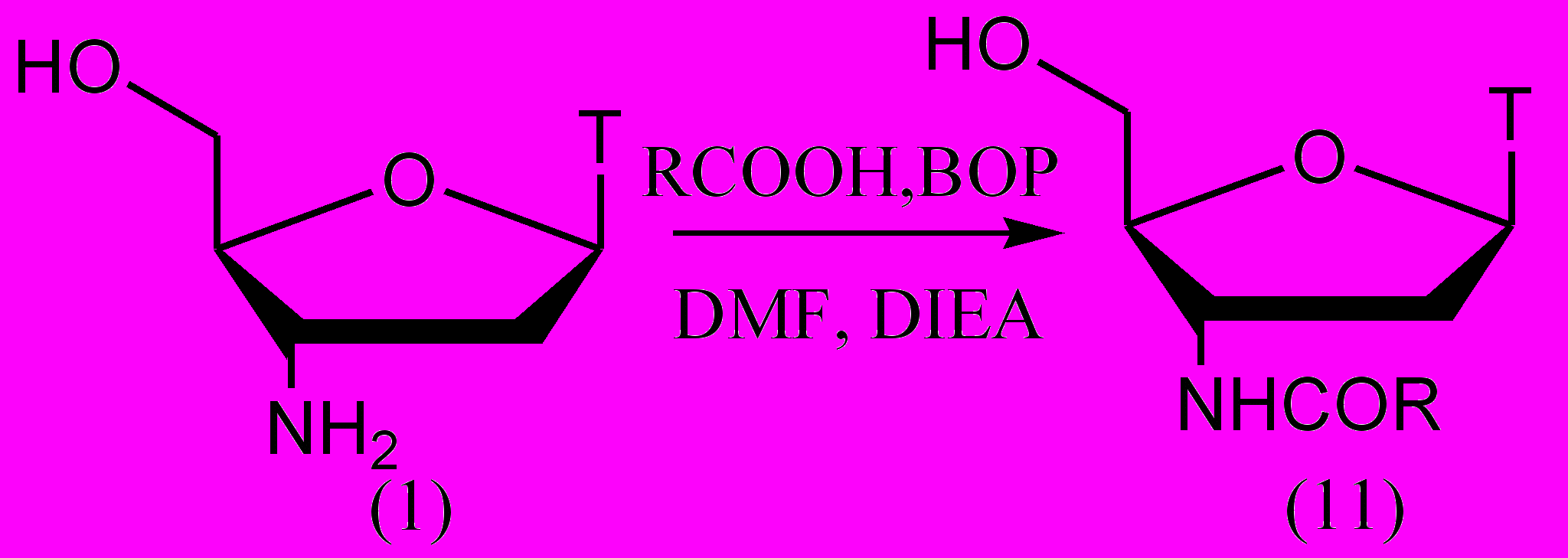
Для демонстрации эффективности применения ВОР-реагента для ацилирования АМТ мы использовали ряд алифатических, ароматических и гетероароматических карбоновых кислот. Выбор кислот определялся целью продемонстрировать методику на максимально разнообразном наборе субстратов (рис. 7, табл. 4). Использование конденсирующего агента позволило селективно ацилировать 3'-аминогруппу без защиты первичной гидроксильной группы. Таким образом, количество стадий было сокращено и повышен суммарный выход продукта.
Таблица 4. Выходы продуктов конденсации АМТ с карбоновыми кислотами на стадии ацилирования
-
№
Кислота
Выход, %
11а
О-метоксибензойная
90
11б
Изоникотиновая
76
11в
2-(4,5-дифенил-1Н-пиразол-1-ил)-уксусная
68
11г
3-бензоилпропионовая
54
11д
3-фенилпропионовая
75
Структуры продуктов ацилирования (9а-в) и (11а-д) и сульфонилирования (10а и б) были установлены с помощью 1Н-ЯМР спектроскопии. Величины химических сдвигов этих соединений соответствуют величинам, приводимым в литературе для производных подобного типа.
4. Синтез 3'-дезокси-3'-изотиоцианотимидина и его производных.
Особый интерес представляют аналоги тимидина, содержащие по 3'-положению химически активную группу, так как предполагается, что такие группы могут взаимодействовать с ферментом, образуя ковалентную связь, и необратимо ингибировать его. К таким группам относится изотиоцианогруппа. 3'-Дезокси-3'-изотиоциано-тимидин ранее был получен и сообщалось, что он обладает заметной противоопухолевой активностью. Он ингибирует лейкемию мышей L5178Y с IC50 равной 3,9 мкг/мл.
Кроме того наличия собственной биологической активности, 3'-дезокси-3'-изотиоцианотимидин может служить базовым соединением для проведения дальнейших модификаций через взаимодействие с различными нуклеофилами. Ранее сообщалось, что при обработке 3'-дезокси-3'-изотиоцианотимидина различными аминами по 3'-положению были введены уреидная и тиоуреидная группы.
До сих пор изотиоцианогруппа вводилась по 3'-положению тимидина либо замещением 3'-сульфонатной группы тиоцианатами щелочных металлов, либо обработкой аминотимидина CS2 в присутствии трифенилфосфина или DCC. Первый метод дает продукт с низким выходом из-за преимущественного образования тиоцианата. Второй метод связан с использованием неудобного в обращении сероуглерода.
Нами был разработан новый способ введения изотиоцианогруппы в нуклеозидную структуру путем обработки АМТ тиофосгеном (рис. 8).
Рисунок 8.
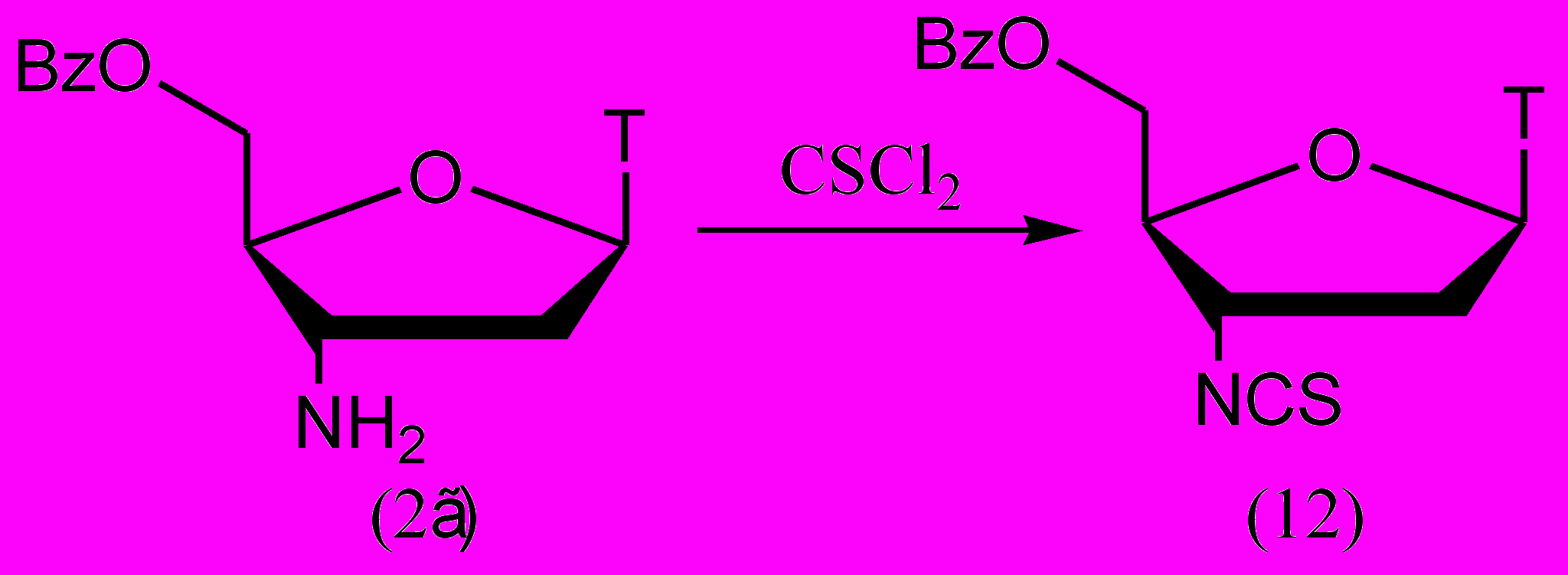
Тиофосгенирование было проведено в двухфазной системе вода-хлороформ. Перед обработкой тиофосгеном 5'-О-Bz-защищен-ный АМТ (2г) был переведен в соль. Бензоильная защитная группа была выбрана из-за ее устойчивости в кислых условиях и для повышения коэффициента распределения продукта между хлороформом и водой. Реакция протекала около суток и целевой продукт (12) был выделен с выходом 82%.
Полученное изотиоцианопроизводное (12) далее вводили в реакцию с N-нуклеофилами (рис. 9). Методика была опробована на NH3 и N2H4. Таким образом, были впервые получены 3'-тиоуреидный (13) и 3'-тиосемикарбазидный (14) аналоги тиимдина. Обе реакции были проведены с 5'-O-Bz-защищенным изотиоцианопроизводным АМТ (12). Его обрабатывали либо метанольным аммиачным раствором, либо 100% гидратом гидразина. В обоих случаях в условиях реакции происходило снятие 5'-О-Bz-защитной группы с образованием незащищенного продукта.
Рисунок 9.
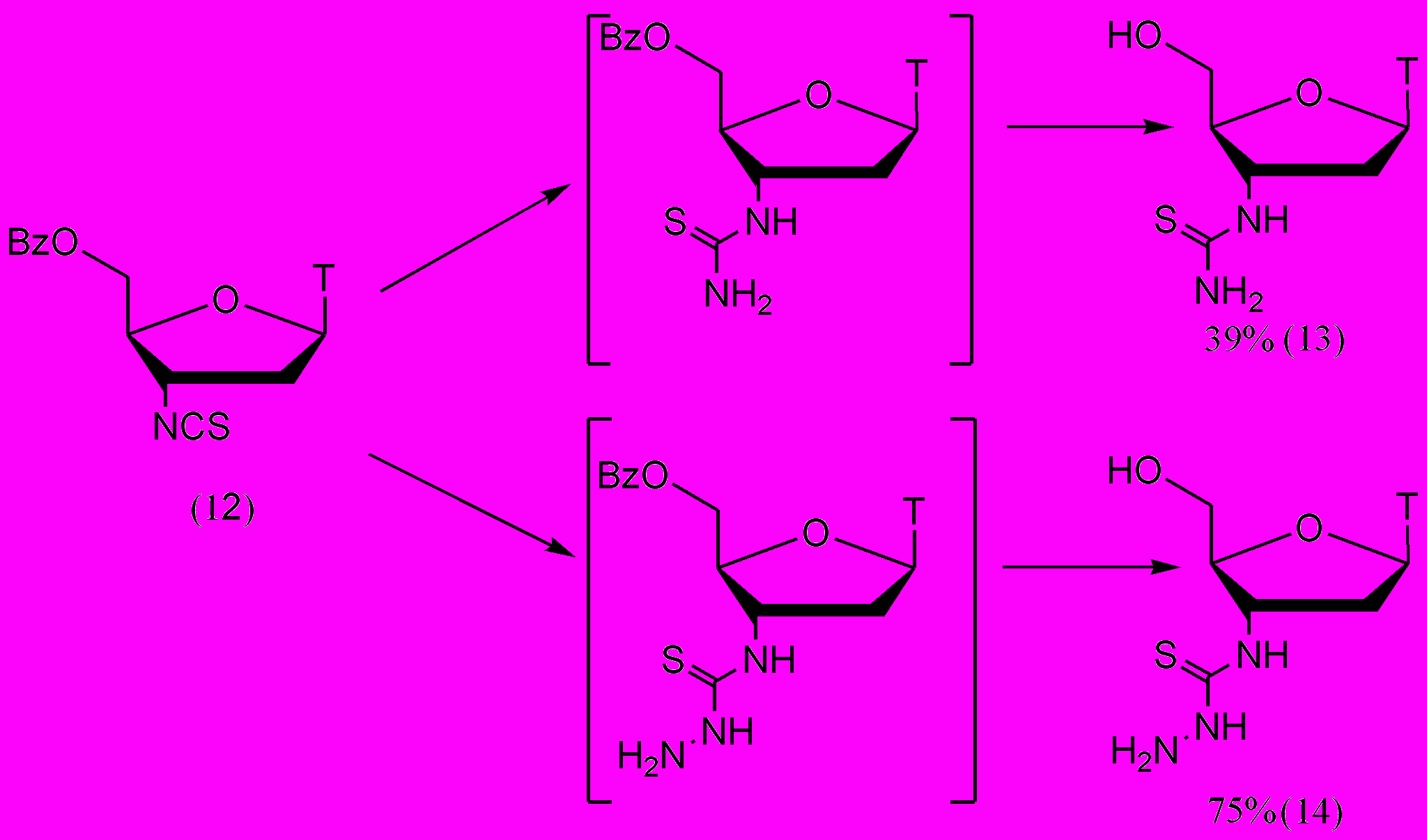
Структура производного (12) и новых тиоуреидного (13) и тиосемикарбизидного (14) производных были подтверждены с помощью ИК и 1Н-ЯМР-спектроскопии.
5. Синтез 3'-уреидных и 3'-тиоуреидных производных 3'-амино-3'-дезокситимидина.
В органической химии одним из способов образования уреидной и тиоуреидной структуры является взаимодействие изоцианатов и изотиоцианатов с различными аминами. Эта методика может быть использована в химии нуклеозидов. При этом возможны два варианта: 1) изотиоциано- или изоцианогруппа входят в структуру нуклеозида, и нуклеозид обрабатывается амином, или 2) аминонуклеозид обрабатывается изоцианатом или изотиоцианатом. Ранее сообщалось об осуществлении обоих подходов. 3'-Уреидную и 3'-тио-уреидную группы вводили для закрепления спейсера флуоресцентной метки и нуклеозид использовали в ДНК-секвенировании. Также сообщалось о синтезе 3'-нитрозоуреидных аналогов тимидина, уридина и 5-фторуридина, которые проявили активность против лейкемии мышей L1210 in vitro.
Применение первого подхода с изоциано- или изотиоциано производными нуклеозидов затруднительно из-за их ограниченной доступности. Второй подход более приемлем, так как 3'-амино-нуклеозид получить достаточно просто, а изоцианаты и изотиоцианаты являются коммерчески доступными реагентами. Впервые этот подход был продемонстрирован на АМТ и 2-хлорэтилизоцианате. Мы расширили спектр 3'-уреидных и 3'-тиоуреидных производных АМТ, продемонстрировав эффективность этого метода еще на одном алифатическом изоцианате, а также на ряде ароматических изоцианатах и изотиоцианатах. Изоцианаты и изотиоцианаты отбирали таким образом, чтобы показать эффективность метода на субстратах разного типа.
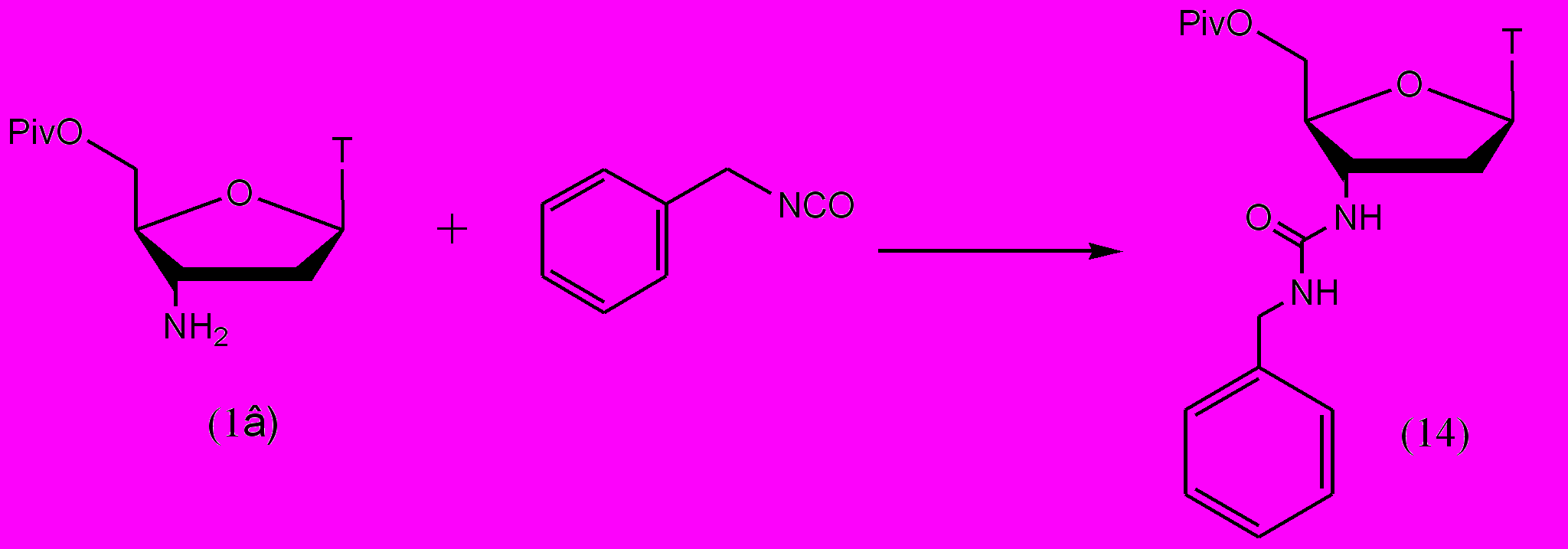
Реакция 5'-O-Piv-защищенного АМТ (1в) с бензилизоцианатом была проведена в кипящем толуоле (рис. 10). После завершения реакции и процедуры выделения целевое уреидное производное (14) было получено с почти количественным выходом.
Рисунок 10.
Реакция с ароматическим изоцианатом протекала в сухом диоксане, реакции с ароматическими изотиоцианатами – в абсолютном метаноле (рис. 11, табл. 5). Для защиты 5'-гидроксильной группы АМТ применяли TBDPS-защитную группу, которая устойчива к воздействию электрофилов. Реакции с 4-фторфенилизотиоцианатом и 2-метоксифенилизоцианатом протекали в течение 3 суток, причем конверсия исходного 5'-защищенного АМТ (1ж) составила лишь 60% и 80% соответственно. Остальные реакции протекали в течение 6 суток.
Рисунок 11.
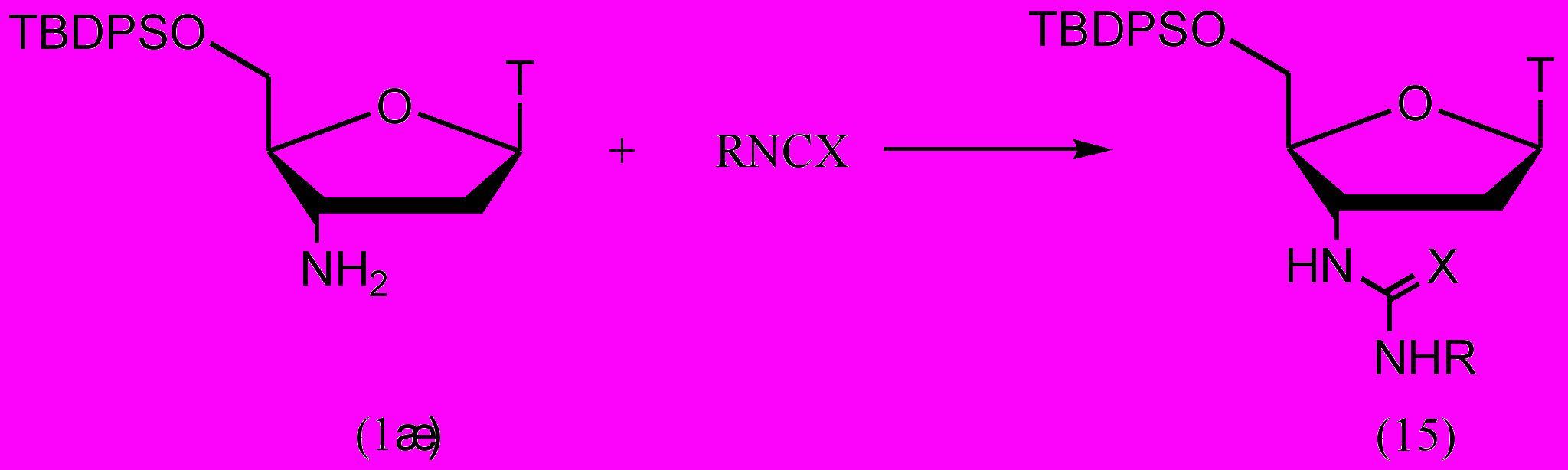
^
Таблица 5. Выходы 3’-уреидных и 3’-тиоуреидных производных АМТ
-
№
R
Х
Выход, %
15а
3,5-диметил-фенил
S
40
15б
2-метилфенил
S
40
15в
4-метоксифенил
S
45
15г
4-фторфенил
S
34
15д
2-метоксифенил
O
39
Структуры всех новых уреидных (14) и (15д) и тиоуреидных (15а-г) производных подтверждены с помощью 1Н-ЯМР-спектроскопии.
6. Синтез 3'-N-нитрозопроизводного 3'-амино-3'-дезокси-тимидина.
В предыдущих разделах была описана работа по расширению спектра производных АМТ уже известных типов. Кроме этого, нами получены производные новых типов.
О модификациях, вводящих по 3'-положению группу со связью N-N ранее сообщалось очень мало. Нам представилось интересным нитрозировать экзоциклическую 3'-аминогруппу АМТ. До сих пор появлялись единичные сообщения о синтезе N-нитрозоуреидных нуклеозидных аналогов, некоторые из которых проявили противолейкемийную активность in vitro. Однако в этих соединениях нитрозирование было проведено по уреидному атому азота в третьем положении, а не по азоту, присоединенному к рибозильному циклу.
Мы впервые провели нитрозирование 3'-аминогруппы АМТ (рис. 12). Однако перед проведением этой реакции необходимо было произвести модификацию 3'-аминогруппы. Хорошо известно, что при нитрозировании первичных алкиламинов образующееся алкилдиазосоединеие неустойчиво. Напротив, вторичные алкиламины образуют устойчивые N-нитрозопроизводные. Поэтому было решено ввести по 3'-аминогруппе АМТ дополнительный алкильный заместитель.
Для алкилирования 3'-аминогруппы 5'-защищенного АМТ (1в) была использована наша методика восстановительного алкилирования с использованием NaB(OAc)3H. 5'-O-Piv-защитная группа была введена для предотвращения нитрозирования первичной гидроксильной группы, она устойчива в кислых условиях реакции и обладает высокой липофильностью, что облегчило процедуру выделения продуктов алкилирования и нитрозирования. Для алкилирования использовали бензальдегид.
Рисунок 12.
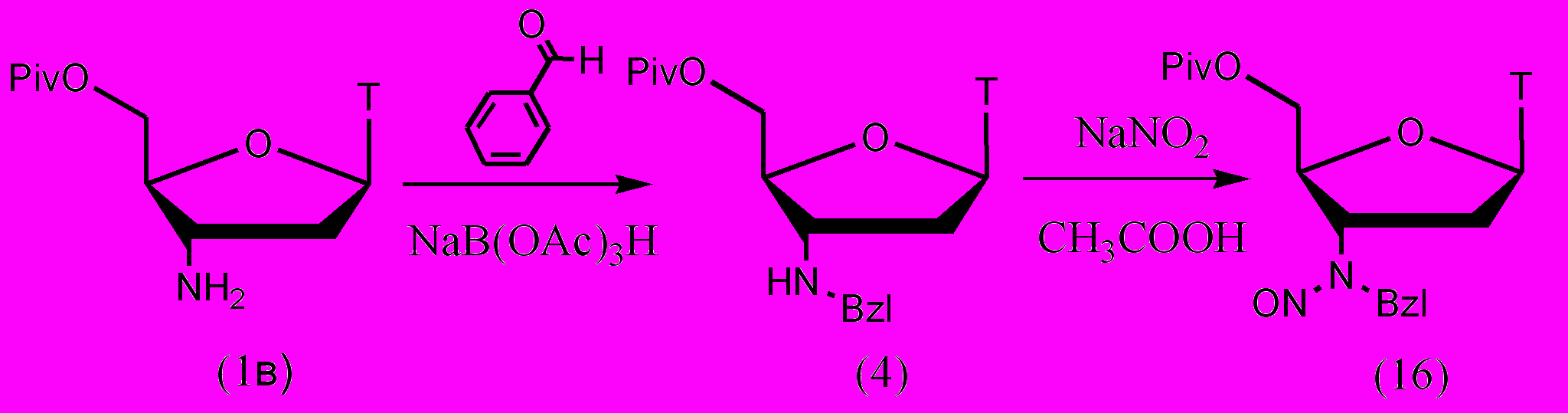
Нитрозирование проводили в уксусной кислоте с использованием NaNO2. Использование двухфазной системы хлороформ-соляная кислота неэффективно из-за низкой конверсии исходного нуклеозида (4). Выход впервые полученного производного (16) составил 62%.
Результаты 1Н-ЯМР и элементного анализа представлены в таблицах 6 и 7.
Таблица 6. Характеристические сигналы 1Н-ЯМР для3'-N-нитрозо-производного АМТ (16)
| № | H-1' | H-2' | H-3' | H-4' | прочие сигналы |
| 1в | 6,11, т, 1Н | 2,12-2,38, м, 2Н | 3,75, м, 1Н | 4,14, м, 1Н | - |
| 4 | 6,2, т, 1Н | 1,7-1,85, м, 2Н | 3,41-3,47, м, 2Н | 3,76-3,80, м, 1Н | PhCH2 7,13-7,24, м, 5Н PhCH2 3,87, д, 2Н |
| 16 | 6,26, иск.т, 1Н | 2,54-2,74, м, 2Н | 5,29, к, 1Н | 4,45, м, 1Н | PhCH2 4,91, к, 2Н C6H5 7,09-7,42, м, 5Н |
Рисунок 13. Расщепление сигнала N-3-имидного протона.
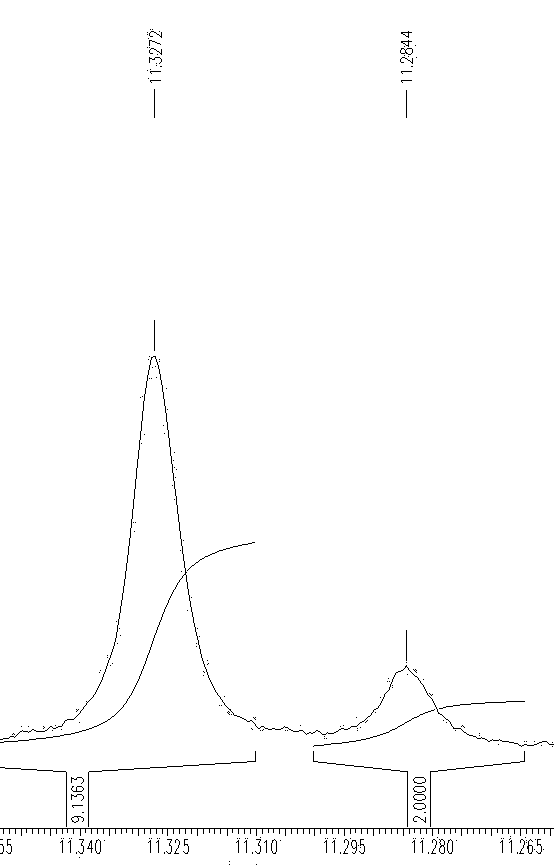
Таблица 7. Данные элементного анализа соединения (16)
| | N, % | C, % | H, % |
| Вычислено | 12,60 | 59,45 | 6,35 |
| Найдено | 12,32 | 59,46 | 6,56 |
Анализ соединения с помощью тандемной системы LC/MS показал наличие иона с массой 445 (расчетная масса соединения (16) 444).
Совокупность аналитических данных подтверждает структуру полученного соединения. На 1Н-ЯМР спектре очень четко прослеживается удвоение почти всех сигналов в соотношении 5:1 (рис. 13). О таком поведении сигналов N-нитрозопроизводных ранее сообщалось в литературе. Соответствующие группы сигналов относятся к двум поворотным изомерам, образующимся из-за частичного двойного характера связи N-NO и, следовательно, повышенного энергетического барьера вращения вокруг этой связи. Эти изомеры существуют именно в соотношении 5:1. Наличие электронноакцепторной группы по 3'-положению подтверждается смещением сигнала протона при C-3' в область слабого поля. Квартет при 4,91м.д. и мультиплет в области 7,09-7,42м.д. соответствуют бензильной группе. Структуру соединения подтверждают также данные элементного анализа (табл. 7) и масс-спектрометрии.
^ 7. Синтез производного 3'-амино-3'-дезокситимидина, содержащего гидразидную функцию по 3'-положению.
О производном АМТ с гидразидной функцией по 3'-положению сообщалось, как о побочном продукте, образующемся в реакции Мицунобу с тимидином. Мы впервые получили 3'-гидразидное производное АМТ как основной продукт с помощью реакции прямого аминирования 3'-аминогруппы АМТ. Эта реакция давно используется для введения гидразильной группы в различные структуры. Однако в химии нуклеозидов она была применена впервые.
В качестве аминирующих агентов до сих пор использовались только О-сульфонил- или О-ацил-гидроксиламины. Мы применили до сих пор неизвестный аминирующий агент N-Boc-O-Ms-гидроксиламин. Его синтез осуществляли двумя последовательными реакциями: установкой Вос-защитной группы с помощью Boc2O и мезилированием. На второй стадии был проведен подбор оптимальных условий реакции. Наибольший выход соединения (17) 84% был достигнут при использовании CH2Cl2 в качестве растворителя и пиридина в качестве основания (рис. 14).
Рисунок 14.
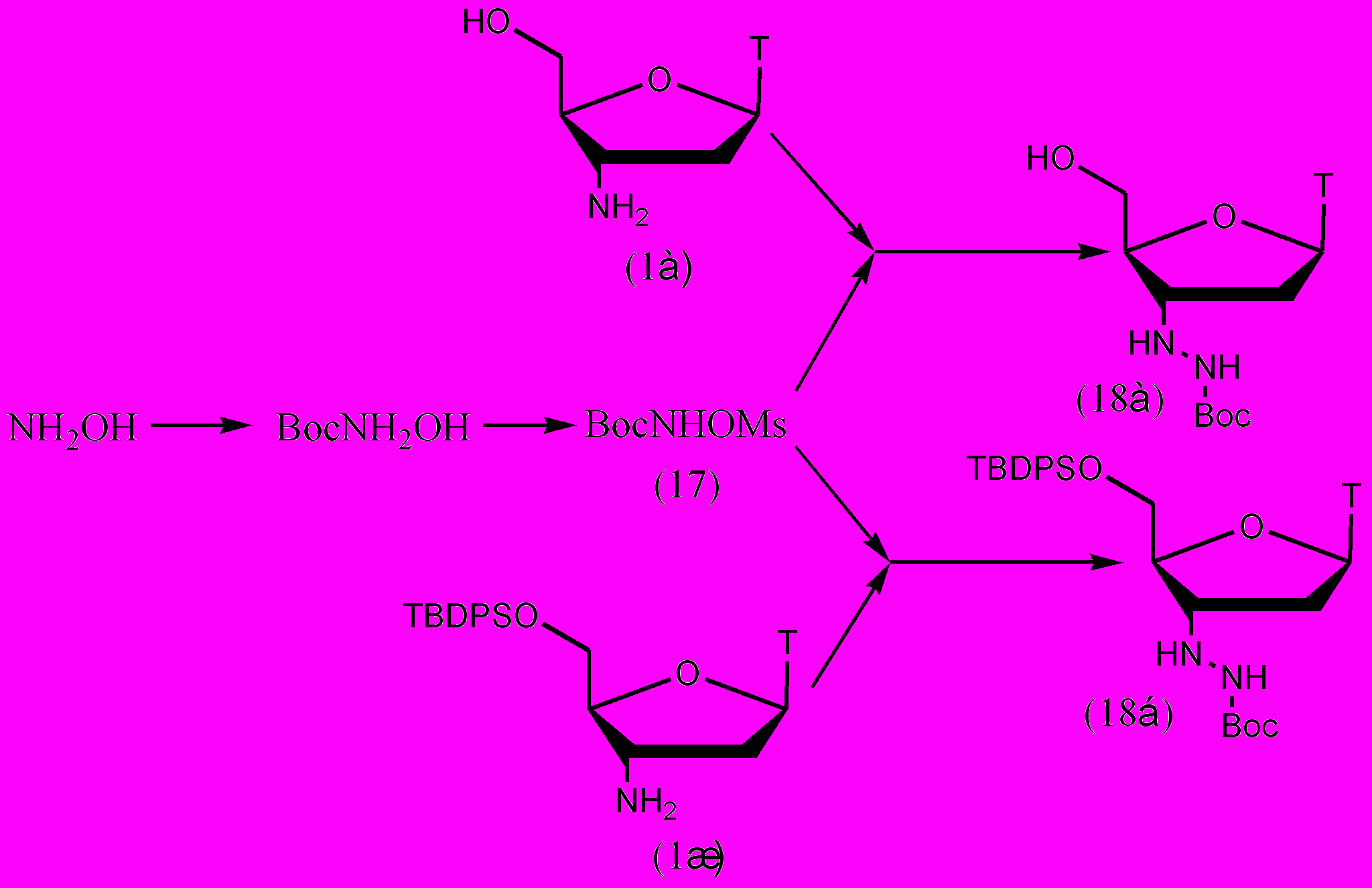
Эффективность реакции аминирования оценивали на незащищенном АМТ (1а) и на АМТ с 5'-O-TBDPS-защитной группой (1ж). Защитная группа была введена для оценки ее влияния на процесс аминирования и для упрощения выделения продукта. В случае незащищенного АМТ (1а) реакцию проводили в абсолютном метаноле при комнатной температуре в присутствии КОН. Продукт удалось выделить с выходом 27%. Для 5'-O-TBDPS-AMT (1ж) реакция была проведена в DMF с использованием в качестве основания DIEA. Выход продукта аминирования (18б) составил 62%.
Результаты 1Н-ЯМР и элементного анализа соединения (18б) приведены в таблицах 8 и 9.
Таблица 8. Характеристические сигналы 1Н-ЯМР для 3'-гидразидного производного АМТ (18б)
| № | H-1' | H-2' | H-3' | H-4' | прочие сигналы |
| 1ж | 6,35, т, 1Н | 2,27-2,47,м, 2Н | 3,82-4,04, м, 1Н | 4,12, м, 1Н | - |
| 18б | 6,35, т, 1Н | 2,31-2,47, м, 2Н | 3,91-4,05, м, 1Н | 4,68, с, 1Н | 3'NHNHBoc 6,88, уш.с, 1Н 3'NHNHBoc 5,88, с, 1Н 3'NHNHCOOC(CH)3 1,26, с, 9Н |
Таблица 9. Данные элементного анализа соединения (18б)
| | N, % | C, % | H, % |
| Вычислено | 9,42 | 62,60 | 7,12 |
| Найдено | 9,19 | 62,65 | 6,97 |
Масс-спектрометрический анализ соединения (18б) был проведен с использованием метода ионизации электроспреем. Были получены ионы с массой 595 и 617, которые соответствуют структурам [M+H]+ и [M+Na]+ (расчетная масса соединения (18б) 594).
Полученная совокупность результатов молекулярного анализа подтверждает структуру соединения (18б). В 1Н-ЯМР спектре при-
сутствуют сигналы протонов гидразидной группы, а также два сигнала, равной интегральной интенсивности, соответствующие протонам двух трет-бутильных групп: одной в ТBDPS-группе и другой, присоединенной к 3'-гидразильной группе 1,26м.д. Это данные подтверждают присутствие в молекуле нуклеозида NHNHBoc-группы. Результаты элементного и масс-спектрометрического анализа также полностью соответствуют предполагаемой структуре соединения.
ВЫВОДЫ.
1. Разработан новый эффективный метод синтеза АМТ путем каталитического восстановления AZT формиатом аммония. Эффективность метода показана на незащищенном AZT и на AZT с 5'-за-щитными группами алкильного, ацильного и силильного типа.
2. Впервые получены 4 новых 3'-N-алкильных производных АМТ. Продемонстрирована эффективность применения для реакции алкилирования АМТ двух субстратов Михаэля, ранее не использовавшихся для этой цели.
3. Получены три серии новых 3'-N-ацильных и 3'-N-сульфо-нильных производных АМТ. Впервые показана перспективность использования для ацилирования АМТ хлорангидридов карбоновых кислот. На серии алифатических и ароматических карбоновых кислот продемонстрирована применимость для ацилирования АМТ конденсирующего ВОР-реагента.
4. Впервые изотиоцианогруппа по 3'-положению тимидина была введена с использованием CSCl2. Продемонстрирована перспективность использования изоцианатов и изотиоцианатов для введения уреидной и тиоуреидной группы по 3'-положению тимидина.
5. Разработан новый метод введения N-нитрозогруппы по 3'-по-ложению тимидина. Получен первый представитель производных этого типа.
6. Впервые продемонстрирована возможность применения реакции прямого аминирования для введения гидразидной группы по 3'-положению тимидина. С помощью этой реакции получен с высоким выходом новый гидразидный аналог тимидина.
^ Основное содержание диссертации изложено в следующих работах.
- Серёгин К.В., Чудинов М.В., Юркевич А.М., Швец В.И. Эффективный синтез производных 3'-амино-3'-дезокситимидина//Био-органическая химия, 2005,-Т.31,-№2,-С.147-150
- Серёгин К.В., Ильтякова Н.А., Чудинов М.В., Швец В.И. Синтез новых 3'-N-ацильных и 3'-N-алкильных производных 3'-амино-3'-дезокситимидина//Вестник МИТХТ, 2006,-Т.1,-№1,-С.33-37
- Серёгин К.В., Чудинов М.В., Юркевич А.М., Швец В.И. Синтез производных 3'-дезокси-3'-аминотимидина//Материалы молодежной научной школы-конференции по органической химии «Актуальные проблемы органической химии», Новосибирск, 2003.
- Серёгин К.В., Чудинов М.В., Юркевич А.М., Швец В.И. Синтез 3'-аминоалкильных аналогов тимидина// Материалы III-его Московского международного Конгресса «Биотехнология: состояние и перспективы развития», Москва, 2005,-С.138-139
- Серёгин К.В., Чудинов М.В., Швец В.И. Синтез новых 3'-N-ациль-ных производных 3'-амино-3'-дезокситимидина//Материалы третьего съезда Общества биотехнологов России им.Ю.А.Овчин-никова, Москва, 2005,-С.21-22
- Чудинов М.В., Серёгин К.В., Юркевич А.М., Швец В.И. Моноалкилгидразины в химии нуклеозидов: синтез и применение//Ма-териалы международной конференции по химии гетероциклических соединений «Кост 2005», Москва, 2005,-С.87-88
1 В руководстве работой принимал участие доцент, кандидат химических наук Чудинов М.В.
В автореферате использованы следующие сокращения:
AZT – 3'-азидо-3'-дезокситимидин, АМТ – 3'-амино-3'-дезокситимидин, Вос – трет-бутилоксикарбонил, ВОР – гиксафторфосфат (бензотриазолил-1-илокси)-трис-(диметиламино)-фосфония, Bzl – бензил, DIEA - диизопропилэтиламин, DMF – диметилформамид, EEDQ – 2-этокси-1-N-этоксикарбонил-1,2-дигидрохинолин, HOBT – 1-N-гидроксибензотриазол, IC50 – концентрация, при которой наблюдается 50%-ное ингибирование роста клеток, LC/MS – тандемный анализ с помощью высокоэффективной ждкостной хроматографии в сочетании масс-спектрометрическим анализом, Ms – мезил, Piv – пивалоил, RT HIV и RT AMV – обратные транскриптазы вирусов ВИЧ и птичьего миелобластоза, TBDPS – трет-бутил-дифенилсилил, TEA – триэтиламин, Trt – Тритил, ВИЧ – вирус иммунодефицита человека, СПИД – синдром приобретенного иммуно дефицита.
