Предупреждение взрывов, аварий и травматизма в системах газоснабжения агропромышленного комплекса путем оценки их состояния и повышения эксплуатационных характеристик
| Вид материала | Автореферат |
- Анализ причин аварийности и травматизма на подконтрольных производствах и объектах., 225.69kb.
- Правительства Российской Федерации от 03. 12. 01 N 841 Собрание закон, 371.05kb.
- Правительства Российской Федерации от 03. 12. 01 N 841 Собрание закон, 370.59kb.
- Районная целевая программа реализации национального проекта «развитие агропромышленного, 148.74kb.
- Учебный план повышения квалификации по программе: «1С. Бухгалтерия», 27.32kb.
- Правительства Российской Федерации от 03. 12. 01 N 841 Собрание закон, 963.75kb.
- Тенденции развития агропромышленного комплекса страны, 35.61kb.
- Разработка метода нечеткой оценки проектных характеристик обучаемого инженера для автоматизированных, 55.1kb.
- Методика оценки последствий аварийных взрывов топливно-воздушных смесей (рд 03-409-01), 414.51kb.
- Аналитической ведомственной программы по дополнительной поддержке занятости работников, 235.34kb.
Одним из важнейших аспектов проблемы водородного растрескивания под напряжением является вопрос о путях и механизмах переноса водорода из внешней среды в сталь, заставляющих атомы водорода в нормальных условиях перемещаться вглубь металла трубы к полостям, давления в которых на 2 3 порядка выше атмосферного.
Предложенный механизм проникновения водорода в сталь основан на реальном строение металла, состоящего из поликристаллитов, между которыми имеются большеугловые межкристаллитные пространства. В свою очередь кристаллиты делятся на фрагменты и блоки, разделенные между собой малоугловыми межфрагментарными и межблочными объемами, входные сечения в которые соизмеримы с диаметром атомов водорода. В межкристаллитных, межблочных и межфрагментарных пространствах сохраняется абсолютный вакуум, куда и проникает атомарный водород под действием градиентов давления и концентрации в соответствии с первым законом Фика (Рис. 1.).
П
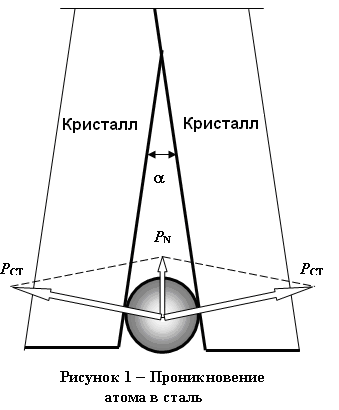 ри наводороживании подземных катоднозащищенных трубопроводов Архимедова сила облегчает проникновение водорода во внутрикристаллитные, межблочные и межфрагментарные полости по нижней образующей трубы, ориентируя перемещение атомов водорода в направлении, близком к нормали к поверхности трубы.
ри наводороживании подземных катоднозащищенных трубопроводов Архимедова сила облегчает проникновение водорода во внутрикристаллитные, межблочные и межфрагментарные полости по нижней образующей трубы, ориентируя перемещение атомов водорода в направлении, близком к нормали к поверхности трубы. Технология получения шовных труб способствует появлению растягивающих напряжений по наружной поверхности образующей трубы, так как ее изготовление гибкой стального листа в вальцах увеличивает входные сечения во внутрикристаллитные объемы.
Остаточные деформации в зонах догиба кромок продольно шовных труб и по осевой линии стального листа способствуют увеличению сечений устьев межкристаллитных, межфрагментарных и межблочных объемов увеличивая вероятность попадания водорода в металл стенки трубы.
Катодная защита трубопроводов создает электрическое поле Е, перемещающее ион водорода (и образующийся из него атом водорода массой m с эффективным «зарядом» q · Z* [ Кл ] в стали) по нормали к поверхности трубы газопровода.
В процессе эксплуатации в результате сезонных вертикальных перемещений из – за изменения уровня грунтовых вод защемленная на боковых поверхностях трубы грунтом эластичная пленочная изоляция вытягивается и по нижней образующей трубопровода наблюдается ее отслоение с образованием гофра, заполненного грунтовыми водами (электролитом) через повреждения гидроизоляционного покрытия и отслоения нахлестов.
Применение импульсных тиристорных защитных катодных станций усугубляет положение, так как амплитуда защитного импульса UИ значительно превышает защитный потенциал UЗ подземного трубопровода, в связи с чем катодная защита при подаче защитных импульсов работает всегда в режиме перезащиты, что приводит к разложению электролита с выделением атомарного водорода, проникающего в стальную трубу.
Образование значительного количества газообразного водорода приводит к дальнейшему отслоению пленочной гидроизоляции, что увеличивает смоченную поверхность трубы газопровода.
Высокие (до 350 [ К ] ) температуры перекачиваемой среды за компрессорными станциями ведут к отслоению пленочного гидроизоляционного покрытия в результате испарения низкотемпературных летучих фракций клеящего состава (праймера) ленты пленочной гидроизоляции.
Давления, испытываемые стенками полостей, хотя там и сохраняется глубокий вакуум, определяются условиями нагружения – атом водорода воздействует на стенки как тонкий клин, утопленный острием в металл.
Сезонные подвижки трубопровода в вертикальной плоскости из – за изменения уровня грунтовых вод приводят к изменению входных сечений в межкристаллитные, межфрагментарные и межблочные объемы, что способствует проникновению водорода в сталь при увеличении входных сечений в микрообъемы и повышает давление на стенки при их уменьшении.
Все перечисленные выше факторы способствуют наводороживанию металла и развитию водородного растрескивания стенок стальных труб газопроводов под действием внешних механических напряжений, вызывая разрушения подземного газопровода.
В итоге сумма слабых воздействий и условия нагружения, наложенные на знакопеременные или изменяющиеся внешние растягивающие нагрузки, обеспечивают проникновение водорода в сталь.
Из всех потенциально возможных источников появления водорода наиболее опасен для подземных газопроводов электролизный водород, постоянно образующийся в значительных количествах в режиме нормальной эксплуатации газопровода (как только под гидроизоляцию проникнет влага), так как все газопроводы оборудованы тиристорной системой катодной
защиты, работающей в моменты поступления защитных импульсов в режиме перезащиты. Подтверждением служит растрескивание трубопроводов при наводороживании стали по нижней образующей трубы и только с наружной стороны.
Атомарный водород перемещается во внутрикрикристаллитные пространства, где сохраняется глубокий вакуум, до достижения одинаковой концентрации газовой фазы во всех доступных объемах, к вершинам пустот и соударяется со стенками полостей, сближающимися под малым углом j к его вершине. Второй закон И.Ньютона определяет соотношение между силой FN , действующей на соударяющиеся тела, и импульсом тела: F N = m ( dV / dt ) , ( 1 )
где dV изменение скорости атома массой m за время dt .
Усилия FCТ воспринимаемые стенками полостей, определяются только условиями нагружения:
FCТ = FN / 2 Sin (a / 2). ( 2 )
Так как границы между фрагментами и блоками малоугловые, то при всех значениях ® 0 Sin . Тогда для любых нормальных значений наружного давления усилия, воздействующие на стенки FCТ, могут достигнуть величин, когда давления РCТ, испытываемые стенками полостей, превысят предел прочности РCТ>>s В для любых металлов (Рис.1), тогда:
РCТ = РN / j . ( 3 )
Покрывая моноатомным слоем поверхность стали, атом водорода с единственным электроном оказывается заряженным положительно, так как его эффективный заряд зависит от контактной разности потенциалов, экспериментально установленный в 1797 году А. Вольта. Это объясняет открытый в начале 80х г.г. ХХ в. французским инженером Пьером Грано эффект перемещения в ванночке с ртутью длиной 300 [мм] под действием электрического тока 400 [А] отрезка медного проводника диаметром 3 [мм] в направлении к отрицательному полюсу со скоростью 0,15 [м / с] по центру тяжести объема ртути идет «электролиз» макрочастиц в расплаве по законам М. Фарадея.
Атомы внедрившиеся в твердое тело перемещаются в металле не только под действием градиентов концентрации (¶c/¶х) [моль/м4] описывающего собственно диффузионный процесс или массоперенос, протекающий в соответствии с первым законом Фика, потенциала (¶j/¶х) [В/м] электропереноса в соответствии с уравнением Фика – Нернста, и температурного градиента (¶T/¶х) [К/м] теплопереноса (энергопереноса) по Фромму Е. и Гебхарту Е, но и градиента давления (¶Р/¶х) [Па/м], описывающего барический перенос или перенос импульса, а также скорости изменения градиента магнитного потока внешнего электромагнитного облучения (¶2Ф)/(¶х¶t) [Вб/(м·с)], объясняющего механизм эвакуации водорода из стали сильными внешними переменными электромагнитными полями. Тогда математическая модель наводороживания при одномерном массопереносе (¶m/¶t) количества вещества ¶m [г], через площадку S [м2] за время ¶t [c] будет иметь вид:
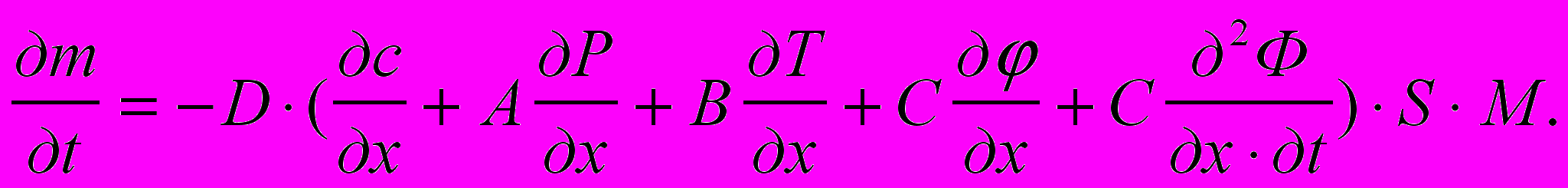 ( 4 )
( 4 )где: А, В, С – интегральные коэффициенты;
М вес грамм – молекулы диффундирующего вещества [г/моль];
D коэффициент диффузии [м2/с].
Знание наводороженности металла трубопровода позволяет оценить несущую способность сооружения и возможность безопасной его эксплуатации. Водород, попавший в межкристаллитные, межфрагментарные и межблочные пространства, создает огромное давление на стенки объемов и сам со стороны стенок испытывает такое же воздействие и находится в микрополостях под давлением выше атмосферного, хотя у вершин этих объемов сохраняется глубокий вакуум. Это создает условия функционирования на поверхности металла концентрационного гальванического элемента, основная токообразующая реакция которого на анодных участках окисление, а на катодных восстановление водорода. При функционировании концентрационного водородного вторичного элемента расход водорода восполняется импульсной катодной защитой. Потенциал стали определяется математической моделью процесса:
| j = [ jЭ 0,0592 · D рН + jК + jАД ] , ( 5) |
где jЭ [B н.в.э.] потенциал образования Fe(ОН)2 ( Fe+ или Fe2 + );
0,0592 перенапряжение [В] реакции разряда иона водорода Н+ ;
DрН величина, показывающая превышение щелочности среды ее
«нейтрального» значения рН = 6,5;
jК; jАД ЭДС концентрационного и концентрационноадсорбционного водородных элементов [^ В] .
Адсорбционная составляющая потенциала jАД может достигать 125
[мВ], но ее величина быстро падает, так как определяется только разностью концентраций адсорбированного на поверхности металла водорода на катодных и анодных участках. ЭДС гальванической пары независимо от концентрации реагирующих компонентов по Нернсту равно:
| Е = jЭ 0,0592 {DрН + [lg (РА / РСТ) ] / z } , ( 6 ) |
где z число электронов, приходящихся на реакцию.
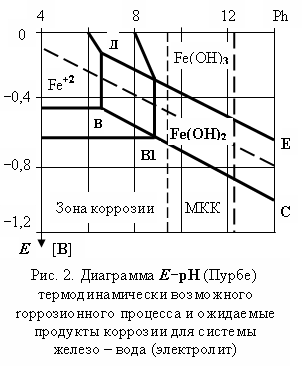
По отклонению от значений диаграммы Пурбе (Рис.2.) электродного потенциала поверхности металла определяют наводороженность стали, рассчитав по уравнению Нернста допустимое давление водорода в металле:
| jК = 0,0592 [ lg (РА / РСТ ) ] ; ( 7 ) |
где РА и РСТ давление водорода на слабо наводороженной наружной поверхности металла и в сильно наводороженных межкристаллитных, межфрагментарных и межблочных объемах.
На основе предложенной физической модели механизма первопричин взрывов – в результате проникновения водорода в сталь и водородного разрушения труб газопроводов под напряжением (стресс – коррозии), уточненной математической модели проникновения водорода в сталь под действием барического переноса и математической модели разблагороживания электрохимического потенциала наводороженного металла разработан «Способ определения стойкости металла подземных трубопроводов к стресс – коррозии» (водородному растрескиванию под напряжением) измерением бесконтактным дистанционным неразрушающим методом электродного потенциала и получен патент Российской Федерации.
М
 етодика обеспечивает диагностику наводороживания металла в самом начале возникновения процесса, когда размеры раскрытия межкристаллитных пространств остаются значительно меньше разрешающей способности всех других методов неразрушающей диагностики не прерывая эксплуатационный режим трубопровода, что позволяет своевременно принять меры по снижению интенсивности наводороживания.
етодика обеспечивает диагностику наводороживания металла в самом начале возникновения процесса, когда размеры раскрытия межкристаллитных пространств остаются значительно меньше разрешающей способности всех других методов неразрушающей диагностики не прерывая эксплуатационный режим трубопровода, что позволяет своевременно принять меры по снижению интенсивности наводороживания. П
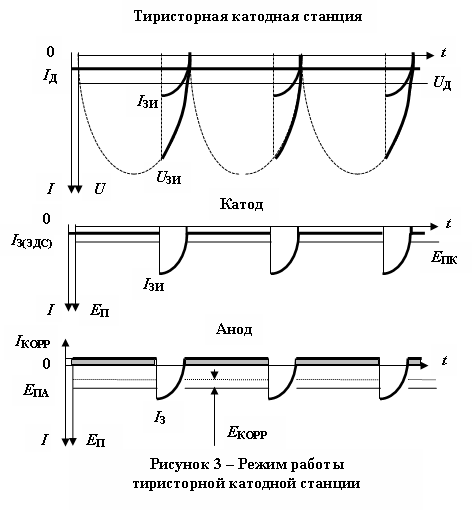 рименение в качестве источников тока тиристорных катодных станций приводит к коррозионным разрушениям подземных газопроводов даже вблизи точек дре-нажа катодных стан-ций – именно в тех местах, где в соответ-ствии с современной теорией подземные со-оружения наиболее на-дежно защищены от коррозионных повреж-дений (Рис. 3).
рименение в качестве источников тока тиристорных катодных станций приводит к коррозионным разрушениям подземных газопроводов даже вблизи точек дре-нажа катодных стан-ций – именно в тех местах, где в соответ-ствии с современной теорией подземные со-оружения наиболее на-дежно защищены от коррозионных повреж-дений (Рис. 3). Защитный ток и напряжение в таких ре-гуляторах получают преобразованием пере-менного синусоидаль-ного однофазного тока 50^ Гц в однополярные импульсы переменной амплитуды с частотой 100 Гц. Величина дей-ствующего значения тока IД и напряжения UД в подобных регу-ляторах определяется соотношением времени протекания тока в цепи и временем пауз между импульсами (IЗ, UЗ). Поэтому формально защищенный действующим значением защитного потенциала трубопровод в паузах между импульсами оказывается свободным от действия защитного тока. Так как в некоторых местах существуют локальные повреждения гидроизоляции (1), под пленочное покрытие поступают влага и грунт (Рис. 4).
П
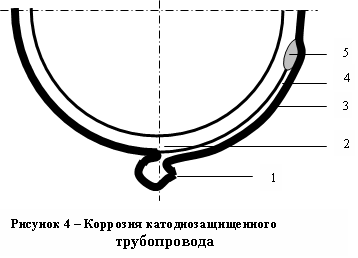 од поврежденной гидрои-золяцией поверхность трубы эффективно аэрируется воз-духом, имеющимся в грунте, что затрудняет адсорбцию водорода. В то же время в непосредственной близости от зон локальных повре-ждений (1) гидроизоляции существуют участки отслое-ния пленочного покрытия (3), заполненные грунтовы-ми водами доступ кислорода в которые затруднен
од поврежденной гидрои-золяцией поверхность трубы эффективно аэрируется воз-духом, имеющимся в грунте, что затрудняет адсорбцию водорода. В то же время в непосредственной близости от зон локальных повре-ждений (1) гидроизоляции существуют участки отслое-ния пленочного покрытия (3), заполненные грунтовы-ми водами доступ кислорода в которые затрудненКатодная поляризация защелачивает прикатодный слой электролита. На поверхностях с мощным локальным повреждением гидроизоляции из за открытости системы в паузах между импульсами рН прикатодного слоя быстро снижается до рН≈7. В местах местного незначительного отслоения гидроизоляции, где сообщение с окружающей средой затруднено, рН длительно сохраняет высокие значения: рН = (9 – 12). На поверхности металла появляются участки, с разной концентрацией протонов в электролите и начинает функционировать концентрационный гальванический элемент, ЭДС которого определяет уравнение Нернста:
Е = 0,0592 {Δ рН + [lg (сА / сД) ]}, ( 8 )
где (сА / сД) отношение количеств адсорбированного водорода на хорошо аэрируемой поверхности в местах мощного локального нарушения изоляции к количеству водорода в мелкодисперсных отложениях в местах местного локального незначительного отслоения пленочного гидроизоляционного покрытия.
Эффективно аэрируемые зоны являются положительными электродами источников тока, а на слабо аэрируемых поверхностях протекают электрохимические коррозионные процессы, связанные с уносом и потерей ионов железа. При поступлении защитных импульсов коррозия прекращается, но в паузах между импульсами коррозионные процессы вновь возбуждаются. Расходные материалы гальванического элемента Н и Fe, так как разность потенциалов сдвигает все окислительные процессы вправо. Защитные импульсы удаляют с поверхности трубы тонкую и плотную магнетитовую пленку, препятствующую проникновению водорода в сталь и протеканию коррозионных процессов:
Fe3O4 + 2H2O = Fe(OH)2 + 2FeO(OH). ( 9 )
Магнетит характеризуется пониженной электрохимической активностью на стадии катодного восстановления до железа и на этот процесс уходит до пяти лет. Образующиеся в процессе реакции метагидрооксид железа III и гидрооксид железа II теряются нижней образующей трубы, выпадая на дно гофра (Рис.4.). Унос продуктов реакции (9) с боковых поверхностей трубы затруднен они скапливаются под гидроизоляцией (5), контактируя с поверхностью трубы (4). Катодная поляризация восстанавливает продукты коррозии до металлического железа по схеме:
FeO(OH) Fe(OH) 2 (HFeO2) 1 Fe. ( 10 )
При отсутствия продуктов коррозии восстанавливаются протоны и поверхность металла покрывается атомарным водородом:
Н1+ + е Н, ( 11 )
что способствует наводороживанию стали. В паузах между импульсами на анодных (сильно наводороженных) участках одновременно с окислением адсорбированного водорода происходит разрушение стали:
Fe + H2O = FeO + 2H, ( 12 )
а при повышенной щелочности по реакции:
Fe + 2H2O = Fe(OН)2 + 2H. ( 13 )
Процессы эти медленные и обычно скорость коррозии не превышает 0,3 мм/год, но ЭДС вторичного концентрационнополяризационного элемента дифференциальной наводороженности сдвигает вправо обе реакции и интенсивность может увеличиться. Токообразующий процесс в паузах между защитными импульсами определяется одной и той же реакцией (11), идущей в разных направлениях:
Н = Н1 + + e , ЕР = 0,00 [ В ] (анод),
Н1+ + е = Н , ЕР + = 0,00 [ В ] (катод).
При подаче отрицательного импульса электрохимический элемент работает в режиме, близком к режиму заряда железного аккумулятора. Кроме реакций ( 10 ) может идти реакция восстановления окиси железа :
2e + FeО + 2H2О = 2 (OH)1 + Fe. ( 14 )
Окисление водорода (в паузах между импульсами защитного тока) происходит только на отрицательном электроде – на сильно наводороженных поверхностях трубы в местах отслоения гидроизоляции, куда только проникает вода и затруднена аэрация. Свободное железо, образовавшееся в процессе электрохимических реакций, не попадает на то место, откуда было извлечено коррозией. Для этого отсутствуют соответствующие условия: восстанавливаемая гидроокись железа не растворима в воде и не является подвижным в подобном электролите компонентом:
2e + Fe(OH) 2 щелочь 2(OH) 1 + Fe .
Так как наряду с окислением железа происходит и его восстановление при поступления на трубу защитных импульсов, в местах непосредственного коррозионного разрушения практически отсутствуют продукты коррозии. При снятии пленочного покрытия в местах коррозионных повреждений можно обнаружить только легко снимающийся слой черного цвета механическую смесь дисперсного железа с незначительной примесью окиси железа FeO, и трехосновного метагидрооксида железа FeO(OH) совместно с незначительным количеством Fe(ОН)2.
Многокилометровая стальная труба, имея значительную площадь поверхности, обладает очень малой удельной поверхностью, в связи с чем количество водорода, поглощаемое сталью трубы, ограничено. Но при появлении с течением времени на поверхности трубы достаточного количества мелкодисперсных отложений последние активно включаются в процесс коррозионного разрушения, так как адсорбируют значительное количество водорода, что приводит к понижению электродного потенциала стальной поверхности, с которой отложения контактируют. Кроме того, отложения выполняют роль активной массы отрицательного электрода железного щелочного аккумулятора. Отложения имеют тонкодисперсную структуру и (вследствие высокой удельной поверхности) более активны и реакционноспособны, чем поверхность металла, что несколько снижает скорость уноса ионов железа из стенки трубы.
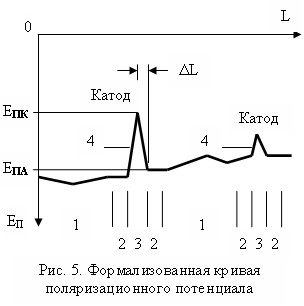
Работа вторичного химического источника тока дифференциальной наводороженности контролируется соотношением площадей анодной и катодной зон. Если площадь катодной (оголенной) зоны значительно меньше площади анодной, то скорость коррозии невелика вследствие быстрой поляризации катодного участка трубы. Это наблюдается на протяженных переувлажненных участках трассы. Если площадь анодных зон значительно меньше площади катодной зоны, то наблюдаются локальные коррозионные повреждения боковых поверхностей труб газопроводов во влажных тяжелых грунтах. Для оценки состояния металла газопровода, срок службы которого превышает 5 лет, предложено эмпирическое выражение, позволяющее определять глубину коррозионного поражения d(КОРР) [ мм ] стенки трубы (Рис. 5) на анодных участках (2):
d (КОРР) = 2 (Е ЭДС (КОРР) / DL) (TГ – 5) (IМАХ / IД (СР)), ( 15 )
где: Е ЭДС (КОРР) / L [ В / м ] градиент потенциалов между вершиной и основанием “воронки провала” (4) на участке (3) кривой поляризационных потенциалов;
Т Г срок службы газопровода в годах;
I МАХ и I Д (СР) максимально возможный (паспортный) и средний действующий ток катодной станции за период эксплуатации [ А ].
Протяженность оголенных участков трубопровода равна протяженности катодных зон (3) – воронок провалов (4). На участке 1 коррозионные
повреждения незначительны, так как мал градиент потенциалов. Площадь S [мм2] повреждения гидроизоляции определяют по формуле:
S = 40000 ЕЭДС(КОРР) ∕ ΔL, ( 16 )
где ЕЭДС(КОРР) = ЕПА ЕПК ; ЕПА и ЕПК потенциалы анодной и катодной зон; ΔL половина протяженности катодной зоны.
П
 редложенная методика по-вышения информативности поля-ризационных кривых позволяет производить диагностику корро-зионных повреждений металла и повреждения гидроизоляции бес-контактным методом, не прерывая эксплуатационный режим трубо-провода, без применения дорого-стоящих внутритрубных снарядов. Это обеспечивает возможность своевременного принятия мер по снижению интенсивности коррозионных процессов.
редложенная методика по-вышения информативности поля-ризационных кривых позволяет производить диагностику корро-зионных повреждений металла и повреждения гидроизоляции бес-контактным методом, не прерывая эксплуатационный режим трубо-провода, без применения дорого-стоящих внутритрубных снарядов. Это обеспечивает возможность своевременного принятия мер по снижению интенсивности коррозионных процессов.Для оперативной диагностики состояния металла газопровода и его гидроизоляции в целях своевременного проведения профилактических мероприятий в целях исключения разрывов трубопроводов, сопровождающихся взрывами и пожарами, разработан «Способ измерения поляризационного потенциала металлических подземных сооружений», при котором измерение потенциала проводят после отключения защитного тока на коротких участках для уменьшения влияния гетерогенности грунта. Значение поляризационного потенциала станции № N определяют суммированием всех показаний милливольтметра до станции № N с нарастающим итогом с учетом знака измеренных потенциалов и вычитают из этой суммы потенциал электрода сравнения:
i = N
ЕПN = U1 + Ui UЭС ; ( 17 )
i =2
где: ЕПN – поляризационный потенциал на станции измерения № N ;
U1 – разность потенциалов труба земля на первой станции измерения между выводом контрольноизмерительной колонки, соединенным с телом трубы и неполяризующимся электродом сравнения;
UЭС – потенциал неполяризующегося электрода сравнения;
Ui – разность потенциалов между электродами сравнения на каждой из станций измерения.
Одним из опаснейших повреждений конструкций газифицированных объектов АПК, работающих в условиях действия растягивающих нагрузках при повышенных температурах, является межкристаллитная коррозия, результатом которой являются разрушения сварных швов трубопроводов и поверхностей нагрева паровых котлов, что приводит к авариям и травматизму. При межкристаллитной коррозии могут отсутствовать ярко выраженные изменения внешнего вида доступных для визуального осмотра мест повреждений, особенно в начальном периоде коррозионного разрушения. Иногда такие изменения невозможно обнаружить без соответствующих приборов, специального оборудования и приспособлений. Чаще всего межкристаллитная коррозия наблюдается в зоне термического влияния сварных швов и в наплавленном металле сварного шва в тех местах конструкции, где шел интенсивный рост кристаллов.
Существует несколько вариантов объяснения причин возникновения межкристаллитной коррозии. Теория химически нестойкой фазы основывается на образовании неустойчивых карбидов внедрения на основе марганца, молибдена и ванадия, образующих цепи, проходящие через искаженные кристаллические решетки металлов. Карбиды реагируют не только с разбавленными кислотами но и с водой.
Остальные модели межкристаллитной коррозии исходят из электрохимической природы разрушения, основу которых составляет контактная разность потенциалов 12, открытая Алессандро Вольта, являющаяся рядом по восходящей работ выхода А электронов с зарядом е=1,6 .1019 Кл двух контактирующих металлов:
12 = (А1 А2) / е . ( 18 )
У часто встречающихся в стали примесей Mn, Cr, Ni и Mo электродные потенциалы соответственно равны: 1,18, 0,74, 0,25, 0,20 ^ В; у железа электродный потенциал 0,44 В, у Si и С 0,857 и 0,199 В (+0,056 В). Работа выхода электронов для Mn, Cr, Ni и Mo равна: 3,81; 4,35; 4,67; 4,12 и 4,21 Дж/моль; для Si и С 3,96 и 4,24 Дж/моль соответственно.
Существующие гипотезы объясняют коррозионные процессы легированных и высокоуглеродистых сталей. Вместе с тем, теория напряжений не объясняет причин межкристаллитной коррозии стали в воде, перегретой до 3500 С. Наличие по границам зерен зон с разными электродными потенциалами изза неоднородности состава не объясняет причин слабой активности коррозионных процессов при непосредственном контакте с агрессивной средой на наружных поверхностях кристаллов, где агрессивной среде обеспечен доступ. Контактная разность потенциалов не объясняет, почему при разности потенциалов 0,3 В между Cr и Fe и при разности потенциалов в 0,15 B между Fe и Ni и в первом и во втором случаях идет коррозия железа, в то время как хром расположен левее железа в ряде активности металлов. Не объясняют существующие теории причин межкристаллитной коррозии у сталей без легирующих добавок, например у стали 20, широко применяющейся не только в энергокотлостроении, но и для изготовления труб газопроводов.
Основной причиной возникновения электрохимических процессов именно по границам зерен кристаллов следует считать наводороживание металла, возникающее при наличии значительных знакопеременных нагрузок. Насыщение металла водородом приводит к разблагороживанию электродного потенциала и возникновению гальванических элементов дифференциальной наводороженности. Источником водорода выступает вода или раствор щелочи, взаимодействующие с железом ( 12, 13 ). При нагревании железо реагирует с концентрированными (примерно 50 %) растворами щелочей с выделением атомарного водорода:
Fe +2(OH)1 +2H2O = [ Fe(OH)4 ] 2 + 2H . ( 19 )
Эта реакция характерна для котловой воды с высокой щелочностью.
Способствуют наводороживанию сварных швов и околошовной зоны термические процессы, происходящие при сварке металла, во время которых происходит укрупнение зерна в зоне перегрева и рост кристаллов столбчатых дендритов в центре сварного шва. Атомы водорода в соответствии с законом Фика «заколачиваются» в межкристаллитные, межфрагментарные и межблочные пространства (в которых при нормальных условиях сохраняется глубокий вакуум) атмосферным давлением и, исходя из условий нагружения, создают высокие давления на стенки полостей, а значит и стенки полостей также оказывают на атомы водорода такое же давление (Рис.1.). Находящийся под огромным давлением в межкристаллитных пространствах водород, расширяясь, производит работу, генерируя ЭДС в соответствии с уравнением Нернста (7), что приводит к понижению электродного потенциала устья элементарного межкристаллитного объема по сравнению с очень слабо наводороженной наружной поверхности стали, контактирующей с водой. Через замкнутую электролитом цепь начинает течь ток, плотность которого теоретически может достигать 32,7 А/м2, что соответствует скорости коррозии 37,9 мм/год. Окисляющийся электрод (анод) подобного гальванического элемента устье межкристаллитного объема, интенсивно разрушающееся электрохимической коррозией. Основная токообразующая реакция (11), идущая в разных направлениях: на аноде окисление водорода, катодный процесс представлен восстановлением водорода. ЭДС этого гальванического элемента дифференциальной наводороженности может достигать 0,25 В, а с учетом адсорбционной составляющей (кратковременно) анодный потенциал может понижаться до 0,4 В. При понижении анодного потенциала ниже 0,12 В возможно протекание реакции окисления гидрооксида железа II до метагидрооксида железа III:
Fe(OH)2 + (OH)1 FeO(ОН) + H2O + е; ( 20 )
потенциал которого в соответствии с диаграммой Пурбе (Рис. 2.) может принимать значения ниже 0,12 ^ В (в зависимости от рН). В увеличенные коррозией сечения межкристаллитных объемов проникают другие атомы и молекулы, в том числе молекулы О2, Н2О и тогда возможны реакции:
4Fe + 2Н2О + 3О2 = 4FeО(OН) = 2(Fe2О3 . Н2О), ( 21 )
4Fe(OН)2 + О2 = 4FeО(OН) + 2H2О , ( 22 )
4 Fe(OН)2 + 2H2О + О2 = 4Fe(OН)3 . ( 23 )
Любая, идущая с выделением водорода, реакция (12, 13, 19), обеспечивает сколь угодно долгое протекание токообразующих процессов, понижающих анодный потенциал устья межкристаллитного объема и сдвигает любую из реакций (20–23) коррозионного процесса вправо. Так как межкристаллитные полости имеют значительную протяженность в толще металла, то возникший концентрационный гальванический элемент дифференциальной наводороженности продолжает свое разрушающее действие, интенсивно расширяя и углубляя межкристаллитную полость. А все химические несовершенства границ кристаллов ускоряют этот процесс, который интенсивно протекает при условии, что площадь наводороженных участков значительно меньше хорошо аэрируемых (катодных) поверхностей металла, защищенных от наводороживания плотной магнетитовой пленкой и слоем наклепа.
В целях постоянного контроля агрессивности котловой воды и интенсивности межкристаллитной коррозии предлагается устанавливать индикаторы коррозии на опускных трубах паровых котлов, помещать в них исследуемые образцы, изолируя их от корпуса индикаторов и определять агрессивность котловой воды при пропаривании измерением электрического сопротивления электролита, а интенсивность межкристаллитной коррозии – измерением ЭДС коррозии.
^ В третьей главе «ОСНОВНЫЕ ПОЛОЖЕНИЯ ПО ПРЕДОТВРА-ЩЕНИЮ ВЗРЫВОВ И АВАРИЙ НА ГАЗИФИЦИРОВАННЫХ ОБЪЕК-ТАХ АПК» рассмотрены возможные пути предотвращения стресс коррозионных процессов, одним из которых является плакирование или легирование поверхностных слоев стали медью и алюминием.
Для обеспечения безопасной эксплуатации объектов АПК необходимо знание свойств материалов, применяемых для изготовления оборудования взрывоопасных и пожароопасных производств. Отсюда – возникает необходимость знания строения металлов, основой которых является кристалл.
Кристалл – упорядоченная совокупность атомов. Каждый атом в кристалле занимает определенное положение, зависящее от его размеров и валентности, которые определяют геометрическую взаимосвязь атома с кристаллической решеткой. Местоположение атома в кристалле характеризует среднее положение его центра массы, так как атом в узле кристаллической решетки совершает тепловые колебания.
Несмотря на существующие разногласия по вопросу описания структуры жидкостей, ее рассматривают как совокупность атомов и молекул, колеблющихся около среднего положения с частотой, зависящей от температуры. Но если в кристалле соседи у отдельного атома остаются постоянными длительное время, то в жидкости соседи меняются чаще, так как границы колебательного перемещения атома определены гораздо менее жестко и атом совершает свои колебания с большей амплитудой, чем в кристалле. В пользу этого представления свидетельствуют диффузионные характеристики жидкостей. Вместе с тем, в жидкости остаются ограничения амплитуды колебаний атомов со стороны соседей, о чем свидетельствует вязкость жидкостей. Различие между кристаллами и жидкостью проявляется в их поведении под действием внешних нагрузок. Жидкость при приложении к ней любой сколь угодно малой сдвиговой силы изменяет свою форму. Твердое тело, при приложении малых нагрузок, деформируется. Упруго – сдвиговая деформация при снятии нагрузки полностью или частично исчезает. Гораздо важнее известный факт, что для превращения кристаллического тела в жидкость при температуре плавления к нему требуется подвести определенное количество энергии при данной температуре. Это скрытая теплота плавления, необходимая для превращения кристаллического тела в жидкость, которая не увеличивает энергии тепловых колебаний, ввиду постоянства температуры процесса. Она необходима для перевода атомов в состояние с большей потенциальной энергией, чем в кристалле, хотя в обоих случаях каждый атом обладает минимально возможной свободной энергией, соответствующей температуре плавления, но в жидкости этот минимум выше, чем в кристалле. Вторая особенность заключается в том, что плотность кристалла больше плотности образовавшегося из него расплава, поскольку кристалл и жидкость имеют разную структуру - строение кристалла всегда более упорядочено. Это относится ко всем металлам, кроме галлия, висмута, германия и кремния.
Современная теория, подробно описывая термодинамику фазовых переходов, не отвечает на вопрос о процессах, заставляющих кристаллическую решетку менять свою структуру при фазовых переходах. Кристаллизация сплавов является одной из важнейших ветвей проблемы фазовых переходов, но прогресс в исследованиях фазовых переходов не оказал заметного влияния на развитие теории кристаллизации вещества. Для изучения явлений, происходящих в кристаллической структуре при приближении к температуре плавления используется широкий диапазон методов – от расчетов классическими и квантовыми методами до модельных экспериментах на «кристаллах» из заряженных капель. Но проблема описания перехода вещества из твердой фазы в жидкую, также как и проблема изоморфного превращения, сохраняет актуальность. Последнее значительное экспериментальное открытие в области науки о кристаллизации, плавлении и жидком состоянии было сделано в начале XX в. в связи с развитием рентгенографии и нейтронографии. Ценные работы были выполнены Г.В. Стюартом, И.Г. Кирквудом, И.Д. Берналом, Н.С. Гингричем, но первым провел систематические исследования структуры жидких металлов с помощью метода рассеяния рентгеновских лучей поверхностью жидкости В.И. Данилов. Он подчеркнул сходство атомных структур ближнего порядка твердых и жидких металлов вблизи температуры плавления и постепенное размытие кристаллоподобной структуры ближнего порядка в жидкостях по мере их перегрева. Результатом открытия был отход от ранее господствовавших представлений о близости строения жидких металлов к хаотическому строению газов, ведущих свое начало от работ Ван – дер - Ваальса, хотя термодинамика утверждает, что жидкое агрегатное состояние вполне самостоятельно и должно обладать определенной структурой. Современные статистические тории жидкого состояния вещества используют представления о парном межатомном взаимодействии, сведения о которых извлекаются из данных рентгенографии и нейтронографии жидких металлов с помощью методов М. Борна - Х.С. Грина и Д.К. Перкуса - Г.И. Йовика. Оба главных подхода к описанию строения вещества моноатомный и кластерный страдают несоответствием термодинамическому условию двухфазности и исходят из того, что представления о моноатомах или кластерах как о структурных единицах достаточны для описания агрегатных состояний вещества. Но термодинамика утверждает, что этого недостаточно, что есть еще, по крайней мере один существенный фактор, определяющий агрегатное состояние вещества.
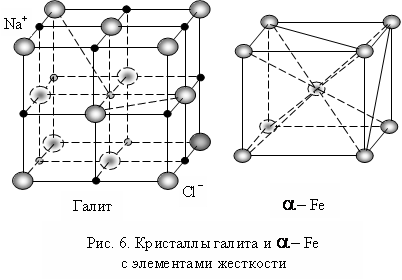
Современные кристаллография и материаловедение совершенно не объясняют причины высокой прочности кристаллов. В соответствии с современными взглядами атомы (и ионы) в узлах кристаллической решетки связаны между собой прочными межатомными связями, но если внимательно рассмотреть модели предлагаемых сингоний кристаллических решеток, то становится очевидным, что подавляющее их число не может самостоятельно сохранять свою форму, так как их пространственный каркас не имеет элементов жесткости, которыми в механике являются диагональные связи плоских и пространственных рам. Простейшей кристаллической решеткой является кубическая решетка галита NaCl, представленная ионной решеткой, в которой ионы натрия Na+ и хлора Cl попеременно располагаются в углах кубов ( Рис. 6.). Если бы натрий и хлор были многовалентны, можно было предполагать, что межатомные связи «вморожены» в узлы решетки, что их взаимное пространственное положение определяется ограничениями, накладываемыми взаимным расположением валентных электронов на орбитах атомов. Но и натрий и хлор одновалентны и связи в решетке осуществляются последовательным «опросом» в пространстве валентным электроном своих соседей. И если связи между узлами ограничены только ближним (ближайшим) порядком по ребрам куба, то подобная кристаллическая решетка должна сложиться под собственным весом, так как в принципе не может сохранить свою форму (как любая жидкость, принимающая под действием силы тяжести форму сосуда, в который она помещена). Но каменная соль твердый и прочный материал.
Аналогичная картина наблюдается при рассмотрении объемно центрированной кубической кристаллической решетки a - железа: 6 полуоктаэдров, имеющих одну общую вершину. Квадратные основания полуоктаэдров являются гранями объемно центрированного куба и также не представляют жесткую конструкцию ( Рис. 6.) при отсутствии диагоналей.
В соответствии с предлагаемой уточненной моделью строения кристаллической решетки твердого тела любая решетка имеет короткие и длинные диагональные связи. Короткие связи по ребрам куба, определяют прочность кристалла. Они не могут укорачиваться. Наличие коротких диагоналей по граням свидетельствует о том, что газообразное вещество превратилось в жидкость. Длинные диагональным связи по противоположным вершинам куба свидетельствуют о том, что жидкость превратилась в твердое тело и определяют жесткость и устойчивость системы. Длинные диагонали самые прочные и способствуют фазовому переходу твердого тела в жидкость, так как вследствие периодичности опросов связей длинная диагональ сильно искажает кристаллическую решетку. В любой момент времени часть атомов кристаллической решетки не связаны между собой связями, поэтому в результате температурных колебаний, наложенных на искажения геометрии решетки они успевают «убежать» на расстояние, превышающее длину связей, в результате чего происходит фазовый переход.
Д
 ля a Fe короткими связями, определяющими прочность металла, будут 8 связей между центральным атомом и вершинами куба. Роль «коротких
ля a Fe короткими связями, определяющими прочность металла, будут 8 связей между центральным атомом и вершинами куба. Роль «коротких диагоналей» играют ребра кубов (8 связей в основаниях и 4 по вертикали). Длинные диагональные связи это связи по диагоналям 6 граней. Одновременно осуществлять опрос связей с соседними атомами в элементарном кубике, не мешая при этом друг другу, могут только два наиболее удаленных атома элементарного кубика. Если синхронизация опроса по одной из осей измерения нарушается, то строго синхронизированный массив элементарных кристаллических ячеек обособляется в блок или фрагмент. Наличие хотя бы малоугловых границ между частями одного кристалла является причиной нарушения синхронизации опроса связей и образования блоков, фрагментов и кристаллов. Разработанная уточненная модель кристаллической решетки твердого тела позволила рассчитать теоретическую прочность железа по методике Я.И. Френкеля, но с более высокой точностью.
Стационарные процессы цементации в твердом карбюризаторе протекают при высоких температурах при дефиците атомарного углерода. Но если насыщаемый углеродом металл подвергают циклическому нагреву и охлаждению в интервале температур, определяемых точками фазовых переходов, то это увеличивает производительность процесса. Сверхбыстрое перераспределение углерода в стали отмечали: Ильинский В.А., Жуков А.А., Костылева Л.В., Локтионова В.А. совместное технологическое воздействие на сталь термодинамических и кинетических факторов, приводящее к росту числа дислокаций, способно инициировать сверхбыстрый массоперенос атомов внедрения, в условиях интенсивного создания энергетических градиентов и термоциклирования. В твердом гелии при фазовом переходе Михин Н.П., Полев А.Н., Руданский Э.Я. наблюдали аналогичное явление.
Выделим в цементованном слое участок бесконечно малой толщины
с содержанием углерода 0,7 и 0,9 %, тогда при Т = 1225 К между этими слоями в соответствии с диаграммой Бенза - Элиотта возникнет перепад термодинамической активности углерода DаС1225 К = 0,2. При охлаждении внешнего слоя до Т = 1025 К термодинамическая активность в нем возрастет до значения аС1025 К = 1,4. Во внутреннем слое с Т = 1225 К активность углерода не изменит своего значения аС1225 К = 0,4. Вследствие разности температур между слоями возрастет перепад термодинамической активности углерода DаС1225-1025К = 1,0, увеличивающий скорость перемещения атомов внедрения в стали.
Эффективный коэффициент диффузии углерода при циклическом наложении на цементируемую поверхность высоких градиентов скорости изменения температур сопровождаемое a¬®g переходами, в соответствии с экспериментальными данными, равен:
-
DЭФФ = х2/[ 4tН(О) ] @ 0,008, ( 24 )
где х путь массопереноса [ мм ], осуществленный за время нагрева или охлаждения tН(О) [ c ].
Особенностью твердого тела являются колебания атомов – из этого получаем зависимость энергии от объема кристаллического тела:
dЕ / dVM = -3k·T(d lnw/dVM) ( 25.)
где VМ - средний объем вакансии, куда диффундирует атом примеси.
Изменение объема V связано с изменением энергии и существование разнородных по объему атомов в твердом теле приводит к образованию объемного градиента. Мечевым В.В. предлагается учет переноса по градиенту изменения объема: dVM /dх – вакансионный перенос .
В общем случае циклическое наложение на цементируемую поверхность высоких градиентов скорости изменения температур сопровождаемое a¬®g переходами при высоком углеродном потенциале на поверхности детали, вызывают диффузионные потоки углерода обусловленные:
1) диффузией по градиентам: концентрации углерода в соответствии с законом Фика, активности углерода по диаграмме Бенза-Элиотта, химического потенциала и вакансионного переноса;
2) собственно термодиффузией, обусловленной градиентом температур;
3) фазовым переносом на перемещающейся межфазной границе a¬®g перехода, перемещающего вглубь материала границы перекристаллизации.
Оценочные расчеты показывают, что диффузионный процесс, теплоперенос и вакансионный перенос не могут обеспечить такую скорость переноса атомов внедрения, которая наблюдается в процессе термоциклирования. Вместе с тем, в результате создания физико – механической модели строения твердого тела Гусевым В.П. была выдвинута гипотеза, что в процессе фазовых переходов твердое тело в ограниченных объемах находится
в псевдожидком состоянии. Следовательно, основной вклад в увеличение толщины диффузионного вносит механизм упорядоченного направленного перемещения атомов углерода на фронте перемещения фазового a¬®g перехода, периодически создаваемого при осуществления термоциклирования. Перемещающаяся при каждом цикле от поверхности в глубину детали волна a¬®g перекристаллизация «гонит» атомы углерода включая механизм, подобный зонному рафинированию металлов. На «Способ цементации стали» получен патент РФ.
Физико – механическая модель проникновения металлоида внедрения из внешней среды в металл и ускоренного переноса его в металле при термоциклировании, определяющими условиями которого служат скорость изменения градиента температуры (¶2T/¶х¶t) [К/мс] и цикличность процесса, накладываемые на полиморфные превращения в стали позволила уточнить математическую модель массопереноса металлоида внедрения стационарных процессов и распространить ее на динамические процессы обработки которая при одномерном массопереносе (¶m/¶t) количества вещества ¶m [г], через площадку S [м2] за время ¶t [c] будет иметь вид::
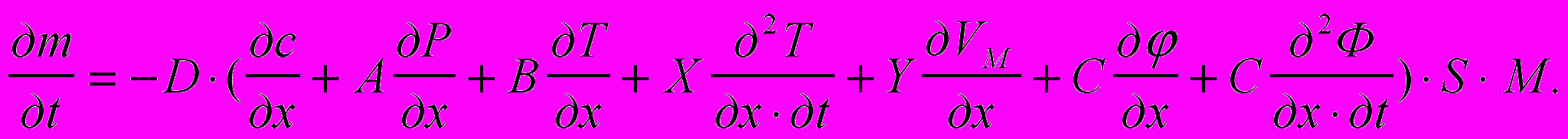 (26)
(26)где А, В, С, X, Y – интегральные коэффициенты;
(¶c/¶х), (¶j/¶х), (¶T/¶х), (¶Р/¶х), (¶VM /¶х), (¶2Ф)/(¶х¶t) градиенты концентрации, потенциала, температуры, давления, вакансий и скорости изменения градиента магнитного потока;
М вес грамм – молекулы диффундирующего вещества [г/моль];
D коэффициент диффузии [м2/с].
Температурные границы термоциклирования определяет диаграмма железо – углерод. В чистом железе →γ превращение при нагревании начинается при Т=11834 К и заканчивается при перегреве до Т = 12834 К. Превращение γ→ при охлаждении начинается при Т = 1183 4 К и заканчивается при переохлаждении до Т =1083 4 К .
С – образная кривая, показывает количество распавшегося аустенита от времени и температуры. Аустенит распадается с образованием перлитов по истечении инкубационного периода. При Т = 1000 К инкубационный период составляет десятки часов, при Т = 870 К секунды. Время распада также зависит от температуры: при Т=1000 К полный распад произойдет за 105 с, а при Т = 870 К распад аустенита заканчивается за 30 с.
Для описания процесса перехода ферритноцементитной структуры в аустенит пользуют L – образные диаграммы изотермического образования аустенита, описывающие скорость превращения при различных температурах протекания процесса. Для образования аустенита эвтектоидной стали при Т = 1000 К нужны сотни минут, в то время как при Т = 1100 К этот процесс заканчивается через несколько секунд!
Фазовые превращения происходят постепенно в зависимости от температуры процесса и степени перегрева или переохлаждения, а псевдожидкая волна полиморфного превращения и при нагревании и при охлаждении перемещается с поверхности детали к сердцевине. Используя С–образную диаграмму при нагреве и L–образную при охлаждении, можно определить время выдержки деталей при экстремальных температурах, для получения заданной толщины цементитного слоя.
В целях предупреждения травматизма во взрывоопасных производствах АПК конструктивными и технологическими методами необходимо создать безопасные технологии, применяя материалы с заданными свойствами. Наличие у железоуглеродистых сплавов двух фаз и фазовых переходов первого рода, обеспечивающих при создании температурных условий энергичный фазовый массоперенос атомов внедрения, позволяет прогнозировать возможность насыщения поверхностных слоев стали различными легирующими компонентами резко изменяющими физико-химические (и потребительские) свойства сталей. Это открывает возможности относительно простого и сравнительно дешевого способа получения алитированных искробезопасных стальных изделий, широко применяющихся во взрывоопасных и пожароопасных производствах. Возможно получение прочных и малоизнашиваемых антифрикционных поверхностей стальных изделий, насыщая их соответствующими компонентами. Гипотетически возможно получение стали с низким удельным сопротивлением, насыщая ее высокопроводящими металлами. Следует ожидать, что имеется возможность получения стали, легированной металлоидами, если легирующие примеси отвечают условиям температурного коридора термоциклирования.
^ В четвертой главе «ТЕРМОДИНАМИКА ПРОЦЕССОВ ПОВЫ-ШЕНИЯ ЭКСПЛУАТАЦИОННЫХ КАЧЕСТВ МАТЕРИАЛОВ ВЗРЫ-ВООПАСНЫХ ОБЪЕКТОВ АПК» рассмотрена термодинамика стационарных и динамических процессов совершенствования материалов взрывоопасных и пожароопасных производств АПК
Безопасность обслуживающего персонала, эксплуатирующего взрывоопасные и пожароопасные объекты АПК, во многом зависит от конструкционных сталей, применяемых при создании оборудования взрывоопасных и пожароопасных производств АПК, а конструкционная прочность материалов зависит от технологических процессов, режимы которых разрабатывались методом проб и ошибок. В настоящее время возможна теоретическая разработка оптимальных режимов химико – термической обработки, основанная на применении законов химической термодинамики. Выводы термодинамики, полученные на основе расчетов энергетических балансов и условиях равновесия реакций, независимы от гипотез о механизмах протекания технологических процессов. Если из законов термодинамики следует, что в данных условиях процесс невозможен, то это означает полную невозможность его осуществления. Если расчеты показывают, что процесс возможен, то это указывает лишь на его принципиальную осуществимость. Реализация процесса зависит от условий достижения состояния равновесия системы. Особенность термодинамических параметров в том, что их изменения при протекании процессов зависит лишь от начального и конечного состояний системы. Это делает выводы термодинамики независимыми от представлений о природе протекающих процессов. Благодаря тому, что функции состояния связаны друг с другом рядом соотношений, можно по изменению одних свойств вычислять другие параметры и с помощью небольшого числа экспериментальных данных предсказать направление протекания процесса. Все физикохимические явления, в которых участвуют сплавы, включают в себя процессы в растворах, представляющие собой однородные смеси двух или более компонентов, соотношение которых может изменяться без нарушения однородности.
Уравнения для коэффициента активности углерода fС в феррите будет:
lg(fС) = lg [аС /( %С)] = ( 5050 / Т ) 3,52; (27)
lg(fС)1 = lg (аС / NС) = ( 5000 / Т ) 2,19. (28)
Из уравнений следует, что парциальная энтальпия углерода в феррите (или изменение энтальпии при переносе 1 [ гатома ] углерода или графита в феррите) составляет 95800 [ Дж / гатом ]. Эта величина значительно больше, чем для аустенита 40250 [ Дж / гатом ]. Таким образом, растворение углерода в феррите сопровождается значительно большим поглощением тепла (энергии), чем при растворении его в аустените, поэтому и растворимость углерода в феррите значительно меньше, чем в аустените.
Коэффициент активности углерода fС в феррите также выше, чем в аустените. При эвтектоидной температуре (1000 ^ К) в разбавленном растворе его значение составляет fС = 646, а в аустените fС = 27. Именно это обстоятельство приводит к тому, что в феррите растворимость углерода мала, так как его активность в Fe уже при малых концентрациях достигает единицы.
Взаимодействие углерода и железа c образованием цементита осуществляется в соответствии с химической реакцией:
С + 3Fe = Fe3C. (29)
Образование этого соединения описывается выражениями:
GFe3C0 ; GC = n ·R ·T · ln аC ; GFe = m ·R ·T · ln аFe; (30)
где n = 1 и m = 3 количество атомов, вступивших в реакцию компонентов при образовании цементита. Вычисленные термодинамические характеристики DН0 и G0 реакции (29) показывают, что свободная энергия Гиббса образования оксида углерода реакции диспропорцинирования основной реакции ХТО стали, отрицательна только при температурах выше 900 [К], в то время, как образование атомарного углерода, адсорбированного поверхностью цементируемой стальной детали, начинается только при температурах ниже 1000 [К]. Это одновременно обеспечивает высокий углеродный потенциал при низких температурах процесса и способствует образованию СО поставщика атомарного углерода, при высоких температурах, так как именно на этой части кривой свободная энергия Гиббса образования угарного газа отрицательна. Значит, режим термоциклирования наиболее благоприятен при цементации,
Свободная энергия образования цементита по реакции (29) определяется из уравнения:
G 0Т H 00 = [G 0Т H 00] Fe3C 3[G 0Т H 00] Fe [G 0Т H00] ГР ,
где G 0Т изменение свободной энергии при образовании цементита;
H 00 тепловой эффект реакции образования Fe3C при Т = 0 [ К ];
[G 0Т H 00] свободная энергия компонентов реакции.
Данные расчетов показывают, что свободная энергия Гиббса образования цементита Fe3C принимает отрицательные значения только при температурах выше 1000 [К], что свидетельствует о том, что растворенный в железе углерод может превратиться в цементит только при температурах выше линии PSKСТАЛЬ.
При рассмотрении термодинамики ускоренных процессов повышения эксплуатационных свойств материалов взрывоопасных и пожароопасных объектов АПК видно, что между активностью углерода и его концентрацией в железе существует линейная зависимость, присущая всем разбавленным растворам. С ростом температуры активность углерода при постоянной концентрации снижается. Это свидетельствует о том, что растворение графита в аустените сопровождается увеличением энтальпии. Характерной особенностью твердого раствора углерода в γFe является одинаковая зависимость активности углерода от температуры при всех концентрациях углерода в металле – парциальная энтальпия углерода в аустените не зависит от его концентрации и составляет НС = 40250 [ Дж / гатом ]. Указанное постоянство НС означает, что энергия взаимодействия углерода с железом не изменяется с ростом концентрации углерода вплоть до насыщения. Тепловой эффект перлитной реакции:
Н = 0,0332[H 0] Fe3C + 0,867[H] [Hγ] . (31)
Энтальпии аустенита и феррита при 1000 [ К ] равна:
Hγ =9630 · 0,0347+919 ( 1 0,0347 ) = 1218 [кал/г - а] = 5,09 [кДж/г - а] ;
H = 22900 · 0,00179 = 41 [кал/г - а] = 171 [ Дж / г - атом ] .
Тепловой эффект перлитного превращения в стали эвтектоидного состава составляет (31) :
H = 0,0332H 0Fe3C + 0,867 · 41 1218 = 0,0332[H 0] Fe3C 1182.
Для определения энтальпии перлитного превращения подставляем в уравнение энтальпию образования цементита:
∆H 0Fe3C = 21,336 [ кДж ] = 5080 [ кал ].
Тогда:
H = 0,0332 · 5080 1182 = 1013 [ кал ] = 4,24 [ кДж ].
Из приведенных уравнений очевидно, что при низких температурах термоциклического процесса при высоком углеродном потенциале на поверхности стали осуществляется транспорт углерода в железо. При высоких температурах процесса происходит растворение углерода в аустените. При температурах ниже 1000 [ К ] при концентрации углерода до 0,81 % происходит перлитное превращение.
Расчеты показывают, что термодинамика динамических процессов ХТО принципиально не отличается от аналогичных стационарных процессов стали. Ускорение технологического процесса достигается исключительно благодаря фазовому переносу и подбору оптимального температурного коридора термоциклирования и времени выдержек при экстремальных температурах. Это позволило уточнить температурные коридоры обработки и подтвердить возможность осуществления динамических процессов цементации стали.
^ В пятой главе «МЕТОДИКА И РЕЗУЛЬТАТЫ ЭКСПЕРИМЕН-ТАЛЬНЫХ ИССЛЕДОВАНИЙ ВЗРЫВООПАСНЫХ ОБЪЕКТОВ ГАЗИ-ФИЦИРОВАННЫХ ПРЕДПРИЯТИЙ АПК» приведены результаты экспериментальных исследований, проведенных на Мышкинском и Шекснинском участках газопровода Ухтинского упрваления Севергазпрома, а также результаты обследования комплексной защиты ЭХЗ нефтепроводов Сургут – Полоцк и Горький Ярославль на водных переходах через реки Ока и Клязьма. В процессе электрохимических исследований и визуальных осмотров вскрытых трубопроводов высказана гипотеза о возможности идентификации наводороженности металла неразрушающими, дистанционными, без вскрытия трубопроводов и вывода их из эксплуатации электрохимическими методами. Разработаны, экспериментально отработаны и внедрены на Мышкинском и Шекснинском участках в процессе проведения натурных исследований методики определения участков газопроводов с высоким содержанием водорода и мест коррозионных разрушений поверхности металла трубы. Измерениями методом отключения станций ЭХЗ установлено, что электрохимический потенциал нефтепровода Сургут – Полоцк соответствует наводорожениой стали. Выданы рекомендации по совершенствованию режима работы ЭХЗ.
В целях исключения разрывов подземных газопроводов, сопровождающихся взрывами и пожарами в результате стресс – коррозионных и коррозионных повреждений, разработаны ускоренные методики насыщения поверхности стали алюминием и углеродом.
^ В шестой главе «ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЙ И ИХ ЭКОНОМИЧЕСКАЯ ЭФФЕКТИВНОСТЬ» приведены технико экономические расчеты эффективности внедренных методики определения мест коррозионных и стресс коррозионных повреждений газопроводов, позволяющей, в отличие от всех других, имеющихся и применяющихся в настоящее время методик, определять участки, на которых возможны повреждения в результате водородного растрескивания под напряжением, идентификация которых, особенно в начальной стадии зарождения стресс коррозионных повреждений, никакими другими методиками невозможна. Это позволяет осуществлять профилактические мероприятия в целях исключения взрывов газопроводов и предупреждения травматизма работников АПК. Экономия потерь газа только от предупреждения разрывов трубопроводов в результате протекания коррозионных и стресс коррозионных процессов составляет более 55 млн. р /год.
