Световой микроскоп. Микроскоп
| Вид материала | Документы |
- Реферат на тему: «Роль вирусов в природе и жизни человека», 45.59kb.
- «Побег», 555.88kb.
- «Дифракция электронов. Электронный микроскоп», 429.35kb.
- Василия Шукшина «Микроскоп», 79.32kb.
- Материально-техническая база кафедры, 50.88kb.
- Список литературы на 10-й класс, 17.21kb.
- Из истории металловедения, 51.29kb.
- Олимпиадные задания по биологии, 69.24kb.
- Заглянув в энциклопедию, сдай готовые ответы учителю! Участники получат свои пятерки!, 186.3kb.
- Шахпаронов И. М., Чичерин, 58.91kb.
1 2
Типы микроскопов. Конструкция М., его оснащение и характеристики основных узлов определяются либо областью применения, кругом проблем и характером объектов, для исследования которых он предназначен, либо методом (методами) наблюдения, на которые он рассчитан, либо же и тем и другим вместе. Всё это привело к созданию различных типов специализированных М., позволяющих с высокой точностью изучать строго определённые классы объектов (или даже только некоторые определённые их свойства). С другой стороны, существуют т. н. универсальные М., с помощью которых можно различными методами наблюдать различные объекты.
Биологические М. относятся к числу наиболее распространённых. Они применяются для ботанических, гистологических, цитологических, микробиологических, медицинских исследований, а также в областях, не связанных непосредственное биологией, - - для наблюдения прозрачных объектов в химии, физике и т. д. Существует много моделей биологических М., отличающихся конструктивным оформлением и дополнительными принадлежностями, которые существенно расширяют круг изучаемых объектов. К этим принадлежностям относятся: сменные осветители проходящего и отражённого света; сменные конденсоры для работы по методам светлого и тёмного полей; фазово-контрастные устройства; окулярные микрометры; микрофотонасадки; наборы светофильтров и поляризационных устройств, позволяющие в обычном (неспециализированном) М. применять технику люминесцентной и поляризационной микроскопии. Во вспомогательном оборудовании для биологическиого М. особенно важную роль играют средства микроскопической техники, предназначенные для подготовки препаратов и проведения с ними различных операций, в том числе и непосредственно в процессе наблюдения.
Биологические исследовательские М. оснащаются набором сменных объективов для различных условий и методов наблюдения и типов препаратов, в том числе эпиобъективами для отражённого света и зачастую фазово-контрастными объективами. Набору объективов соответствует комплект окуляров для визуального наблюдения и микрофотографирования. Обычно такие М. имеют бинокулярные тубусы для наблюдения двумя глазами.
Рис. 8. Принципиальная оптическая схема инвертированного микроскопа.
Кроме М. общего назначения, в биологии широко используются и различные М., специализированные по методу наблюдения (см. ниже).

инвертированные М. отличаются тем, что объектив в них располагается под наблюдаемым предметом, а конденсор - - сверху. Направление хода лучей, прошедших сверху вниз через объектив, изменяется системой зеркал, и в глаз наблюдателя они попадают, как обычно, снизу вверх (рис. 8). М. этого типа предназначены для исследования громоздких объектов, которые трудно или невозможно расположить на предметных столиках обычных М. В биологии с помощью таких М. изучают находящиеся в питательной среде культуры тканей, которые помещают в термостатирующую камеру для поддержания заданной температуры. Инвертированные М. применяют также для исследования химических реакций, определения точек плавления материалов и в других случаях, когда для осуществления наблюдаемых процессов требуется громоздкое вспомогательное оборудование. Для микрофотографирования и микрокиносъёмки инвертированные М. снабжают специальными устройствами и камерами.
Особенно удобна схема инвертированного М. для наблюдения в отражённом свете структур различных поверхностей. Поэтому она применяется в большинстве металлографических М. В них образец (шлиф металла, сплава или минерала) устанавливается на столике полированной поверхностью вниз, а остальная его часть может иметь произвольную форму и не требует какой-либо обработки.
Существуют также металлографические М., в которых объект располагают снизу, закрепляя его на специальной пластине; взаимное положение узлов в таких М. то же, что и в обычных (неинвертированных) М. Изучаемая поверхность часто предварительно протравливается, благодаря чему зёрна её структуры становятся резко отличимыми друг от друга. В М. этого типа можно использовать метод светлого поля при прямом и косом освещении, метод тёмного поля и наблюдение в поляризованном свете. При работе в светлом поле объектив одновременно служит и конденсором. Для темнопольного освещения применяются зеркальные параболические эпиконденсоры. Введение специального вспомогательного устройства позволяет осуществить фазовый контраст в металлографических М. с обычным объективом (рис. 9).
Люминесцентные М. оснащаются набором сменных светофильтров, подбирая которые можно выделить в излучении осветителя часть спектра, возбуждающую люминесценцию конкретного исследуемого объекта. Подбирается также светофильтр, пропускающий от объекта только свет люминесценции. Свечение многих объектов возбуждается УФ лучами или коротковолновой частью видимого спектра; поэтому источниками света в люминесцентных М. служат дающие именно такое (и очень яркое) излучение ртутные лампы сверхвысокого давления (см. Газоразрядные источники света). Помимо специальных моделей люминесцентных М., имеются люминесцентные устройства, используемые совместно с обычными М.; они содержат осветитель с ртутной лампой, набор светофильтров и т. н. опак-иллюминатор для освещения препаратов сверху.
Ультрафиолетовые и инфракрасные М. служат для исследований в невидимых для глаза областях спектра. Их принципиальные оптические схемы аналогичны схеме обычных М. Из-за большой сложности исправления аберраций в УФ и ИК областях конденсор и объектив в таких М. часто представляют собой зеркально-линзовые системы, в которых существенно уменьшается или полностью отсутствует хроматическая аберрация. Линзы изготовляются из материалов, прозрачных для УФ (кварц, флюорит) или ИК (кремний, германий, флюорит, фтористый литий) излучения. Ультрафиолетовые и инфракрасные М. снабжены фотокамерами, в которых фиксируется невидимое изображение; визуальное наблюдение через окуляр в обычном (видимом) свете служит, когда это возможно, лишь для предварительной фокусировки и ориентировки объекта в поле зрения М. Как правило, в этих М. имеются электроннооптические преобразователи, превращающие невидимое изображение в видимое.
Поляризационные М. предназначены для изучения (с помощью оптических компенсаторов)
изменений в поляризации света, прошедшего через объект или отражённого от него, что
открывает возможности количественного или полуколичественного определения различных
характеристик оптически активных объектов. Узлы таких М. обычно выполняются так,
чтобы облегчить точные измерения: окуляры снабжаются перекрестием, микрометрической
шкалой или сеткой; вращающийся предметный столик угломерным лимбом для
измерения угла поворота; часто на предметном столике крепится Федорова столик, дающий возможность произвольно поворачивать и наклонять препарат для нахождения кристаллографических и кристаллооптических осей. Объективы поляризационных М. специально подбираются так, чтобы в их линзах отсутствовали внутренние напряжения, приводящие к деполяризации света. В М. этого типа обычно имеется включаемая и выключаемая вспомогательная линза (т. н. линза Бертрана), используемая при наблюдениях в проходящем свете; она позволяет рассматривать интерференционные фигуры (см. Кристаллооптика), образуемые светом в задней фокальной плоскости объектива после прохождения через исследуемый кристалл.
С помощью интерференционных М. наблюдают прозрачные объекты по методу интерференционного контраста; многие из них конструктивно аналогичны обычным М., отличаясь лишь наличием специального конденсора, объектива и измерительного узла. Если наблюдение производится в поляризованном свете, то такие М. снабжаются поляризатором и анализатором. По области применения (главным образом биологические исследования) эти М. можно отнести к специализированным биологическим М. К интерференционным М. часто относят также микроинтерферометры М. особого типа, применяемые для изучения микрорельефа поверхностей обработанных металлических деталей.
Стереомикроскопы. Бинокулярные тубусы, используемые в обычных М., при всём удобстве наблюдения двумя глазами не дают стереоскопического эффекта: в оба глаза попадают в этом случае под одинаковыми углами одни и те же лучи, лишь разделяемые на два пучка призменной системой. Стереомикроскопы, обеспечивающие подлинно объёмное восприятие микрообъекта, представляют собой фактически два М., выполненных в виде единой конструкции так, что правый и левый глаза наблюдают объект под разными углами (рис. 10). Наиболее широкое применение такие М. находят там, где требуется производить какие-либо операции с объектом в ходе наблюдения (биологического исследования, хирургической операции на сосудах, мозге, в глазу — микрургия, сборка миниатюрных устройств), — стереоскопическое восприятие облегчает эти операции. Удобству ориентировки в поле зрения М. служит и включение в его оптическую схему призм, играющих роль оборачивающих систем; изображение в таких М. прямое, а не перевёрнутое. Так как угол между оптическими осями объективов в стереомикроскопах обычно 12°, их числовая апертура, как правило, не превышает 0,12. Поэтому и полезное увеличение таких М. бывает не более 120.
М. сравнения состоят из двух конструктивно объединённых обычных М. с единой окулярной системой. Наблюдатель видит в двух половинах поля зрения такого М. изображения сразу двух объектов, что позволяет непосредственно сравнить их по цвету, структуре и распределению элементов и другим характеристикам. М. сравнения широко применяются при оценке качества обработки поверхностей, определении сортности (сравнение с эталонным образцом) и т. д. Специальные М. такого типа используют в криминологии, в частности для идентификации оружия, из которого выпущена исследуемая пуля.
Назначение измерительных М. состоит в точном измерении линейных и угловых размеров объектов (зачастую совсем не малых). По способу измерения их можно разделить на два
расстояние не превышает линейных размеров поля зрения М. В таких М. непосредственно (с помощью шкалы или винтового окулярного микрометра) измеряется не сам объект, а его изображение в фокальной плоскости окуляра, и лишь затем, по известному значению увеличения объектива, вычисляется измеренное расстояние на объекте. Часто в этих М. изображения объектов сравниваются с образцовыми профилями, нанесёнными на пластинки сменных окулярных головок. В измерительных М. 2-го типа предметный столик с объектом и корпус М. можно с помощью точных механизмов перемещать друг относительно друга (чаще - столик относительно корпуса); измеряя это перемещение микрометрическим винтом или шкалой, жестко скрепленной с предметным столиком, определяют расстояние между наблюдаемыми элементами объекта. Существуют измерительные М., у которых измерение производится лишь в одном направлении (однокоординатные М.). Гораздо более распространены М. с перемещениями предметного столика в двух перпендикулярных направлениях (пределы перемещений до 200x500 мм); для специальных целей применяются М., в которых измерения (а следовательно, и относительные перемещения столика и корпуса М.) возможны в трёх направлениях, соответствующих трём осям прямоугольных координат. На некоторых М. можно проводить измерения в полярных координатах; для этого предметный столик делают вращающимся и снабжают шкалой и нониусом для отсчёта углов поворота. В наиболее точных измерительных М. 2-го типа употребляются стеклянные шкалы, а отсчёты на них осуществляются с помощью вспомогательного (т. н. отсчётного) микроскопа (см. ниже). Точность измерений в М. 2-го типа значительно выше по сравнению с М. 1-го типа. В лучших моделях точность линейных измерений обычно порядка 0,001 мм, точность измерения углов — порядка Г. Измерительные М. 2-го типа широко применяются в промышленности (особенно в машиностроении) для измерения и контроля размеров деталей машин, инструментов и пр.
В устройствах для особо точных измерений (например, геодезических, астрономических и т. д.) отсчёты на линейных шкалах и разделённых кругах угломерных инструментов производят с помощью специальных отсчётных М. - - шкаловых М. и М.-микрометров. В первых имеется вспомогательная стеклянная шкала. Её изображение регулировкой увеличения объектива М. делают равным наблюдаемому интервалу между делениями основной шкалы (или круга), после чего, отсчитывая положение наблюдаемого деления между штрихами вспомогательной шкалы, можно непосредственно определить его с точностью около 0,01 интервала между делениями. Ещё выше точность отсчётов (порядка 0,0001 мм) в М.-микрометрах, в окулярной части которых помещен нитяной или спиральный микрометр. Увеличение объектива регулируют так, чтобы перемещению нити между изображениями штрихов измеряемой шкалы соответствовало целое число оборотов (или полуоборотов) винта микрометра.
Помимо описанных выше, имеется значительное число ещё более узко специализированных типов М., например М. для подсчёта и анализа следов элементарных частиц и осколков деления ядер в ядерных фотографических эмульсиях, высокотемпературные М. для изучения объектов, нагретых до температуры порядка 2000 °С, контактные М. для исследования поверхностей живых органов животных и человека (объектив в них прижимается вплотную к изучаемой поверхности, а фокусировка М. производится специальной встроенной системой).
Часто М. в качестве важной составной части используются в сложных установках в сочетании с другими приборами. Примерами могут служить предназначенные для определения спектров поглощения препаратов микроспектрофотометрические установки (см. Спектрофотометр), в которых М. объединены со специальными монохроматорами и устройствами, измеряющими световые потоки; ряд приборов, применяемых в офтальмологии; компараторы, микрофотометры и многие др.
Микроскопическая техника в биологии, совокупность методов и приёмов для изучения с помощью оптического и электронного микроскопов строения, жизнедеятельности, развития, химического состава и физических свойств клеток, тканей и органов. М. т. включает: подготовку живых объектов к микроскопическому исследованию и его проведение, изготовление постоянных (неживых) препаратов; микро-, гисто- и цитохимические исследования; особые методы подготовки препаратов для электронной микроскопии.
Прижизненные наблюдения в проходящем свете осуществляются на простейших, мелких яйцах, культивируемых клетках и тканях, прозрачных участках тела многоклеточных (например, на кровеносных сосудах в плавательной перепонке лягушки). В отражённом свете под микроскопом можно изучать поверхностные структуры клетки, ткани, органа. Для цитофизиологических наблюдений пользуются прижизненным окрашиванием, дающим представление о рН клетки и её органоидов, а также о физиологическом состоянии живого объекта. Для прижизненных наблюдений требуются: нагревательный столик (рис. 1) особый термостат, перестраиваемый на заданную температуру в широком температурном диапазоне; стеклянные, пластмассовые, кварцевые, металлические или другие камеры (рис. 2) с постоянной или проточной средой требуемого состава. Наблюдаемые объекты (чаще клетки однослойных культур) могут длительное время оставаться нормальными при достаточном снабжении их питательными веществами и кислородом. Одна из задач М. т. для живых объектов - - повышение контрастности изображения, для чего используется, например, фазово-контрастное устройство. Интерференционная микроскопия дополнительно даёт сведения о толщине объекта, концентрации в нём сухого вещества, содержании воды и показателе преломления. Прижизненные наблюдения проводятся также в тёмном поле (ультрамикроскопия) с использованием специального конденсора; при этом объект освещается сбоку, а фон остаётся тёмным. Темнопольное устройство позволяет увидеть чрезвычайно мелкие (например, коллоидные) частицы. С помощью поляризационного микроскопа можно изучать объекты (или их элементы), обладающие оптической анизотропией. Для исследования как живых, так и неживых биологических объектов применяется люминесцентная микроскопия, особенно для изучения вторичной флуоресценции, возникающей при окраске клеток и тканей слабыми концентрациями флуорохромов (акридиновый оранжевый, эритрозин, родамин и др.). Различия во флуоресценции отдельных химических веществ (нуклеиновых кислот, липидов) позволяют изучать их локализацию, динамику изменений и даже количество изучаемого вещества. Соединение белка с флуорохромом (изоцианат флуоресцеина) и связывание этого вещества с антителами (см. Иммунофлуоресценция) даёт возможность выяснить локализацию антигенов, судьбу антител и др. вопросы иммунологии. Недавно получил распространение метод микроскопии живых и неживых объектов в ультрафиолетовых лучах с использованием специальной кварцевой оптики. Наблюдения над живыми объектами документируются микрокиносъёмкой, особенно замедленной.
Для получения постоянных препаратов объект фиксируют, т. е. убивают так, чтобы он сохранил по возможности неизменной структуру. Наиболее распространённые фиксаторы -формалин, спирт, четырёхокись осмия, а также комбинированные фиксаторы — смеси веществ. Фиксация (особенно для электронной микроскопии) осуществляется также методом лиофилизации, высушиванием мазков (например, крови) или отпечатков. При работе с клеточными культурами используются пластинки из стекла или слюды, на которых клетки располагаются в один слой. В других случаях для микроскопии пользуются срезами, получаемыми на микротоме, объект при этом обезвоживают и заливают в парафин, целлоидин, желатину или замораживают. Для электронной микроскопии материал обычно
фиксируют чётырёхокисью осмия, а заливку производят в акриловые мономеры, которые полимеризуют соответствующим катализатором, или в эпоксидные смолы.
Микро-, гисто- и цитохимические исследования. Для повышения контрастности препаратов, наблюдаемых в оптический микроскоп, применяют красители, избирательно окрашивающие разные клеточные структуры. Особенно широко используются красители в гистохимии. Гистохимические реакции основаны на образовании некоторыми веществами нерастворимых и иногда окрашенных осадков, обнаруживаемых микроскопически. Ферменты обнаруживаются в клетках по активности при их воздействии на определённые субстраты, находящиеся в ткани или добавленные извне. Интенсивность гистохимических реакций часто изучают и оценивают визуально. Более совершенны количественные методы оценки, например подсчёт числа клеток с определённой интенсивностью окраски, числа зёрен осадка, а также авторадиография, цитофотометрия.
При электронной микроскопии вирусов, микроорганизмов, ультратонких срезов более крупных объектов их контрастность усиливают напылением частиц металла. Для негативного контраста объект помещают в раствор более плотного вещества (например, фосфорно-вольфрамовой кислоты), заполняющего промежутки между изучаемыми частицами, которые выглядят светлыми на тёмном фоне. Контраст усиливают также, применяя «электронные красители» (четырёхокись осмия, уранил и др.), избирательно связывающиеся с некоторыми участками объекта. При использовании ферритина зёрна его, содержащие молекулы железа, обнаруживаются в составе клеточных структур.
Прижизненное окрашивание, витальное окрашивание, метод окрашивания живых клеток специальными красителями, применяемыми в нетоксических концентрациях. Такими красителями могут быть основные, например нейтральный красный и метиленовый синий (хромофорная группа связана с катионом), и кислотные, например феноловый красный и цианол (хромофорная группа связана с анионом). Проникая в клетки животных, одни красители диффузно окрашивают цитоплазму, другие красители откладываются в виде гранул в области Гольджи комплекса, оставляя ядро и цитоплазму неокрашенными. При повреждении клеток окрашивание диффузными красителями усиливается, гранулярные же теряют способность образовывать гранулы и окрашивают цитоплазму и ядро диффузно. В живых клетках растений красители конденсируются в вакуолях, в мёртвых — прокрашиваю весь протопласт. Эти особенности дают возможность отличать мёртвые и поврежденные клетки от живых (см. Паранекроз}. Количественный учёт связанного клетками красителя позволяет судить о более тонких сдвигах в их функциональном состоянии. Прижизненная цитофотометрия используется для определения количества красителя, связанного отдельной клеткой и даже разными её участками. Кислотные гранулярные красители применяются для выявления элементов ретикулоэндотелиальнои системы и изучения их состояния; метиленовый синий — для избирательной окраски отдельных нейронов; некоторые служат индикаторами концентрации водородных ионов и окислительно-восстановительного потенциала. Распределение в клетках красителей из группы флуорохромов исследуют с помощью флуоресцентного микроскопа; они служат для оценю жизнеспособности клеток и для некоторых цитохимических исследований.
И. П. Суздальская
Рис. 2. Камера для культивирования клеток и прижизненных наблюдений за их ростом и развитием: 1 — камера в собранном виде; 2 — камера в разобранном виде: а — верхняя стальная пластина; б — резиновая прокладка; в — покровное стекло; г — средняя секция; д - нижняя стальная пластина; 3 — часть средней секции снизу: е — каналы; ж -резервуары.
Цитофотометрия (от цито,.., фото.., и ...метрия), один из методов количественной цитохимии, позволяющий определять химический состав клеток в гистологическом препарате по поглощению света клетками. Через препарат пропускают монохроматическое излучение (свет) в виде пучка, диаметр которого соизмерим с диаметром клетки или внутриклеточной структуры. Концентрацию (С) исследуемого вещества в клетке находят по Бугера —Ламберта — Бера чакону: Ф = Фое-ксh, где Ф — интенсивность света после его прохождения через клетку; Фо — интенсивность падающего на клетку света; к — удельный монохроматического поглощения, показатель исследуемого вещества (рассчитанный на единицу его концентрации) при данной длине волны света; h — длина пути, проходимого светом в клетке (практически — толщина гистологического препарата). Найдя концентрацию вещества внутри клетки и измерив её объём, можно рассчитать общее количество этого вещества в клетке. Ц. разработана шведским гистологом Т. Касперсоном в 1936. Чувствительность метода порядка 10-12 г. Точность Ц. снижается из-за ошибки измерения вследствие неравномерности распределения вещества внутри клетки; для предотвращения этой ошибки используют т. н. сканирующую, или Ц. при двух разных длинах волн излучения. Ультрафиолетовая (УФ) Ц. позволяет определять в неокрашенных препаратах количество нуклеотидов, нуклеиновых кислот, белков по естественному поглощению ими УФ-лучей. Шире распространена Ц. в видимой области спектра; при этом используют естественную окраску отдельных веществ или чаще искусственное окрашивани< препаратов специфическими гистохимическими красителями, связывающимися с химическими компонентами клетки в определённых количествах. С помощью большинства красителей выявляют в клетке нуклеиновые кислоты, белки и их отдельные реактивные группы, а также определяют активность ряда ферментов.
Лит.: Бродский В. Я., Трофика клетки, М, 1966; Введение в количественную цитохимию, пер. с англ., М., 1969; Gaspersson Т., Cell growth and cell function, N. Y., 1950.
Л.З. Певзнер
микроскопические биологические объекты можно разделить на амплитудные и фазовые.
К первым (амплитудным) относятся поглощающие свет окрашенные препараты (ткани, клетки, микробы), которые можно наблюдать с помощью обычной световой микроскопии. При прохождении света через окрашенные участки препарата амплитуда световой волны уменьшается и эти участки видны как более темные, по сравнению с соседними неокрашенными участками.
Ко вторым (фазовым) - такие же, но неокрашенные, не поглощающие света объекты, структуры которых различаются по показателю преломления, а сами объекты отличаются от окружающей среды толщиной и показателем преломления. После прохождения света через эти объекты, амплитуда световой волны не изменяется, а изменяется фаза. На приведенной динамической схеме показаны изменения амплитуды световой волны при прохождении через окрашенный объект и фазы - через неокрашенный. Наш глаз различает изменения амплитуды световой волны (различие в поглощении света), но не различает изменений фазы световой волны (различий в преломлении света). Поэтому для наблюдения в микроскопе этих объектов, Цернике предложил способ перевода фазовых различий в амплитудные. Этот способ в микроскопии называется фазово-контрастным и широко используется в настоящее время для наблюдения живых, неокрашенных биологических объектов. Объекты сильно рассеивающие свет можно наблюдать с помощью темнопольной микроскопии
Качество изображения
Качество изображения определяется разрешающей способностью микроскопа, т.е. минимальным расстоянием, на котором оптика микроскопа может различить раздельно две близко расположенные точки, разрешающая способность зависит от числовой апертуры объектива, конденсора и длины волны света, которым освещается препарат. Числовая апертура(раскрытие) зависит от угловой апертуры и показателя преломления среды, находящейся между фронтальной линзой объектива и конденсора и препаратом.
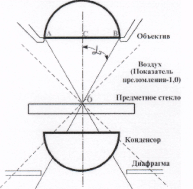
Угловая апертура объектива - это максимальный угол (АОВ), под которым: могут попадать в
объектив лучи, прошедшие через препарат.
Числовая апертура объектива равна произведению синуса половины угловой апертуры на показатель преломления среды, находящейся между предметным: стеклом и фронтальной линзой объектива.
N.A. = n • sin
где, N.A. - Числовая апертура; n - показатель преломления среды между препаратом и объективом;
sin - синус угла а равного половине угла АОВ на схеме.
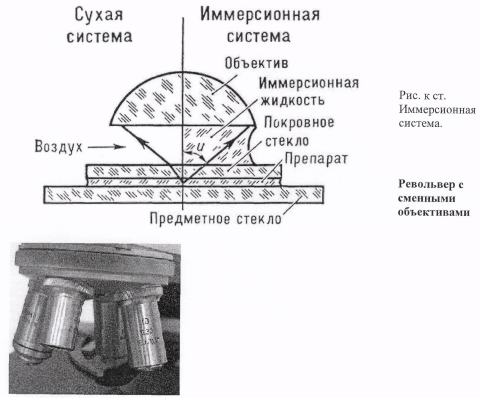
Таким образом, апертура сухих систем (между фронтальной линзой объектива и препаратом-воздух) не может быть более 1 (обычно не более 0,95).
Среда, помещаемая между препаратом и объективом, называется иммерсионной жидкостью или иммерсией, а объектив, рассчитанный для работы с иммерсионной жидкостью называют иммерсионным. Благодаря иммерсии с более высоким показателем преломления чем у воздуха, можно повысить числовую апертуру объектива и, следовательно, разрешающую способность.
Числовая апертура объективов всегда гравируется на их оправах. Разрешающая способность микроскопа зависит также от апертуры конденсора. Если считать апертуру конденсора равной апертуре объектива, то формула разрешающей способности имеет следующий вид:
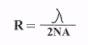
где R - предел разрешения; - длина волны; N.A - числовая апертура. Из этой формулы видно, что при наблюдении в видимом свете (зеленый участок спектра -=550нм), разрешающая способность (предел разрешения) микроскопа не может быть >
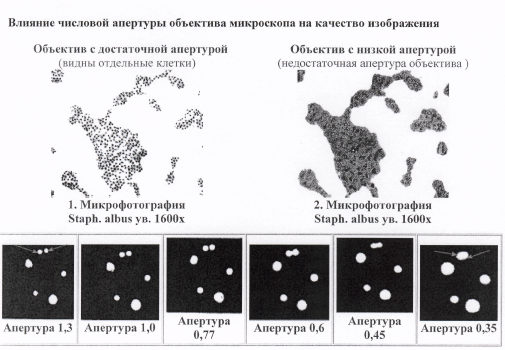
Пути повышения оптической разрешающей способности:
0,2мкм
- Выбор большого угла светового конуса как со стороны объектива, так и со стороны
источника освещения. Благодаря этому возможно собрать в объективе более
преломленные лучи света от очень тонких структур. Таким образом, первый путь
повышения разрешения - это использование конденсора, числовая апертура
которого соответствует числовой апертуре объектива.
- Второй способ - использование иммерсионной жидкости между фронтальной
линзой объектива и покровным стеклом. Так мы воздействуем на показатель
преломления среды n, описанный в первой формуле. Его оптимальное значение,
рекомендуемое для иммерсионных жидкостей, составляет 1.51.
Полезное увеличение
Увеличение микроскопа зависит от увеличения объектива, окуляра, промежуточных линз и длины тубуса. Приблизительно определить увеличение микроскопа можно, умножая увеличение объектива на увеличение окуляра и увеличение промежуточных линз (если они предусмотрены в конструкции микроскопа). Для точного определения увеличения микроскопа используют объект-микрометр и окуляр-микрометр.
Различают полезное и бесполезное увеличение, зависящее от увеличения окуляра. Полезное увеличение обычно равно числовой апертуре объектива, увеличенной в 500-1000 раз. Более высокое окулярное увеличение не выявляет новых деталей и является бесполезным. В зависимости от среды, которая находится между фронтальной линзой объектива и препаратом, различают "сухие" объективы малого и среднего увеличения (до 40х) и иммерсионные с максимальной апертурой и увеличением (до 90-100х) (см. таблицу).
| Числовая апертура (N.A.) | Разрешающая способность, мкм | Полезное увеличение 1000x(N.A.) |
| | "Сухие" объективы малого увеличения | |
| 0.4 | 6.9 | 40 |
| 0.12 | 2.3 | 120 |
| 0.5 | 1.1 | 250 |
| | "Сухие" объективы среднего увеличения | |
| 0.5 | 0.55 | 500 |
| 0.65 | 0.42 | 650 |
| 0.75 | 0.37 | 750 |
| 0.95 | 0.29 | 950 |
| | Иммерсионные объективы | |
| 1.3 | 0.21 | 1300 |
| 1.4 | 0.19 | 1400 |
Иммерсионные жидкости необходимы для увеличения числовой апертуры и соответственно повышения разрешающей способности иммерсионных объективов, специально рассчитанных для работы с этими жидкостями и, соответствующим образом, маркированными. Иммерсионные жидкости, помещенные между объективом и препаратом, имеют более высокий показатель преломления, чем воздух. Поэтому, отклоненные мельчайшими деталями объекта лучи света, не рассеиваются, выходя из препарата, и попадают в объектив, что приводит к повышению разрешающей способности.
Существуют объективы водной иммерсии (маркированные белым кольцом), масляной иммерсии (черное кольцо), глицериновой иммерсии (желтое кольцо), монобромнафталиновой иммерсии (красное кольцо). В световой микроскопии
биологических препаратов применяются объективы водной и масляной иммерсии. Специальные кварцевые объективы глицериновой иммерсии пропускают коротковолновое ультрафиолетовое излучение и предназначены для ультрафиолетовой (не путать с люминесцентной) микроскопии (то есть для изучения биологических объектов, избирательно
поглощающих ультрафиолетовые лучи). Объективы монобромнафталиновой иммерсии в микроскопии биологических объектов не используются. В качестве иммерсионной жидкости для объектива водной иммерсии используется дистиллированная вода, масляной иммерсии -природное (кедровое) или синтетическое масло с определенным показателем преломления.
В отличие от других иммерсионных жидкостей масляная иммерсия является гомогенной,
так как имеет показатель преломления равный или очень близкий показателю преломления
стекла. Обычно этот показатель преломления (n) рассчитан для определенной спектральной
линии и определенной температуры и указывается на флаконе с маслом. Так, например,
показатель преломления иммерсионного масла для работы с покровным стеклом для
спектральной линии D в спектре натрия при температуре =20 0С равен 1,515 (nD 20 = 1,515 ),
для работы без покровного стекла (nD 20=1,520).
Для работы с объективами-апохроматами нормируется также дисперсия, то есть разность
показателей преломления для различных линий спектра.
Использование синтетического иммерсионного масла предпочтительнее, поскольку его
параметры более точно нормируются, и оно в отличие от кедрового, не засыхает на
поверхности фронтальной линзы объектива.
Учитывая, вышесказанное, ни в коем случае нельзя пользоваться суррогатами иммерсионного масла и, в частности, вазелиновым маслом. При некоторых способах микроскопии для: увеличения апертуры конденсора, иммерсионная жидкость (чаще дистиллированная вода) помещается между конденсором и препаратом.
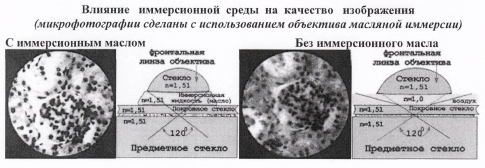
Иммерсионная система.
И. с. применяются в микроскопах. В качестве иммерсионных жидкостей применяют кедровое или минеральное масло (показатель преломления 1,515); водный раствор глицерина (1,434); воду (1,333); монобромнафталин (1,656); вазелиновое масло (1,503); йодистый метилен (1,741). Оптические характеристики иммерсионной жидкости (показатель преломления и дисперсия) входят в расчёт И. с., поэтому И. с. можно применять только с той жидкостью, на которую система рассчитана. В противном случае резко ухудшится качество изображения. Включение объектива в состав И. с. даёт возможность повысить его апертуру А, а следовательно, и разрешающую способность микроскопа. «Сухая» система не может иметь А > 1, у масляных И. с. А достигает 1,3, у монобромнафталиновой - - 1,6. В И. с. уменьшается рассеяние света и тем самым увеличивается контраст изображения. Это особенно важно при исслеловании слабо отражающих объектов.
И. с. позволяют исследовать объекты, находящиеся на разной глубине в иммерсионной жидкости, путём погружения в неё объектива. Например, с объективом, рассчитанным на
водную
и
 ммерсию, можно наблюдать микроорганизмы в воде.
ммерсию, можно наблюдать микроорганизмы в воде.Объективы различаются по оптическим характеристикам и конструкции:
- по степени исправления хроматической аберрации: - ахроматы, апохроматы и др.
- с исправленной кривизной изображения: - планахроматы, планапохроматы
- по длине тубуса микроскопа - 160 мм для проходящего света, 190 мм для отраженного света, бесконечность для проходящего и отраженного света;
- по свойствам иммерсии: сухие системы (без иммерсии) и иммерсионные системы.
Объективы апохроматы отличаются от ахроматов степенью исправления хроматической абберации. Благодаря более совершенному устранению дефектов изображения, связанных с хроматической абберацией, качество изображения, получаемого при наблюдении цветных объектов (окрашенные срезы, микроорганизмы и т.п.), особенно при больших увеличениях, значительно выше при использовании апохроматов. Апохроматы, а также ахроматы большого увеличения применяются совместно с компенсационными окулярами.
Некоторые характеристики объективов выгравированы на их оправе. К ним относятся : • увеличение (4,10,40,100, и др.), •апертура (0,12; 0.30; 0,65 1,25), •длина тубуса (160 и др.)
•толщина покровного стекла (0,17), •тип иммерсии (МИ - масляная иммерсия - черный ободок, ВИ - водная иммерсия - белый ободок и др.)
| Группа | Объективы | Числ. апертура | Увеличение в | Характеристика |
| | | | крат | |
| 1 | малых увеличений и апертур | А<0.2 | <10 | Сухие системы -между препарат0.65ом и фронтальной |
| | | | | линзой |
| | | | | объектива - |
| | | | | воздух |
| 2 | Средних увеличений и | 0.2<А<0.65 | <10 | |
| | апертур | | | |
| 3 | Больших увеличений и | А>0.65 | >40 | Иммерсионные системы - между |
| | апертур | | | препаратом: и фронтальной |
| | | | | линзой |
| | | | | объектива - |
| | | | | иммерсионная |
| | | | | среда с высоким |
| | | | | показателем |
| | | | | преломления |
| Увеличение, крат. | Числовая апертура | Система | Рабочее расстояние*, мм |
| 10 | 0,3 | сухая | 7,24 |
| 20 | 0,4 | сухая | 1,7 |
| 40 | 0,65 | сухая | 0,55 |
| 40 | 0,75 | Водная иммерсия | 1,80 |
| 90 | 1,25 | Масляная иммерсия | 0,1 |
* - Рабочим расстоянием называется расстояние от верхней поверхности покровного стекла до оправы первой линзы объектива.
Окуляры - предназначены для увеличения размеров изображения структур объекта, полученного объективом до величины, хорошо различимой глазом (или другим приемником изображения. Такое увеличение называется полезным и соответствует величине равной 500-1000 числовых апертур объектива. Дальнейшее увеличение не выявляет новых деталей объекта, а приводит к размыванию границ выявленных объективом деталей, их нерезкости, и является бесполезным. Различные окуляры используются аналогично лупе для рассматривания полученного изображения, а также для его проецирования на фото-, кинопленку или мишень видеокамеры.
Окуляры различаются по конструкции и собственному увеличению. В настоящее время в биологических микроскопах, чаще всего используются окуляры Гюйгенса и компенсационные.
Окуляры Гюйгенса используются с объективами - ахроматами малого увеличения, •Компенсационные - с ахроматами большого увеличения и апохроматами.
Окуляры Гюйгенса состоят из 2-х линз: верхней - глазной и нижней - полевой. В фокусе глазной линзы расположена диафрагма поля. Компенсационные окуляры устраняют остаточную абберацию объективов. Для проецирования изображения применяются фотоокуляры и гомали (отрицательные системы, исправляющие некоторые оптические дефекты полученного объективом изображения). Гомали не пригодны для визуального наблюдения.
Тип окуляра и кратность увеличения обозначаются на оправе глазной линзы (например, окуляр Гюйгенса - 7х, компенсационный окуляр - К7х или комп7х).
Конденсор предназначен для того, чтобы сфокусировать на препарате свет от осветителя. Он состоит из нескольких линз, превращающих параллельные лучи от осветителя в сходящиеся. Одной из деталей конденсора является апертурная диафрагма, необходимая для правильного освещения препарата
Конденсор состоит из нескольких линз, вмонтированных в металлическую оправу, закрепляемую особым винтом в гильзе держателя. По существу конденсор представляет светосильный, короткофокусный объектив (в ряде случаев вместо конденсора используют объектив такой же апертуры, как и объектив, с которым ведется наблюдение, зажимая его в особое центрируемое приспособление, которое вставляют в гильзу конденсодержателя). Чем светосильнее конденсор, тем большее число линз он содержит. Конденсор высокой апертуры (например, А=1,2) не следует применять с объективами малых и средних увеличений, так как в этом случае будет освещена только центральная: часть поля зрения. Чтобы осветить все поле зрения указанных объективов, в некоторых конструкциях, фронтальная линза конденсора вывинчивается или выключается из хода лучей с помощью рычага. Оставшаяся нижняя часть конденсора, работает с небольшой апертурой порядка 0,3-035, может применятся самостоятельно, как конденсор с большим фокусным расстоянием и полностью освещать поле зрения этих объективов.
Влияние раскрытия апертурной диафрагмы конденсора микроскопа на качество изображения
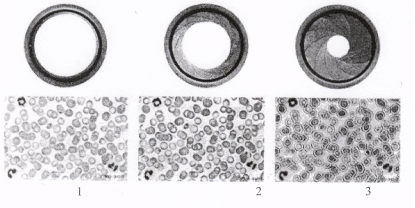
- Недостаточно контрастное изображение в результате слишком большого раскрытия
апертурной диафрагмы конденсора.
- Четкое изображение. Нормальное раскрытие апертурной диафрагмы.
- Нечеткое изображение. Дифракционные ободки в результате недостаточного раскрытия
апертурной диафрагмы конденсора.
В качестве источника света в современных осветителях микроскопов обычно использую низковольтные лампы накаливания с толстой нитью. Широкое применение получили ламп накаливания с йодным циклом (кварцево-галогенные лампы - КГМ). Помимо лампы, в конструкцию осветителя входит коллекторная линза, позволяющая получить при соответствующей фокусировке параллельный пучок лучей, а также ирисовая полевая диафрагма, от раскрытия которой зависит освещенное поле на препарате.
Осветители бывают в виде отдельного устройства, накладные, а также встроенные
штатив микроскопа.
Светофильтры, используемые в световой микроскопии биологических объектов, условно можно разделить на две группы: ослабляющие световой поток без изменения спектрального состава света (нейтральные светофильтры, матовое стекло, скрещенные поляризационные фильтры) и светофильтры, выделяющие определенную область спектра. Нейтральные светофильтры и матовые стекла используются после настройки света по Келеру, если яркость источника света слишком велика. Светофильтры выделяющие определенную область спектра могут быть использованы для усиления или ослабления контраста некоторых деталей в окрашенных препаратах. Для увеличения контраста необходимо использовать светофильтры дополнительные по цвету к цвету окраски. Для ослабления контраста - светофильтры аналогичные цвету окраски. Более широко светофильтры используются при фотомикроскопии.
Выбор увеличения
Выбор увеличения зависит от того, какие детали объекта нам необходимо выявить. В начал исследования любой препарат просматривают с малым увеличением (объектив 8х, 10х или меньше), выбирают участок, детали которого необходимо рассмотреть, после чего осторожно поворачивают револьвер, устанавливая объектив нужного увеличения. Проверяют правильность установки освещения по Келеру. В случае необходимости исследования мельчайших деталей, выбирают иммерсионный объектив с максимальной апертурой (до 1,4 )
Предметные и покровные стекла
Предметные стекла предназначены для помещения на них различных микропрепаратов
взвеси бактерий, срезы ткани, отпечатки органов, мазки крови и т.п.). Они имеют форму
прямоугольных плоскопараллельных пластинок, изготовленных из прозрачного бесцветног
силикатного стекла.
- Чаще всего выпускаются предметные стекла размером 26х76мм
толщина предметных стекол должна быть не более 1,1мм. На их поверхности не должно быть дефектов (царапин и др.).
- Использование предметных стекол большей толщины может препятствовать
настройке освещения по Келеру. Особенно существенно использование тонких
высококачественных предметных стекол при работе по методу "темного поля"
Покровные стекла предназначены для предохранения микропрепаратов от пыли и
механических повреждений при микроскопировании. Покровные стекла, чаще всего имеют форму квадратных плоскопараллельных пластинок, размерами преимущественно 18x18 и 24x24 мм. Толщина покровного стекла не должна превышать 0,17мм
Объектив с коррекционной оправой
Особое значение толщина покровных стекол имеет при использовании сухих объективов
большого увеличения (40х).
- Покровные стекла нестандартной толщины могут быть использованы только с сухими объективами, имеющими коррекционную оправу, на которой указана толщина покровного стекла.
- Для иммерсионных объективов, толщина покровного стекла не имеет существенного значения. Однако, использование покровных стекол большей толщины, чем рабочее расстояние объектива, может явиться препятствием для получения четкого изображения препарата из-за невозможности сфокусировать объектив на препарат. Кроме того, при безуспешной попытке сфокусировать объектив может быть повреждена его фронтальная линза
Препарат для микроскопии, предназначенный для длительного хранения
Для улучшения качества изображения, и в случае необходимости хранения препаратов,
между покровным и предметным стеклами могут быть помещены различные заключающие
среды с более высоким, чем у воздуха, показателем преломления.
- К средам для кратковременного хранения и наблюдения препаратов относятся: вода и водные растворы, глицерин, спирты и т.п.(препараты типа "раздавленная капля"). Для уменьшения испарения жидкости эти препараты окантовываются по краям покровного стекла расплавленной смесью воска с парафином, маслом, клеем и др.
- В качестве сред для длительного хранения препаратов используют канадский бальзам, синтетические смолы (поливиниловый спирт, полистирол и т.п.)
Фотомикроскопия
фотомикроскопия позволяет вводить микроскопическое изображение в память компьютера, производить измерения размеров объектов(морфометрия) и их оптических характеристик(денситометрия)
Системы анализа изображений
системы анализа изображения состоят из микроскопа, средств ввода и оцифровки изображения, персонального компьютера и программного обеспечения, основные области применения систем анализа изображений в микроскопии - это научные исследования, объективизация диагностики, уменьшение рутинных работ (например анализ клеточного состава мазка крови), формирование автоматизированных рабочих мест специалистов (морфолг, гематолог и др.)
системы ввода изображения позволяют наблюдать на экране монитора изображение микроскопических объектов, одновременно с визуальным наблюдением их в микроскопе. При этом монитор может быть установлен на значительном расстоянии от микроскопа. Это позволяет использовать телевизионную микроскопию для целей обучения и для консультации со специалистами. Большое значение имеет ввод микроскопических изображений в компьютер для архивации, анализа, создания обучающих пособий
Погрешности изображения, получаемого с помощью оптики.
Изображение, получаемое с помощью отдельной линзы, не является совершенным - оно
обладает целым рядом дефектов. Поэтому, в оптике микроскопа используют комбинацию
различных линз, которые позволяют компенсировать эти недостатки. К таким погрешностям
линз и, в частности, микроскопической оптики относятся сферическая абберация,
хроматическая абберация, кривизна поля изображения и др.
Сферическая абберация связана с тем, что лучи проходящие через центральный участок линзы, проделывают в стекле более длинный: путь, чем лучи проходящие через периферический участок, поэтому фокусируется в разных плоскостях, что приводит к нерезкости изображения.
Хроматическая аберрация связана со способностью линзы различно преломлять составляющие белый свет лучи различных участков спектра.
Кривизна поля изображения выражается в невозможности одновременно сфокусировать центральный и периферический участки поля зрения.
Помимо указанных погрешностей существуют и другие (например кома, астигматизм), которые здесь не рассматриваются. Сферическая абберация приводит к нерезкости изображения, поскольку лучи, проходящие через центр и периферию линзы фокусируется в разных плоскостях. Хроматическая аберрация особенно ухудшает качество изображения при наблюдении окрашенных препаратов, кривизна поля препятствует получению хорошей микрофотографии. Эти погрешности устраняются путем подбора комбинации линз с различной кривизной поверхности, с разной преломляющей способностью, изготовленных из различного сорта оптического стекла.
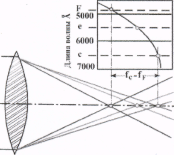
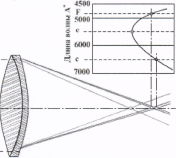
На рисунках 3, 4 показаны два вида хроматической абберации:
хроматическая аберрация положения (рис.3) при которой изображения, образованные лучами разных участков спектра фокусируются в разных плоскостях, и
хроматическая аберрация увеличения (рис.4), при которой эти изображения имеют разную величину, что ведет к образованию цветных ободков вокруг деталей изображения.
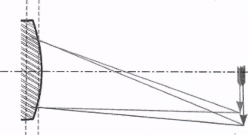
Рис. 5 Исправление хроматической аберрации
На рис.5 показано частичное исправление хроматической аберрации путем комбинации
Инвертированный микроскоп.
Методы наблюдения в проходящем и отраженном свете,
Метод фазового контраста,
Метод темного поля;
Области применения.
Флуоресцентные микроскопы
Устройство и принципиальные особенности эпи-флуоресцентного микроскопа Устройство и принципиальные особенности конфокального сканирующего микрос
Области применения флуоресцентных микроскопов.
Спектральные флуоресцентный и КР- микроскопы: устройство и применение. Двухфотонная флуоресцентная микроскопия: принцип, особенности и применение.
с
Биологические объекты исследования методами микроскопии.
Пространственное и спектральное разрешение.
Микроскопия единичных молекул.
Флуорофоры и их характеристики, существенные для микроскопии.
Метод FRAP (восстановление флуоресценции после фотовыгорания )
Метод FRET (флуоресцентный резонансный перенос энергии).
Собственные клеточные флуорофоры.
Флуоресцирующие биологически-активные соединения и их изучение методами оптической микроскопии.
Флуоресцентные зонды и их применение в микроскопии.
Флуоресцентные метки: выбор: процедура и особенности мечения: применение.
Литература.
- Аппельт Г. Введение в методы микроскопического исследования, М.,1959
- Михель К. Основы теории микроскопа, М., 1955
- Панов В.А., Андреев Л.Н. Оптика микроскопов, Л.,1976
- Пешков М.А. Микроскоп и основные методы работы с ним. В кн. "Лабораторные
методы исследования патогенных простейших", М., 1957, стр. 7-51
- Световая микроскопия в биологии. Методы. Под ред. А. Лейси, М., 1992
- Скворцов Г.Е., Панов В.А., Поляков Н.И., Федин Л.А. Микроскопы, 1969
В интернете: rph.ru
Лит.: Мейсель М. П., Люминесцентная микроскопия, «Вестник АН СССР», 1953, № 10, с. 3—10; Ромейс Б., Микроскопическая техника, пер. с нем., М., 1954; Брумберг Е. М., О флуоресцентных микроскопах, «Журнал общей биологии», 1955, т. 16, № 3, с. 222—37; Современные методы и техника морфологических исследований. [Сб. ст.], под. ред. Д. А. Жданова, Л., 1955; Роскин Г. И., Левинсон Л. Б., Микроскопическая техника, 3 изд., М., 1957; Аппельт Г., Введение в методы микроскопического исследования, пер. с нем., М., 1959; Зубжицкий Ю. Н., Метод люминесцентной микроскопии в микробиологии, вирусологии и иммунологии, Л., 1964.
Лит.: Руководство по цитологии, т. 1—2 М. — Л., 1965-66.,
Лит.: Михель К., Основы теории микроскопа, пер. с нем., М., 1955; Ринне Ф., Берек М., Оптические исследования при помощи поляризационного микроскопа, пер. с нем., М., 1937; Микроскопы, под ред. Н. И. Полякова, М., 1969; Тудоровский А. И., Теория оптических приборов, 2 изд., ч. 1—2, М. — Л., 1948—52; Франсон М., Фазово-контрастный и интерференционный микроскопы, пер. с франц., М., 1960; Федин Л. А., Микроскопы, принадлежности к ним и лупы, М., 1961; Федин Л. А., Барский И. Я., Микрофотография, Л., 1971; Оптические приборы для измерения линейных и угловых величин в машиностроении, М., 1964.
Л. А. Федин.
Усанов Дмитрий Александрович, Скрипаль Анатолий Владимирович. Телевизионная измерительная микроскопия. - Саратов : Изд-во Сарат. ун-та, 1996.
Multidimensional microscopy / Cheng Р.С. et al. ed. - New York etc. : Springer, Cop. 1994.
Corle Timothy R., Kino Gordon S. Confocal scanning optical microscopy and related imaging systems. - San Diego (Calif.) etc. : Acad. press, 1996.
Scanning probe microscopy and spectroscopy : Theory, techniques, a. applications / Ed. by Bonnell Dawn A. - 2d ed. - New York etc. : Wiley-VCH, Cop. 2001.
Methods in enzymology. Vol. 307 : Confocal microscopy / Ed. by Conn P. Michael. - Cop. 1999. -XXXII.
"Principles of Fluorescence Spectroscopy (2-nd edition)." J.R. Lakowicz, Kluwer Academic/Plenum Publishers, New York, NY, 1999.
"Protein Localization by Fluorescence Microscopy: A practical approach." V.J. Allan, Oxford University Press, Oxford, England, 2000.
Fluorescence recovery after photobleaching (FRAP) - A technique in light microscopy using a pulse from a focused laser microbeam to deplete the fluorescence in a local region in a living cell The subsequent recovery of fluorescence in the irradiated region is measured to establish the mobility of the molecules that carry the fluorescent tag.
