Автореферат разослан 2008 г
| Вид материала | Автореферат |
- Автореферат разослан 2008, 441.97kb.
- Автореферат разослан 2008, 287.64kb.
- Автореферат разослан февраля 2008, 524.47kb.
- Автореферат разослан 15 июля 2008, 318.27kb.
- Автореферат разослан 21 мая 2008 года, 603.72kb.
- Автореферат разослан 2008, 369.45kb.
- Автореферат разослан 25 сентября 2008, 237.94kb.
- Автореферат разослан 18 декабря 2008, 250.07kb.
- Автореферат разослан марта 2008, 380.31kb.
- Автореферат разослан " " 1996, 264.76kb.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Эпизоотическая ситуация в РФ
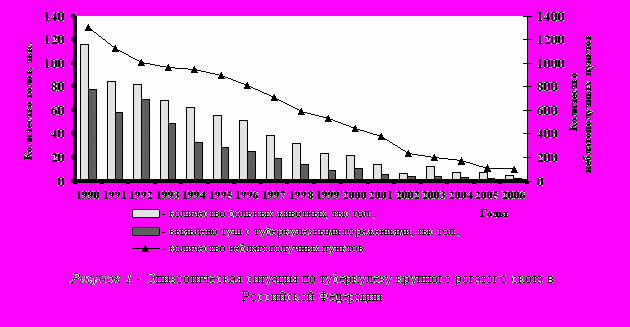
Эпизоотическая ситуация по туберкулезу крупного рогатого скота за последний период в РФ, несмотря на ухудшение эпидемиологической обстановки, неуклонно улучшается. Так, с 1990 по 2006 г. количество неблагополучных пунктов в стране сократилось с 1124 до 99, или в 11,4 раза (рис. 1), заболевших животных – с 116,2 до 5,3 тыс. гол., т. е. в 22 раза, очаговость – в 2 раза, пораженность туберкулезом туш - в 17,3 раза.
В 2006 г. туберкулез крупного рогатого скота регистрировался в 6 федеральных округах РФ из 7 (85,7%), в том числе в 22 субъектах (24,7%.).
Анализ показал, что наиболее неблагополучным является Южный федеральный округ, где туберкулез регистрируется в 9 (69,2%) субъектах РФ. В Сибирском федеральном округе туберкулез регистрируется в 3 субъектах РФ (21,4%), на долю которых приходится 29 % общего количества неблагополучных пунктов, зарегистрированных в Российской Федерации. Не регистрируется туберкулез в Северо-Западном федеральном округе, на грани оздоровления находится Дальневосточный регион страны.
В ряде субъектов РФ (Московская, Орловская, Ростовская, Курганская, Тюменская области, Республика Мордовия) выявлено несоответствие данных ветеринарно-санитарной экспертизы мясокомбинатов и рынков, уровня неблагополучия и заболеваемости туберкулезом, что требует уточнения эпизоотической обстановки по туберкулезу в хозяйствах, у животных которых при ветеринарно-санитарной экспертизе выявлены характерные для туберкулеза поражения.
Автоматизированная система
эпизоотологического мониторинга (АСЭМ)
Автоматизированная система эпизоотологического мониторинга разработана для оптимизации сбора, хранения, обработки и анализа эпизоотологической информации в масштабах субъектов РФ и входящих в них административных территорий с целью эффективного и оперативного контроля противоэпизоотических мероприятий.
Критерии оценки эпизоотической ситуации отобраны на основе многолетних традиционных методов эпизоотологического мониторинга и ранее разработанных критериев и рекомендаций по технологии противотуберкулезных мероприятий, а также нормативно-технической документации, регламентирующей мероприятия при туберкулезе животных.
По запросу пользователя в качестве вычисляемых характеристик АСЭМ выдает за любой временной отрезок по любой административной территории в цифровом и графическом исполнении такие показатели, как распространенность, уровень неблагополучия, количество исследованных животных, инцидентность, заболеваемость, пораженность туш и др.
Совершенствование методов и средств диагностики туберкулеза
Диагностика туберкулеза у ареактивного к туберкулину
молодняка крупного рогатого скота
Одной из причин ареактивности молодняка крупного рогатого скота к туберкулину является врожденная толерантность в результате инфицирования возбудителем туберкулеза в ранний постнатальный период жизни.
Для решения вопроса в научно-производственном опыте в шести хозяйствах Новосибирской области телят в возрасте до 12 дней иммунизировали вакциной БЦЖ и через 45 дней исследовали внутрикожно ППД-туберкулином для млекопитающих. При этом процент не реагирующих на туберкулин телят колебался в пределах 0,6–16,7 (в среднем 6,1). При повторной иммунизации через 45 дней количество не реагирующих телят снизилось до 3,9% (0,6–13,6%). Отсутствие реакций на туберкулин у части иммунизированных БЦЖ телят, а также зараженных патогенным возбудителем туберкулеза, свидетельствует об иммунологической толерантности.
Опыт продолжили в условиях экспериментальной базы ИЭВСиДВ СО РАСХН, на которой разместили животных трех групп по 5 голов в каждой. Первую группу составили телята, дважды (после первой вакцинации и допрививки) не реагирующие на туберкулиновую пробу, вторую – вакцинированные БЦЖ за 3 мес. до постановки опыта, третью – не вакцинированные (контроль). Через 3 недели всех телят заразили вирулентной культурой M.bovis (шт. 14, ВНИИБТЖ) орально в дозе 0,1 мг/кг живой массы.
Установлено, что исследованные в различных диагностических тестах (РСК, туберкулиновая проба) ареактивные животные реагировали на протяжении опыта (9 мес.) менее интенсивно и в меньшем количестве. При патолого-анатомических исследованиях наиболее обширные, вплоть до генерализации, туберкулезные поражения во внутренних органах и лимфатических узлах установлены у ареактивных к туберкулину телят.
Таким образом, часть инфицированных возбудителем туберкулеза телят в ранний постнатальный период не реагируют на внутрикожное введение туберкулина в возрасте 7–8 мес. У таких животных развиваются тяжелые формы поражений, они на протяжении длительного времени являются скрытыми источниками распространения возбудителя туберкулеза.
Указанная схема ранней диагностики туберкулеза с использованием вакцины БЦЖ апробирована в производственных условиях на 3112 телятах. При этом через 45 дней после вакцинации БЦЖ телят в возрасте до 14 дней не реагировало на туберкулин в среднем 7,1%, с колебаниями от 0,7 до 16,8% по отдельным фермам, причем это явление наблюдали на 10 из 13 экспериментальных фермах.
Через 45–60 дней после повторной вакцинации не реагировало на туберкулин в среднем 21,7% телят на шести фермах, или 1,5% от числа первично вакцинированных в возрасте до 14 дней. Большинство этих телят отставали в росте, были ослаблены, а при убое у них обнаружены во внутренних органах и лимфатических узлах туберкулезные поражения.
Таким образом, результаты производственного испытания подтвердили данные опытов по выявлению больных туберкулезом ареактивных к туберкулину телят при повторной вакцинации БЦЖ. Такие животные являются весьма опасными источниками распространения инфекции.
Питательные среды на основе минерального комплекса
растительного происхождения для культивирования микобактерий
Учитывая богатый минеральный состав и наличие большого количества биологически активных веществ, в качестве добавок при экспериментальном конструировании новых питательных сред использовали компоненты биологического и неорганического происхождения: суспензию из сухих пекарских дрожжей (ГОСТ 171–81), соевое молоко (ТУ 9222–002–10126 558–94), оксидат торфа (ТУ 88 БССР 135–88) и приготовленный нами минеральный комплекс – вытяжку из золы древесины березы.
За основу были взяты технологии приготовления оригинальных плотных питательных сред Финн–2, Гельберга и Левенштейна-Йенсена, наиболее часто применяемых в ветеринарной бактериологической практике для диагностики туберкулеза у разных видов животных.
В серии экспериментов были приготовлены и испытаны 52 варианта плотных питательных сред с использованием компонентов биологического и неорганического происхождения: суспензии из сухих пекарских дрожжей, соевого молока, оксидата торфа и приготовленного минерального комплекса – вытяжки из золы древесины березы (в различных концентрациях, соотношениях компонентов, способах стерилизации и внесения, значениях рН). В результате испытаний отобрали оптимальный вариант, названный «Питательная среда ИЭВСиДВ».
Установлено, что питательная среда ИЭВСиДВ, содержащая в своем составе минеральный комплекс из вытяжки золы древесины березы и оксидат торфа в определенных концентрациях, при сравнительной дешевизне обладает лучшими ростовыми свойствами в сравнении с коммерческими средами (табл. 1).
При посеве культур M. bovis на среду ИЭВСиДВ срок первичного роста составляет 6,2, M. tuberculosis – 5,3 суток, что вдвое меньше, чем на средах Финн-2 и Фаст-3Л. При посеве биоматериала от экспериментально зараженных M. bovis лабораторных животных на среду ИЭВСиДВ срок первичного роста сокращается на 4,1 – 6,7 (на 29 – 38%), от больного туберкулезом крупного рогатого скота – на 4,8 – 8,7 суток (на 23 – 29%). При культивировании M. avium и атипичных микобактерий (M. smegmatis) не выявлено преимуществ среды ИЭВСиДВ в сравнении с коммерческими средами
Т а б л и ц а 1 – Сравнительная характеристика показателей роста (сутки)
микобактерий на коммерческих питательных средах и среде ИЭВСиДВ
| Культура, биоматериал | Финн–2 | ФАСТ–3Л | ИЭВСиДВ | |||
| первич- ный | интен- сивный | первич- ный | интен- сивный | первич- ный | интен- сивный | |
| M. bovis (шт. 8, ВИЭВ) | 10,1±0,2 | 16,3±0,6 | 11,5±0,2 | 18,3±0,2 | 6,2±0,1 | 11,4±0,6 |
| M. tuberculosis (шт. Н37Rv) | 9,1±0,4 | 15,1±0,6 | 11,4±0,3 | 17,3±0,3 | 5,3±0,2 | 8,1±0,2 |
| M. avium (шт. 780, ВИЭВ) | 9,3±0,5 | 13,1±0,8 | 7,1±0,3 | 11,3±0,6 | 10,4±1,6 | 13,5±2,4 |
| M. smegmatis (ИЭВСиДВ) | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 | 2,0 |
| Биоматериал от морских свинок (M. bovis) | 14,6±0,3 | 23,7±0,5 | 17,2±1,1 | 24,4±1,6 | 10,5±0,3 | 13,2±0,5 |
| Биоматериал от крупного рогатого скота (M. bovis) | 21,4±0,9 | 25,3±0,9 | 23,1±1,0 | 26,7±1,0 | 16,6±0,6 | 19,5±0,9 |
Сконструированная новая жидкая питательная среда, с включением в состав способствующих стимуляции роста микобактерий туберкулеза вытяжки из золы древесины березы, криалла и сыворотки крови лошадей, позволяет, в сравнении с оригинальной средой Сотона, получить первичный рост M. bovis раньше на 6 суток (на 43%), M. tuberculosis – на 8 (на 58%), а интенсивный рост обоих видов возбудителя – на 8 суток (на 37 – 40%).
Метод седиментации при обработке биоматериала от животных
для бактериологического исследования на туберкулез
Результативность бактериологического исследования на туберкулез во многом зависит от предварительной обработки биоматериала. В ветеринарной бактериологической практике чаще всего используются методы Гона (Гона-Левенштейна-Сумиоши), Аликаевой и флотации.
В исследованиях использовали такой физический прием, как седиментация, т.е. расслоение дисперсных систем под действием силы тяжести с отделением дисперсной фазы в виде осадка, необходимое для обогащения жидкодисперсной части гомогенизата микроорганизмами, высвобожденными из биологического материала от животных.
Процесс седиментации осуществляли в два этапа. Ткани биоматериала (пробы внутренних органов и лимфатических узлов) разрезали на кусочки размером 0,5 см3, помещали в ступку и заливали 6%-ным раствором щавелевой кислоты в соотношении 1:6. Через 20 – 30 мин. кислоту сливали, кусочки пробы промывали в течение 5 мин. дистиллированной водой, меняя ее 3 раза. Отмытые кусочки тканей растирали со стерильным песком. Гомогенизат разбавляли физраствором (1:15) и проводили первичную седиментацию в течение 3, 4, 5 и 6 мин. Установлено, что полное оседание крупных частиц гомогенизата при первичной седиментации наступает через 5 мин.
Для освобождения жидкодисперсной части гомогенизата от примесей проводили вторичную седиментацию в течение 1, 2, 3, и 4 мин. При этом жидкодисперсную часть, полученную после первичной седиментации в ступке, переносили в бактериологические пробирки. Наибольшее количество высвобожденных микобактерий туберкулеза и меньшее – примесей при повторной седиментации наблюдается через 3 мин. Жидкодисперсную часть после вторичной седиментации центрифугировали при 3500 об/мин. в течение 20 мин., надосадочную жидкость сливали, а обогащенный возбудителем туберкулеза осадок использовали для бактериологического исследования.
Для сравнительного анализа эффективности предварительной обработки биоматериал от реагирующего на туберкулин крупного рогатого скота из неблагополучных по туберкулезу хозяйств (пробы внутренних органов, лимфатические узлы) обрабатывали тремя методами: Гона, Аликаевой и предложенным нами методом двойной седиментации. Биоматериал высевали на питательную среду Левенштейна-Йенсена.
Из биоматериала, обработанного методом двойной седиментации, культуры микобактерий выросли в 89 пробирках (49,4%), т.е. рост культур был на 36,6% больше, чем при обработке по методу Гона, и на 36,1% больше, чем при обработке по методу Аликаевой (табл. 2). При этом загрязненность посевов сопутствующей микрофлорой в сравнении с методом Гона была ниже в 3,4 раза, Аликаевой – в 7,5 раза.
Т а б л и ц а 2 – Влияние способов предварительной обработки биоматериала
на высеваемость микобактерий туберкулеза и загрязненность посевов
| Метод обработки биоматериала | Засеяно пробирок | Рост культур | Загрязненность посевов | ||
| пробирок | % | пробирок | % | ||
| Гона Аликаевой Двойной седиментации | 180 180 180 | 23 24 89 | 12,8 13,3 49,4 | 24 53 7 | 13,3 19,4 3,8 |
Таким образом, при использовании для посева на питательные среды жидкодисперсной суспензии биоматериала, полученной двойной седиментацией в течение 5 и 3 мин., значительно повышается высеваемость микобактерий и достигается высокая чистота роста возбудителя туберкулеза.
Усовершенствование методики постановки ПЦР
в диагностике туберкулеза
Учитывая результаты достижений молекулярно-генетической диагностики инфекционных болезней, в том числе туберкулеза, методом ПЦР провели исследования по усовершенствованию методики постановки реакции, позволяющей выявить возбудителя туберкулеза непосредственно в биоматериале от больных туберкулезом животных. Основным требованием к праймерам являлись специфичность и способность выявлять комплекс патогенных микобактерий.
Исходя из результатов исследований с патогенными ( M. bovis, M. tuberculosis, M. avium) и атипичными (M. smegmatis, M. flavium, M. triviale, M. flaviscens) микобактериями, наиболее информативным следует считать метод выделения ДНК микобактерий, включающий предварительную обработку биоматериала от животных двойной седиментацией тканей с последующим жестким режимом обработки образцов хлороформом и фенолом. Предложенная реакционная смесь (100 мкл смеси состоит из 10 мкл 10-кратного буфера, 4 мкл 5 мМ dNTP, 8 мкл праймера, 66 мкл Н2О и 2 мкл Таg-полимеразы) для проведения амплификации по качественным показателям не уступает классической прописи, но более доступна и проста. Для постановки ПЦР с ДНК микобактерий, выделенных из биоматериала от животных, необходимо 40 циклов амплификации. При такой кратности циклов продукт ПЦР синтезируется в достаточном количестве для качественного проведения и контроля электрофореза. Предложенный метод позволяет выделить ДНК микобактерий из биоматериала уже через 7 дней после инфицирования морских свинок патогенными и атипичными микобактериями. При анализе образцов биоматериала от больного туберкулезом крупного рогатого скота методом ПЦР с использованием ДНК микобактерий отмечены высокая чувствительность и специфичность, превосходящие аналогичные показатели при культуральном методе исследования. При температуре отжига праймеров 68°С неспецифические реакции ПЦР на ДНК непатогенных микобактерий исчезают.
Одним из вариантов ПЦР-генетического типирования микроорганизмов является анализ полиморфизма длин фрагментов рестрикции (ПДФР) ампликонов, получаемых с помощью специфических праймеров. Методы, выявляющие геномный полиморфизм, обладают рядом преимуществ перед традиционными подходами при идентификации возбудителя болезней. С учетом этого провели исследования по выяснению возможности выявления специфических праймеров для дифференциации патогенных культур микобактерий. В работе использовали данные EMBL/Gen FGH Bank/DDB c проведением предварительного анализа нуклеотидных последовательностей разных видов патогенных микобактерий. Для анализа в программах OLIGI и DIROM был осуществлен подбор и синтез специфических праймеров для референтных штаммов культур патогенных видов микобактерий (M.bovis, шт. BCG; M.bovis, шт. 8; M.tuberculosis, шт. Н37Rv; M.avium, шт. 19).
Проанализировав вставки нуклеотидных последовательностей M.bovis, M.bovis BCG и M.tuberculosis, выделили ДНК микобактерий из референтных штаммов и эпизоотических культур. Установлено, что предельный срок хранения ДНК микобактерий составляет 6 мес. при t –18°С. Выбраны и синтезированы два специфических праймера для предварительной дифференциации микобактерий туберкулезного комплекса от атипичных видов, а также два специфических праймера для постановки ПЦР-ПДРФ, фланкирующих фрагмент вставки IS 6110 в 1289 нуклеотидных пар (н.п.).
Анализ полученных в ПЦР-ПДРФ генетических профилей с помощью праймеров рестриктазы Alu1 выявил характерный для M.tuberculosis фрагмент в 504 н. п., отсутствующий у M.bovis и M.bovis BCG, а в генетическом профиле M.bovis – фрагмент в 307 н. п., отсутствующий у M.tuberculosis и M.bovis BCG.
Электронный кутиметр для оценки внутрикожной аллергической
реакции на введение туберкулиновых препаратов
При аллергической диагностике туберкулеза у разных видов животных обязательным является измерение толщины кожной складки после введения туберкулинов. С этой целью отечественное приборостроение выпускает несколько видов линейных и циферблатных кутиметров, однако они не дают четких показаний, и их невозможно использовать без дополнительной подсветки в темное время суток и в помещениях с недостаточным освещением.
Нами разработано новое техническое решение электронного кутиметра (рис. 2) для аллергической диагностики туберкулеза животных, производственное испытание которого показало его технологичность и надежность в использовании, точность и стабильность результатов промеров кожной складки как в условиях животноводческих помещений при любом световом режиме и освещении, так и на открытом воздухе.

Рисунок 2 – Цифровой ветеринарный кутиметр
Снятие ограничений по туберкулезу на фоне проявления
неспецифических реакций на туберкулин
К настоящему времени система профилактики и ликвидации туберкулеза сформировалась и в целом оказывает положительное влияние на эпизоотическую обстановку. Однако, возникают нестандартные ситуации, требующие корректировки и дополнений ряда положений, регламентирующих противотуберкулезные мероприятия. Так, часто проявление неспецифических туберкулиновых реакций наблюдается на фоне неблагополучия стад по туберкулезу, когда эти реакции, ввиду сложной дифференциации, учитываются как специфические. Оздоровление таких ферм по общепринятым критериям, предусмотренным санитарными и ветеринарными правилами, недостижимо.
Основанием для проведения комплекса дополнительных исследований с целью снятия ограничений должно явиться отсутствие туберкулезных поражений во внутренних органах и лимфатических узлах при убое реагирующих на туберкулин животных в течение последнего года.
Согласно разработанной схеме, критерием благополучия фермы по туберкулезу является получение 4-кратных отрицательных результатов патолого-анатомических и бактериологических исследований биоматериала от реагирующих на туберкулин животных. Схема предусматривает ежеквартальные, в течение года, аллергические исследования поголовья на туберкулез, убой всех реагирующих на туберкулин животных с ветеринарно-санитарной экспертизой внутренних органов и лимфатических узлов и бактериологическое исследование биоматериала.
Если на любом этапе исследований туберкулез при убое реагирующих на туберкулин животных подтвержден или выделен возбудитель из биоматериала, применение схемы прекращают и продолжают проводить оздоровительные мероприятии. При получении 4-кратных отрицательных результатов патолого-анатомических и бактериологических исследований ферму признают благополучной по туберкулезу, и после проведения заключительных мероприятий снимают ограничения.
Разработанная схема диагностических исследований апробирована в 48 неблагополучных по туберкулезу хозяйствах Сибири, с которых в течение года сняты ограничения. Рецидивов инфекции не отмечено.
Совершенствование методов и средств профилактики туберкулеза
Эффективность профилактического туберкулостатического
препарата ниазон при туберкулезе крупного рогатого скота
Общая характеристика
Ниазон представляет собой прозрачный вязкий водный раствор светло-желтого цвета, в состав которого входят изониазид, гидразон изониазида, полимер-пролонгатор метилцеллюлоза, стабилизатор трилон Б, антимикробные вещества – производные параоксибензойной кислоты и вода для инъекций в определенном соотношении. Препарат получают путем иммобилизации изониазида и гидразона изониазида на водорастворимом полимере.
Ниазон после длительного (в течение 1 года) хранения при комнатной температуре в защищенном от света месте не изменил цвет и не расслоился, а изменение основных параметров (рН, суммарное содержание активно действующего вещества – изониазида, массовое соотношение глюкозил-изониазида и изониазида) находилось в пределах нормативных требований.
Токсикологическая характеристика
Опыт по определению острой токсичности ниазона на 48 самцах белых мышей показал, что тяжесть клинических симптомов и время гибели животных находятся в прямой зависимости от дозы препарата, а ЛД50 препарата составляет 796,0±124,8 мг/кг живой массы. Признаки интоксикации у мышей наступали через 30–40 мин. после введения ниазона в летальных дозах. На основании результатов опыта, согласно ГОСТ 12.1.007–76 «Вредные вещества. Классификация и общие требования безопасности», ниазон относится к препаратам 3-го класса опасности – вещества умеренно опасные.
Важным показателем безопасного применения бактериостатических препаратов является также индекс широты терапевтического действия, определяемый делением максимально переносимой дозы (ЛД0) на величину ориентировочно-профилактической дозы. Исходя из этого, максимально переносимая доза ниазона составляет 300 мг/кг, а ориентировочно- профилактическая – 20 мг/кг. При соотношении этих показателей терапевтический индекс для ниазона составляет 15, что указывает на широкий предел безопасного применения препарата для химиопрофилактики туберкулеза животных.
В длительном токсикологическом эксперименте (9 мес.) на самцах крыс линии «Вистар» изучили хроническую токсичность ниазона при подкожном введении в дозе 20 мг/кг живой массы по схеме: 4 раза через 10 дней, далее - ежемесячно. Установлено, что ниазон не вызывает существенных изменений гематологических показателей (Р>0,05), в том числе содержания гемоглобина, количества эритроцитов и лейкоцитов в сравнении с контрольными животными и не вызывает нарушений антитоксической функции печени. Средняя продолжительность «гексеналового сна» крыс опытной (3378±40 сек.) и контрольной (3328±56,3 сек.) групп достоверно не отличалась.
Показатели эмбрионального материала (количество желтых тел беременности, живых и мертвых плодов, пол, масса, длина эмбрионов) опытных и контрольных крыс достоверно не отличались (Р>0,05), т. е. ниазон не обладает тератогенным и эмбриотоксическим действием на организм самок. Продолжительность эстрального цикла, общая эмбриональная, доимплантационная и постимплантационная смертность эмбрионов опытных крыс не превышали показатели контрольных, что свидетельствует об отсутствии гонадотоксических свойств и повышении доминантных летальных мутаций.
Фармакокинетика ниазона в сыворотке крови
Фармакокинетику активной фракции ниазона – изониазида определяли на 10 кроликах и 10 телятах 5–6-месячного возраста по методу О. Волленберга в модификации Р.И. Шендеровой (1975). Ниазон вводили подкожно, однократно, в дозе 20 мг/кг живой массы.
Установлено, что максимальное содержание изониазида в сыворотке крови содержится на 5-е сутки после введения препарата – 5,8 мкг/мл у кроликов и 8,6 мкг/мл у телят. Бактериостатический уровень (0,8–1,0 мкг/мл) изониазида у кроликов сохранялся до 8, у телят – до 10 дней, что учтено нами в дальнейшем при разработке схемы применения ниазона.
Бактериостатическая активность
В опыт отобрали 24 морские свинки и сформировали 3 группы по 8 голов в каждой. Морским свинкам 1-й опытной группы инъецировали ниазон в дозе 20 мг/кг живой массы и через 5 дней заразили их культурой M.bovis (шт. 14, ВНИИБТЖ) в оттитрованной дозе – 0,00001 г. Животным 2-й опытной группы ниазон ввели одновременно с заражением. Морских свинок 3-й группы заразили без применения препарата ниазон (контроль). Ниазон вводили лабораторным животным каждые 10 дней 4 раза, в дальнейшем – 1 раз в месяц, в течение 5 месяцев.
В ходе опыта все контрольные морские свинки пали в течение 2 мес. с генерализованными формами поражений туберкулезом внутренних органов. Животных 1–2-й опытных групп декапитировали через 6 мес. после заражения на фоне применения ниазона. При патолого-анатомическом исследовании характерных для туберкулеза изменений во внутренних органах опытных животных не установлено. Посев биоматериала на среду Финн–2 также не дал положительного результата.
В опыте на крупном рогатом скоте 5 телятам перед заражением ввели подкожно в область нижней трети шеи ниазон в дозе 20 мг/кг живой массы, 5 телят были контрольными (без применения ниазона). Всех телят заразили per os оттитрованной культурой M.bovis (шт. 14, ВНИИБТЖ) в дозе 0,15 мг/кг живой массы. Телятам опытной группы ниазон вводили 4 раза через 10 дней, в дальнейшем – 1 раз в месяц. Ежемесячно опытных и контрольных животных аллергически исследовали на туберкулез.
Согласно результатам аллергических исследований, животные контрольной группы (без применения ниазона) начали реагировать на внутрикожное введение туберкулина через 1 мес. после заражения утолщением кожной складки на 8,8±2,1 мм. У телят опытной группы этот показатель был достоверно ниже – 2,7±0,6 мм (Р<0,05) , т.е. не в диагностическом параметре. При последующих исследованиях у животных контрольной группы величина среднего утолщения кожной складки несколько уменьшилась через 6 мес. после заражения, однако оставалась высокой для диагностического титра – 6,2±1,2 мм.
Через 6 мес. после заражения всех телят опытной и контрольной групп подвергли убою. При ветеринарно-санитарной экспертизе у телят, которым вводили ниазон, характерных для туберкулеза поражений внутренних органов и лимфатических узлов не обнаружено, а при бактериологическом исследовании биоматериала исходная культура заражающего штамма возбудителя туберкулеза не выделена. При этом у всех контрольных телят, зараженных M.bovis и не подвергавшихся химиопрофилактике ниазоном, на вскрытии обнаружены туберкулезные поражения в различных лимфатических узлах, а при бактериологическом исследовании изолирована культура заражающего агента.
Таким образом, введение ниазона в соответствии с разработанными дозой и схемой обеспечивает 100%-ю профилактическую защиту морских свинок и молодняка крупного рогатого скота при заражении вирулентной культурой M. bovis.
Аллергизирующие свойства ниазона и влияние его на ультраструктуру
микобактерий
В опытах на морских свинках установлено, что ниазон не обладает аллергизирующим действием и не оказывает отрицательного влияния на капиллярную проницаемость кожи, а также не угнетает аллергическую реактивность организма к туберкулину при заражении культурой M. bovis.
Изучение субмикроскопической организации микобактерий при электронной микроскопии показало, что в зависимости от дозы ниазона происходят глубокие изменения морфологической структуры возбудителя, приводящие к его гибели. Так значительные изменения субмикроскопической организации М.bovis отмечены при концентрации ниазона 0,9 мкг/мл. Форма клеток микобактерий варьирует от округлой до звездчатой, клеточная стенка теряет трехслойное строение и выявляется как одноконтурная структура, цитоплазматическая мембрана фрагментирована и не имеет четких очертаний, цитоплазматическая мембрана и клеточная стенка разделены обширным периплазматическим пространством, цитоплазма клеток неравномерной плотности, разрежена, плотный гранулярный компонент скапливается в разных участках клетки, нуклеотид четко не определяется.
Таким образом, полученные данные свидетельствуют о возможности беспрепятственного длительного применения ниазона для профилактики туберкулеза крупного рогатого скота.
Средство снижения токсичности ниазона
Учитывая высокую иммуномодулирующую активность препаратов ДНК, способствующих индукции интерферона в организме и являющихся сильными адаптогенами, повышающими сопротивляемость организма, в качестве средства снижения токсичности ниазона испытали натриевую соль ДНК из молок лососевых рыб (дешевое и доступное сырье).
Исследования на 80 белых мышах показали, что острая токсичность ниазона при совместном применении с натриевой солью ДНК из молок рыб снижается при всех параметрах ЛД с увеличением дозы препарата по действующему веществу (изониазиду) в среднем на 12,4%.
Техника введения ниазона в организм
Ниазон крупному рогатому скоту вводят шприцем Жанэ подкожно в область нижней трети шеи животного в карман, образующийся при оттягивании кожи, через кровобрательную иглу № 2652 или № 2651 с переходным резиновым шлангом, из расчета 0,2 мл/кг живой массы, молодняку – в кожный карман переднего края лопатки.
Испытание ниазона в системе оздоровительных мероприятий
Ниазон в системе противотуберкулезных мероприятий испытан в 35 неблагополучных по туберкулезу фермах на 7,9 тыс. гол. крупного рогатого скота. Препарат вводили не реагирующим на ППД-туберкулин для млекопитающих животным подкожно в дозе 20 мг/кг живой массы каждые 10 дней, затем ежемесячно в течение 4 – 7 месяцев.
С учетом эпизоотической ситуации по туберкулезу на отдельных фермах, кратность введения ниазона составила 8–11 раз, или 8,6 раза в среднем на одну ферму. Все фермы после прекращения выявления реагирующих на туберкулин животных и при отрицательных результатах патолого-анатоми-ческих и бактериологических исследований, предусмотренных санитарными и ветеринарными правилами, а также после проведения заключительных мероприятий были оздоровлены и с них сняты ограничения по туберкулезу. Срок оздоровления ферм составил 12–16 мес. (13,7 мес. в среднем). Повторных вспышек туберкулеза в оздоровленных фермах не регистрировали.
Повышение протективных свойств вакцины БЦЖ
с помощью иммуномодуляторов
В качестве иммуномодуляторов повышения протективных свойств вакцины БЦЖ испытывали препараты рибонуклеиновой кислоты (РНК): полирибонат (поливедрим) – односпиральная РНК; ридостин (индуктор интерферона) – двухспиральная РНК. Иммуномодуляторы получены в НИКТИ БАВ ГНЦ ВБ «Вектор».
Физико-химические, пирогенные, токсические, анафилактогенные и другие свойства полирибоната и ридостина изучены ранее Ю.С. Аликиным (1992–1995), в связи с чем подробно изложим результаты собственных экспериментов, проведенных совместно с Протодьяконовой Г.П., по изучению влияния этих препаратов на повышение иммуногенных свойств вакцины БЦЖ при туберкулезе животных.
Полирибонат
Влияние полирибоната на иммуногенные свойства вакцины БЦЖ изучали в опыте на 180 морских свинках, разделенных на 18 групп. Всех животных иммунизировали вакциной БЦЖ и заразили оттитрованной дозой M.bovis (шт. 14, ВНИИБТЖ). Морским свинкам 3–17-й групп одновременно с вакцинацией внутримышечно вводили полирибонат в различных дозах (30, 50 и 65 мг на голову). Повторно полирибонат вводили в указанных дозах в сроки от 12 до 16 сут.
Результаты исследований показали, что все животные, зараженные без предварительной иммунизации вакциной БЦЖ (1-я группа), пали в среднем в течение 78 сут. с характерными для туберкулеза поражениями внутренних органов. Средняя продолжительность жизни морских свинок, иммунизированных вакциной БЦЖ без полирибоната, составила 96 сут.
Наибольшая продолжительность жизни после заражения (убиты через 145 сут.) отмечена в группах животных (3–17), привитых БЦЖ в сочетании с дробным введением полирибоната. Наименьшую пораженность внутренних органов опытных животных наблюдали в 9–11 группах.
Увеличение дозы полирибоната до 100 мг на голову при однократном введении существенно не повлияло на защитные свойства вакцины БЦЖ.
Таким образом, наибольшая степень иммунной защиты морских свинок от заражения возбудителем туберкулеза бычьего вида достигается при иммунизации их вакциной БЦЖ в сочетании с дробным введением иммуномодулятора полирибоната в дозе 30 мг на голову через 14 дней.
Влияние полирибоната на протективные свойства вакцины БЦЖ изучали на 15 бычках 10–12-дневного возраста, сформированных в 4 группы. Животных 1-й группы (3 гол.) не вакцинировали (контроль), 2-й (4 гол.) – иммунизировали БЦЖ в дозе 1 мг на голову, внутрикожно. Бычков 3-й группы вакцинировали БЦЖ в сочетании с однократным внутримышечным введением полирибоната в дозе 1 мг/кг живой массы, 4-й – в сочетании с дробным введением полирибоната по схеме: первый раз одновременно с вакциной в дозе 0,5 мг /кг, второй – через 14 дней в той же дозе.
Через 2,5 мес. после вакцинации всех бычков заразили вирулентной культурой возбудителя туберкулеза – M.bovis (шт. 14, ВНИИБТЖ) в дозе 0,15 мг/кг живой массы. Через 5 мес. после заражения все животные были убиты, проведены ветеринарно-санитарная экспертиза внутренних органов, лимфатических узлов и бактериологическое исследование биоматериала.
Результаты опыта показали, что лучший протективный эффект от заражения возбудителем туберкулеза отмечен в группе животных, иммунизированных вакциной БЦЖ с дробным введением полирибоната с интервалом 14 дней. Результаты патолого-анатомических и бактериологических исследований свидетельствовали, что эти телята не заразились туберкулезом. При иммунизации БЦЖ в сочетании с однократным введением полирибоната в дозе 1 мг/кг живой массы характерные для туберкулеза поражения при убое были найдены у одного животного (25%).
Среди телят, вакцинированных БЦЖ без иммуномодулятора, туберкулез при убое установлен у двух (50%) и у одного теленка – по результатам бактериологического исследования биоматериала. У всех контрольных животных (только заражение) при убое зарегистрирован туберкулез, причем у двух отмечена генерализация туберкулезного процесса.
Иммунизация телят БЦЖ вызывала повышение интенсивности фагоцитарной активности нейтрофилов, выявленное в опсонофагоцитарной реакции, наиболее высокий показатель наблюдали у иммунизированных телят в сочетании с дробным введением полирибоната, что свидетельствует о повышении неспецифической резистентности организма.
Полученные данные послужили основанием для проведения производственного испытания вакцины БЦЖ с полирибонатом в одном из неблагополучных по туберкулезу районов Новосибирской области. Результаты производственного испытания показали, что до применения вакцины БЦЖ с иммуномодулятором полирибонат при проверке уровня напряженности иммунитета через 45–60 дней не реагировало на туберкулин в целом 15,2% телят (табл. 3). Сочетанное применение вакцины БЦЖ и полирибоната позволило снизить этот показатель до 0,3%. Результаты производственного испытания подтвердили полученные нами экспериментальные данные о повышении протективных свойств вакцины БЦЖ при сочетанном использовании с полирибонатом.
Т а б л и ц а 3 – Сравнительная оценка напряженности иммунитета у телят,
вакцинированных БЦЖ и БЦЖ с полирибонатом
| Год | Вакцинировано БЦЖ, гол. | Исследовано туберкулином через 45 дней | Не реагировало на туберкулин | |
| гол. | % | |||
| Вакцинация БЦЖ без полирибоната | ||||
| 1992 1993 | 11325 10021 | 10215 9311 | 1854 1381 | 15,5 14,8 |
| Всего | 21346 | 19526 | 2965 | 15,2 |
| Вакцинация БЦЖ с полирибонатом | ||||
| 1994 1995 | 10254 10876 | 9587 10025 | 35 22 | 0,4 0,2 |
Ридостин
В опыте на 175 морских свинках установлено, что сочетанное применение вакцины БЦЖ и ридостина значительно снижает степень поражения внутренних органов при заражении вирулентной культурой M.bovis. При этом все животные остались живы (срок наблюдения 140 дн.)
В опыте на кроликах (25 гол.) индекс пораженности органов и показатели специфического лизиса лейкоцитов в крови были также ниже у зараженных животных на фоне предварительного применения БЦЖ и ридостина, а протеинограмма (общий белок, альбумины, α1 и α2- глобулины, β- глобулины и иммуноглобулины класса G1 и G2) существенно не отличалась от показателей контрольных животных, что свидетельствовало о сбалансированности анаболических и катаболических процессов.
Таким образом, совместное применение вакцины БЦЖ и иммуномодуляторов РНК полирибоната и ридостина повышает клеточный и гуморальный иммунитет, что приводит к увеличению иммуногенности вакцины и препятствует заражению возбудителем туберкулеза.
Экономическая оценка системы противотуберкулезных мероприятий
В методологическом отношении экономические исследования при различных болезнях животных предусматривают изучение следующих основных показателей: причиняемого экономического ущерба, затрат на оздоровительные мероприятия и их экономической эффективности. Разноречивость данных и различные методические подходы предопределили необходимость исследований в новых экономических условиях ведения животноводства и изменившейся структуры экономических потерь при туберкулезе.
Экономический ущерб
Исходя из клинического проявления туберкулеза и специфики оздоровительных мероприятий, обоснованы и разработаны формулы расчета отдельных видов потерь в их структуре. Расчеты по разработанной методике показали, что экономический ущерб, причиняемый туберкулезом крупного рогатого скота, составляет в среднем 14361,3 руб. на одно заболевшее животное (табл. 4).
Т а б л и ц а 4 – Структура и коэффициенты экономического ущерба
при туберкулезе крупного рогатого скота
| Вид экономического ущерба | На одно заболевшее животное | ||
| руб. | доля ущерба, % | потери продукции, кг | |
| Сокращение срока эксплуатации коров Убой некондиционного молодняка Утилизация туш Снижение качества мяса Потери приплода Снижение качества молока Потери молока при пастеризации Потери молока при туберкулинизации | 1571,5 779,0 378,4 319,2 794,0 9220,7 1024,6 273,9 | 10,9 5,4 2,7 2,2 5,6 64,2 7,1 1,9 | 3,42 (молоко) 0,31 (жив. масса) 0,15 (жив. масса) 0,13 (жив. масса) 0,55 (голов) 20,00 2,23 0,60 |
| ВСЕГО: | 14361,3 | 100,0 | |
Наибольшие потери (64,2%) обусловлены снижением качества молока при дополнительной вынужденной пастеризации в неблагополучных хозяйствах и сокращением срока продуктивного использования коров (10,9%). При этом от одного больного туберкулезом животного теряется в среднем 26,3 ц молока, 59 кг мяса в живой массе и 0,55 головы приплода. В племенных хозяйствах экономический ущерб повышается в среднем на 57%.
Используя показатели динамики эпизоотической ситуации (заболеваемость, движение неблагополучных пунктов, пораженность туш и др.), с учетом разработанных коэффициентов рассчитали объемы экономического ущерба, причиняемого туберкулезом крупного рогатого скота, в Российской Федерации за 1961–2003 гг., т.е. за 43 года. Для сопоставимости данных расчеты представлены в ценах на сельскохозяйственную продукцию 2005 г.
За указанный период в России выявлено и убито на мясоперерабатывающих предприятиях 5 млн 876,2 тыс. голов больного туберкулезом крупного рогатого скота. Наибольший экономический ущерб от туберкулеза в стране отмечен в 1963–1989 гг. с колебаниями от 1,5 до 3,5 млрд руб. в отдельные годы. С 1990 г. прослеживается устойчивое равномерное снижение объемов экономического ущерба, который достиг минимального значения в 2002 г. (99,2 млн руб.). Суммарный экономический ущерб, причиненный туберкулезом крупного рогатого скота экономике животноводства России за период анализа, превысил 84,9 млрд руб. При этом потеряно более 15,3 млн т молока, 1,6 млн т мяса и 3,5 млн голов приплода.
