Навчальний посібник Затверджено рішенням Центральної методичної ради здму протокол №9 від 21. 05. 2009 Запоріжжя 2009
| Вид материала | Документы |
Содержание2. Загальні питання токсикології шКТ ПО ВІДНОШЕННЮ ДО ВВЕДЕНОЇ КІЛЬКОСТІ Ефективні періоди напіввиведення деяких Біологічна дія іонізуючого випромінювання 3. Радіобіологічна та токсикологічна |
- Затверджено рішенням Центральної методичної ради Запорізького державного медичного, 1450.14kb.
- План методичної роботи Лобойківської сзш на 2008-2009 навчальний рік Затверджено, 68.96kb.
- Затверджено Вченою радою Вінницького національного технічного університету як навчальний, 2268.74kb.
- Міське будівництво та господарство Київ 2010, 1366.79kb.
- Впровадження інтерактивних методів навчання на заняттях англійської мови (навчально, 3448.66kb.
- Зпрограми підготовки магістрів керівників проектів та програм, 163.51kb.
- Зпрограми підготовки магістрів державного управління, 912.55kb.
- М. Слов’янськ Затверджено рішенням педагогічної ради дошкільного навчального закладу, 642.58kb.
- Фортеця в Меджибожі, 314.72kb.
- Сучасні освітні технології Укладач, 753.67kb.
Радон при кімнатній температурі є одним з найважчих газів. Найбільш стабільний ізотоп (222Rn) входить до складу радіоактивних рядів 238U, 235U і 232Th.
У природі радону дуже мало, його можна віднести до найменш поширених на нашій планеті хімічних елементів.
Рівноважний вміст радону в земній корі складає 7×10-16 % за масою. Вміст його в земній корі завглибшки до 1,6 км близько 115 т. Утворюючись в радіоактивних рудах і мінералах, радон поступово надходить на поверхню землі, в гідросферу і в атмосферу. Середня концентрація радону в атмосфері близько 6×10-17% (за масою); у морській воді – до 1∙10-15 Kи∙л-1.
За нормальних умов радон - газ без кольору, запаху і смаку, один літр якого має масу 10 г; tkип – 61,8°C, tпл – 71°C. Щільність при 0°C біля 9,9 г/л.
На зовнішній електронній оболонці атому радону знаходиться 8 електронів, саме тому хімічно радон досить інертний. Внаслідок хімічної інертності радон відносно легко покидає кристалічну решітку «батьківського» мінералу і потрапляє в підземні води, природні гази і повітря.
Концентрація радону в повітрі залежить насамперед від геологічних особливостів ґрунтів (граніти, в яких багато урану, є активними джерелами радону, в той же час над поверхнею морів радону мало), а також від погоди (під час дощу мікротріщини, по яких радон поступає з ґрунту, заповнюються водою; сніговий покрив також перешкоджає доступу радону в повітря).
Радон є сильно токсичним, що пов'язано з його радіоактивними властивостями. При розпаді радону утворюються нелеткі радіоактивні продукти (ізотопи полонію (Po), вісмуту (Bi) і свинцю (Рb)), які важко виводяться з організму. Важливе токсикологічне значення має довгоіснуючий дочірній продукт розпаду радону - 210Po.
Власна радіоактивність радону викликає його флуоресценцію. Газоподібний і рідкий радон флуоресценує блакитним світлом; у твердого радону при охолоджуванні до азотних температур колір флуоресценції стає спочатку жовтим, потім червоно-оранжевим.
Шляхами надходження радону в організм є органи дихання і неушкоджена шкіра. Радон розчиняється в крові, воді та інших рідинах організму. Значно краще радон розчиняється в жирах. Виключно висока розчинність радону в жирах обумовлює ефективне поглинання його жировими тканинами тварин і людини під час надходження до організму. Унаслідок значного вмісту жиру в організмі людини «розчинність» радону в людському тілі вища, ніж у воді. При динамічній рівновазі вміст радону в 1см3 людського тіла складає 0,45 від вмісту радону в 1 см3 повітря.
Радон міститься в атмосферному повітрі, повітрі ґрунту і природних водах. Значні кількості радону містяться в уранових копальнях. В стані радіоактивної рівноваги 1г Ra відповідає 3,7•1010 Бк Rn. Це така кількість радону, в якій відбувається 3,7•1010 розп/с, займає об'єм 0,66 мм3, важить 6,5 мкг. В порівнянні з іншими радіоактивними газами – тороном і актиноном радон має значно більший період напіврозпаду. Розпадаючись, радон дає початок послідовному ряду твердих радіоактивних речовин, що випускають α-, β-частки і γ-кванти. Радіаційна небезпека при дії радону на організм пов'язана з його дочірніми продуктами, особливо групи його короткоживучих ізотопів від RаA до RaC1.
Співвідношення концентрацій вільного Rn і продуктів його розпаду RаA, RаB, RаC в повітрі шахт складає:1:0,5; 0,2:0,1 при вентиляції 3-5 об'єм•год-1. У житлових приміщеннях відповідно величини для RаA, RаB, RаC складають 0,7-0,9, 0,6-0,8 і 0,4-0,6. RаA і RаB мають більш інтенсивне β-випромінювання, а RаB, RaС і RaC1 інтенсивніше α-випромінювання в порівнянні з іншими продуктами розпаду. Значна частина продуктів розпаду радону затримується в легенях. При співвідношенні Rn і його продуктів розпаду 1:0,61; 0,29:0,21 і вільній фракції RаA, рівній 4%, доза опромінення бронхіального дерева продуктами розпаду, що осідають в ньому, складає 0,0036 Гр за 1 місяць роботи. У бронхах затримуються 50% вільних і 8% фіксованих на частках пилу атомів продуктів розпаду, в паренхімі 0 і 50% відповідно. В цілому поглинена доза за 1міс складає для RаA 0,002-0,0012; RаB 0,002-0,001; RаC 0,002-0,0016 Гр. Найбільш тяжким наслідком інгаляцій продуктів розпаду Rn є рак легенів.
2. ЗАГАЛЬНІ ПИТАННЯ ТОКСИКОЛОГІЇ
РАДІОЛОГІЧНИХ РЕЧОВИН
Визначення шляхів проникнення радіонуклідів в організм має важливе практичне значення. Для деяких радіоактивних речовин шлях введення істотно впливає на характер всмоктування, розподілення, виведення і біологічну дію. Радіоактивні речовини можуть надходити в організм через органи дихання, травний тракт, шкіру. Найбільш вірогідним джерелом можливого надходження радіоактивних речовин в організм людини є повітря, забруднене радіоактивними газами і аерозолями, а також продукти харчування.
З повітрям в організм людини можуть надходити гази, пари і зважені в повітрі рідкі та тверді частки.
Дисперсні системи, що є суспензією твердих і рідких часток в повітрі або в іншому газоподібному середовищі, називаються аерозолями. За розміром часток аерозолі умовно розділяють на пил, туман і дим.
За своїм походженням аерозолі підрозділяють на дисперсні, що утворюються при подрібненні радіоактивних речовин, і конденсаційні, які виникають унаслідок конденсації при випаровуванні речовин.
За фізико-хімічними властивостями аерозолі розділяють на заряджені (уні- і біполярні) і незаряджені. За однорідністю розмірів їх частини ділять на монодисперсні і полідисперсні.
По мірі проникнення в легеневі альвеоли розрізняють респірабельну фракцію, 5-10 мкм і нижче, і нереспірабельну більше 15-20 мкм.
«Доля» аерозолів, що відклалися в легенях, багато в чому залежить від фізико-хімічних властивостей речовини. Добре розчинні сполуки радіоактивних речовин швидко всмоктуються в дихальні шляхи і надходять в кров'яне русло. На відміну від розчинних аерозольних часток, нерозчинні в значній кількості осідають на стінках органів дихання, потім видаляються з легенів за допомогою слизу і вій миготливого епітелію бронхів.
Для оцінки кількісної затримки і відкладення пилових часток в легенях застосовують коефіцієнт відкладення, що є відношенням кількості часток, які відклалися в дихальних органах, до вмісту їх у повітрі, що вдихається.
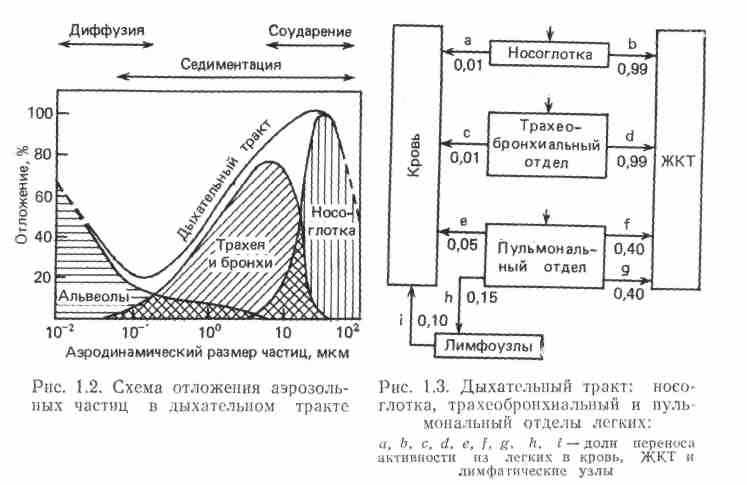
-
Мал. 1. Схема відкладення аерозольних часток в дихальному тракті.
Мал. 2. Дихальний тракт: носоглотка, трахеобронхіальний і пульмональний відділи легенів:
a, b, c, d, e, f, g, h, I – долі переносу активності з легенів в кров, ШКТ і лімфатичні вузли.
На мал. 1 показана залежність між розміром часток і їх відкладенням у верхньому і нижньому відділах органів дихання.
Мілкодисперсні аерозолі з діаметром часток 0,1-0,001 мкм в значних кількостях затримуються в альвеолах, більші (1-10 мкм) – в трахеї і легенях, а аерозолі з діаметром часток більше 10 мкм – в носоглотці.
При інгаляційному надходжені радіоактивні аерозолі всмоктуються не лише легенями, але і шлунково-кишковим трактом (ШКТ). Залежно від розміру аерозольних часток, їх розчинності величина всмоктування в легенях або ШКТ змінюється. Аерозольні частки діаметром 10 мкм і більше майже повністю затримуються в носоглотці і надходять не в легені, а в ШКТ. Так, близько 50% всіх радіоактивних аерозолей в найближчу годину надходить в шлунок і кишечник, тому при інгаляції важко розчинних радіоактивних речовин визначаючим є їх всмоктування з ШКТ.
Легенева динаміка «метаболізму» аерозолів показана на мал. 2. Видно, що значна кількість аерозолів може надходити з носоглотки і трахеобронхіального відділу легенів в ШКТ. Не дивлячись на те, що легені відіграють меншу роль в процесі всмоктування важко розчинних радіоактивних речовин, інгаляційний шлях надходження для розчинних радіонуклідів вважається одним з основних і найбільш небезпечних.
Надходження радіоактивних речовин в ШКТ може відбуватися з їжею і водою. Шлях надходження радіоактивних речовин в ШКТ і їх просування в основному такий як і звичайних хімічних речовин, що містяться в харчових продуктах.
Для кількісної оцінки всмоктування радіоактивної речовини з ШКТ в кров і лімфу в токсикології використовують величину, що зветься коефіцієнтом резорбції всмоктування. Це – доля радіонукліда, виявлена в організмі за певний час спостереження по відношенню до вихідної кількості.
За значенням коефіцієнта всмоктування всі радіонукліди підрозділяються на чотири групи: що володіють високою мірою резорбції в легенях і ШКТ (75-100%); із значною резорбцією в легенях (25-50%) і в ШКТ (10-30%); з помірною резорбцією в кишечнику (1-10%) і значним всмоктуванням в легенях (25-30%); що практично не всмоктуються в кишечнику (0,1-0,00001%) і добре резорбуються з легенів (20-25%) (табл. 1).
Таблиця 1
РЕЗОРБЦІЯ РАДІОАКТиВНиХ РЕЧОВиН З ЛЕГЕНІВ І
шКТ ПО ВІДНОШЕННЮ ДО ВВЕДЕНОЇ КІЛЬКОСТІ
| Група | Радіонуклід | Коефіцієнт резорбції, % | |
| Легені | ШКТ | ||
| I | 3 H(HTO), 24 Na, 35 S, 40 K, 82 Br, 86 Rb, 131 I, 137 Cs, 222 Rn | 75-100 | 75-100 |
| II | 45 Ca, 60 Co, 89 Sr, 90 Sr, 127 Te, 226 Ra | 25-50 | 10-30 |
| III | 54 Mn, 59 Fe, 65 Zn, 76 As, 106 Ru, 111 Ag, 19 Au, 207 Bi ?10 Po, 238 U | 25-30 | 1-10 |
| IV | 7 Ве, 91 I, 140 La, 144 Ce, 147 Pm, 143 Pr, 231 Ра, 234 Th, 238 Np, 239 Pu, 241 Am, 142 Cm, 252 Cf | 20-25 | 0,1-0,00001 |
- Примітка:*- дані по резорбції значно варіюють залежно від
дисперсності часток і вигляду сполуки, у складі
якої радіонуклід потрапляє в організм.
Збудження нервової системи сприяє підвищенню всмоктування радіонуклідів в організмі, гальмування значно уповільнює цей процес. Частина радіоактивних речовин після всмоктування в кров і лімфу розноситься по організму, а кількість радіонуклідів, що залишилася, через деякий час видаляється з кишечника. За час проходження по ШКТ радіоактивні речовини опромінюють стінку кишечника на всьому її протязі. Таким чином, під час надходження радіоактивних речовин через рот окремі ділянки ШКТ можуть отримувати значну дозу опромінення, і в деяких випадках ШКТ стає критичним органом.
На всмоктування радіонуклідів через шкіру істотно впливає зовнішня температура. При підвищенні температури відбувається розширення кровоносних судин шкіри, розкриття сальних і потових залоз, що сприяє всмоктуванню радіонуклідів. Під час надходження радіоактивних речовин, що знаходяться в повітрі, при всмоктуванні через шкіру важливе значення має тиск пари і відкладення речовини на поверхні шкіри. Проникнення радіоактивних речовин через шкіру залежить від фізико-хімічних властивостей речовини, pH середовища, розчинності у воді, жирах і фізіологічного стану шкіри.
Для кількісної оцінки величини надходження радіонуклідів через шкіру використовують термін «коефіцієнт всмоктування». Це кількість активності, що виявлена в організмі за певний час спостереження, по відношенню до вихідної кількості, нанесеної на шкіру. Значення коефіцієнтів всмоктування різних радіонуклідів під час надходження їх через неушкоджену шкіру приведені в табл. 2. Видно, що надходження радіонуклідів в організм залежить від хімічного складу сполуки, що наноситься на шкіру.
Ці дані показують, що проникність шкіри людини і різних видів тварин для одного і того ж нукліда не однакова. При порівнянні даних (див. табл. 1, 2) за величиною надходження радіоактивних речовин через органи дихання і ШКТ видно, що через шкіру вони проникають в значно менших кількостях.
Під час надходження радіоактивних речовин через шкіру відбувається опромінення як самої шкіри, так і внутрішніх органів. Найбільш чутливим до дії радіонуклідів є базальний шар шкіри, де знаходяться росткові клітини епідермісу.
Окрім розглянутих шляхів надходження радіоактивні речовини можуть проникати в організм через кон'юнктиву очей. Резорбція радіонуклідів при різних шляхах надходження неоднакова. Найшвидше радіоактивні речовини резорбуються при внутрішньочеревному, внутрішньом’язовому введенні, значно повільніше – при підшкірному.
Таблиця 2
Надходження деяких радіонуклідів через непошкоджену шкіру
| Радіонуклід | Коефіцієнт всмоктуванн % | Тривалість дії, год. | Об'єкт дослід-ження |
| Тритій (НТО) Na2H32PO4 45 CaCl2 65 ZnCl2 89 SrCl2 90 SrCl2 Na299MoO4 106 RuCl3 110 AgNO3 Na131I Na131I 132 TeCl4 137 CsCl 140 BaCl2 144 Ce(NO3)3 144 CeCl2 204 TlNO3 210 Po(NO3)2 239 Pu(NO3)4 239 Pu(NO3)4 239 Pu(NO3)4 239Pu(C6H5O8)4 241 Am(NO3)4 | 0,7 (зима) 2,6 (весна) 3,2 (літо) 2,0 (осінь) 0,75 0,6 1,2 0,89 0,68 2,8 0,5 0,06 0,72 0,42 0,14 0,62 0,39 0,68 0,32 0,3 3,8 0,1-0,3 0,017 0,15 0,14 0,0062 | 4 4 4 4 1 1 24 24 6 24 6 1 6 24 24 6 6 4 6 24 3 120 6 336 6 6 | Щур –⁄⁄– –⁄⁄– –⁄⁄– Миша –⁄⁄– –⁄⁄– Щур –⁄⁄– –⁄⁄– –⁄⁄– Миша Щур Порося Щур Порося Щур Миша Щур –⁄⁄– Порося Щур Порося Кролик Порося –⁄⁄– |
Експериментальними дослідженнями встановлено, що радіоактивні речовини можуть надходити через плаценту в організм плоду, що розвивається. У значних кількостях проникають через плаценту тритій, 131 I, 59 Fe, 137 Cs, 32 P та ін. Радіонукліди можуть надходити з молоком годуючих самок до потомства. З молоком добре виділяються: тритій, 131 I, 90 Sr та ін.
Надійшовши в організм, радіоактивні речовини всмоктуються в кров і лімфу і розносяться по різних органах і тканинах. Знання закономірностей розподілу, особливостей обміну і депонування радіонуклідів, їх перерозподіл в організмі має виключно важливе значення, оскільки дає уявлення про переважне променеве ураження тих або інших органів, дозволяє зрозуміти механізм дії радіонукліда, встановити критичний орган, оцінити величину опромінення критичного органу і дати висновок про прогноз променевого ураження.
У вітчизняній і іноземній літературі є багато робіт з вивчення особливостей обміну і закономірностей розподілу радіонуклідів в організмі. Проте вивчення питань розподілу не можна вважати завершеним, оскільки метаболізм радіонуклідів в організмі є динамічним процесом, обумовленим фізико-хімічними і фізіологічними чинниками.
При оцінці величини депонування слід розрізняти «концентрацію» і «вміст» радіонукліда в органах і тканинах. Концентрація характеризує питому активність масової долі органу. Одиницею вимірювання є одне ядерне перетворення в секунду, або беккерель (Бк). Крім того концентрація може бути виражена у відсотках введеної кількості. Вміст – це абсолютна активність в цілому органі. Такий процес щоденного накопичення радіонукліда в організмі характеризує кратність накопичення, тобто величину, що показує, в скільки разів вміст радіонукліда в організмі перевищує введену дозу. Так, якщо до кінця спостереження в організмі міститься 150% добового надходження, то кратність накопичення дорівнюватиме 1,5.
Орган з переважним накопиченням радіонукліда, що наражається на найбільшу небезпеку унаслідок значного опромінення, називається критичним органом.
Всі радіонукліди за характером свого розподілу умовно поділяються на чотири групи:
- остеотропні – 32 P, 45 Ca, 90 Sr, 90 Y, 95 Zr, 140 Ba, 226 Ra, 238 U, 239 Pu (цитрат);
- що переважно накопичуються в органах з ретикулоендотеліальною тканиною – 140 La, 144 Ce, 147 Pm, 227Th, 239 Pu (нітрат);
- що специфічно беруть участь в обміні речовин і вибірково накопичуються в окремих органах і тканинах: 131 I в щитовидній залозі, 59 Fe в еритроцитах, 65 Zn в підшлунковій залозі; 99 Мо у райдужній оболонці ока;
- що рівномірно розподіляються по всіх органах і тканинах: 3 H, 40 K, 86 Rb, 95 Nb, 106 Ru, 137 Cs.
Розподіл радіонуклідів в організмі обумовлений їх хімічними властивостями, здатністю утворювати колоїди і легко гидролізуватися. Крупні колоїдні частки затримуються в печінці, мілкодисперсні накопичуються в кістковій тканині. Величина і швидкість депонування деяких радіонуклідів залежать від віку, статі, дози сполуки, що вводиться, і складу харчового раціону. У молодому, зростаючому організмі внаслідок великої інтенсивності обміну речовин радіонукліди відкладаються в більшій кількості, ніж в дорослому.
При хронічному надходженні радіонукліда в організм спостерігається поступове накопичення ізотопів в органах і тканинах. Розподіл радіонуклідів усередині одного і того ж органу може бути нерівномірним.
Встановлено, що 90 Sr і 226 Ra при однократному введенні в організм концентруються в певних ділянках скелету, а саме: в зоні росту трубчастих кісток – метафізах і епіфізах. При інгаляції 239 Pu нерівномірно розподіляється в тканині легенів. Навколо бронхів спостерігаються осередкові скупчення 239 Pu, такі ж скупчення виявлені в лімфатичних вузлах середостіння, в стінці альвеол і альвеолярних макрофагах. При введенні 131 I також спостерігається нерівномірний розподіл його в мікроструктурних елементах щитовидної залози.
Мікророзподіл радіонуклідів має важливе значення в тканинній дозиметрії при оцінці потужності тканинної дози, а також до певної міри може допомогти в з'ясуванні патогенезу променевого ураження окремих органів і систем. Органи з підвищеним вмістом радіонуклідів отримуватимуть велику дозу опромінення, що може позначитися на важкості променевого ураження. Накопичення радіонукліда в зоні росту кісткової тканини призводить до утворення «гарячих плям», де кількість їх може перевищувати в 5-20 разів вміст нукліда в найближчих тканинах.
Рекомендації МКРЗ пропонують враховувати чинник нерівномірного розподілу при розрахунку дози опромінення, збільшуючи значення ефективної енергії в п'ять разів для остеотропних ά і β-опромінювачів, за винятком 226 Ra. Це пов'язано з тим, що більшість остеотропних радіонуклідів розподіляються в кістках дуже нерівномірно, більше, ніж 226 Ra, і здатні викликати значні біологічні пошкодження. В табл. 3 приведені дані розподілу деяких радіонуклідів в організмі людини.
Таблиця 3
РОЗПОДІЛ ДЕЯКИХ РАДІОНУКЛІДІВ в
ОРГАНІЗМІ ЛЮДИНи
| Радіо-нуклід | Орган або тканина | Частка нукліда, що міститься в критичному органі | |
| 90 Sr | Кістки Інші тканини | | 0,99 0,01 |
| 131 I | Щитовидна залоза Кістки Нирки Печінка | | 0,2 0,13 0,02 0,06 |
| 137 Cs | М'язи Кістки Нирки Печінка Селезінка | | 0,79 0,08 0,006 0,09 0,007 |
| 210 Po | Кістки Нирки Печінка Селезінка | | 0,08 0,13 0,22 0,07 |
| 226 Ra | Кістки Нирки | | 0,99 0,00002 |
| 238 U | Кістки Нирки | | 0,85 0,065 |
| 239 Pu | Кістки Нирки Печінка | | 0,9 0,01 0,07 |
Процеси виведення радіонуклідів з організму протікають з різними швидкостями і залежать від багатьох чинників, а також від функціонального стану видільних систем. Найбільша кількість радіоактивних речовин виділяється через ШКТ, особливо радіонукліди, які погано всмоктуються в травному тракті: трансуранові елементи, лантаноїди. Розчинні сполуки радіонуклідів, а також тритій, 137Cs добре виділяються через нирки. Величина і швидкість виведення радіоактивних речовин з організму залежить від їх фізико-хімічних властивостей. Швидко виводяться з організму газоподібні 3H, 222Rn, 133Xe, 85Kr. Основна кількість радіоактивних газів виділяється через легені і шкіру. Тривало затримуються в органах і тканинах ізотопи елементів з великою атомною масою, а також радіонукліди, що знаходяться в організмі в колоїдному стані (210Po, 226Ra і 238U). Відносно швидко виводяться з організму 24Na, 137Cs, 131I та ін. Радіонукліди, створюючи колоїдні комплекси з білками, надходять в печінку і виділяються з жовчю в кишечник.
Одним з основних органів виділення радіоактивних речовин з організму є нирки. Більшість розчинних радіонуклідів виділяються через нирки протягом першої доби. Радіоактивні аерозолі, а також продукти розпаду Ra, Th, Rn можуть виділятися з організму через органи дихання.
Процеси екскреції радіоактивних речовин з легенів, кишечника, нирок нерозривно пов'язані з явищами реабсорбції. Величина реабсорбції радіонуклідів при виділенні з організму може бути різною, тому ці дані необхідно враховувати при оцінці величини депонування радіонуклідів. Зменшення вмісту радіоактивної речовини в організмі може відбуватися не лише унаслідок його виведення, але і завдяки радіоактивному розпаду, що особливо характерно для короткоживучих радіонуклідів: 131I, 24Na, 32P та ін. Біологічне виведення і радіоактивний розпад – це два незалежних процеси. Час, протягом якого з організму виділяється половина радіонукліда, що однократно надійшла, називають біологічним періодом напіввиведення (Тб). Фактичний же склад радіоактивного ізотопу в організмі вимірюється ефективним періодом напіввиведення (Теф). Це час, протягом якого організм звільняється від половини речовини, що депонує в ньому, як шляхом біологічного виведення, так і унаслідок радіоактивного розпаду. Для довгоживучих радіонуклідів ефективний період напіввиведення в основному визначається біологічним виведенням.
Виведення радіоактивних речовин з організму є складним процесом, оскільки кожен орган має своє значення Теф (табл. 4).
Таблиця 4
ЕФЕКТИВНІ ПЕРІОДИ НАПІВВИВЕДЕННЯ ДЕЯКИХ
РАДІОНУКЛІДІВ З ОРГАНІЗМУ (доба)
| Орган | Тритій | 90Sr | 137Cs | 210Po | 226Ra | 235U | 239Pu |
| Все тіло | 10 | 5700 | 40 | 25 | 900 | 100 | 6,4∙104 |
| М'язи | - | - | 138 | - | - | - | - |
| Кістки | - | 6400 | 138 | - | 1600 | 300 | 7,2∙104 |
| Легені | - | - | 138 | 30 | - | 365 | - |
| Нирки | - | - | - | 46 | 10 | 15 | - |
| Печінка | - | - | - | - | - | 15 | 3,0∙104 |
| Селезінка | - | - | - | 42 | - | - | |
При аналізі процесу виведення радіоактивних речовин з організму розрізняють фракції ізотопу, що виводяться швидко і повільно. Так, наприклад, при відкладенні 90Sr в кістковій тканині розрізняють дві фракції – змінну і фіксовану в кістках. Перша відкладається на поверхні кісткових структур і швидко виводиться. Друга, фіксована фракція, депонується в компактній речовині і повільно виводиться з кісток. При тривалому потраплянні в організм не фіксована фракція 90Sr в скелеті постійно наростає, а швидкість виведення уповільнюється.
Виведення з організму органічно пов'язаних сполук з клітинами і тканинами відбувається значно повільніше, ніж швидко обмінних, не пов'язаних із структурними елементами. Так, час виведення оксиду тритію з водної фази органів щурів складає 3 доби, а виведення органічно зв'язаного тритію відбувається за 64-100 діб.
Радіонукліди мають різну біологічну ефективність. За своєю біологічною дією радіоактивні речовини розрізняються між собою залежно від виду, енергії випромінювання, періоду напіврозпаду, величини всмоктування, накопичення і швидкості виведення з організму. Найбільший біологічний ефект при попаданні всередину організму визначається від дії ά-випромінювачів у зв'язку з високою їх щільністю іонізації в тканинах. Деякі дослідники вважають, що біологічна ефективність ά-активних речовин в 10 разів більша, ніж ефективність β- випромінювачів. Трохи меншу небезпеку для організму представляють β- і γ- випромінювачі.
Біологічну дію іонізуючого випромінювання в організмі умовно розділяють на три рівні: фізико-хімічний, клітинний і органний або системний рівень. В табл. 5 показано розвиток змін в організмі, що виникають при дії іонізуючого випромінювання.
Фізико-хімічний рівень включає всі первинні процеси, що протікають в клітині. Іонізуюче випромінювання (рентгенівське, β- і γ-випромінювання, важкі ядерні частки) має високу біологічну активність. При взаємодії іонізуючого випромінювання з клітинами і тканинами в процесі перетворення цього випромінювання на хімічну енергію в організмі зароджуються активні центри радіаційно-хімічних реакцій.
Клітинний рівень дії включає всі порушення і процеси, обумовлені змінами функціональних властивостей опромінених клітинних структур. Всі процеси, що протікають на цьому рівні, підкоряються біологічним законам життя клітини як цілісної, складно функціонуючої біологічної системи.
Органний або системний, рівень включає всі процеси і зміни, пов'язані з порушенням функцій організму. Біологічна дія іонізуючого випромінювання виявляється у всіх органах і клітинах живого організму. Спостерігаються зміни в кровотворній, периферійній і центральній нервових системах.
Таблиця 5
БІОЛОГІЧНА ДІЯ ІОНІЗУЮЧОГО ВИПРОМІНЮВАННЯ
| № з/п | Час | Ефект дії |
| 1 | 10-24-10-4 с 10-16-10-8 с | Поглинання енергії. Початкові взаємодії. Рентгенівське і γ-випромінювання, нейтрони. Електрони, протони ά-частки |
| 2 | 10-12-10-8 с | Фізико-хімічна стадія. Перенесення енергії у вигляді іонізації на первинній траєкторії. Іонізовані і електронно-збуджені молекули |
| 3 | 10-7-10-5 с декілька годин | Хімічні пошкодження. Пряма дія. Побічна дія. Вільні радикали, що утворюються з води. Збудження молекули до теплової рівноваги |
| 4 | Мікросекунди, секунди, хвилини, декілька годин | Біомолекулярні пошкодження. Зміни молекул білків, нуклеїнових кислот під впливом процесів обміну |
| 5 | Хвилини, години, тижні | Ранні біологічні і фізіологічні ефекти. Біохімічні пошкодження. Загибель клітин, загибель окремих тварин |
| 6 | Роки, століття | Віддалені біологічні ефекти. Стійке порушення функцій. Генетичні мутації, дія на потомство. Соматичні ефекти: рак, лейкоз, скорочення тривалості життя, загибель організму |
Радіоактивні речовини при надходженні в організм можуть викликати гостре, підгостре і хронічне променеве ураження. Гостре захворювання виникає від введення великої дози радіонуклідів. При цьому відмічаються виражені зміни в крові (лейкопенія, ретикулопенія), крововилив в різні органи, пригноблення імунної реактивності, зниження маси тіла. Загибель тварин настає протягом перших двох тижнів.
Підгостре ураження характеризується змінами лімфоїдного і еритроїдного ростків кровотворення. Поряд із зниженням кількості лейкоцитів знижується кількість еритроцитів, гемоглобіну і ретикулоцитів. Порушується проникність судин, подовжується час згортання крові, зменшується кількість тромбоцитів, виникають інфекційні ускладнення, зменшується маса тіла. Тварини гинуть через 1-3 місяці після введення радіонуклідів.
Хронічний перебіг процесу пов'язаний з дією малих доз інкорпорованих радіонуклідів. При цьому в ранні терміни клінічні явища можуть бути відсутніми. У крові відмічаються якісні зміни: анізоцитоз і пойкілоцитоз еритроцитів, токсична зернистість нейтрофілів, вакуолізація протоплазми, пікноз лімфоцитів. У тварин спостерігається зниження імунологічної реактивності, судинні розлади, пригноблення статевої функції, раннє старіння, скорочення тривалості життя, розвиваються пухлини різних органів і тканин.
Біологічна дія малих доз радіоактивних речовин, що не скорочують природної тривалості життя, компенсується захисними фізіологічними функціями організму. Проте при зміні умов зовнішнього середовища і функціонального стану організму можуть виснажитися компенсаторні механізми, і у віддалені терміни після ураження дія іонізуючого випромінювання може виявитися. При цьому специфіку захворювання багато в чому визначає характер розподілу радіонукліда. Так, при дії остеотропних радіонуклідів 90 Sr, 140 Ba, 226 Ra, 239 Pu виражені зміни спостерігаються в кістковій тканині, кровотворній системі унаслідок вибіркового відкладення їх в кістковому мозку і, як наслідок, його опромінення. У віддалені терміни можуть виникати лейкоз, пухлини кісткової тканини.
Біологічна дія радіоактивних речовин, що добре всмоктуються, не залежить від шляху їх введення в організм.
У токсикологічній практиці для оцінки токсичності різних радіонуклідів визначають летальні дози. При вивченні порівняльної токсичності різних радіонуклідів користуються абсолютно летальною, мінімально летальною дозою і дозою, що викликає загибель 50% тварин до певного терміну, наприклад ЛД 50/30 (табл. 6).
Таблиця 6
ДОЗИ РАДІОАКТИВНИХ РЕЧОВИН, що ВИКЛИКАЮТЬ ЗАГИБЕЛЬ 50% ЩУРІВ Протягом 30 ДІБ
| Радіонуклід | ЛД 50/30, кБк/год. | Радіонуклід | ЛД 50/30, кБк/год. |
| 3H | 37 000 | 144 Ce | 125,8 |
| 35 S | 114,7 | 147 Pm | 259,0 |
| 89 Sr | 166,6 | 152 Eu | 27,7 |
| 90 Sr | 55,5 | 198 Au | 1,3 |
| 90 Y | 259,0 | 210 Po | 1,11 |
| 91 Y | 136,9 | 226 Ra | 55,5 |
| 95 Zn | 273,8 | 233 U | 1,48 |
| 95 Nb | 310,8 | 237 Np | 0,011 |
| 106 Ru | 136,9 | 239 Pu | 2,185 |
| 131 I | 148,0 | 241 Am | 4,07 |
| 137 Cs | 79,5 | 244 Cm | 4,07 |
| 140 Ba | 74,0 | 252 Cf | 0,44 |
| 140 La | 526,5 | | |
Токсичність радіонуклідів оцінюють не за активністю в беккерелях, а за поглиненою в організмі тканинною дозою. При цьому необхідно мати на увазі різну радіочутливість органів і тканин на опромінення і різну швидкість відновних процесів.
Біологічний ефект від інкорпорованих радіонуклідів визначається за час перебування їх в організмі.
Поглинена доза D – це середня енергія dE, передана випромінюванням речовині в деякому елементарному об'ємі, поділена на масу dm в цьому об'ємі; D = dE/dm. Грей (Гр) – одиниця поглиненої дози в системі СІ: 1 Гр дорівнює одному джоулю, поглиненому в кілограмі речовини; 1 Гр = 1 Дж/кг = 100 рад.
При оцінці біологічної дії радіонуклідів важливе значення має і потужність поглиненої дози. Потужність поглиненої дози P - приріст поглиненої дози dD за певний проміжок часу dt, що ділиться на цей проміжок: P = Dt/dt. Ефективність опромінення залежить від поглиненої дози, а потужність поглиненої дози впливає на формування віддалених ефектів, швидкість відновних процесів. Біологічна дія радіоактивних речовин залежить не лише від поглиненої дози, але і від її розподілу в часі. Інтенсивність опромінення визначається ритмом надходження радіонуклідів в організм, залежить від чутливості різних органів і систем і швидкості репарації променевих уражень. Вражаючий ефект радіонукліда при дробовому введенні виявляється у меншій мірі, ніж при однократному введенні тієї ж активності. При дробовому введенні 239 Pu в кількості 0,185-2,96 кБк/г збільшується тривалість життя тварин в порівнянні з однократним введенням. Дробове введення сприяє збільшенню тривалості життя щурів, зменшує появу остеосарком. При цьому спостерігається менш виражене пригноблення лейко- і тромбопоеза в порівнянні з однократним введенням. Розвиток у тварин лейкозів і анемій не залежить від умов надходження радіонуклідів.
3. РАДІОБІОЛОГІЧНА ТА ТОКСИКОЛОГІЧНА
ДІЯ РАДОНУ
В ранніх дослідженнях на тваринах вивчались гострі форми ураження, що викликані вдиханням радону. Перше дослідження Е.С. Лондона з вивчення токсичного ефекту радону на жабах і мишах було проведене в 1904 р. Загибель жаб і мишей наставала в ранні терміни після інгаляції радону. Причиною загибелі було ураження дихального апарату еманацією Ra.
Вдихання радону, очищеного від продуктів розпаду, при концентрації 8,14•104 Бк/л викликає загибель мишей протягом різного періоду часу. Однократна дія радону при концентрації 27,75 •107 Бк/л викликає 50% загибель мишей протягом 30 діб. Однократна інгаляція радону концентрацією 12,32•107 Бк/л протягом 5 хв викликає 100% загибель мишей протягом 40 діб. У тварин розвивається токсична пневмонія, виражені зміни з боку крові (зниження гемоглобіну, лейкоцитоз, перед загибеллю тварин – лімфопенія). У загиблих тварин на розтині спостерігається гіперемія органів, геморагічні виразки в кишечнику. У кістковому мозку - обширні вогнища некрозів. У селезінці і лімфатичних вузлах реєструється зменшення кількості фолікулів аж до повного їх зникнення. Порівнюючи токсичність радону для мишей і кроликів, можна побачити, що миші чутливіші, ніж кролики. Так, з 14 кроликів, затравлених радоном при 3-годинній експозиції і концентрації (1,036-1,36)×107 Бк/л, половина тварин загинули протягом 23 діб, а всі інші прожили до 90 діб, тоді як всі миші загинули на 15-у добу. Згідно даних дослідників виведення радону з організму відбувається в перші 4-6 годин після інгаляції через легені і шкіру.
При триразовій одночасовій інгаляції радону концентрацією 29,6•104 Бк/л у щурів знижується маса тіла. Спостерігаються коливання в кількості еритроцитів і особливо ретикулоцитів. У білій крові відмічається збільшення кількості лейкоцитів до 21-26 тис. Лейкоцитоз в основному обумовлений збільшенням абсолютної кількості лімфоцитів. В результаті дії радону у тварин знижується опірність організму, що сприяє розвитку вторинних інфекцій. Інгаляційна затравка щурів радоном концентрацією 29,6•105 Бк/л і експозицією 4 години приводить до важких патологічних змін, у тварин розвивається набряк легенів, осередкова емфізема, ураження бронхів. У віддалені терміни відмічена різка метаплазія бронхіального епітелію, розвиток новоутворень.
У літературі є дослідження з вивчення впливу внутрішньовенного введення радону кроликам. М.І. Неменов показав, що однократне введення радону дозою (48,1-55,5)•108 Бк є абсолютно смертельним для кроликів.
У роботі А.А. Канаревської та інших наводяться дані про хронічну дію радону після однократного підшкірного введення собакам дозою (3,7-33,3)•107 Бк. У тварин спостерігали пригноблення еритро- і лейкопоезу з подальшим частковим відновленням кровотворної функції. Відмічено утворення компенсаторних вогнищ кровотворення в діафізах трубчастих кісток. Порушення кістково-мозкового кровотворення в грудині з'являються раніше, ніж в кістковому мозку хребців, ребер та інших кісток. У частини собак після підшкірного введення радону розвивається різко виражена анемія, відмічається порушення лейкопоезу і тромбопоезу.
Дочірні продукти 222Rn викликають у щурів рак легенів, гістологічно схожий на рак легенів у людини. Щурів-самців у віці 3 місяців піддавали інгаляції 222Rn з кумулятивною дозою 20 і 40 РРМ* протягом 1 години 2 рази в тиждень.
Концентрація 222Rn в інгаляційних камерах була 111 Бк/л. Контрольні щури піддавалися дії 222Rn, зазвичай присутньому в закритих приміщеннях, що дорівнював 2 РРМ, протягом всієї тривалості життя. Скорочення тривалості життя у щурів не спостерігали. Частота раку легенів складала для контрольної групи 0,83%, для дози 20 РРМ - 2,21% і для дози 40 РРМ - 3,82%. У дослідних щурів термін виникнення пухлин був коротший, ніж в контрольних. Коефіцієнт ризику склав приблизно 700•106 на РРМ.
Доза 20 РРМ розглядається авторами як подвоююча доза для індукції раку легенів.
Оцінюючи біологічну дію радіоактивних речовин і джерел іонізуючого випромінювання на організм людини, необхідно чітко розмежовувати соматичні і генетичні наслідки опромінення. Соматичні ефекти, викликані дією випромінювання, стосуються лише саму опромінену людину, тоді як генетичні ефекти (дія випромінювання на зародкові клітки) в більшості випадків не небезпечні для даного індивідуума, але можуть виявитися небезпечними для подальших поколінь.
Проте, якщо в більшій частині зародкових клітин в результаті опромінення виникнуть летальні мутації, порушиться репродуктивна здатність даного індивідуума; хоч фізичний стан його може і не відрізнятися від норми, стануться генетичні зміни. Генетичні зміни можуть поєднуватися з соматичними порушеннями.
_______________________________________________________________________________________________________________
- Примітка:
