Учебное пособие Санкт-Петербург Издательство спбгпу 2003
| Вид материала | Учебное пособие |
- Учебное пособие Издательство спбгпу санкт-Петербург, 1380.47kb.
- Методические указания Санкт-Петербург Издательство спбгпу 2007, 1378.97kb.
- Министерство образования Российской Федерации Санкт-Петербургский государственный политехнический, 2776.63kb.
- Учебное пособие Санкт-Петербург 2011 удк 621. 38. 049. 77(075) Поляков, 643.33kb.
- Учебное пособие Санкт-Петербург Издательство спбгэту «лэти» 2004, 1302.72kb.
- Учебное пособие Санкт-Петербург 2009 удк 802., 485.15kb.
- Учебное пособие Санкт-Петербург Издательство спбгэту «лэти» 2006, 1935.03kb.
- Учебное пособие Санкт-Петербург Издательство спбгэту «лэти» 2006, 648.91kb.
- Новые поступления в библиотеку балтийского русского института, 158.89kb.
- Методические указания Санкт-Петербург Издательство спбгпу 2003, 1310.56kb.
8.2. ОСНОВЫ ТЕОРИИ КОРРОЗИИ МЕТАЛЛОВ
Газовая коррозия
Газовая коррозия наблюдается при работе металлических конструкций, контактных и других аппаратов, арматуры обжиговых и нагревательных печей, деталей двигателей внутреннего сгорания, при термической обработке, горячей ковке и др. В природных условиях она встречается редко. Газовая коррозия протекает при контакте металлов с газами в отсутствии электропроводящих растворов.
Область существования высокотемпературной газовой коррозии определяется интервалом температур. Нижняя граница соответствует температуре конденсации пара на поверхности металла. Это состояние, называемое точкой росы, зависит от парциального давления паров воды. Для воздуха при атмосферном давлении оно оценивается температурой, равной 240–250 °С, а для отходящих газов теплоэлектростанций — 90–100 °С.
При температурах, превышающих точку росы, начинается область химической газовой коррозии.
Верхняя температурная граница определяется такими свойствами металла, как жаростойкость и жаропрочность.
Жаростойкость характеризует способность металла сопротивляться коррозионному воздействию газов при высокой температуре.
Жаропрочность определяет способность материала в условиях высокотемпературного воздействия сохранять хорошие механические свойства, длительную прочность и сопротивление ползучести.
Металл может быть жаростоек, но не жаропрочен, и наоборот — жаропрочен, но не жаростоек.
Жаропрочные стали на основе железа можно эксплуатировать при температурах до 700 °С, алюминиевые и медные сплавы — до 150 °С. Эффективное сочетание жаропрочности и жаростойкости достигается в сплавах системы никель–хром — до 1000 °С.
С повышением температуры скорость газовой коррозии почти всегда увеличивается (табл. 32).
Таблица 32
Скорость коррозии металлов в некоторых средах, г/м2.сут
| Металл | Атмосфера, °С | |||||||
| О2 | Н2О (пар) | СО2 | SO2 | |||||
| 700 | 900 | 700 | 900 | 700 | 900 | 700 | 900 | |
| Fe | 511 | 1243 | 622 | 575 | 587 | 1133 | 354 | 5000 |
| Cr | 4,7 | 22,0 | 0,5 | 12,0 | 2,7 | 13,0 | 1,6 | 32,0 |
| Ni | 9,6 | 28,0 | 0,3 | 14,0 | 3,9 | 36,0 | 923 | 837 |
| Co | 37,8 | 931,0 | 8,0 | 259 | 27,0 | 443 | 598 | 1633 |
| Cu | 120 | 439 | 33,0 | 153 | 65,0 | 123 | 1,3 | 2,0 |
| W | 412 | 3762 | 21,0 | 1792 | 139,0 | 139 | 470 | 290 |
Продукты коррозии образуются в результате одновременного протекания ряда последовательных и параллельных реакций. Рассмотрим процесс образования сплошной оксидной пленки при окислении металла кислородом из газовой фазы (рис. 109).
Процесс окисления металла протекает в несколько стадий:
- ионизация металла и переход его в форме ионов и электронов в слой оксида;
- перемещение ионов металла Меn+ и электронов в слое оксида;
- перенос кислорода из газового потока к поверхности оксида;
- адсорбция кислорода на поверхности;
- превращение адсорбированного кислорода в ион О2– в слое оксида;
- реакция образования оксида.
В некоторых случаях отдельные стадии процесса могут выпадать или трансформироваться. Но в общем, все стадии процесса взаимосвязаны и протекают последовательно. Суммарная скорость процесса определяется скоростью самой медленной реакции. Например, если медленно протекает стадия 3, то процесс лимитируется внешней диффузией, если 1, 2 или 6 — имеет место внутридиффузионный контроль процесса.
Рис. 109. Схема процесса образования оксидной пленки на металле
Отличительной особенностью коррозии металла в отдельных случаях является затухание процесса во времени. Это происходит в том случае, когда на поверхности металла образуется защитная пленка. Если пленка сплошная и имеет хорошую адгезию с поверхностью, то она изолирует металл от контакта с агрессивной средой и коррозия прекращается.
В атмосферных и промышленных условиях большинство металлов покрыто пленкой продуктов коррозии. Жаростойкость металлов во многом определяется свойствами пленок.
В зависимости от толщины различают пленки:
- тонкие (невидимые) — толщиной от мономолекулярного слоя до 40 нм;
- средние (видимые благодаря интерференционному окрашиванию как цвета побежалости) — толщиной 40–500 нм;
- толстые (видимые) — толщиной более 500 нм.
Толщина образуемых пленок во многом определяется условиями окисления.
Сплошность получаемой пленки характеризует способность тормозить дальнейший процесс коррозии.
Критерий сплошности впервые был сформулирован Пиллингом и Бедворсом. Условие сплошности выполняется в том случае, когда молекулярный объем химического поверхностного соединения (например, оксида) больше объема металла, израсходованного на образование молекулы оксида. Соотношение объема образованного оксида исходного металла может быть легко подсчитано.
Предположим, что окисляется 1 грамм-атом металла. Его объем можно определить по формуле
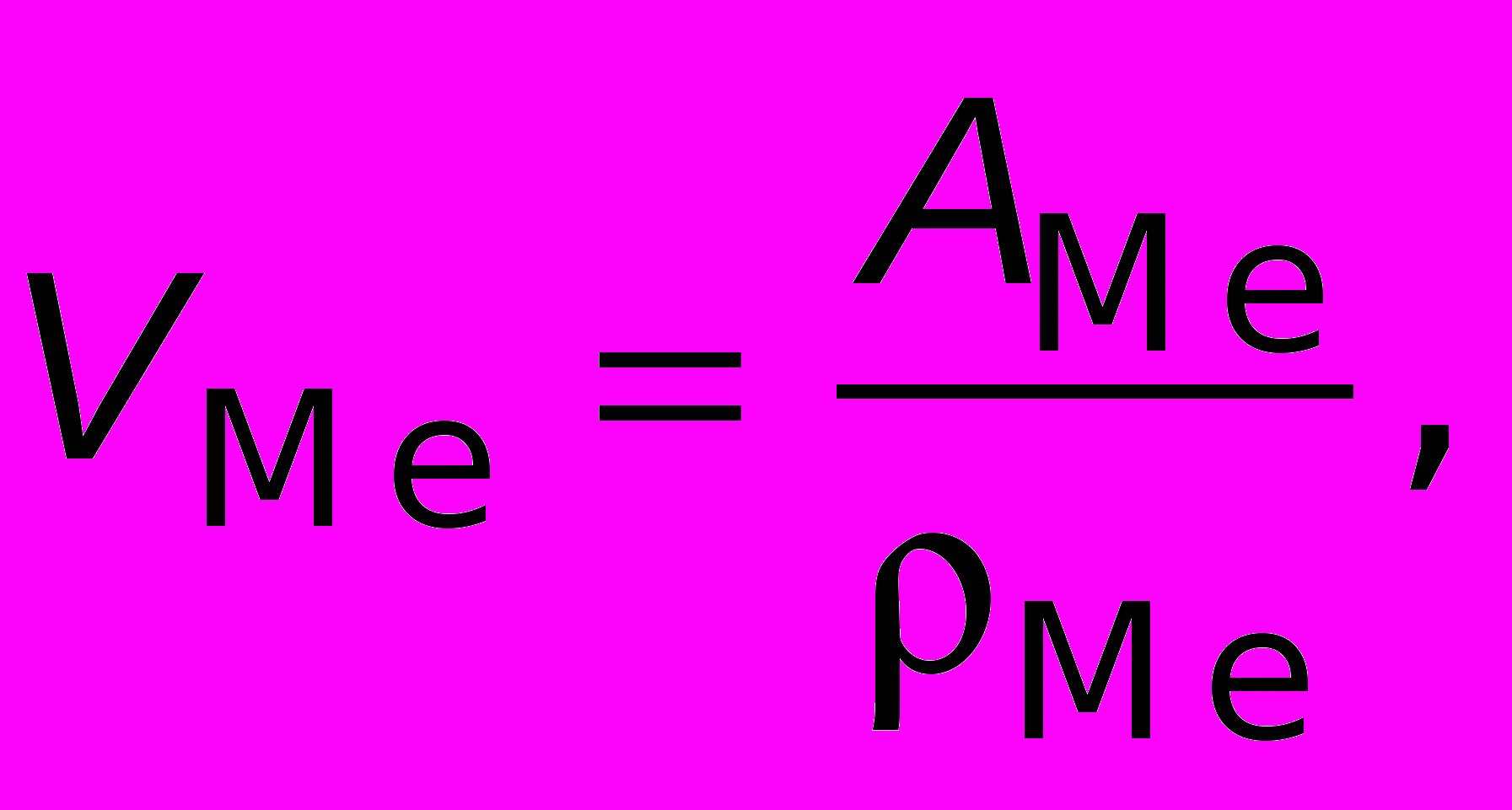
где
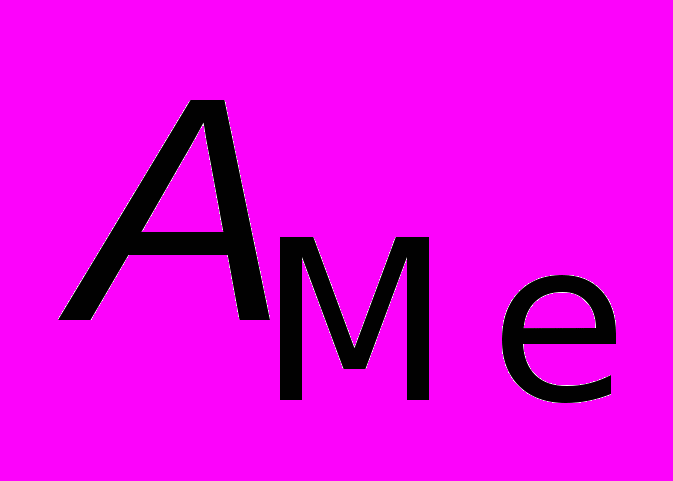 — атомная масса металла;
— атомная масса металла; 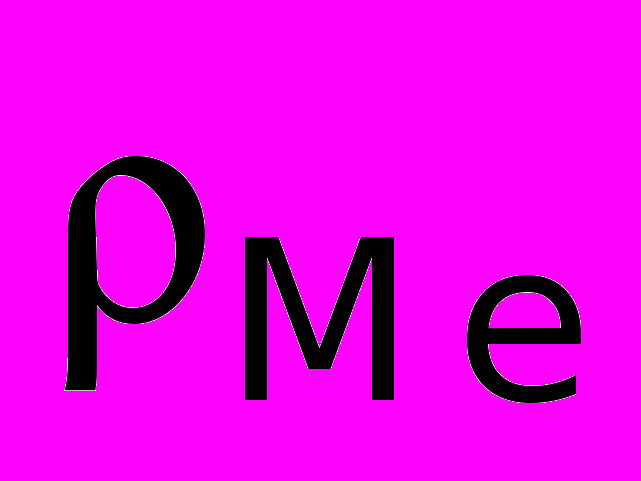 — плотность металла.
— плотность металла.Объем полученного оксида
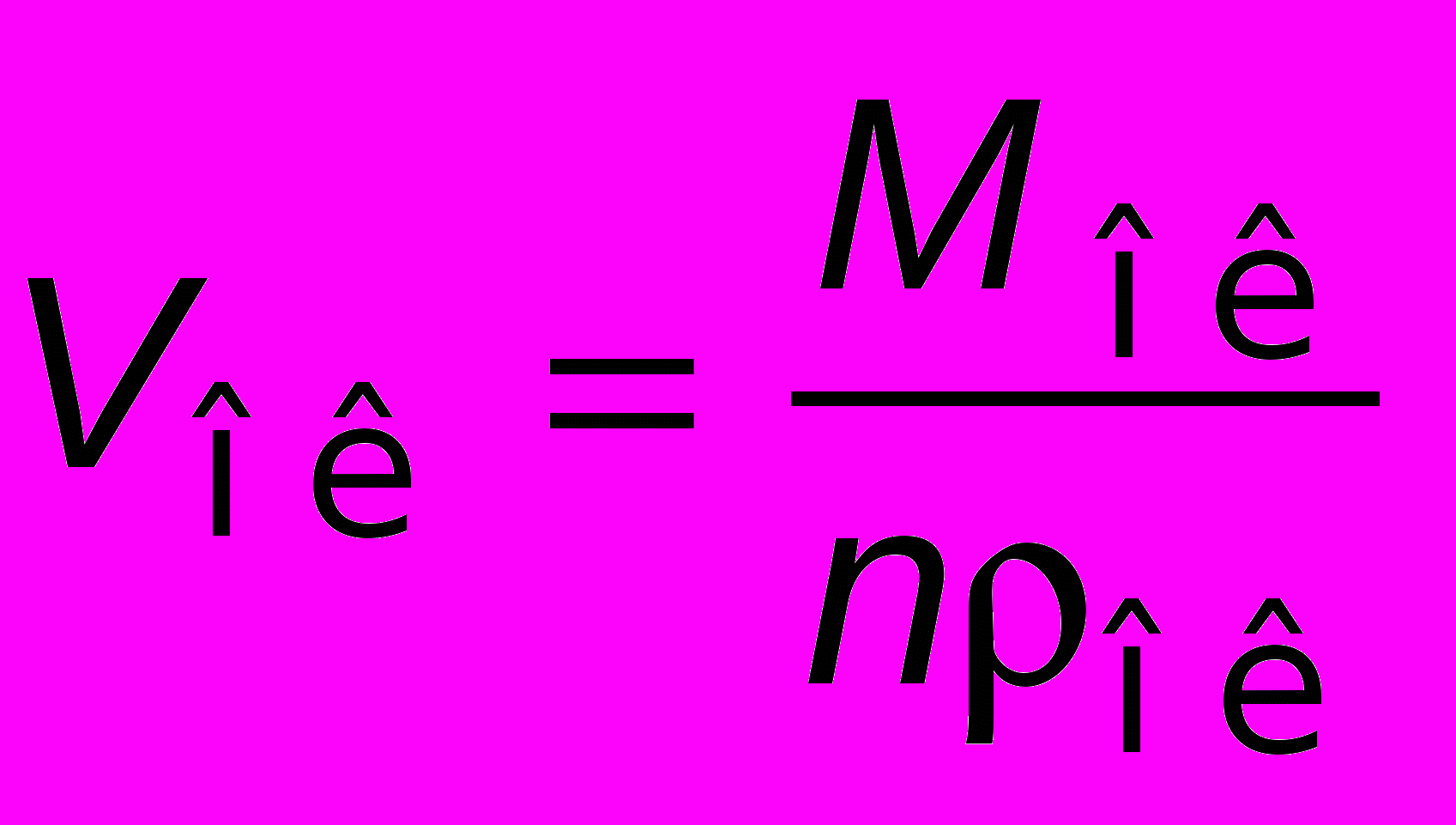
где
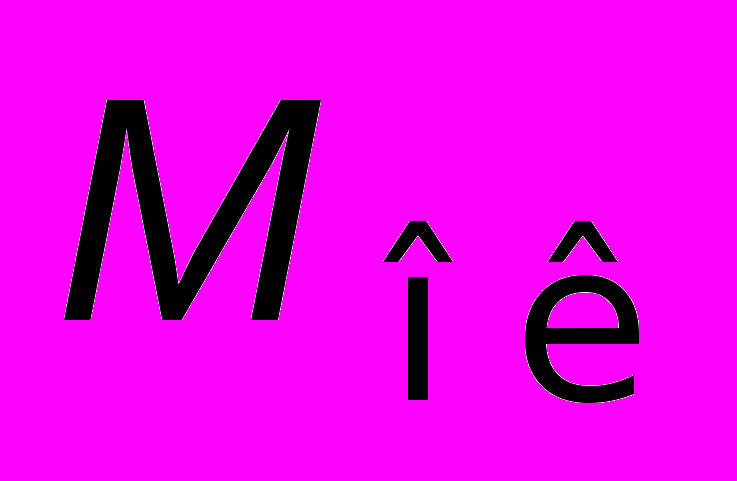 — молекулярная масса оксида; n — число атомов металла в молекуле оксида;
— молекулярная масса оксида; n — число атомов металла в молекуле оксида; 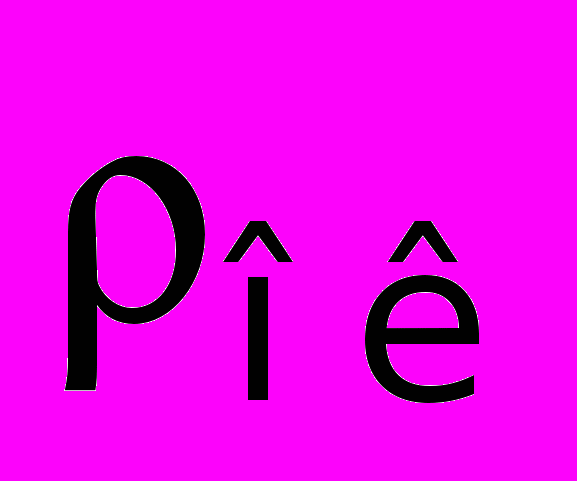 — плотность оксида.
— плотность оксида.Соотношение между объемом оксида и объемом металла:
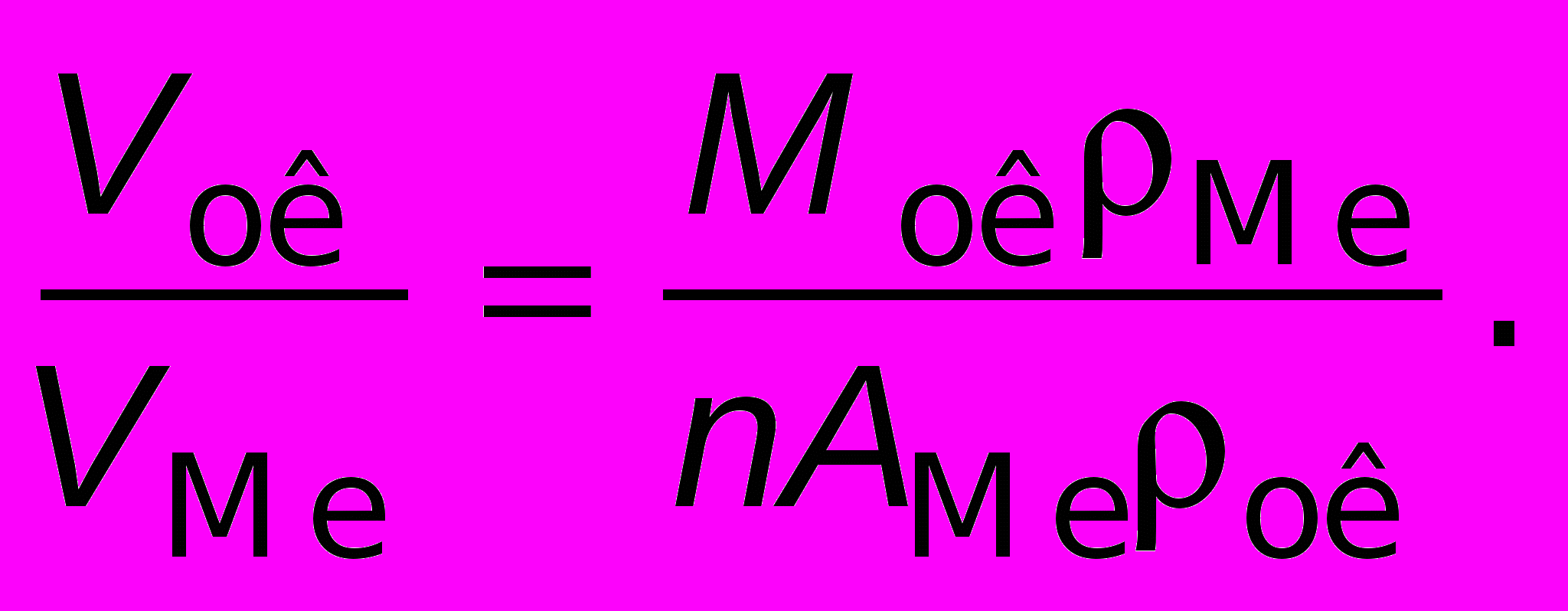
Очевидно, что при
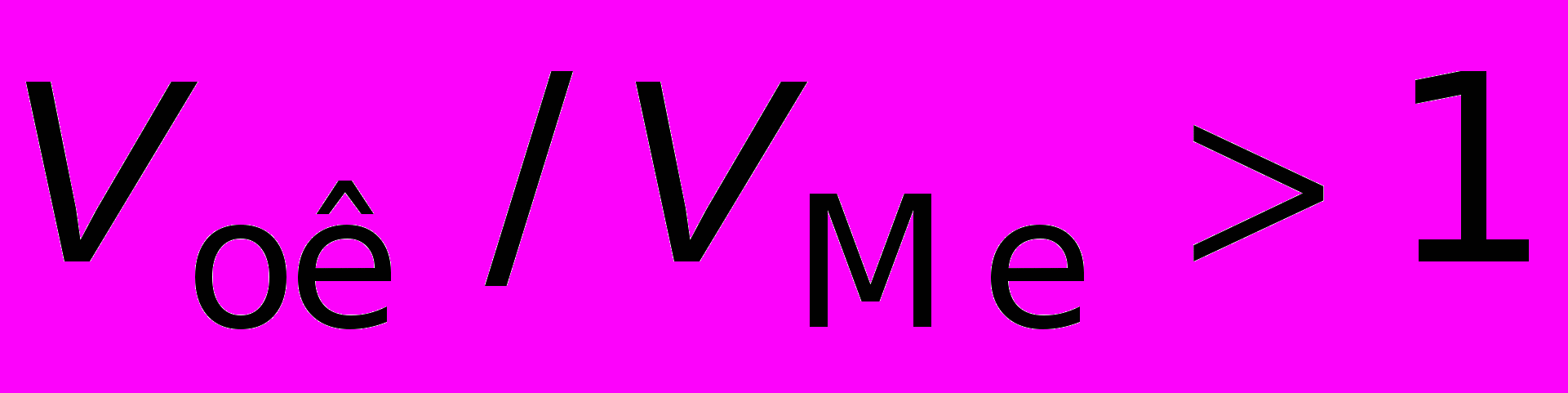 образуется сплошная пленка, при
образуется сплошная пленка, при 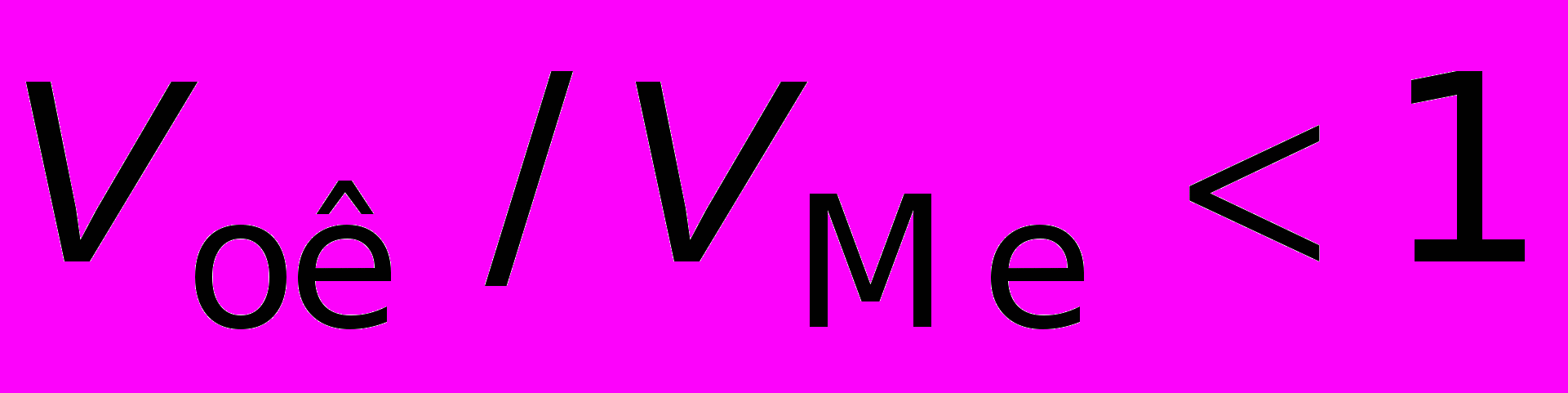 пленка не получается сплошной.
пленка не получается сплошной.Для ряда металлов установлена логарифмическая зависимость скорости окисления от времени, которая описывается уравнением
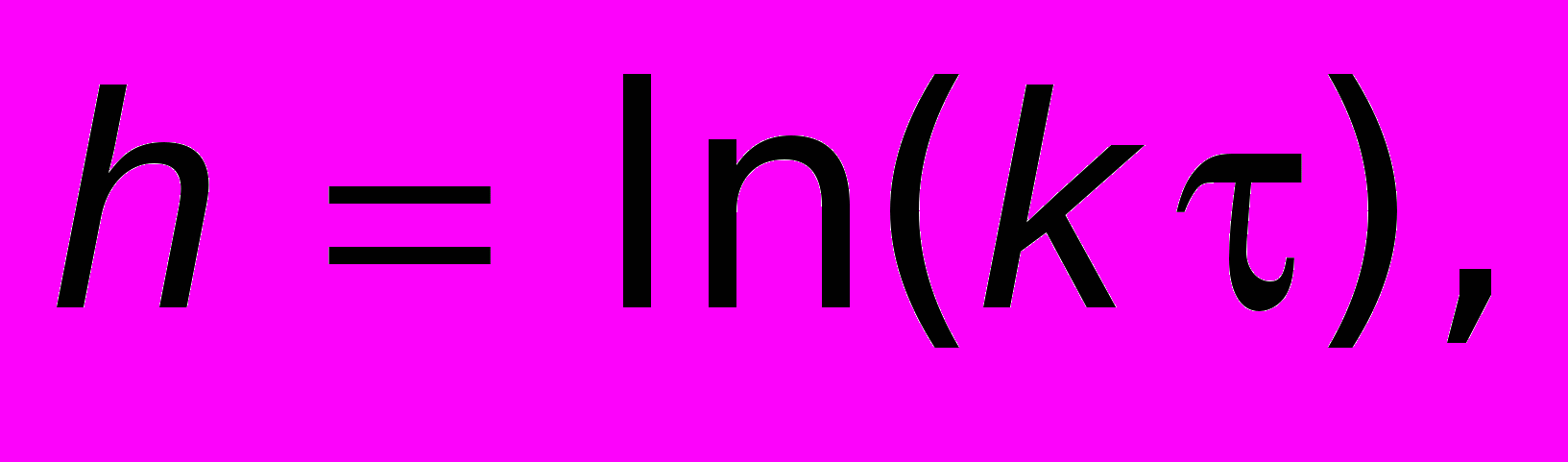
где k — константа.
Логарифмический закон роста пленки установлен экспериментально для окисления на воздухе алюминия и цинка в интервале температур 25–225 °С, никеля — до 650 °С, железа до 375, меди — до 100 °С.
Щелочные и щелочноземельные металлы, которые имеют отношения объема оксида к объему металла
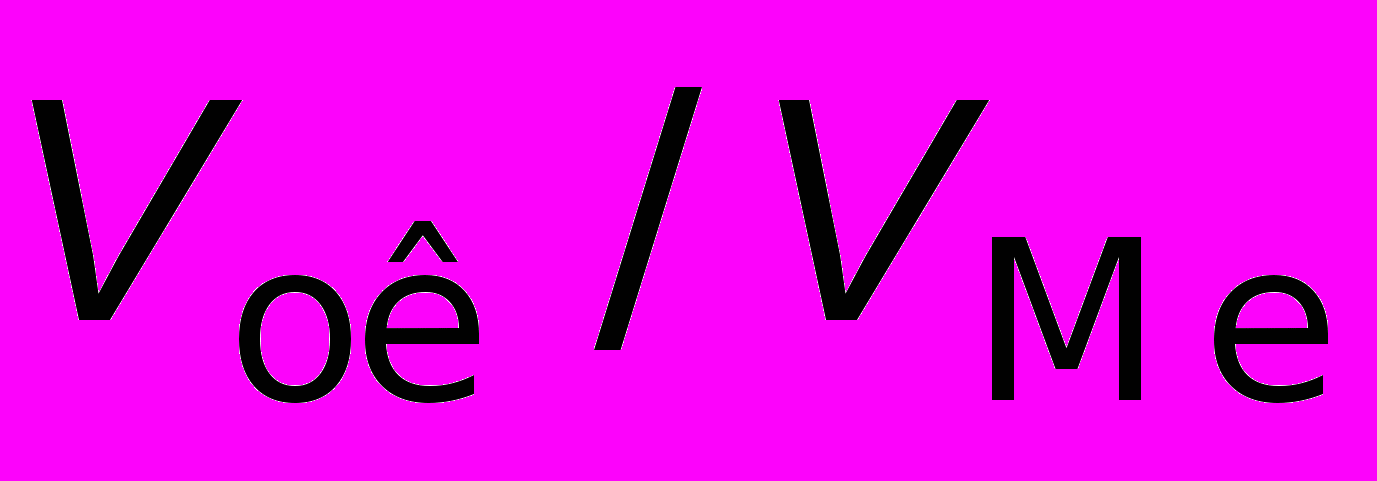 меньше единицы, окисляются по линейному закону. По уменьшению скорости окисления эти металлы располагают в ряд
меньше единицы, окисляются по линейному закону. По уменьшению скорости окисления эти металлы располагают в рядK > Na > Ba > Ca > Mg.
Линейный ход кинетической зависимости характерен и для металлов, оксиды которых летучи при высоких температурах. К этой группе относятся металлы Mo, Os, Ru, Ir, V, W.
Для ряда технически значимых металлов наблюдается параболическая зависимость скорости окисления во времени. Приближенно по возрастанию устойчивости к газовой коррозии в атмосфере воздуха можно расположить следующие металлы в ряд: W < Fe < Co < Cu < Ni. К этой группе относятся и Mn, Be, Zn, Ti.
В группу металлов, дающих пленки с наиболее высокими защитными свойствами и окисляющихся по логарифмическому закону, входят Si, Al, Cr. Они расположены по возрастанию устойчивости.
Константа скорости окисления тем больше при прочих равных условиях, чем больше изменение свободной энергии и чем выше удельная электропроводимость материала пленки. Если оксид обладает электроизолирующими свойствами, дальнейшего окисления не происходит. Этим объясняется, например, стойкость алюминия к процессам окисления.
На защитные свойства поверхностных пленок влияют природа и состав сплава, температура, давление и состав газа.
Электрохимическая коррозия
Для протекания электрохимической коррозии необходима электропроводящая среда — растворы кислот, щелочей или солей. Этот вид коррозии встречается в природе повсеместно.
При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и переход ионов металла в раствор. При этом протекают два процесса, а именно переход ионов:
- из металла в раствор с образованием сольватированных (в водных растворах — гидратированных) ионов (окислительный или анодный процесс):
Ме + mH2O + ne
- из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (восстановительный или катодный процесс).
Скорости прямого и обратного перехода в общем случае неодинаковы. Если растворение металла происходит быстрее, чем его осаждение, то металл по отношению к электролиту заряжается отрицательно. В результате скорость растворения металла уменьшается, а скорость его осаждения увеличивается. Сдвиг потенциала в отрицательную сторону продолжается до тех пор, пока не будет достигнуто равновесие.
Возникновение разности потенциалов между металлом и раствором означает, что на границе раздела фаз (металл/электролит) должны появиться на некотором расстоянии друг от друга положительно и отрицательно заряженные слои, которые образуют двойной электрический слой (рис. 110). Обычно разрушение происходит на аноде.
Причиной электрохимической коррозии является термодинамическая неустойчивость металлов в среде электролита.
Рис. 110. Принципиальная схема электрохимического коррозионного процесса: D — катодный деполяризатор
Стадии любого электродного процесса:
- подвод реагирующих веществ к поверхности электрода из объема раствора;
- перенос заряженных частиц (электронов или ионов) через границу раздела фаз;
- отвод продуктов реакции в объем раствора.
Скорость электродного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей и зависит от потенциала.
В простейшем случае коррозии металлов, с образованием их растворимых продуктов (т.е. ионов Меn+), коррозионные процессы принято называть процессами растворения металлов. Образование ионов металла из его атомов, например, в кислом растворе можно представить совокупностью реакций
Ме = Меn++ ne, (1)
в которой электроны освобождаются, и
Н3О+ + е = (1/2)Н2 + Н2О, (2)
в которой электроны, освободившиеся в реакции (1), присоединяются к ионам водорода. В результате на металле одновременно протекают две реакции — анодная (1) и катодная (2).
Перенос электронов осуществляется на поверхности металла, а перемещение ионов — в электролите.
При протекании электрохимического процесса анодный и катодный потенциалы Еа и Ек выравниваются и принимают значение потенциала Ест. Этот потенциал называют стационарным или смешанным (компромиссным) потенциалом.
При Ест соблюдается равенство катодного и анодного токов, т. е.
ia = ik = iкор,
где iкор — скорость коррозии или саморастворения металла.
Если бы при этом электродные процессы не протекали, то потенциалы электродов сравнялись бы и наступила полная поляризация.
В действительности анодный и катодный процессы продолжаются. Присутствие в растворе деполяризаторов обеспечивает протекание реакций, в результате которых образуется Н2 или ОН–. Таким образом, если из двух реакций противоположного направления, одновременно протекающих на металле в отсутствии внешнего тока, одна является реакцией растворения, а другая — реакцией восстановления какого-либо окислительного компонента раствора, например ионов водорода, то это и есть коррозионный процесс.
Под коррозией, таким образом, понимают самопроизвольный процесс, происходящие на металле в условиях, когда металл погружен в раствор и ток от внешнего источника через него не проходит.
Коррозию металлов, при которой катодная реакция осуществляется с выделением водорода, называют коррозией металлов с водородной деполяризацией.
На практике с такими явлениями сталкиваются при хранении и перевозке кислот, при кислотном травлении металлов, при получении кислот на стадии абсорбции.
Для коррозия металлов с водородной деполяризацией характерно:
- большая зависимость скорости коррозии металла от рН раствора;
- большая зависимость коррозионной стойкости сплавов от их природы и содержания в них катодных примесей;
- увеличение скорости коррозии во времени, что связано с ростом посторонних примесей на поверхности металла в результате его растворения;
- возможность появления водородной хрупкости металлов.
Процессы коррозии металлов, у которых катодная реакция осуществляется с участием растворенного в электролите кислорода, называются коррозией с кислородной деполяризацией.
С кислородной деполяризацией корродируют металлы, находящиеся в атмосфере или соприкасающиеся с водой и растворами солей: обшивка судов в речной или морской воде, оборудование охладительных систем химических заводов, магистральные трубопроводы и т. д. Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
К внутренним факторам, определяющим скорость и характер электрохимической коррозии, относятся состояние поверхности, химический состав, структура металла и т. д. Неоднородность поверхности металла является одной из причин местной коррозии. Тщательная, тонкая обработка поверхности (шлифовка, полировка) повышает коррозионную стойкость металлов, способствуя образованию более однородной сплошной оксидной пленки на их поверхности. При грубой обработке истинная поверхность контакта металла с агрессивной средой увеличивается, усиливая коррозию.
Внешние факторы, влияющие на скорость реакции металлов, определяются природой и свойствами коррозионной среды и ее параметрами (температура, давление, скорость движения раствора электролита и т. д.).
