Етодика изучения темы «скорость химических реакций»
| Вид материала | Документы |
- Работников образования Кафедра естествознания реферат на тему: классификация химических, 424.08kb.
- Урок химии в 11классе по теме «Классификация химических реакций», 65.15kb.
- Задачи изучения дисциплины, 16.34kb.
- Стереохимия, область химии, изучающая пространственное строение молекул и влияние этого, 19.63kb.
- Урок 13-14: «Химические свойства алканов». (10 «б» класс), 38.16kb.
- Закон и периодическая система химических элементов Д. И. Менделеева" Значение и место, 131.75kb.
- О скорости электромагнитных волн, 270.07kb.
- Ие вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют, 436.76kb.
- IV. научные основы приготовления и практического использования катализаторов генезис, 1934.2kb.
- «Основные закономерности химических реакций. Производство серной кислоты контактным, 28.35kb.
Тема 13. мЕТОДИКА ИЗУЧЕНИЯ ТЕМЫ
«сКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ»
1. Место и значение темы в курсе химии средней школы
Изучение темы «Скорость химической реакции» в средней школе имеет большое теоретическое и практическое значение для понимания учащимися закономерностей протекания различных химических процессов, способствуя тем самым, формированию и развитию логического мышления и мировоззрения. Данная тема является теоретической базой для последующего изучения технологических процессов производства в области химии. Поэтому, одной из актуальных задач педагогов и методистов является совершенствование методики изучения вопросов, входящих в данную тему, повышая, тем самым, эффективность обучения.
Тема «Скорость химических реакций» изучается в курсе химии средней школы, в зависимости от авторских программ в 8-11 классах.
О. С. Габриелян описывает тему «Скорость химических реакций» в 8 классе и, в соавторстве с Г. Г. Лысовой, – в 11 классе. Л. С. Гузей в соавторстве с Р. П. Суровцевой и В. В. Сорокиным описывает в учебнике для 8 класса, в соавторстве с Р. П. Суровцевой в 10 классе.
На тему отводится от 2 до 6 уроков, в зависимости от авторской программы.
Данная тема занимает ключевые позиции, наряду с другими, поскольку позволяет понять механизмы и сущность протекания тех или иных химических процессов. Изучение темы помогает учащимся учиться абстрактно мыслить, поскольку сущность некоторых явлений нельзя показать на конкретных примерах. В связи с этим, при изучении темы необходимо активно привлекать проблему и химический эксперимент, поскольку такая постановка материала позволит учащимся продуктивнее мыслить, лучше понимать сущность изучаемых явлений.
Объяснение понятий зависимости скорости реакций от катализатора приводится на основе теории активированного комплекса. Эта теория в сочетании с кинетической теорией молекулярного движения позволяет понять, как влияют на скорость различные факторы (концентрация, температура, катализатор и др.). Эти представления позволяют не только связать между собой ранее изученные теории, но и создают основу для последующего рассмотрения равновесий в химических системах.
Приступая к изучению темы «Скорость химических реакций», учащиеся уже знают, что различные реакции протекают с разными скоростями. Однако, они совершенно не представляют себе, как объяснить эти различия и как связать их с изменениями энергии при реакциях, или с кинетической теорией газов и т.п.
Значение этой темы целесообразно рассматривать в трех аспектах.
а). Для формирования знаний и умений учащихся по химии. Изучение основных закономерностей химических реакций позволяет учащимся понять связь теории и практики и продолжить дальнейшее изучение химии. В процессе изучения темы, учащиеся получают новую для них информацию, тем самым формируются новые понятия темы, такие как скорость химических реакций, механизмы их протекания, понятия о катализе и т.д. Тема является теоретической базой для формирования понятий научных принципов процессов производства. Знания темы создают возможность управления химическими процессами. Практические умения и навыки учащихся формируется на практических занятиях (лабораторная работа с экспериментом). На практической работе у учащихся развиваются практические навыки обращения с лабораторным оборудованием, реактивами, появляется практический интерес к наблюдаемым явлениям. При объяснении темы учителю следует опираться на ранее полученные знания учащихся из курса физики (строение атома, средняя скорость при неравномерном движении, ее зависимость от пути и времени), математики (математические выражения и их расчет), химии (строение вещества, периодический закон и периодическая система Д. И. Менделеева, атомно-молекулярное учение).
б). Для воспитания учащихся. Материал данной темы позволяет рассмотреть проблему охраны окружающей среды; дает возможность формировать у школьников бережное отношение к природе, гражданскую ответственность за ее сохранность; позволяет формировать научное мировоззрение путем установления взаимосвязей и взаимозависимостей явлений в ходе химических процессов и в природе. При изучении данной темы осуществляется трудовое воспитание и профориентация учеников. Учащиеся на практических занятиях формируют ответственность при проведении работ, учатся работать в коллективе; знание техники безопасности будет воспитывать у школьников внимательность и аккуратность при выполнении лабораторных опытов.
в). Для развития учащихся. Как было указано выше, для развития учеников необходимо привлекать постановку проблемы и химический эксперимент. Постановка проблемных вопросов будет способствовать развитию мышления, внимания, речи и памяти. Химический эксперимент дает возможность визуально наблюдать химические явления, признаки химических реакций, наблюдать разницу в скорости протекания химических реакций. Появляется возможность глубже задуматься над причинами (факторами) влияющими на скорость химических реакций, что благотворно отражается на развитии мышления учащихся. На основе эксперимента школьники будут делать выводы о сущности этих факторов. Вербальные объяснения наблюдаемых явлений будут способствовать развитию речи, более грамотному изложению тех или иных понятий. При выполнении лабораторных опытов ученики будут развивать навыки работы в химической лаборатории.
Очень важно показать учащимся, что учение о скоростях химических реакций находится на переднем крае химической науки, т.к. наши знания в области механизмов реакции пока достаточно ограничены, и что в этой интересной и важной области исследований имеется открытое поле деятельности для способных и заинтересовавшихся химией учащихся. В частности, можно отметить, что лишь для очень небольшого числа реакций известно что-либо конкретное об их активированных комплексах, а в большинстве случаев точный механизм реакции не известен.
2. Тематический поурочный план
Приводится следующий примерный тематический поурочный план в соответствии с логикой изучаемого материала. Данный план отличается от традиционных и авторских тем, что уроки насыщены экспериментом. В план входит отдельный урок по решению задач, предлагается обобщение темы в виде самостоятельной работы (компьютерное тестирование).
Таблица 1.
| № | Тема урока | Основные понятия | Межпредметные связи | Химический эксперимент | Домашнее задание |
| Скорость химических реакций | |||||
| 1 | Скорость химических реакций. Влияние различных факторов на скорость реакции | Скорость химической реакции. Измерение и размерность скорости. Факторы, влияющие на скорость. Сущность факторов. Закон действия масс. Правило Вант-Гоффа. Катализатор. | Физика (строение атома). Математика (зависимость средней скорости от пути и времени). | Химический эксперимент, показывающий и подтверждающий влияние различных факторов на скорость реакции. | §13; вопросы и задания после параграфа. |
| 2 | Катализаторы в химических реакциях. | Катализаторы. Ферменты. Ингибиторы. Катализ. Энергия активации. Энергетический барьер. | Физика (энергия активации). Биология (ферменты, как биокатализаторы). | Оборудование: прибор для получения кислорода разложением пероксида водорода. | §14; вопросы и задания после параграфа. |
| 3 | Решение задач. | Скорость химических реакций. Закон действия масс. Правило Вант-Гоффа. | Физика, математика (работа с уравнениями и формулами). | – | Задачи по карточкам (выдаются учителем в конце урока). |
| 4 | Обобщение по теме «Скорость химических реакций». Самостоятельная работа (тестирование). | Повторение и закрепление изученных понятий по теме. Проверка знаний учащихся. | Физика. Математика. Биология. | – | Повторение изученного материала. |
3. Основные понятия темы
В связи с тем, что учащиеся при изучении темы «Скорость химических реакций» сталкиваются с новыми понятиями необходимо продолжить ведение терминологического словаря, с помощью которого учащимся будет легче ориентироваться в материале. Мы предлагаем следующий вариант такого словаря, где термины и понятия систематизированы с учетом уже изученного материала.
Абсорбция – процесс аналогичный адсорбции. Абсорбция отлична от адсорбции тем, что при первой происходит поглощение веществ во всем объеме поглотителя – абсорбента (гомогенная система).
Адсорбция – процесс, при котором растворенные вещества поглощаются поверхностным слоем жидкости или твердого тела. Речь идет о гетерогенной системе. Примером может служить обесцвечивание раствора фуксина при действии активированного угля в качестве адсорбента.
Атом – наименьшая частица химического элемента, сохраняющая все его свойства. Каждому элементу соответствует определенный вид атомов, строение которых определяет химическую индивидуальность элемента. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Атом в целом электронейтрален. Атомы могут существовать как в свободном состоянии, так и в соединении с атомами того же элемента или других элементов, образуя молекулы.
Атомно-молекулярное учение – теоретическое обобщение научных данных о строении и процессах взаимодействия веществ. Основы были заложены М.В. Ломоносовым, развиты Д. Дальтоном и другими учеными. Основные положения этого учения изложены в работе «Элементы математической химии» (1741). Сущность учения Ломоносова можно свести к следующим положениям: 1) вещества состоят из «корпускул» – молекул. 2) Молекулы состоят из «элементов» – атомов. 3) Частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц. 4) Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных – из различных атомов. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества из «сложных атомов», в современном понимании – молекул. Учение окончательно утвердилось в середине XIX века, на международном съезде химиков в г. Карлсруэ в 1860 г., где были приняты определения понятий молекулы и атома.
Активные молекулы – частицы, обладающие энергией, достаточной для осуществления данной химической реакции. Число таких молекул в системе зависит от факторов (условий), при которых осуществляется данная химическая реакция. Неактивные частицы можно сделать активными, если сообщить им необходимую дополнительную энергию, – этот процесс называется активацией.
Активаторы (в химии): 1) вещества (промоторы), добавление которых к катализатору увеличивает его активность, избирательность или устойчивость. Например, железный катализатор синтеза аммиака содержит несколько процентов Al2O3, K2O. Оксид ванадия V2O5 – катализатор окисления SO2 в SO3 – активируют добавками оксидов щелочных металлов. 2) Атомы элементов, вводимые в небольших количествах в кристаллическую решетку кристаллофосфоров, образующие вместе с окружающими их атомами решетки центры люминесценции кристаллофосфоров. Для кристаллофосфора сульфида цинка активаторами являются Cu, Ag, Au, Mn, редкоземельные элементы; для флюорита CaF2 – редкоземельные элементы. 3) Вещества, способствующие коррозии, например ионы водорода, кислород, растворенный в воде. В биохимии активаторами называют вещества, усиливающие действия ферментов.
Активация молекул – сообщение молекулам некоторой дополнительной энергии, необходимой для осуществления химического взаимодействия между ними. Один из способов активации – увеличение температуры: при повышении температуры число активных частиц сильно возрастает, благодаря чему резко увеличивается скорость химической реакции.
Активные центры – участки катализатора на которых осуществляется химическая реакция. Последние представляют собой негомогенные области кристаллических решеток, например, грани или углы субмикроскопических кристаллов. Активность определенных катализаторов увеличивается при введении строго контролируемых добавок – промоторов.
Гетерогенная система – неоднородная система, состоящая из нескольких однородных систем (фаз), отделенных поверхностью раздела. Фазы могут отличаться друг от друга по составу и свойствам. Примером могут служить: жидкость – насыщенный пар, насыщенный раствор с осадком; многие сплавы. Промежуточное положение между гетеро- и гомогенной системами занимают коллоидные растворы.
Гетерогенная химическая реакция – реакция, реагенты которой находятся в разных фазовых состояниях, в отличие от гомогенной химической реакции. Пример – горение серы: Sтв+
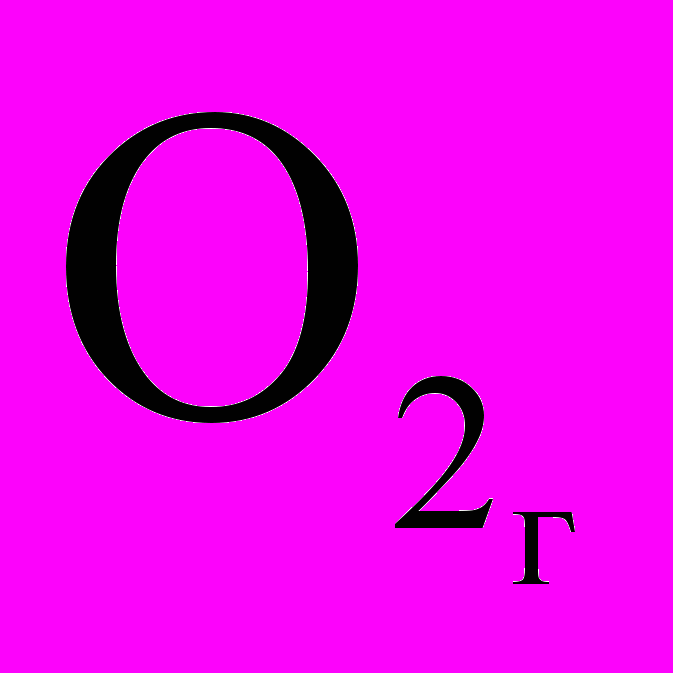 → S
→ S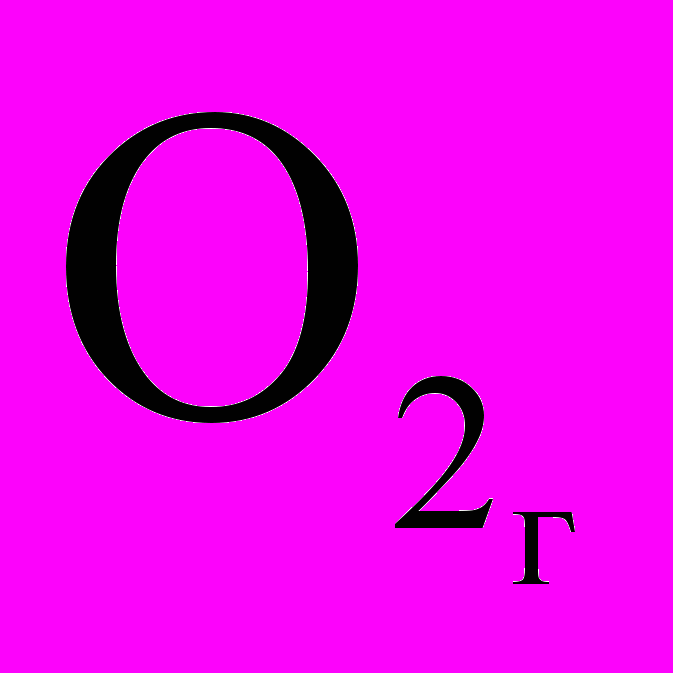 .
.Гетерогенный катализ – каталитический химический процесс, осуществляемый в гетерогенной системе. В гетерогенном катализе реагенты и катализатор представлены разными фазами. Пример: окисление диоксида в триоксид серы в присутствии твердого катализатора – оксида ванадия V2O5:
2SO2 + O2 → 2SO3.
Исходные вещества и продукты реакции представлены газовой фазой, а катализатор твердой фазой.
Гомогенная система – физико-химическая система, состоящая из одной фазы. В гомогенной системе из двух и более компонентов каждый компонент распределен в массе другого в виде молекул, атомов, ионов. Составные части гомогенной системы нельзя отделить друг от друга механическим путем. Примерами таких систем служат: жидкие или твердые растворы, смесь газов и др.
Гомогенная химическая реакция – реакция, реагенты которой представлены одинаковыми фазовыми состояниями, т.е. реакция осуществляемая в гомогенной системе. Пример – взаимодействие газообразных оксида азота (II) и кислорода: 2NOг +
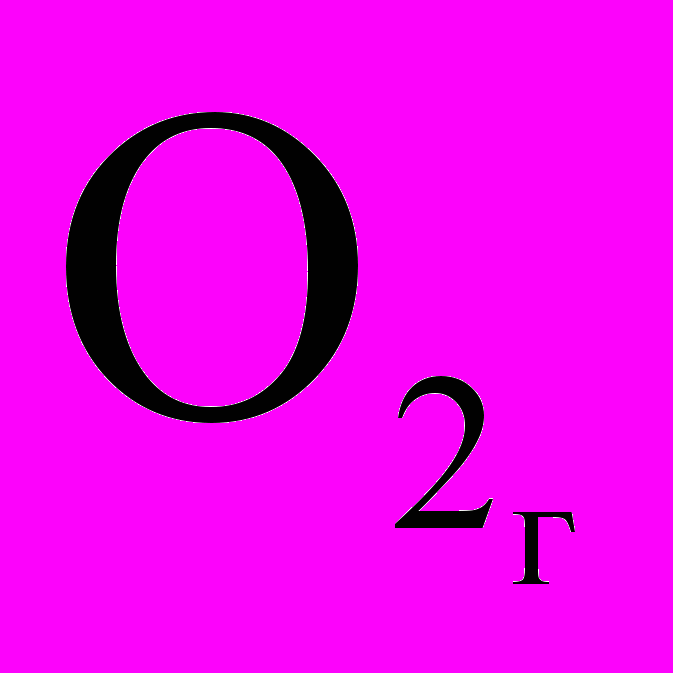 → 2N
→ 2N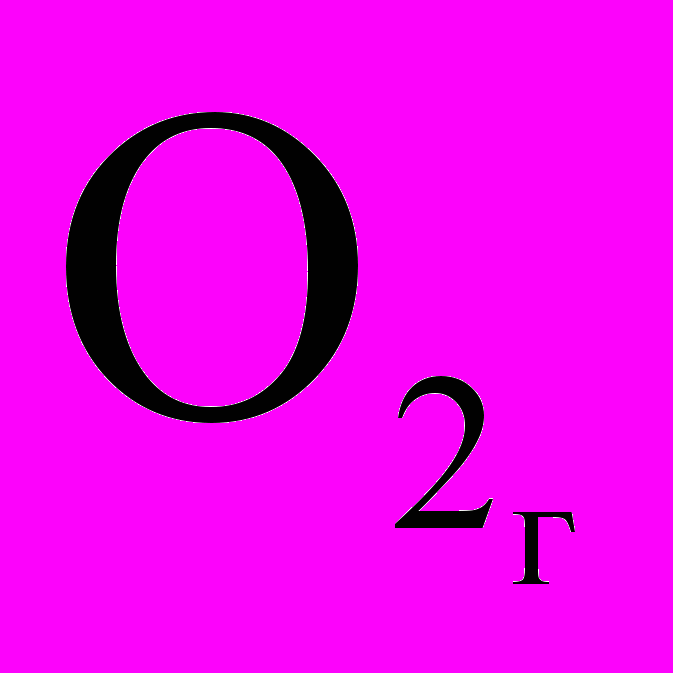 .
.Гомогенный катализ – каталитический химический процесс, осуществляемый в гомогенной системе. В гомогенном катализе реагенты и катализатор представлены одной фазой. Катализаторами здесь выступают кислоты и основания. Большинство этих реакций относятся к области органической химии.
Закон действия масс – закон, согласно которому скорость гомогенной химической реакции пропорциональна концентрации реагирующих веществ. Устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии. З.д.м. установлен в 1864 – 1867 гг. К. Гульдбергом и П. Вааге. Согласно этому закону скорость, с которой вещества реагируют друг с другом зависит от их концентрации. З.д.м. широко используется при различных расчетах химических процессов. Математически этот закон можно записать: v=k[A]x[B]y, где k – константа скорости химической реакции; причем, x+y≤3, поскольку, тримолекулярные реакции практически не осуществимы.
Ингибиторы – вещества, замедляющие или предотвращающие реакции окисления, полимеризации, окисления, коррозии металлов и др. Например: гидрохинон – ингибитор окисления бензальдегида; соединения технеция – ингибиторы коррозии сталей.
Катализ – явление изменения скорости химической реакции под действием катализаторов.
Катализаторы – вещества, изменяющие скорость химической реакции, не подвергаясь сами окончательному химическому превращению в данном процессе.
Каталитическая химическая реакция – химическая реакция, протекающая при наличии в системе катализатора.
Кинетика химическая – учение о скоростях химических реакций. Под кинетикой реакции понимают зависимость скорости данной реакции от концентрации реагирующих веществ, температуры и других параметров (потенциал электрода – в электрохимических реакциях, мощности дозы излучения в радиационно-химических реакциях и др.).
Кинетическое уравнение химической реакции – математическое выражение зависимости скорости химической реакции от концентраций реагентов:
 ,
,где v – скорость химической реакции; k – константа скорости химической реакции; [А], [B] – равновесные концентрации веществ, x, y – стехиометрические коэффициенты в уравнении химической реакции.
Константа равновесия – постоянная величина. Равна отношению произведения равновесных концентраций всех продуктов реакции в степенях, равных стехиометрическим коэффициентам при каждом продукте в уравнении реакции, к произведению концентраций всех реагентов в соответствующих степенях. Для реакции вида jA+kB
 pR+qS, где A, B, R, S – химические вещества, участвующие в реакции, а j, k, p, q – соответствующие стехиометрические коэффициенты в данном уравнении реакции, согласно з.д.м., в условиях равновесия выполняется соотношение:
pR+qS, где A, B, R, S – химические вещества, участвующие в реакции, а j, k, p, q – соответствующие стехиометрические коэффициенты в данном уравнении реакции, согласно з.д.м., в условиях равновесия выполняется соотношение: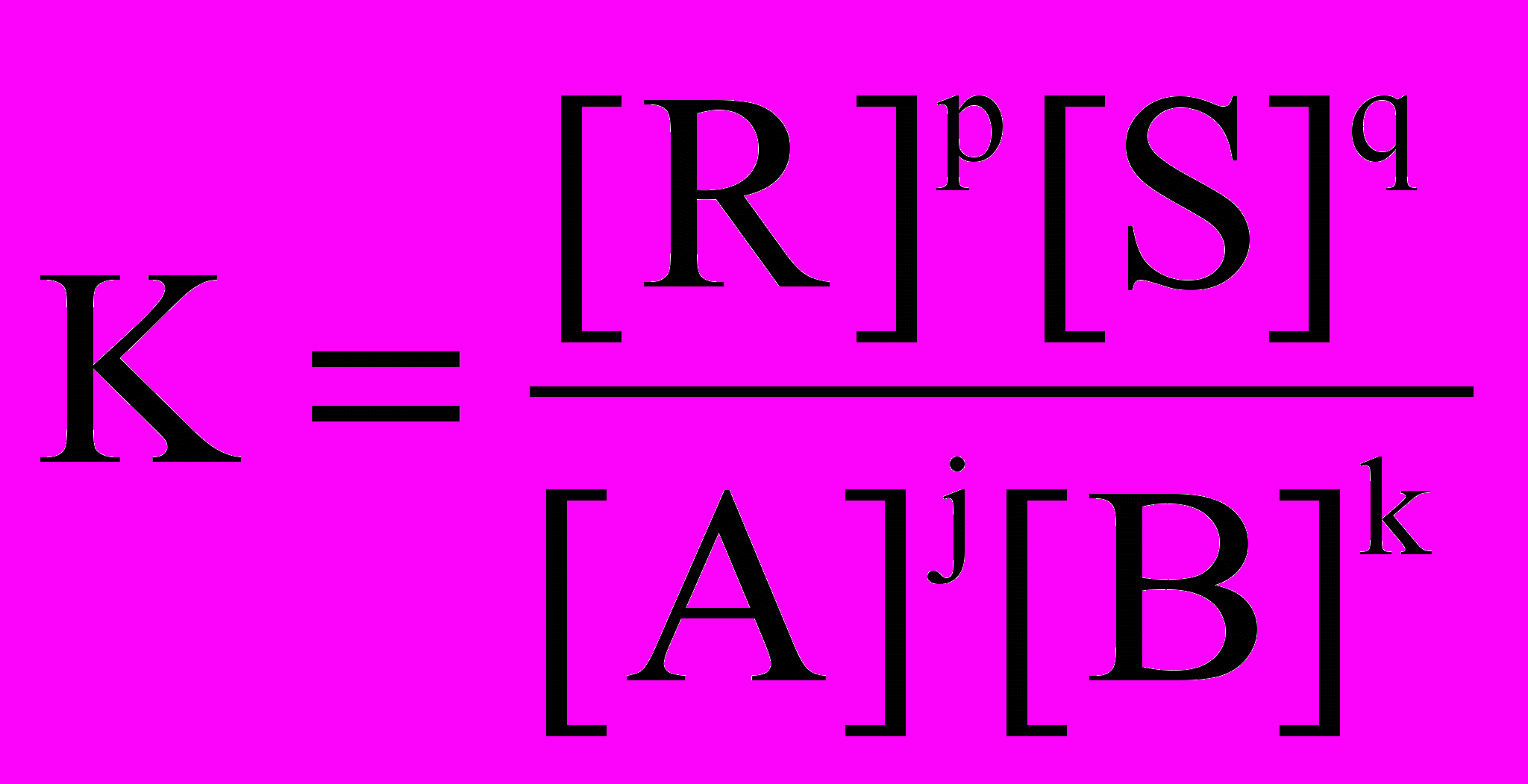 ,
,где К - константа равновесия.
Константа скорости химической реакции (k) – коэффициент пропорциональности в кинетическом уравнении, зависящий от природы реагирующих веществ и условий протекания реакции, и не зависящий от их концентраций. Физический смысл константы скорости: k=1 в случае, если исходные концентрации реагирующих веществ равны 1 моль/л.
Концентрация молярная (молярность) – физическая величина, показывающая содержание количества вещества в одном литре раствора или газа. М=
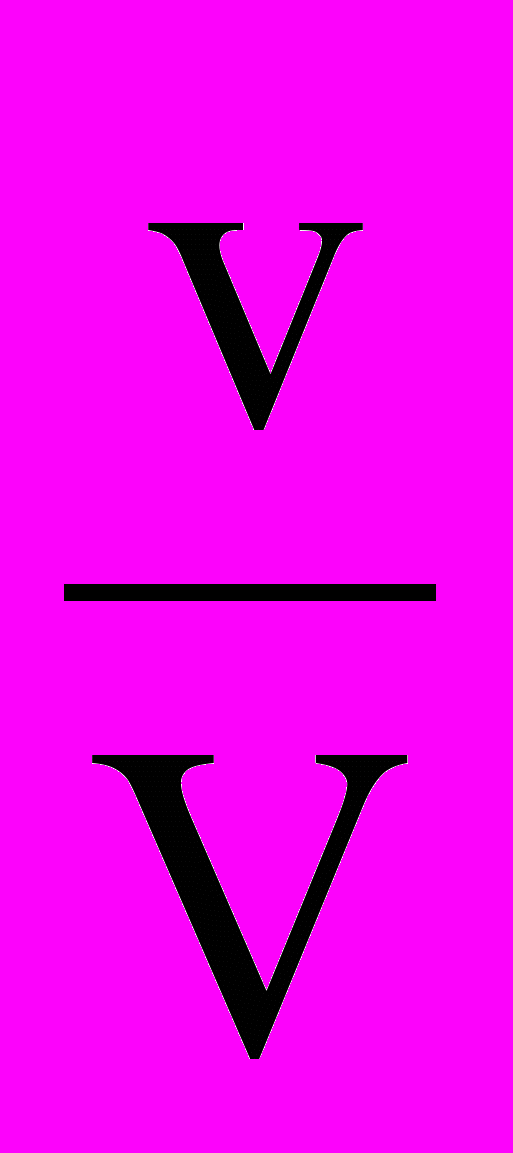 . Где М – молярная концентрация, v – количество вещества, V – объем раствора или газа. Размерность – моль/л, или моль/м3.
. Где М – молярная концентрация, v – количество вещества, V – объем раствора или газа. Размерность – моль/л, или моль/м3.Молекулярность реакции – определяется числом молекул, одновременным взаимодействием между которыми осуществляется акт химического превращения. Одностадийный процесс, в котором участвует только одна молекула, называется мономолекулярной. Одностадийные реакции могут протекать с участием двух (бимолекулярные) молекул или трех (тримолекулярные). Примером бимолекулярной реакции является реакция между монооксидом азота и озоном, приводящая к образованию диоксида азота и кислорода:
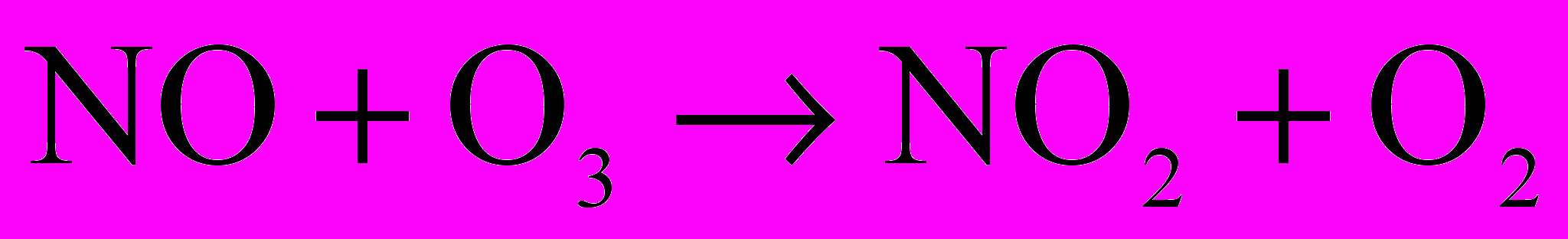
Обратимые химические реакции – реакции, которые при одних и тех же условиях могут одновременно протекать в противоположных направлениях. Пример: H2O + SO2
 H2SO3.
H2SO3.Порядок реакции – определяется по виду уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ. Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем вышеописанную зависимость. Это можно изобразить общей схемой A+B
 C+D, в данном случае порядок равен двум.
C+D, в данном случае порядок равен двум.Правило Вант-Гоффа – показывает зависимость скорости реакции от температуры: при повышении температуры на каждые десять градусов, скорость большинства химических реакций возрастает в два-четыре раза:
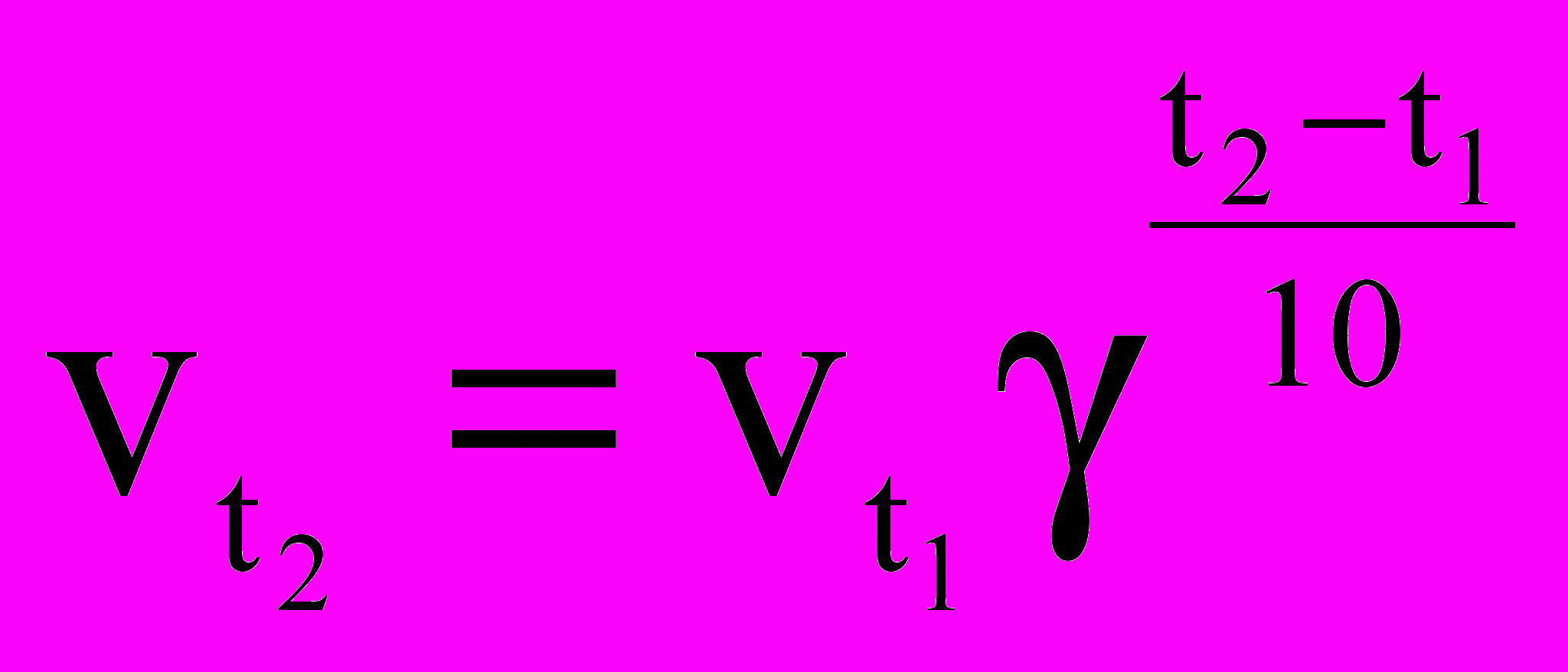 ,
,где
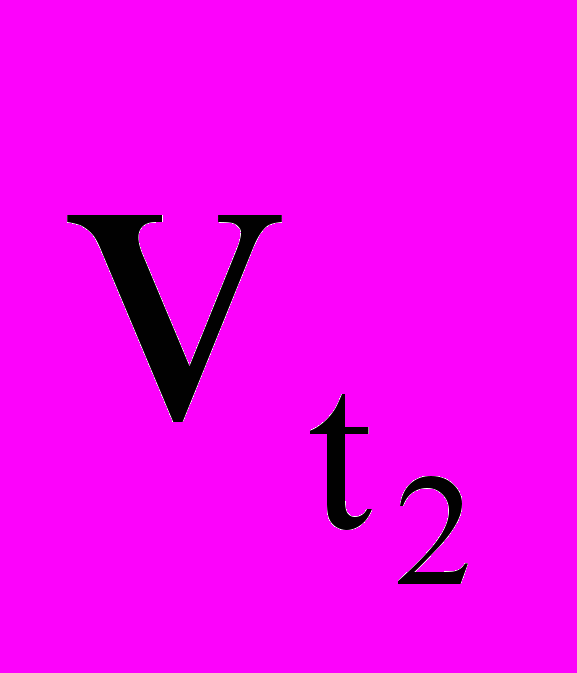 ,
, 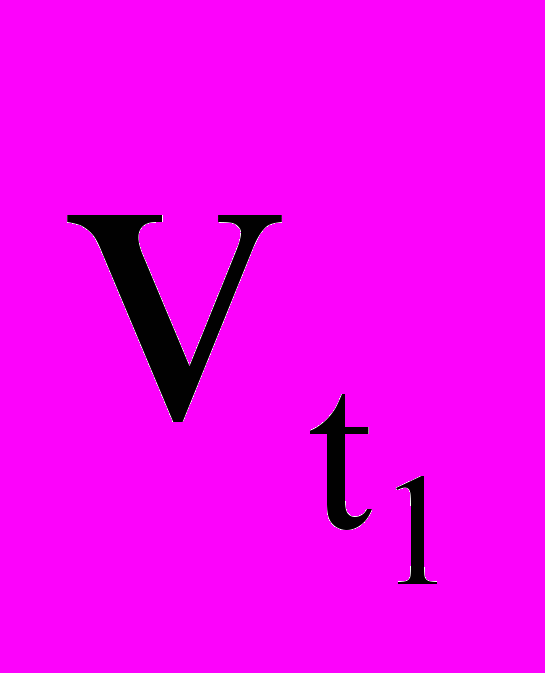 - скорости реакций соответственно при конечной t2 и начальной t1 температурах, а γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 ОС.
- скорости реакций соответственно при конечной t2 и начальной t1 температурах, а γ – температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры на каждые 10 ОС.Принцип Ле Шателье – правило, согласно которому при оказании на систему, находящуюся в устойчивом равновесии внешнего воздействия, изменяя концентрацию реагентов, давление и температуру в системе, равновесие смещается в том направлении, в котором эффект воздействия уменьшается. Например, добавление водорода в равновесную систему 2N2+3H2
 2NH3 смещает равновесие системы в таком направлении, чтобы концентрация водорода уменьшилось. Из этого следует, что равновесие смещается в направлении образования дополнительного количества NH3. Одновременно произойдет и некоторое уменьшение количества N2. Добавление в систему дополнительного количества N2 также вызовет смещение равновесия в сторону образования аммиака. Если в систему добавить NH3, равновесие сместится в направлении снижения концентрации NH3, то есть влево.
2NH3 смещает равновесие системы в таком направлении, чтобы концентрация водорода уменьшилось. Из этого следует, что равновесие смещается в направлении образования дополнительного количества NH3. Одновременно произойдет и некоторое уменьшение количества N2. Добавление в систему дополнительного количества N2 также вызовет смещение равновесия в сторону образования аммиака. Если в систему добавить NH3, равновесие сместится в направлении снижения концентрации NH3, то есть влево. Равновесие химическое – такое состояние системы, при котором одновременно и непрерывно протекают реакции в обоих направлениях, так что количества веществ, которые превращаются в единицу времени в прямой реакции, равно количеству веществ, которые образуются в реакции, идущей в обратном направлении. Химическое равновесие носит динамический характер:
2NO2
 2NO+O2
2NO+O2 Скорость химической реакции (v) – изменение концентрации реагирующих веществ в единицу времени, при неизменном объеме системы.
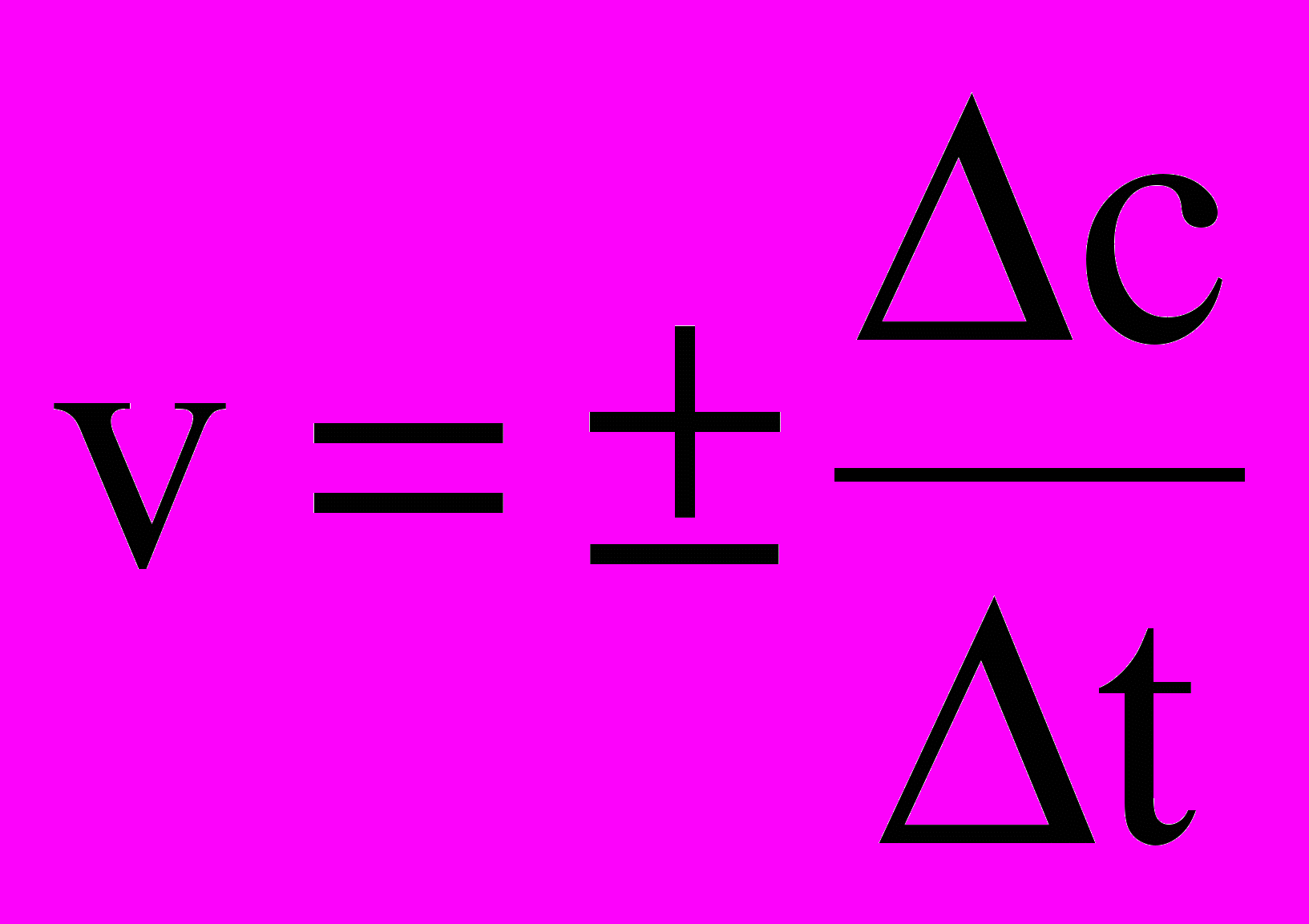 . Отрицательный знак в правой части уравнения говорит о том, что концентрация c исходного вещества уменьшается со временем.
. Отрицательный знак в правой части уравнения говорит о том, что концентрация c исходного вещества уменьшается со временем.Температура (t, T) – термодинамический параметр, характеризующий энергетическое состояние частиц вещества или системы. Измеряется в градусах Цельсия ОС, в этом случае температура обозначается t и в кельвинах К, в этом случае – T.
Температурный коэффициент (γ) – эмпирическая величина, показывающая, во сколько раз увеличивается скорость данной реакции, при повышении температуры на каждые десять градусов.
Фаза – компонент гетерогенной системы, обладающий одинаковыми химическими и термодинамическими свойствами, ограничивающие поверхность раздела; носитель физических, физико-химических и химических свойств веществ. Например, лед-вода при 0 ОС вместе – двухфазная система: жидкая фаза – вода, твердая – лед.
Ферменты (энзимы) – органические катализаторы белковой природы, вырабатываемые клетками живых организмов; участвуют во всех биохимических процессах; обладают большой активностью и специфичностью действий. Примеры: амилаза, мальтаза, панкреатин и другие.
Фотохимические реакции – химические реакции, вызываемые действием света
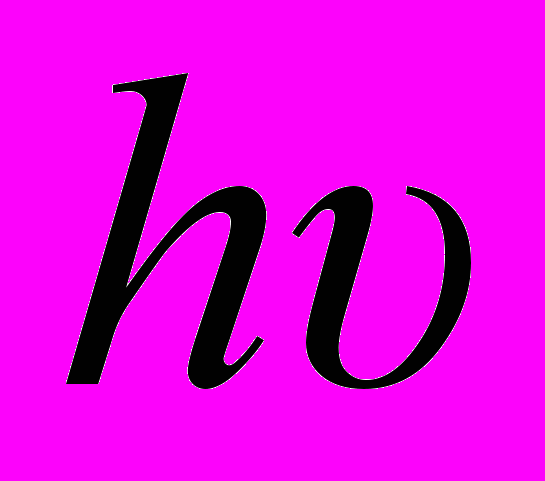 . Например: фотосинтез в растениях, распад бромида серебра в светочувствительном слое фотопластинки, превращение молекул кислорода в озон в верхних слоях атмосферы, взаимодействие хлора с водородом на свету с образованием HCl и др.
. Например: фотосинтез в растениях, распад бромида серебра в светочувствительном слое фотопластинки, превращение молекул кислорода в озон в верхних слоях атмосферы, взаимодействие хлора с водородом на свету с образованием HCl и др. Экзотермические реакции – реакции, протекающие с выделением энергии. Пример: горение угля.
C+O2=CO2+394 кДж
Эндотермические реакции – реакции, протекающие с поглощением энергии. Пример: разложение СаСО3 на СаО и СО2.
CaCO3→CaO+CO2
Энергия активации (Е) – представляет собой тот избыток энергии, которым должны обладать молекулы реагентов по сравнению со средней энергией, чтобы между ними произошла химическая реакция.
4. Химический эксперимент
Для формирования понятий данной темы рекомендуется использовать исследовательский эксперимент в сопровождении презентации (См. отдельный файл РР в Приложении) с последующей постановкой проблемных вопросов и их выяснения через эвристическую беседу с учениками.
Опыт №1. Примеры реакций, протекающих с различной скоростью. Внесите в пламя горелки медную пластинку, через некоторое время на ней появляется черный налет оксида меди (II): 2Cu + О2 = 2CuO. Внесите в пламя ленту магния, окисление металла сопровождается яркой мгновенной вспышкой: 2Mg + О2 = 2MgO. В качестве аналогичной реакции окисления металла, можно продемонстрировать железный предмет, покрытый ржавчиной.
Опыт №2. Зависимость скорости реакции от природы реагирующих веществ. В три демонстрационные пробирки поместите по щепотке порошков магния, железа и меди. Добавьте в них по 1-2 мл раствора соляной кислоты (1:2). Отметьте относительные скорости реакции в каждой пробирке (быстро, медленнее, реакция не идет).
Опыт №3. Зависимость скорости гомогенной реакции от концентрации реагирующих веществ. Приготовьте раствор серной кислоты концентрацией 1 моль/л, разбавляя более концентрированный раствор водой (соблюдайте технику безопасности при растворении серной кислоты) до получения раствора плотностью 1,06 г/мл. Приготовьте раствор тиосульфата натрия концентрацией 1 моль/л, растворением в мерной колбе объемом 500 мл навески кристаллогидрата Na2SO3S5H2O массой 124 г. Из этого раствора путем разбавления его части в 2 раза (1:1) и в 4 раза (1:3) получите растворы концентрацией 0,5 и 0,25 моль/л. В три стакана, сделав на них предварительно надписи (H2SO4) карандашом по стеклу, налейте раствор серной кислоты (по 50 мл). В пронумерованные колбы объемом 150 мл, также промаркированные надлежащим образом, налейте по 50 мл каждого раствора тиосульфата натрия. В колбы с растворами соли последовательно при перемешивании добавьте раствор серной кислоты. Зафиксируйте время с момента добавления кислоты до появления мути (опалесценции) в каждой колбе и оформите результаты по форме:
| № колбы | Концентрация Na2SO3S, моль/л | Время протекания реакции (τ), сек. | Условная скорость реакции, v=1/τ |
| 1 | 1 | | |
| 2 | 0,5 | | |
| 3 | 0,25 | | |
Постройте график зависимости скорости реакции от концентрации в координатах "Концентрация Na2SO3S – условная скорость реакции".
Сделайте вывод о зависимости скорости реакции от концентрации раствора тиосульфата натрия. Согласуются ли данные эксперимента с законом действующих масс?
Опыт №4. Зависимость скорости гетерогенной реакции от поверхности реагирующих веществ. Поместите в две большие пробирки равные по массе порции цинка в виде порошка и в виде гранул. Прилейте к ним равные объемы раствора соляной кислоты (1:1). Наблюдайте визуально различие в скорости этих реакций. Сделайте выводы.
Опыт №5. Зависимость скорости реакции от катализатора. В три пробирки налейте по 2 мл раствора пероксида водорода (30%). Одновременно добавьте в сосуды по небольшой щепотке порошков оксида марганца (IV), угля и оксида меди (II). Наблюдайте разложение пероксида и сделайте вывод о влиянии указанных веществ на его скорость. В три пробирки поместите равные навески порошка цинка; в одну из них добавьте 1 мл раствора формалина, в другую – 1 мл воды, в третью – порошок меди и 1 мл воды. Прилейте в каждую пробирку по 2 мл раствора соляной кислоты (1:1). Наблюдайте различие скорости взаимодействия металла с кислотой в пробирках и сделайте выводы.
Опыт №6. Смещение химического равновесия. Приготовьте разбавленные и концентрированные растворы хлорида железа (III) и роданида калия. Слейте в стакан по 20 мл разбавленных растворов хлорида железа (III) и роданида калия и наблюдайте возникновение розовой окраски смеси за счет образования роданида железа (III):
FeCl3 + 3KSCN
 Fe(SCN)3 + 3KCl
Fe(SCN)3 + 3KClПолученный раствор (если его окраска слишком интенсивна, разбавьте его водой) разлейте в четыре колбы объемом по 50 мл. Одну колбу с раствором оставьте для сравнения, во вторую и третью колбы добавьте немного концентрированных растворов хлорида железа (III) и роданида калия. Наблюдайте значительное усиление окраски растворов в обоих сосудах по сравнению с исходной окраской. В четвертую колбу добавьте немного кристаллического хлорида калия и перемешайте; окраска ослабевает. Выполните соответствующее оформление хода эксперимента и сделайте выводы.
5. Конспект урока по теме «Скорость химических реакций»
Для формирования понятия о скорости химических реакций, важное значение имеет разработка урока по теме. Мы предполагаем вести урок с позиции проблемного обучения, где после постановки учителем проблемы, учащиеся самостоятельно могли бы делать выводы, на основании эксперимента. Следующий план-конспект, который по нашему мнению было бы целесообразно применить при изучении темы на уроках химии, предусмотривает не только теоретическое знакомство учащихся с основными понятиями данной темы, но и применение наглядности в виде наиболее показательных химических реакций, которые позволят улучшить понимание учащихся основных моментов при изучении факторов, влияющих на скорость химических реакций.
Тема урока: «Скорость химических реакций».
Цели урока:
а) образовательные (формирование новых понятий):
- понятие скорости химических реакций;
- понятие химической кинетики;
- факторы, влияющие на скорость химических реакций;
- понятие о катализе;
б) воспитывающие:
- формирование мировоззрения;
- воспитание ответственности к работе;
в) развивающие:
- развитие речи учащихся;
- развитие памяти учащихся;
- развитие мышления учащихся через химический эксперимент.
Тип урока: передача и усвоение нового материала с использованием беседы и эксперимента.
Методы урока:
- наглядные (рассмотрение понятий темы, формул, рассмотрение протекания химических реакций, демонстрируемых учителем, применение медиапрезентации);
- словесные (объяснения учителя и вопросы к классу).
Ход урока:
I. Вводная часть.
Химические реакции протекают с различными скоростями. Для одних это доля секунды, для других минуты, дни; некоторым требуются десятилетия или более длительные промежутки времени.
Р
 ассмотрим пример: ВЫВОД: Различные реакции протекают с
ассмотрим пример: ВЫВОД: Различные реакции протекают с горение спички; различными скоростями
 ржавление железа;
ржавление железа; Возникает вопрос: какие факторы определяют скорость химической реакции? Как измерять скорость и как управлять химическими реакциями?
Р
 аздел химии, изучающий скорости химических реакций называется химической кинетикой.
аздел химии, изучающий скорости химических реакций называется химической кинетикой.Для ответа охарактеризуем скорость химической реакции.
II. Понятие скорости химической реакции.
Из курса физики известно, что скорость какого-либо процесса (v) измеряется изменением определенной физической величины в единицу времени. В ходе реакции исходные вещества расходуются (их количество уменьшается), а количество продуктов реакции увеличивается.
Вывод: в ходе реакции изменяются количество веществ во времени.
О
 пределение 1. Скорость химической реакции равна изменению количеств исходных веществ в единицу времени.
пределение 1. Скорость химической реакции равна изменению количеств исходных веществ в единицу времени.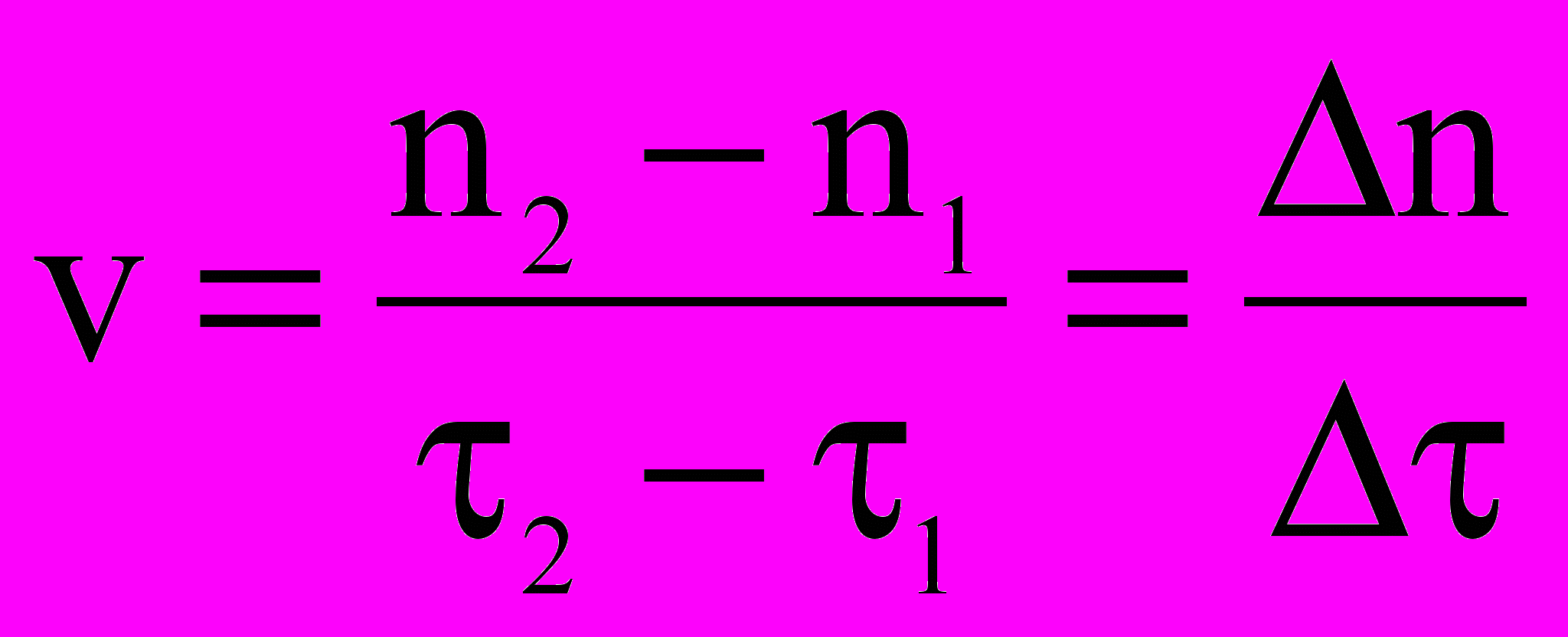
Но количества веществ будут сопоставимы лишь в случае, если они приведены к одинаковым объемам.
К
 акая физическая величина характеризует количество вещества в единицу объема? (
акая физическая величина характеризует количество вещества в единицу объема? (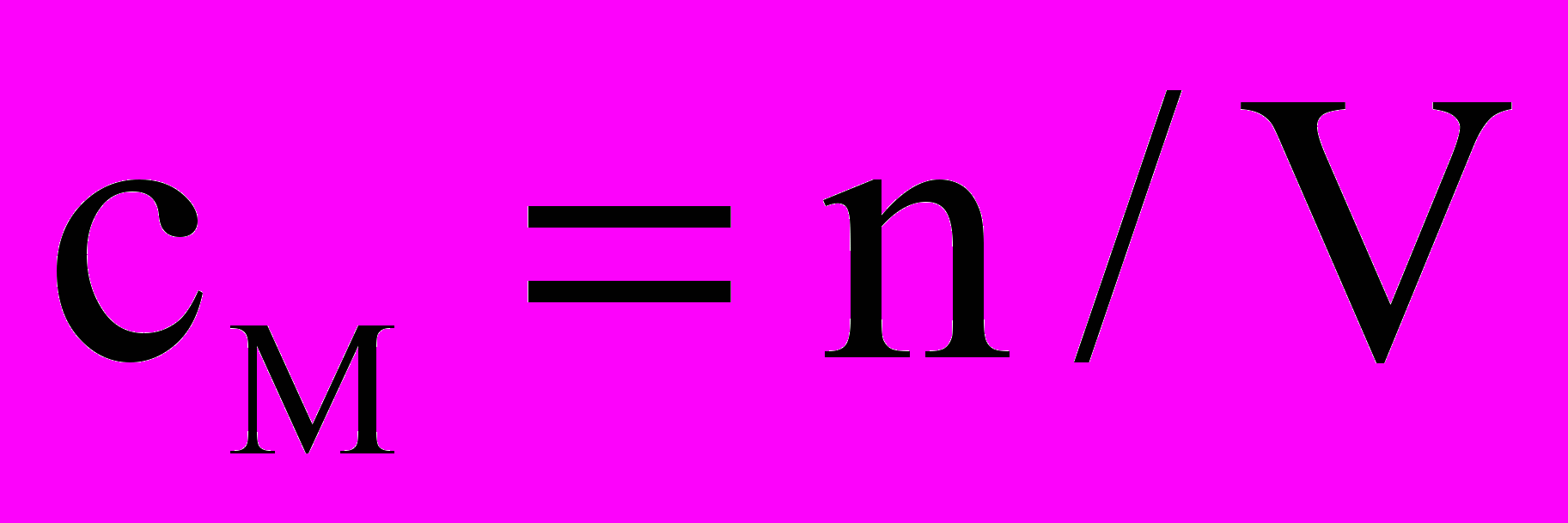 )
)По скорости изменения молярной концентрации исходного вещества можно судить о скорости химической реакции.
Определение 2. Скорость химической реакции равна изменению концентраций реагирующих веществ в единицу времени при неизменном объеме системы.
К
 акова размерность скорости химической реакции?
акова размерность скорости химической реакции? 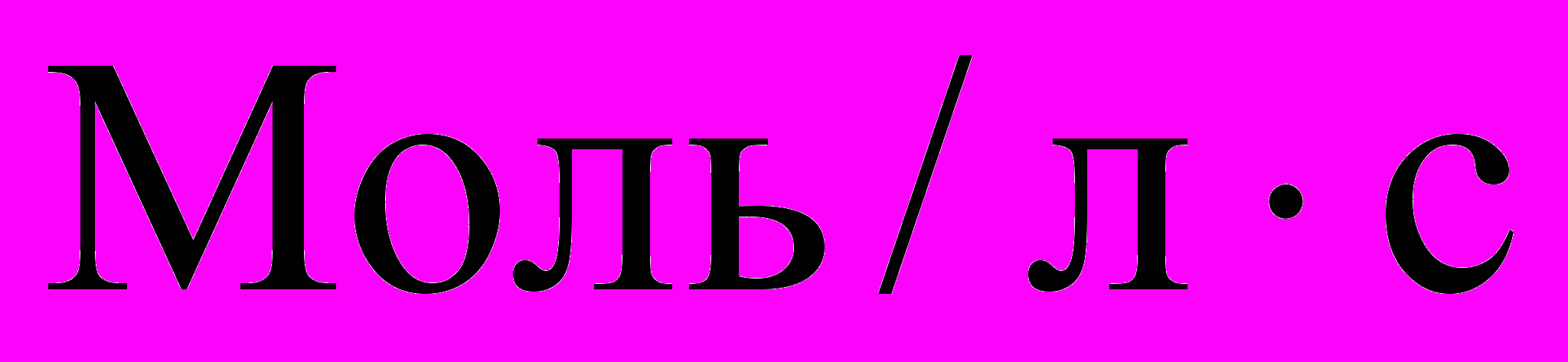
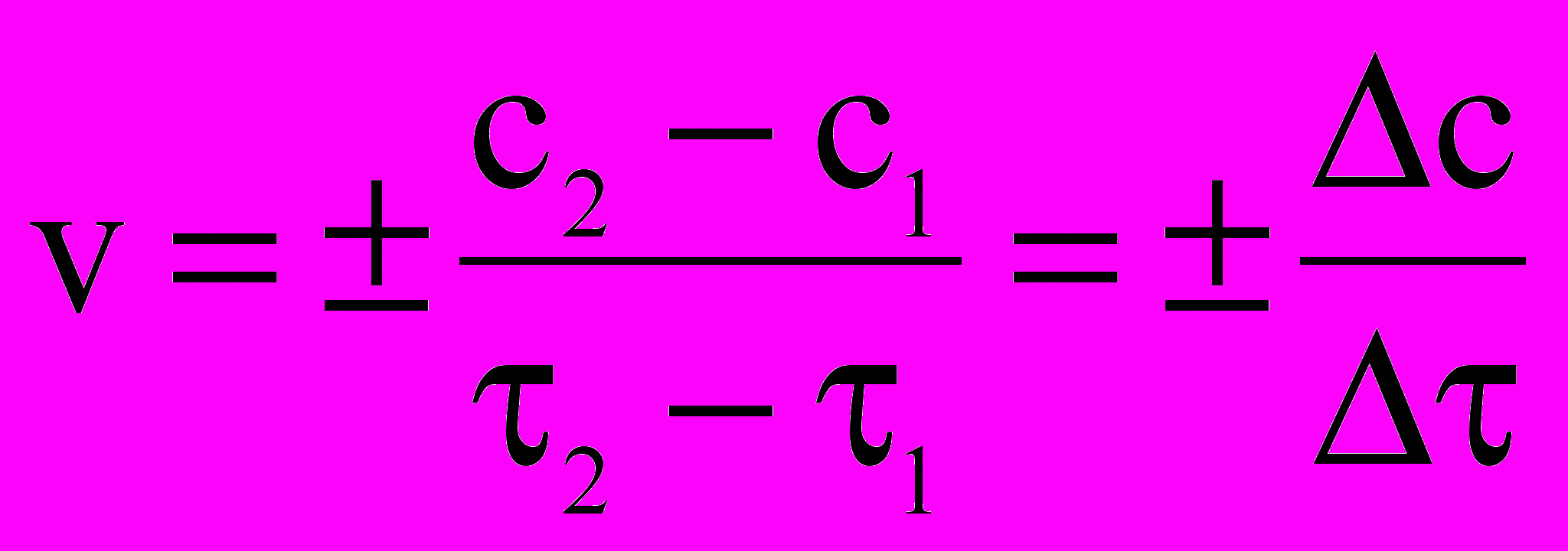
Отрицательный знак в правой части уравнения ставится потому, что концентрация (c) исходного вещества уменьшается со временем, а скорость не может быть отрицательной величиной.
III. Факторы, влияющие на скорость химической реакции.
Мы познакомились с понятием скорости и способом ее выражения. Рассмотрим причины, влияющие на скорость химической реакции.
П
 одумайте, что, по вашему мнению, оказывает влияние на скорость химической реакции?
одумайте, что, по вашему мнению, оказывает влияние на скорость химической реакции?Приведем и обсудим несколько опытов.
О
 пыт №1. Берем три пробирки под номерами 1, 2, 3. В первой пробирке находится порошок магния. Во второй – порошок железа. В третьей – порошок меди. К каждой пробирке приливаем равные объемы раствора HCl (1:1). Наблюдаем:
пыт №1. Берем три пробирки под номерами 1, 2, 3. В первой пробирке находится порошок магния. Во второй – порошок железа. В третьей – порошок меди. К каждой пробирке приливаем равные объемы раствора HCl (1:1). Наблюдаем: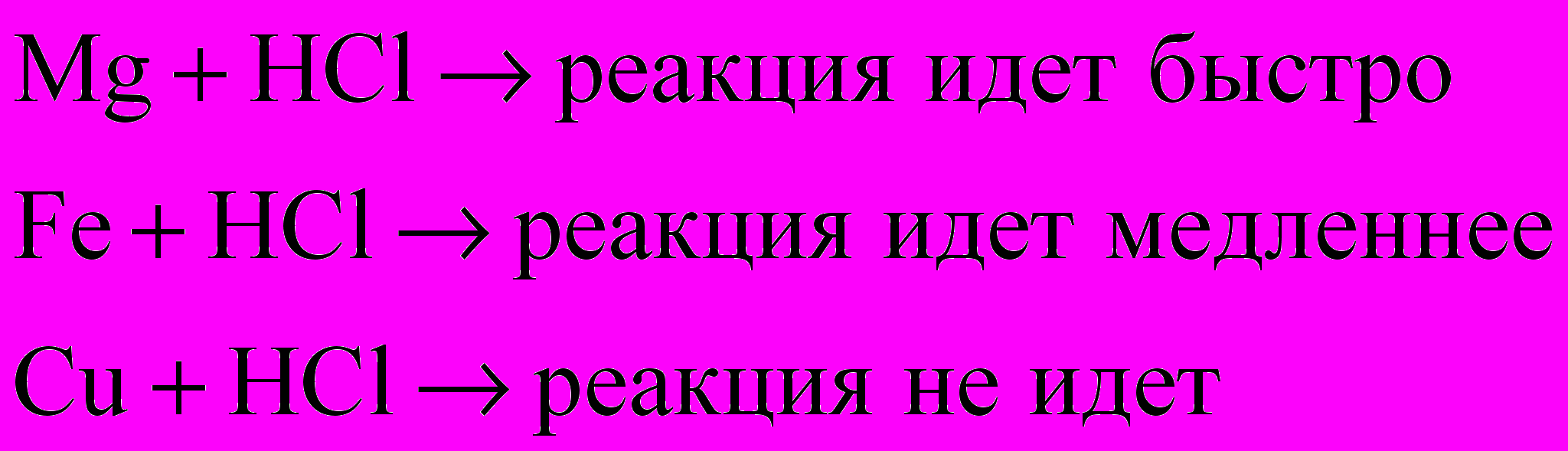
У
 читель ставит проблему: «Какой фактор оказывает влияние на скорость реакций и какова его сущность?».
читель ставит проблему: «Какой фактор оказывает влияние на скорость реакций и какова его сущность?».Ученики отвечают исходя из опыта, что в данном случае это природа реагирующего вещества (металла). Сущность фактора – строение металлов (оно различно), следовательно, различна и скорость химической реакции. Оформление на доске может выглядеть следующим образом (презентация):
Опыт №1. Реакции соляной кислоты с металлами.
| Х  имическая реакция имическая реакция | Фактор, определяющий скорость | Сущность |
 | природа реагента (металла) | строение реагента (металла) |
О
 пыт №2. Возьмем два химических стакана с приготовленными растворами тиосульфата натрия Na2S2O3. В первом – раствор тиосульфата натрия, концентрацией с1. Во втором – тот же раствор, концентрацией с2=0,5с1. приливаем к первому стаканчику разбавленный раствор H2SO4 (в пропорции 1:1).
пыт №2. Возьмем два химических стакана с приготовленными растворами тиосульфата натрия Na2S2O3. В первом – раствор тиосульфата натрия, концентрацией с1. Во втором – тот же раствор, концентрацией с2=0,5с1. приливаем к первому стаканчику разбавленный раствор H2SO4 (в пропорции 1:1). 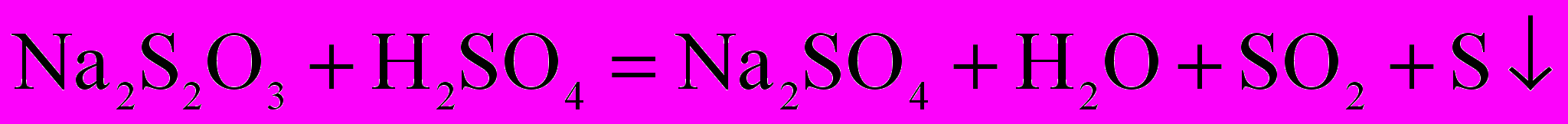
Отмечаем время выпадения осадка (момент помутнения). Ко второму стаканчику аналогично приливаем раствор H2SO4.
Записываем результаты времени выпадения осадка τ1, τ2.
У
 читель ставит проблему: какой фактор оказывает влияние на скорость, и какова его сущность?
читель ставит проблему: какой фактор оказывает влияние на скорость, и какова его сущность?Ученики отвечают исходя из опыта: в данном случае фактор – это концентрация реагирующего вещества. Сущность – повышение концентрации влечет рост числа молекул и увеличение числа соударений между ними. Число соударений тем больше, чем выше концентрация реагентов.
Оформление на доске может выглядеть следующим образом:
Опыт №2. Взаимодействие тиосульфата натрия различных концентраций с серной кислотой.
-
Х имическая реакция
имическая реакция
Фактор, определяющий скорость
Сущность
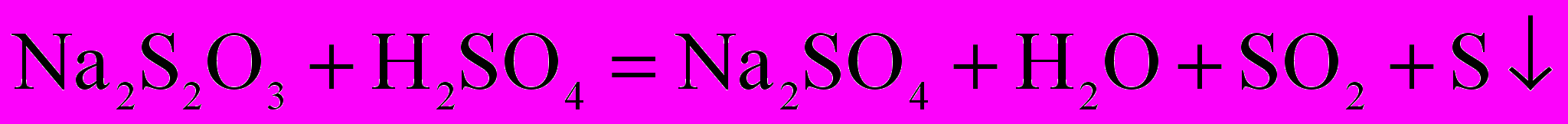
I вариант с(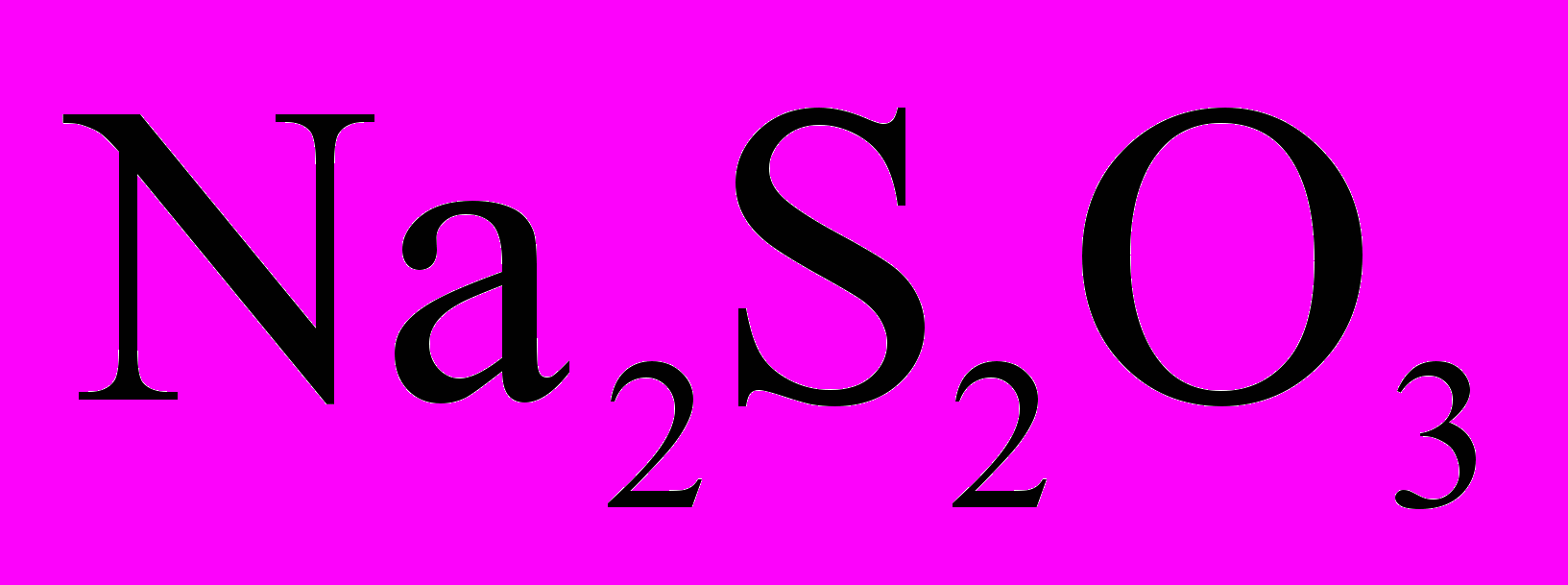 )=1 → 15 секунд
)=1 → 15 секунд
II вариант с(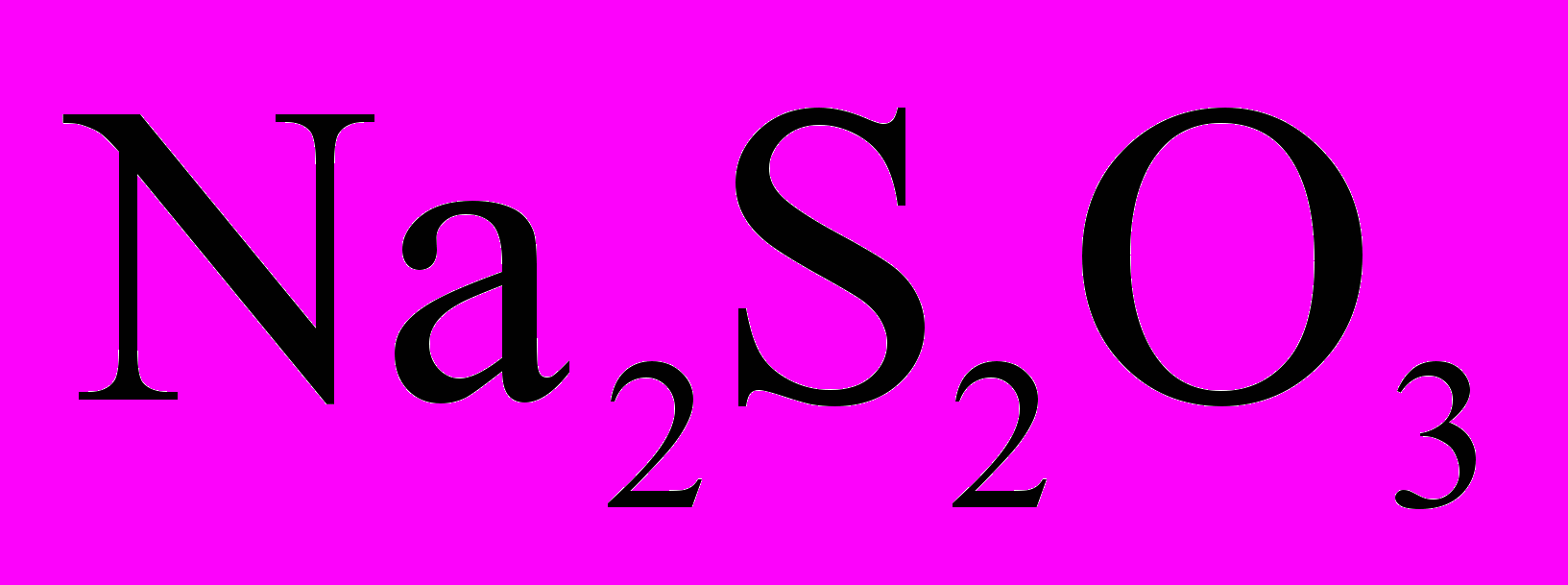 )=0,5 → 30 секунд
)=0,5 → 30 секунд
Концентрация реагентов
Увеличение числа соударений реагирующих частиц
Математическое выражение зависимости. Закон Гульдберга и Вааге (Норвегия, 1867 г.). Для реакции вида А+В=С (концентрацию обозначим как [A] и [В]) можно записать: v=k[A][B], где k – коэффициент пропорциональности или константа скорости данной химической реакции, зависящая от природы вещества и температуры, но не зависящая от концентрации; [А] и [В] – равновесные концентрации веществ А и В.
Формулировка закона: при постоянной температуре скорость химической реакции пропорциональна произведению концентрации реагирующих веществ.
Д
 ля реакции типа 2NO+O2=2NO2 справедлива запись: v=k[NO]2[O2], применим это уравнение к нашей реакции:
ля реакции типа 2NO+O2=2NO2 справедлива запись: v=k[NO]2[O2], применим это уравнение к нашей реакции:v=k[Na2S2O3][H2SO4]
Мы условились, что в первом случае концентрация исходных веществ равна единице, следовательно, v1=k[1][1]=k1 (константа скорости равна самой скорости). Во втором случае: v2=k[0,5][1]=k0,5. Поделив выражение 1 на выражение 2, получим 1/0,5=2. Этим объясняется разница во времени первой и второй реакциями. Данное уравнение применимо только для простейших гомогенных систем (об этом подробнее на следующем уроке).
О
 пыт №3. Берем две пробирки под номерами 1 и 2. В первую пробирку помещаем немного порошка цинка. Во вторую пробирку 1-2 гранулы цинка. Приливаем к обеим пробиркам равные объемы соляной кислоты. Наблюдаем:
пыт №3. Берем две пробирки под номерами 1 и 2. В первую пробирку помещаем немного порошка цинка. Во вторую пробирку 1-2 гранулы цинка. Приливаем к обеим пробиркам равные объемы соляной кислоты. Наблюдаем: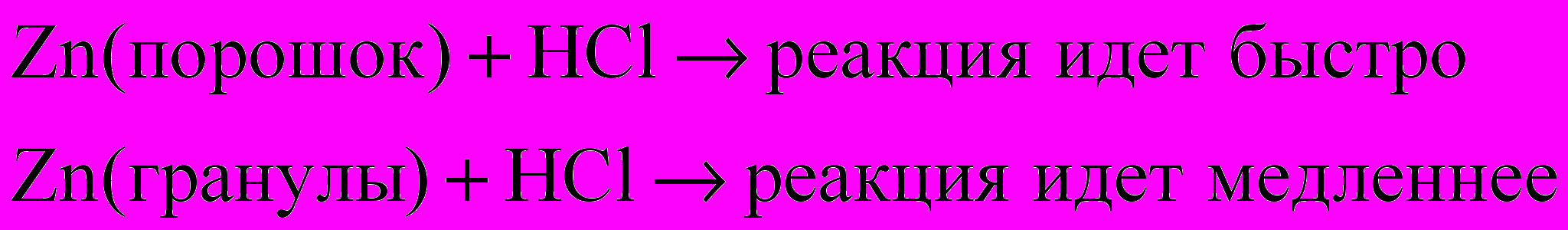
У
 читель ставит проблему: «Какой фактор оказывает влияние на скорость и какова его сущность?».
читель ставит проблему: «Какой фактор оказывает влияние на скорость и какова его сущность?».Ученики отвечают исходя из опыта, что в данном случае фактор – площадь соприкосновения реагента (металла). Сущность – увеличение числа соударений.
Оформление на доске может выглядеть следующим образом:
-
Химическая реакция
Фактор, определяющий скорость
Сущность
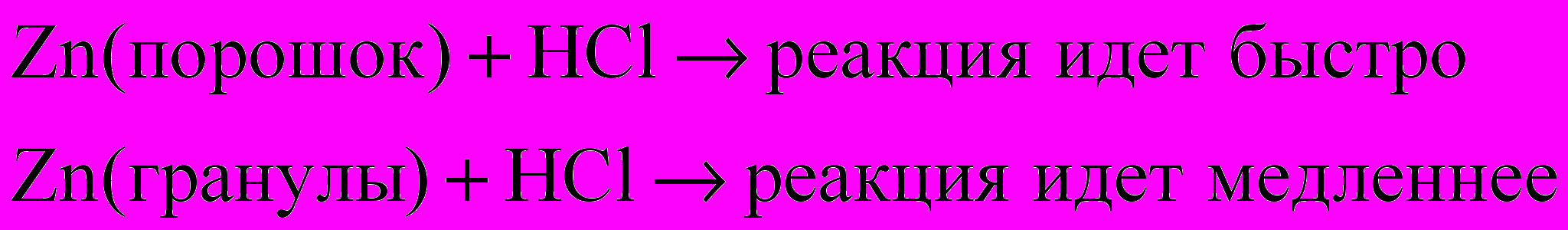
Площадь соприкосновения веществ
Увеличение числа соударений реагирующих частиц
О
 пыт №4 (мысленно). Представим реакцию в газовой фазе:
пыт №4 (мысленно). Представим реакцию в газовой фазе:N2 + 3H2
 2NH3 + Q
2NH3 + QУчитель ставит проблему: «Какой фактор будет оказывать влияние на скорость в данной реакции, и какова его сущность?».
У
 ченики отвечают исходя из РАССУЖДЕНИЙ, что в данном случае фактор – может быть увеличение давления (концентрации). Сущность – увеличение числа соударений.
ченики отвечают исходя из РАССУЖДЕНИЙ, что в данном случае фактор – может быть увеличение давления (концентрации). Сущность – увеличение числа соударений.Оформление на доске может выглядеть следующим образом:
-
Химическая реакция
Фактор, определяющий скорость
Сущность



Увеличение давления (концентрации)
Увеличение числа соударений
О
 пыт №5. Берем два химических стакана с одинаковыми растворами Na2S2O3. К первому приливаем разбавленную серную кислоту. Второй раствор подогреваем на 10 0С выше комнатной температуры и приливаем равный объем разбавленной серной кислоты. Наблюдаем:
пыт №5. Берем два химических стакана с одинаковыми растворами Na2S2O3. К первому приливаем разбавленную серную кислоту. Второй раствор подогреваем на 10 0С выше комнатной температуры и приливаем равный объем разбавленной серной кислоты. Наблюдаем: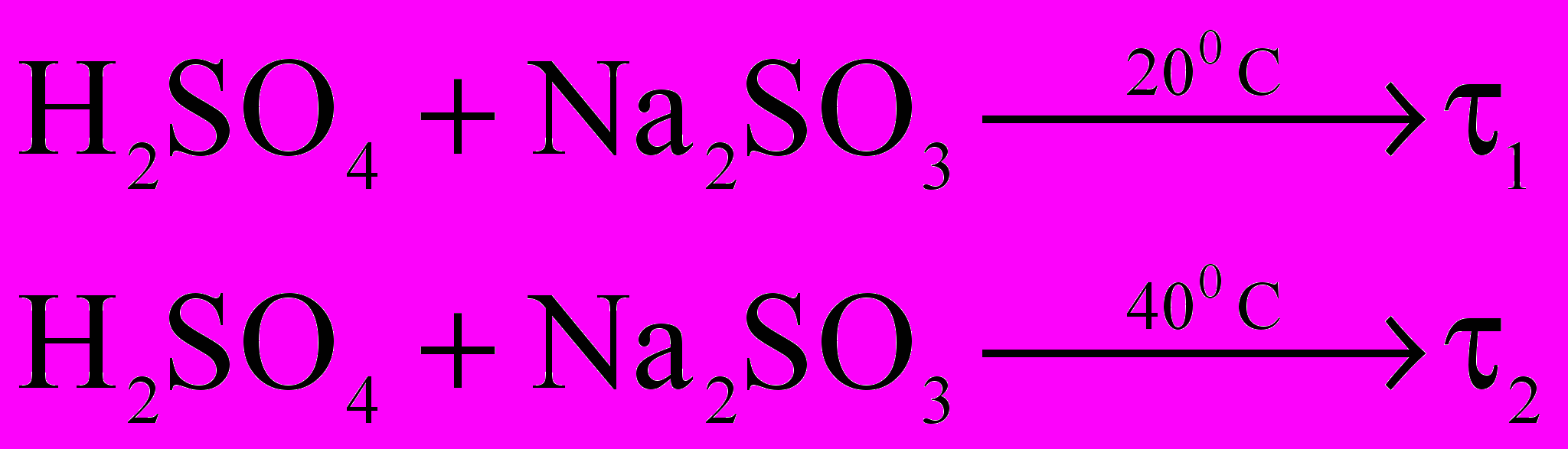
У
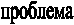 читель ставит проблему: «Какой фактор оказывает влияние на скорость реакции и какова его сущность?».
читель ставит проблему: «Какой фактор оказывает влияние на скорость реакции и какова его сущность?».У
 ченики отвечают исходя из опыта, что в данном случае фактор – увеличение температуры. Сущность – в результате увеличения температуры увеличивается число активных молекул.
ченики отвечают исходя из опыта, что в данном случае фактор – увеличение температуры. Сущность – в результате увеличения температуры увеличивается число активных молекул.Оформление на доске может выглядеть следующим образом:
-
Химическая реакция
Фактор, определяющий скорость
Сущность
Увеличение температуры
Увеличивается число активных молекул
Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
О
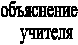 пределение: при повышении температуры на каждые 100С скорость большинства химических реакций возрастает в 2-4 раза.
пределение: при повышении температуры на каждые 100С скорость большинства химических реакций возрастает в 2-4 раза.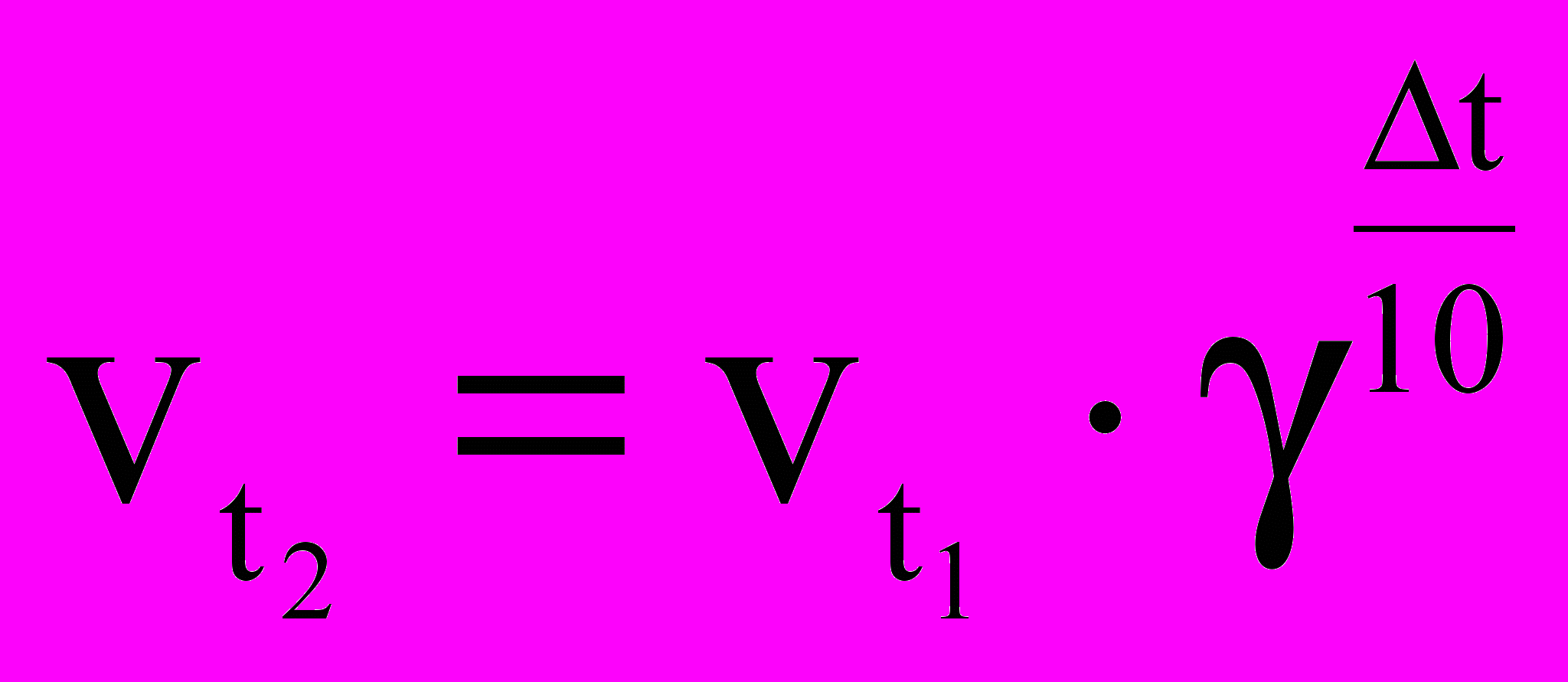 , где γ – температурный коэффициент, показывающий во сколько раз увеличивается скорость реакции с повышением температуры на каждые 100С, t2 – конечная температура, t1 – начальная температура.
, где γ – температурный коэффициент, показывающий во сколько раз увеличивается скорость реакции с повышением температуры на каждые 100С, t2 – конечная температура, t1 – начальная температура.Опыт №6. В трех пронумерованных пробирках содержится порошок Al (Zn). В первую пробирку ничего не добавляем. Во вторую добавляем немного порошка меди. В третью пробирку добавляем немного формалина.
У
 читель ставит проблему: «Возможно ли влияние меди и формалина на скорость реакции Al с HCl, если эти вещества сами по себе с соляной кислотой не реагируют?».
читель ставит проблему: «Возможно ли влияние меди и формалина на скорость реакции Al с HCl, если эти вещества сами по себе с соляной кислотой не реагируют?».Учащиеся, вероятнее всего, не смогут ответить на этот вопрос.
Учитель предлагает проверить это.
Н
 аблюдаем:
аблюдаем:
В данной реакции медь и формалин – вещества, изменяющие скорость реакции. Такие вещества называются катализаторами. Катализаторы в реакции не расходуются и в продукты реакции не входят. Одни катализаторы ускоряют реакцию – положительный катализ (или просто катализ), другие замедляют – отрицательный катализ (такие вещества называют ингибиторами). Более подробно с катализаторами мы познакомимся на следующем уроке.
Оформление на доске может выглядеть следующим образом:
-
Химическая реакция
Фактор, определяющий скорость
Сущность

Присутствие катализатора
Катализатор влияет на скорость химических реакций
Закрепление. Учитель с учениками повторяет по итогам проведенных опытов факторы, влияющие на скорость реакций, и их сущность. Учащиеся у доски с помощью учителя решают задачи.
З
 адача №1. Исходная концентрация одного из реагирующих веществ составляет 1 моль/л. Через 4 секунды от начала реакции она составила 0,6 моль/л. Найдите скорость этой реакции.
адача №1. Исходная концентрация одного из реагирующих веществ составляет 1 моль/л. Через 4 секунды от начала реакции она составила 0,6 моль/л. Найдите скорость этой реакции.Решение: (1-0,6)/4=0,1 моль/
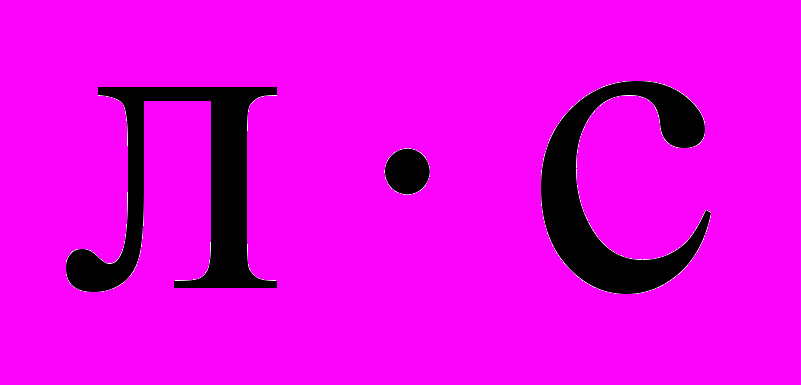 .
.Задача №2. Реакция при температуре 500С протекает за 2 мин., 15 с. За сколько времени закончится данная реакция при температуре 700С, если γ=3.
Решение: t2=700С, t1=500С;
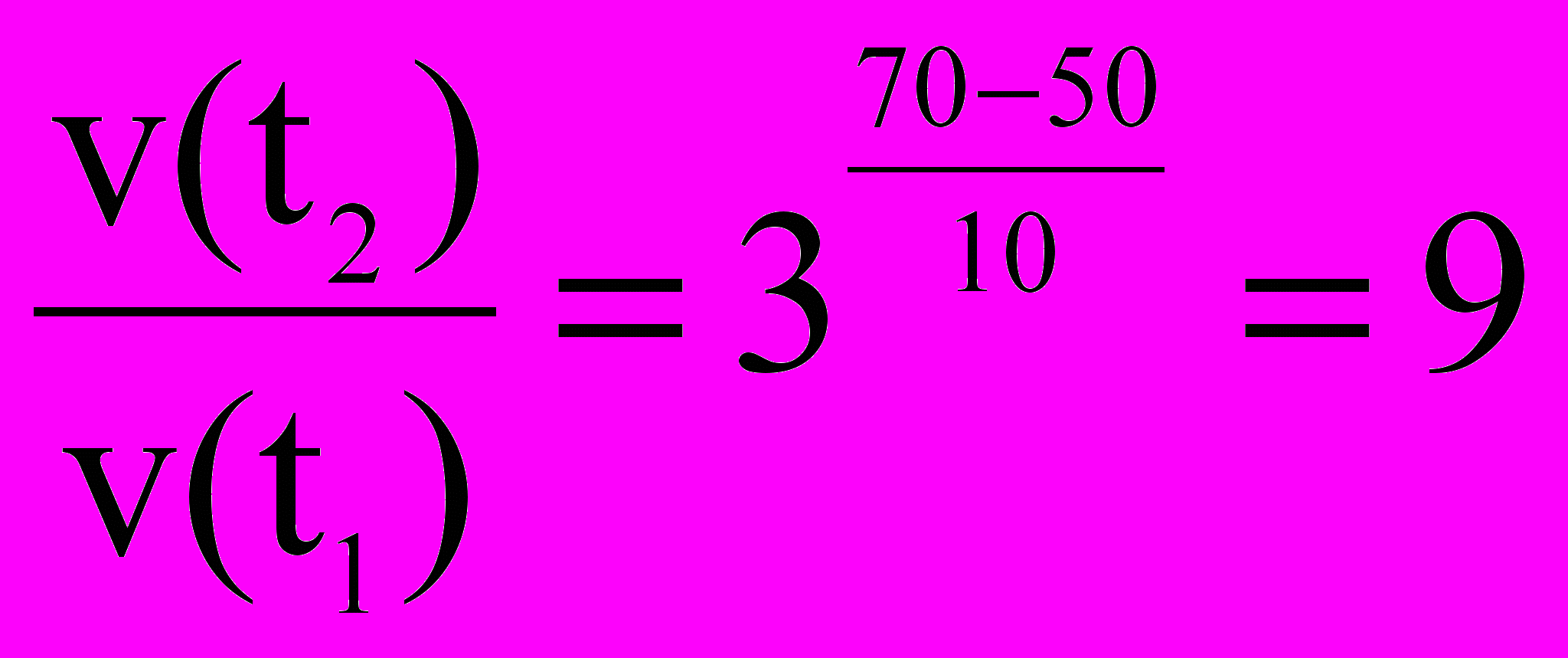 , следовательно, скорость реакции увеличивается в 9 раз, и завершается за
, следовательно, скорость реакции увеличивается в 9 раз, и завершается за 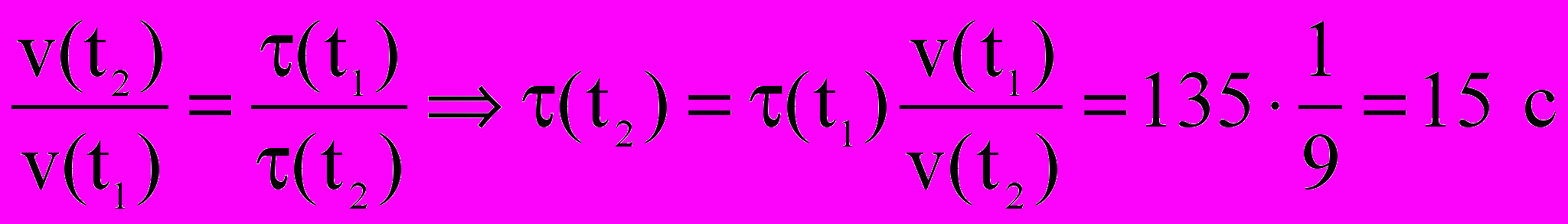 .
.Итог урока: на сегодняшнем уроке мы познакомились с понятием скорости химической реакции, с факторами, влияющими на скорость реакций, посмотрели химические реакции, протекающие с различными скоростями, научились решать задачи по теме.
Д
 омашнее задание: §13; вопросы и задания после параграфа.
омашнее задание: §13; вопросы и задания после параграфа.Урок окончен.
6. Контроль и учет знаний учащихся (компьютерное тестирование)
Предлагаем следующий вариант тестовых заданий.
1. Единицей измерения скорости реакции может быть:
а) моль/(
 ); б) моль/ч; в) г/(
); б) моль/ч; в) г/( ); г) м/(
); г) м/( ).
).2. Скорость химической реакции определяется уравнением:
а)
 ; б)
; б) 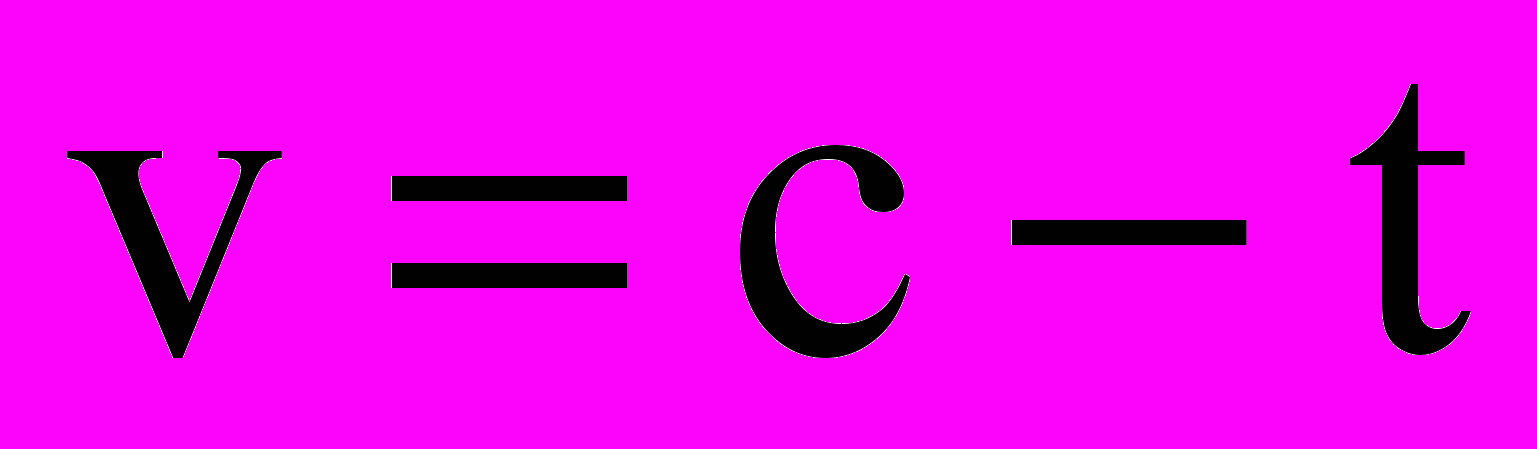 ; в)
; в) 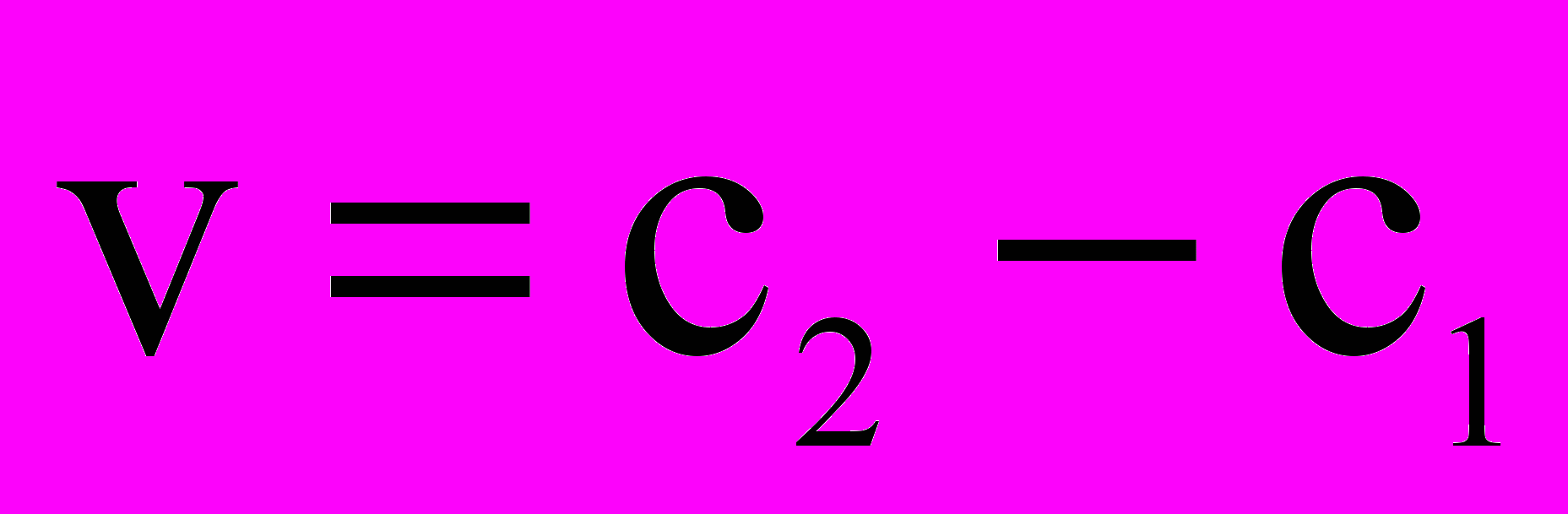 ; г)
; г)  .
.3. Скорость реакции повышается при нагревании и увеличении концентрации реагирующих веществ. Эти правила выполняются:
а) чаще всего; б) всегда; в) при повышении давления; г) при нормальных условиях.
4. Скорость гетерогенной химической реакции при увеличении поверхности реагирующих веществ:
а) не изменяется; б) незначительно изменяется; в) возрастает; г) снижается.
5. При одновременном повышении температуры на 10 0С и уменьшении концентрации одного из веществ в три раза скорость гомогенной реакции, вероятнее всего:
а) вначале возрастает, затем уменьшается; б) возрастает; в) уменьшается; г) не изменится.
6. В каком ряду химические знаки расположены в порядке снижения скорости реакций этих веществ с соляной кислотой?
а) Na, Mg, Zn, Fe, Cu; б) Mg, Na, Fe, Zn, Cu;
в) Na, Mg, Fe, Cu, Zn; г) Mg, Na, Zn, Cu, Fe.
7. Какие два вещества будут реагировать между собой с большей скоростью при прочих равных условиях?
а) Zn и H2SO4; б) H2SO4 и Mg; в) H2SO4 и Fe; г) Pb и H2SO4.
8. Вычислите среднюю скорость химической реакции А + В = 2С, если начальная концентрация А = 0,25 моль/л, а через 20 секунд – 0,10 моль/л:
а) 0,30; б)
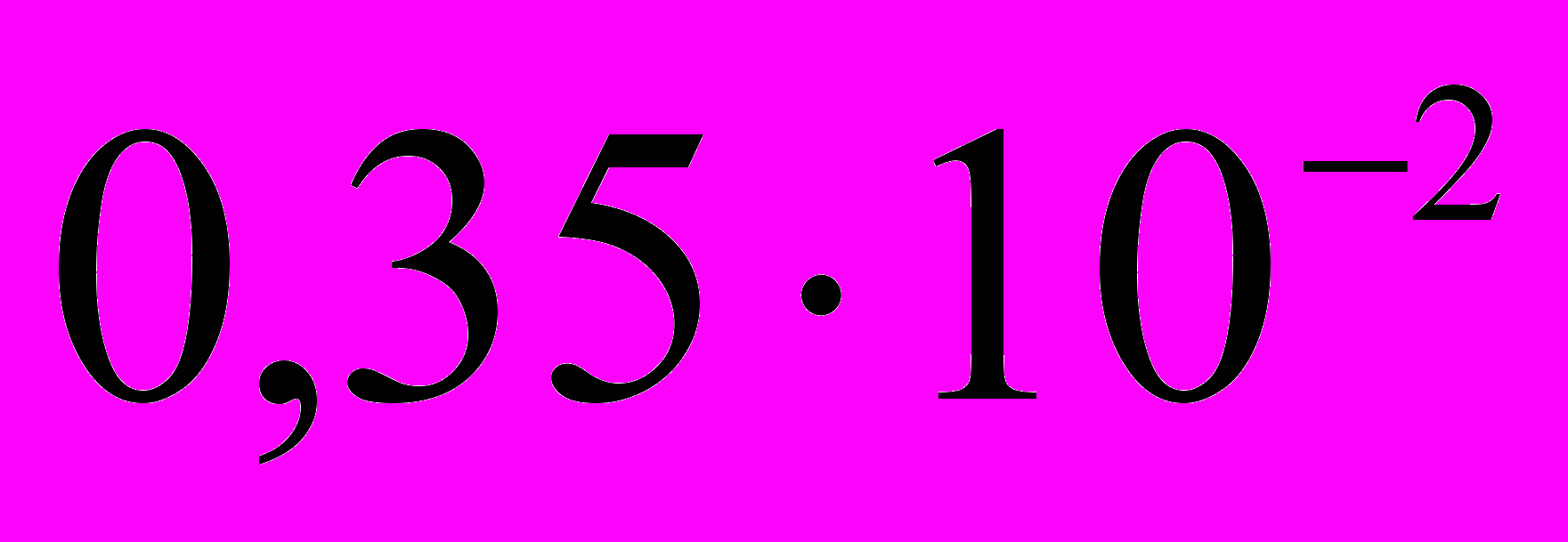 ; в)
; в) 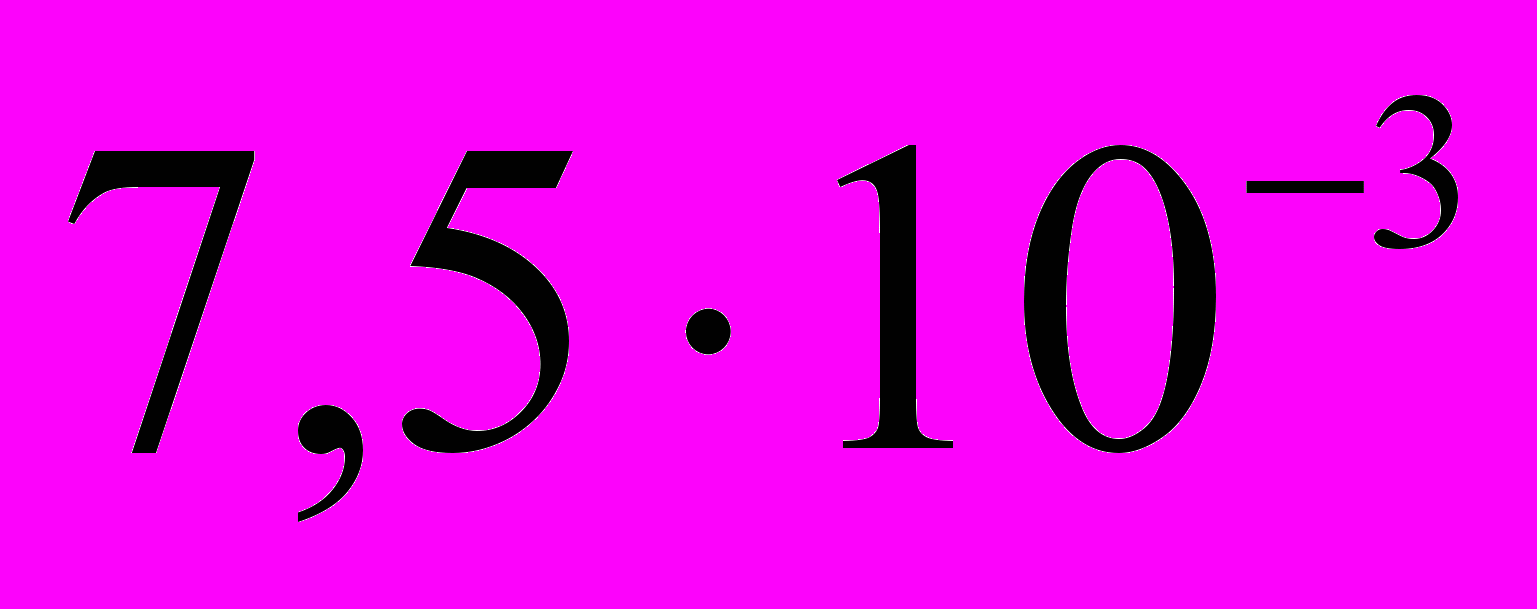 ; г) 0,15.
; г) 0,15.9. При 60 0С скорость реакции равна 2 моль/(
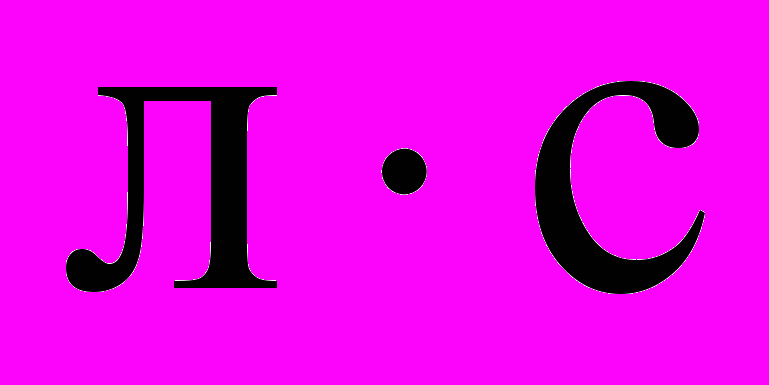 ). Вычислите скорость этой реакции при 20 0С, если температурный коэффициент равен 2:
). Вычислите скорость этой реакции при 20 0С, если температурный коэффициент равен 2:а) 0,125; б) 0,120; в) 0,040; г) 1,00.
10. Скорость реальных процессов и реакций зависит от совокупности воздействия нескольких факторов. Сделайте предположение, где будет быстрее корродировать (ржаветь) железо:
а) в квартире; б) в пустыне; в) в джунглях; г) на солнечной поверхности Луны; д) на вершине Эвереста; е) в Антарктиде.
11. Температурный коэффициент реакции равен 3. Начальная скорость реакции равна 4 моль/(
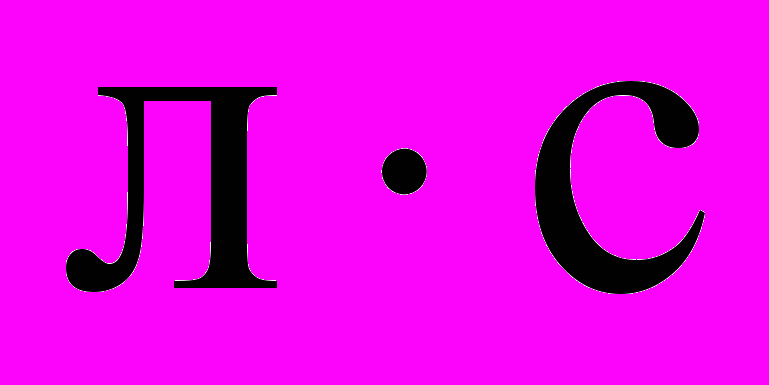 ). Какова будет скорость этой реакции при повышении температуры на 40 0С?
). Какова будет скорость этой реакции при повышении температуры на 40 0С?а) 120; б) 480; в) 240; г) 324.
12. Гомогенная реакция с участием газов отвечает уравнению А + 2В = С. Как увеличится ее скорость, если концентрация вещества В увеличить в два раза; давление увеличить в три раза?
а) в 4 и 9 раз; б) в 4 и 27 раз; в) в 3 и 18 раз; г) в 8 и 9 раз.
13. Как изменится скорость реакции между азотом и водородом, если вначале увеличить давление, а затем повысить температуру?
а) вначале возрастет, затем уменьшится; б) возрастет; в) уменьшится; г) вначале уменьшится, затем возрастет.
14. Известно, что скорость гетерогенной реакции зависит от поверхности реагирующих веществ. Как изменится объем выделившегося ацетилена, если кусочек карбида кальция массой 10 г разбить на 100 частей?
а) возрастет примерно в 10 раз; б) возрастет примерно в 100 раз;
в) не изменится; г) увеличится примерно в 1000 раз.
15. Катализатор – вещество, которое:
а) увеличивает скорость реакции; б) изменяет скорость реакции, формально не участвуя в ней; в) вначале увеличивает скорость химической реакции, затем уменьшает ее; г) замедляет скорость реакции.
16. Катализаторы изменяют скорость химических реакций в связи с тем, что изменяется:
а
 ) температура; б) концентрация веществ;
) температура; б) концентрация веществ; в) число столкновений молекул; г) другая причина.
17. Гомогенная реакция с участием газообразных веществ описывается уравнением 2А + Б
 2С + Q. В какую сторону сместится равновесие, если давление повысить; температуру повысить?
2С + Q. В какую сторону сместится равновесие, если давление повысить; температуру повысить?а) вправо, влево; б) вправо, вправо; в) влево, вправо; г) влево, влево.
18. В какую сторону сместится равновесие в реакции
2Атв + Бж
 2Сг + Дж + Q, если давление повысить; температуру понизить?
2Сг + Дж + Q, если давление повысить; температуру понизить?а) влево, влево; б) влево, вправо; в) вправо, влево; г) вправо, вправо.
19. Как влияют катализаторы на смещение химического равновесия?
а) влияют, но слабо; б) увеличивают выход продукта; в) не влияют;
г) положительные катализаторы смещают равновесие вправо, а ингибиторы влево.
20. Дополнительная энергия, которую необходимо передать реагирующим частицам для того, чтобы между ними началось химическое взаимодействие:
а) термический эффект; б) теплота реакции; в) энергия связи; г) энергия активации.
21. При повышении давления в 2 раза скорость химической реакции
2SO2(г.) + O2(г.)
 2SO3(г.) увеличится:
2SO3(г.) увеличится:а) в 2 раза; б) в 4 раза; в) в 6 раз; г) в 8 раз.
22. При повышении температуры на 20 0С скорость реакции увеличилась в 16 раз, следовательно температурный коэффициент реакции равен:
а) 2; б) 4; в) 8; г) 32.
23. При понижении давления в 3 раза скорость реакции
N2(г.) + 3H2(г.)
 2NH3(г.) уменьшится:
2NH3(г.) уменьшится:а) в 3 раза; б) в 9 раз; в) в 27 раз; г) в 81 раз.
24. Скорость газовой реакции А + 3В
 АВ3 увеличится в 1000 раз при увеличении концентрации вещества В:
АВ3 увеличится в 1000 раз при увеличении концентрации вещества В:а) в 5 раз; б) в 10 раз; в) в 15 раз; г) в 20 раз.
25. При увеличении давления в 5 раз скорость газовой реакции
А + 3В
 АВ3 увеличится в:
АВ3 увеличится в:а) в 225 раз; б) в 525 раз; в) в 625 раз; г) 1025 раз.
26. Участки катализатора на которых осуществляется химическая реакция это:
а) активные центры; б) ингибиторы; в) ферменты; г) активированный комплекс.
27. Гетерогенный катализ это каталитический процесс, осуществляемый в системе представленной:
а) одной фазой; б) двумя фазами; в) тремя фазами; г) двумя и более фазами.
28. Исходная концентрация одного из реагентов составляет 1 моль/л. Через 4 секунды от начала реакции она составила 0,6 моль/л. Скорость этой реакции:
а) 0,1 моль/
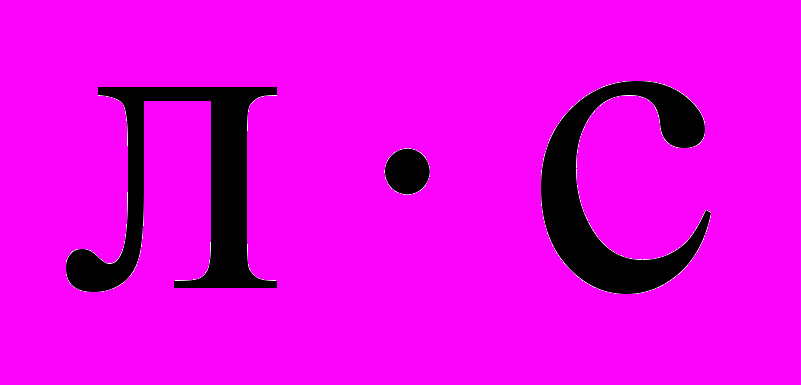 ; б) 0,2 моль/
; б) 0,2 моль/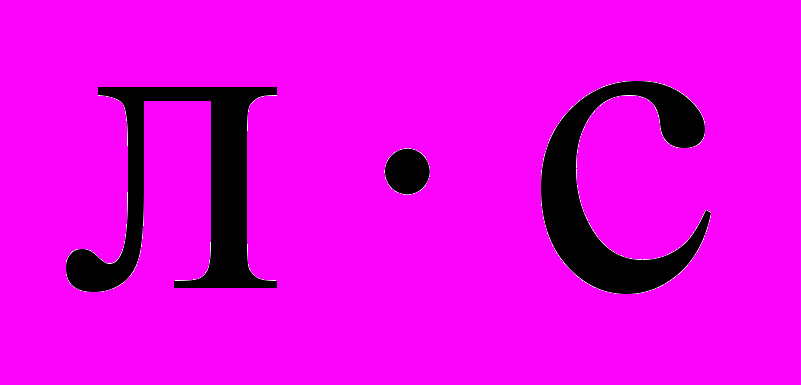 ; в) 0,3 моль/
; в) 0,3 моль/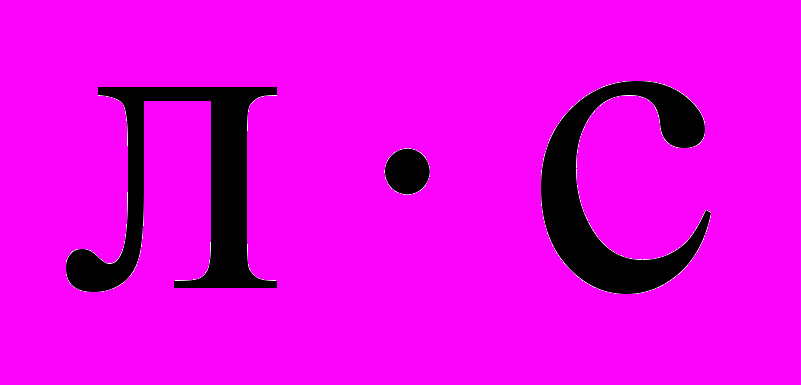 ; г) 0,4 моль/
; г) 0,4 моль/ .
.29. Реакция при температуре 500С протекает за 2 мин. За сколько времени закончится данная реакция при температуре 700С, если γ=3?
а) 15 с; б) 30 с; в) 45 с; г) 60 с.
30. Во сколько раз увеличится скорость реакции при повышении температуры с 30 0С до 70 0С, если температурный коэффициент равен 2?
а) 16 раз; б) 32 раз; в) 15 раз; г) 64 раз.
ВОПРОСЫ И ЗАДАНИЯ
- Место темы в курсе химии.
- Значение темы в курсе химии.
- Основные понятия темы.
- Химический эксперимент и его методика.
- Основные методические приемы при изучении темы.
- Ответьте на вопросы тестового задания.
- Проведите анализ урока и текста лекции в целом и выскажите свои суждения по их содержанию.
- Проанализируйте и решите тестовые задания.
- Рассмотрите презентацию к уроку и выскажите свое мнение о ней.
