Рабочая программа дисциплины аналитическая химия Направление подготовки
| Вид материала | Рабочая программа |
Содержание1*. Отнесите катион к соответствующей аналитической группе. |
- Рабочая программа дисциплины (модуля) «Линейная алгебра и аналитическая геометрия», 275.82kb.
- Рабочая программа дисциплины (модуля) «математический анализ», 424.74kb.
- Рабочая программа дисциплины (модуля) «Уравнения математической физики», 266.58kb.
- Рабочая программа дисциплины «аналитическая химия» Направление подготовки: 020100 Химия, 633.63kb.
- Рабочая программа по дисциплине «Спектральные методы анализа» для специальности 020101, 175.88kb.
- Примерная программа наименование дисциплины «Неорганическая и аналитическая химия», 341.23kb.
- Примерная программа наименование дисциплины аналитическая химия рекомендуется для направления, 147.22kb.
- Программа дисциплины дпп. Ф. 04 Аналитическая химия цели и задачи дисциплины: Цель, 214.72kb.
- Рабочая программа дисциплины аналитическая химия и фхма направление ооп 240100 Химическая, 585.6kb.
- Рабочая программа дисциплины аналитическая химия и фхма направление ооп 240100 Химическая, 369.61kb.
Демонстрационный вариант контрольного теста № 1
1*. Отнесите катион к соответствующей аналитической группе.
| 1. Ni2+ 2. Cr3+ 3. Mn2+ 4. Ba2+ 5. Fe3+ 6. Co2+ | А. Первая группа Б. Вторая группа В. Третья группа Г. Четвертая группа Д. Пятая группа Е. Шестая группа |
2*. Отнесите анион к соответствующей аналитической группе.
| 1. Ацетат 2. Фосфат 3. Сульфит 4. Бромид 5. Карбонат | А. Первая группа Б. Вторая группа В. Третья группа |
3&. Медь (II) открывается реакцией с гексацианоферратом калия, уравнение которой: _______________________________________________________________________
4*. Установите соответствие между катионами и реактивами, используемыми для их обнаружения.
1. Ba2+ А. (NH4)2SO4
2. Ca2+ Б. K2Cr2O7
3. Sr2+ В. (NH4)2C2O4
Г. NaCl
Д. Ни один из указанных
5. Для обнаружения ионов алюминия в среде с pH = 5 необходимо подействовать
1. 8-оксихинолином
2. Концентрированной серной кислотой
3. Нитратом калия
4. Пероксидом водорода
5. Бихроматом калия
6. Какими способами можно повысить чувствительность аналитических реакций?
1. Увеличением концентрации путем выпаривания исследуемого раствора
2. Изменением температуры
3. Введением органических растворителей;
4. Изменением pH.
7*. Сравните недостатки двух систем анализа катионов.
| 1. Сероводородная система 2. Кислотно-основная система | А. Система разработана неполно Б. Применяются вредные для здоровья реагенты В. Длительность анализа Г. Используются дорогие реактивы |
8. Какими химическими свойствами обладают гидроксиды 6-й аналитической группы катионов?
1. Амфотерны, растворимы в избытке щелочи
2. Нерастворимы в избытке щелочи
3. Образуют растворимые аммиакаты
4. Растворимы в воде
9. Охарактеризуйте реакции обнаружения катионов серебра и ртути (I) с раствором иодида калия.
1. Образуются желтые осадки иодидов серебра и ртути (I) соответственно
2. Образуются красные осадки иодидов серебра и ртути (I) соответственно
3. Образуются зеленые осадки серебра и ртути (I) соответственно
4. Образуется желтый осадок иодида серебра и зеленый осадок иодида ртути (I)
10. Гидроксиды каких катионов 5-й аналитической группы быстро окисляются кислородом воздуха?
1. Марганца (II)
2. Железа (II)
3. Сурьмы (III)
4. Висмута (III)
11. Как можно объяснить аналитический эффект выпадения осадка при добавлении ацетона к гипсовой воде?
1. Ацетон взаимодействует с ионами кальция
2. Понижается растворимость сульфата кальция в присутствии неполярного растворителя, и он выпадает в осадок
3. Ацетон связывает сульфат-ионы с образованием малорастворимого соединения.
12. Как можно открыть анионы брома и иода при их совместном присутствии в растворе?
1. По появлению фиолетовой окраски, затем желтой
2. По появлению желтой окраски, а затем фиолетовой
3. По переходу фиолетовой окраски через красновато-бурую в лимонную
4. По переходу лимонной окраски в фиолетовую
13. Какой аналитический эффект наблюдается при обнаружении аниона фосфата нитратом серебра?
1. Выпадает белый осадок
2. Выпадает желтый осадок
3. Выпадает бурый осадок
4. Реакционная смесь окрашивается в желтый цвет
Демонстрационный вариант контрольного теста № 2
1. Что называется относительной ошибкой опыта?
1. Разность между практическим и теоретическим результатами анализа
2. Разность между теоретическим и практическим результатами анализа
3. Отношение абсолютной ошибки к практическому результату анализа, умноженному на 100%
4. Отношение абсолютной ошибки к теоретическому значению, умноженному на 100%
2. Какой объем осадителя рекомендуется брать для анализа?
1. Эквивалентный
2. Произвольно избыточный
3. Полуторократный избыток
4. Трехкратный избыток
3. С добавками какого из перечисленных реагентов следует вести промывание осадка сульфата бария?
1. Хлороводородной кислоты
2. Хлорида аммония
3. Серной кислоты
4. Без добавления других реагентов, промывание дистиллированной водой
4*. Установите соответствие между изображением лабораторной посуды и ее названием.
| 1 2 3 4 5 6 | 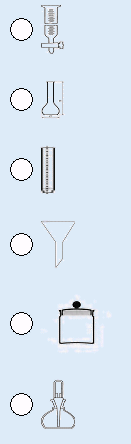 | А. Бюретка Б. Пипетка В. Воронка Г. Мерная колба Д. Капельница Е. Бюкс Ж. Эксикатор З. Мерный цилиндр |
5. Чем руководствуются при выборе индикатора?
1. Показателем титрования
2. Областью перехода окраски индикатора
3. Точкой эквивалентности
4. Совпадением показателя титрования индикатора с рН-областью скачка на кривой титрования
6. Молярная масса эквивалента фосфорной кислоты при титровании ее стандартным раствором NaOH с индикатором фенолфталеином равна:
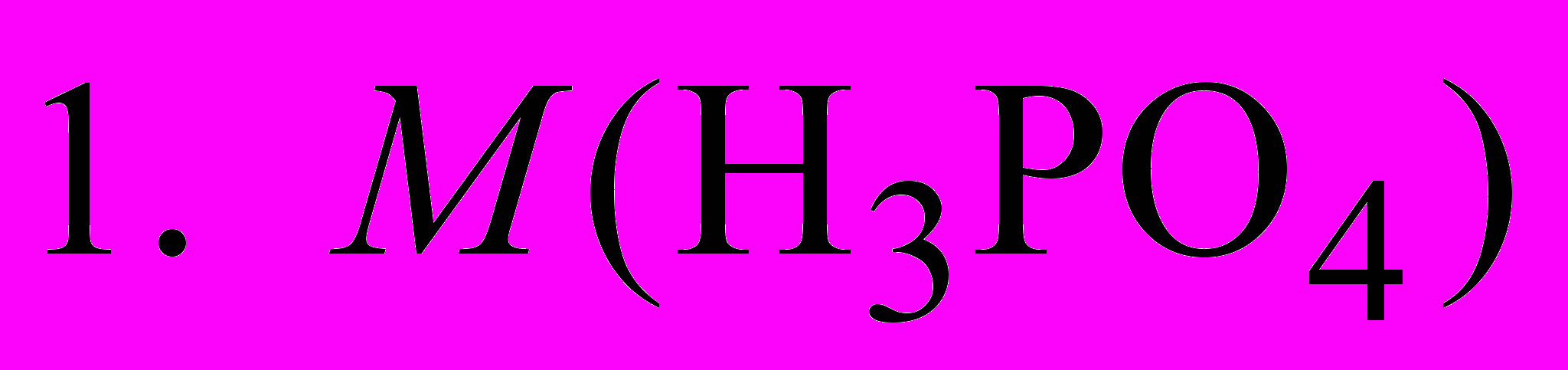

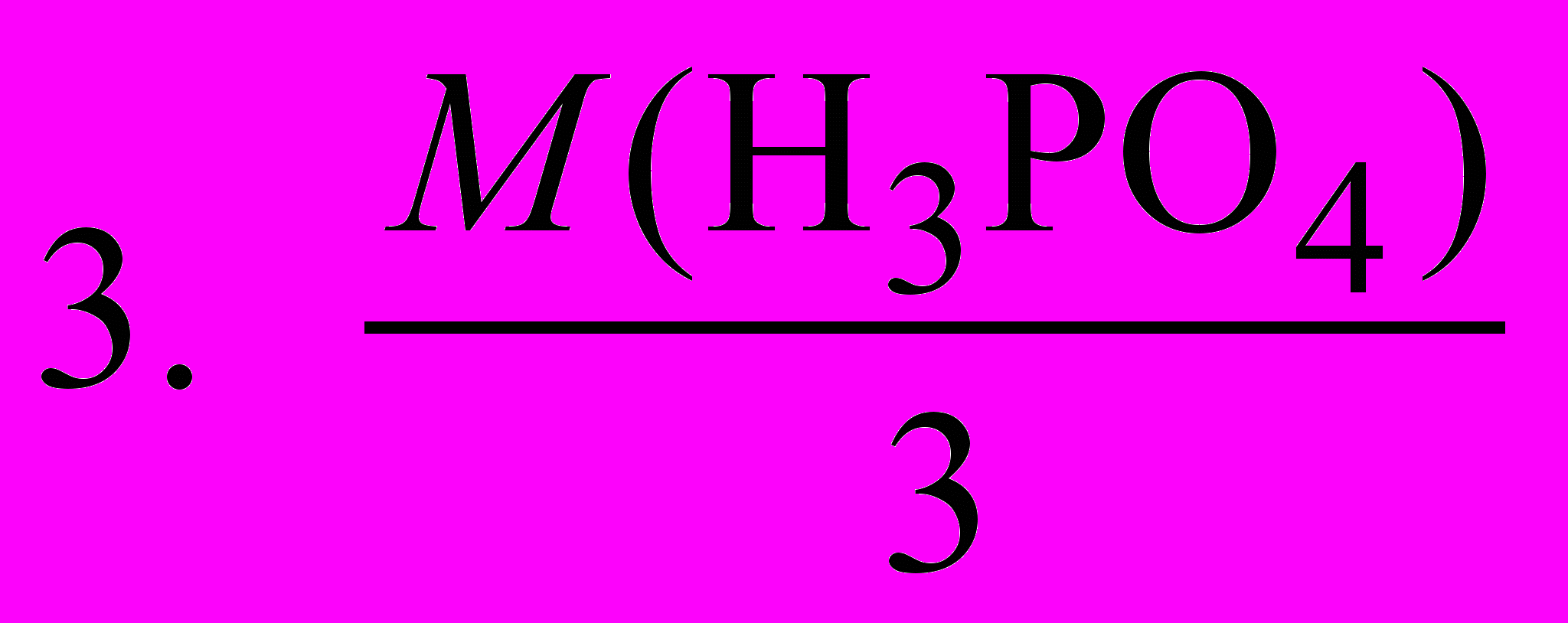
7. Безиндикаторным способом титрования является
1. Иодометрия
2. Аскорбинометрия
3. Перманганатометрия
4. Броматометрия
8. Пользуясь таблицей стандартных редокс-потенциалов, установите, какое из соединений не может окислить водород.
1. Тетратионат натрия
2. Йод
3. Оксид свинца (IV)
4. Сера
9. На чем основано фиксирование точки эквивалентности по способу Фольгарда?
1. На образовании ярко окрашенных комплексных соединений в точке эквивалентности
2. На дробном осаждении;
3. На образовании окрашенных соединений с адсорбционными индикаторами
10. Раздельное комплексонометрическое титрование ионов металлов
1. Возможно, если условные константы устойчивости комплексонатов различаются не меньше, чем в 107 раз
2. Возможно, если условные константы устойчивости комплексонатов различаются не меньше, чем в 104 раз
3. Невозможно
4. Возможно, если комплексонаты металлов имеют различную окраску
Демонстрационный вариант контрольного теста № 3
1*. Сопоставьте вид хроматографии и его характеристику.
| 1. Распределительная хроматография. 2. Ионообменная хроматография. 3. Осадочная хроматография. 4. Адсорбционно-комплексообразовательная. | | А. Основана на обратимом обмене ионов, содержащихся в растворе, на ионы, входящие в состав ионообменника. Б. Разделение веществ происходит вследствие образованная малорастворимых осадков в определенном порядке, который обусловливается их растворимостью. В. Основана на различиях в константах устойчивости соответствующих комплексных соединений, образующихся в колонке. Г. Разделение веществ происходит вследствие их различного распределения между двумя жидкими фазами, одна из которых неподвижна, а другая подвижна. |
2. От каких факторов зависит скорость перемещения и Rf в бумажной хроматографии? Выберите один, наиболее правильный и полный ответ.
1. От природы вещества.
2. От концентрации определяемого вещества и температуры.
3. От природы бумаги и метода проявления пятна.
4. От применяемого растворителя и давления его пара.
5. От природы вещества и состава применяемого растворителя.
3х. Подпишите названия компонентов хлорсеребряного электрода, обозначенные цифрами (рис. 8.2).

1. ______________________________________.
2. ______________________________________.
3. ______________________________________.
4. ______________________________________.
5. ______________________________________.
6. ______________________________________.
4. В каких координатах строится дифференциальная кривая при потенциометрическом титровании?
1. V/Е – V(титранта). 3. Е/V – V(титранта).
2. Е – V (титрования). 4. 2Е/V2 – V(титранта).
5. Какие параметры влияют на электрическую проводимость?
1. Природа электролита.
2. Концентрация ионов и их подвижность.
3. Температура.
4. Вязкость растворителя и его диэлектрическая проницаемость.
5. Кулонометр – это (выберите одно, наиболее правильное определение)...
1. Любая электролитическая ячейка.
2. Гальванический элемент.
3. Электролитическая ячейка, в которой со 100 %- выходом по току протекает электрохимическая реакция.
4. Гальванический элемент, в котором со 100 %- выходом по току протекает электрохимическая реакция известной стехиометрии.
5. Электролитическая ячейка, в которой со 100 %- выходом по току протекает электрохимическая реакция известной стехиометрии.
6. От каких факторов зависит потенциал полуволны?
1. рН.
2. Добавление веществ, способных к комплексообразованию с электроактивным ионом.
3. Природа растворителя.
4. Температура.
5. Природа фонового электролита.
6. Концентрация фонового электролита.
7. При количественном определении вещества методом прямой полярографии на полярограмме определяют...
1. Высоту волны. 3. Высоту полуволны.
2. Потенциал полуволны. 4. Потенциал начала восстановления.
8*. Найдите соответствие оптического метода и его характеристики.
1. Люминесцентный А. Основан на измерении показателей
анализ. светопреломления веществ.
2. Поляриметрический Б. Основан на испускании излучения
анализ. веществом под воздействием раз-
3. Эмиссионный спект- личных видов возбуждения.
ральный анализ. В. Основан на измерении интенсивно-
4. Атомно-абсорб- сти света, излучаемого веществом
ционный анализ. при его энергетическом возбуждении.
5. Рефрактометрический Г. Основан на измерении величины угла
анализ. вращения плоскости поляризации света
оптически активными веществами.
Д. Основан на измерении поглощения монохрома
тического излучения атомами определяемого
вещества в газовой фазе после атомизации
вещества.
9. В основе эмиссионного спектрального анализа лежит процесс...
1. Энергетический переход внутренних электронов в молекуле.
2. Энергетический переход внешних электронов в молекуле.
3. Переход внешних электронов в атоме с основного уровня на возбуждённый.
4. Переход внешних электронов в атоме с возбуждённого уровня на более низкий.
10*. Подберите к источникам света соответствующий спектральный диапазон.
1. Водородная лампа. А. 1,6 – 2,0 мкм.
2. Лампа накаливания. Б. 200 – 400 нм.
3. Штифт Нернста. В. 350 – 1000 нм.
4. Глобар-штифт. Г. 2 – 16 мкм.
11*. Какой из вариантов фотометрического метода следует выбрать, если главным требованием к анализу является:
1. Быстрота выполнения А. Метод градуировочного графика.
анализа. Б. Метод шкалы.
2. Высокая точность при В. Метод молярного коэффициента
оптимальном содер- поглощения.
жании компонента. Г. Метод добавок.
3. Учёт влияния фона. Д. Метод дифференциальной
4. Высокая точность при фотометрии.
интенсивной окраске
раствора.
12. Почему люминесцентный метод применим только для определения малых концентраций веществ?
1. При больших концентрациях люминесценция исчезает.
2. При больших концентрациях люминесценция слишком интенсивна и определение затруднительно.
3. При больших концентрациях нарушается пропорциональность между концентрацией и интенсивностью люминесценции.
4. При больших концентрациях наблюдается сдвиг спектральной кривой люминесценции в область более коротких волн.
Вопросы к коллоквиуму № 1
- Основные правила безопасности при работе в химических лабораториях.
- Техника безопасности при обращении со стеклянной посудой.
- Первая помощь при несчастных случаях в химической лаборатории.
- Определение плотности.
- Весы. Взвешивание. Весы точные. Весы аналитические. Аналитические электронные весы. Весы торзионные. Правила взвешивания и обращения с весами. Уход за весами.
- Химические реактивы, их виды и назначение. Хранение химических реактивов. Правила обращения с химическими реактивами.
- Химическая посуда. Стеклянная химическая посуда общего назначения. Пробирки и обращение с ними. Химические воронки. Химические стаканы. Колбы. Кристаллизаторы.
- Стеклянная посуда мерная. Мерные цилиндры . Мерные колбы. Бюретки. Пипетки.
- Стеклянная посуда специальная. Капельницы. Промывалка.
- Правила обращения со стеклянной химической посудой.
- Фарфоровая посуда.
- Пробки. Правила обращения с пробками.
- Железные штативы с набором держателей и колец. Треноги. Зажимы. Тигельные щипцы.
- Мытье и сушка химической посуды.
- Техника приготовления растворов. Хранение растворов.
- Ступки. Правила измельчения в ступке.
- Фильтрование. Назначение фильтрования, фильтровальные материалы и способы фильтрования.
- Спиртовка. Правила работы.
- Электрические нагревательные приборы (плитки, муфельные печи, сушильные шкафы). Правила работы.
Вопросы к коллоквиуму № 2
- Классификация методов физико-химического анализа
- Общая характеристика и классификация электрохимических методов.
- Электрохимическая цепь (ячейки). Индикаторный электрод и электрод сравнения. Чувствительность и селективность электрохимических методов.
- Электроды для потенциометрического анализа. Классификация электродов. Формулы для определения потенциала электродов.
- Потенциометрия. Теоретические основы метода. Схема установки для потенциометрических измерений. Методы потенциометрического измерения.
- Прямая потенциометрия и потенциометрическое титрование. Кривые потенциометрического титрования. Определение точки эквивалентности.
- Кондуктометрия. Принцип метода. Понятие электрического сопротивления, удельной и эквивалентной электропроводности. Основные количественные зависимости.
- Прямая кондуктометрия, кондуктометрическое титрование. Кривые титрования, способы обнаружения точки эквивалентности.
- Вольтамперометрия. Классификация вольтамперометрических методов. Теоретические основы и практическое применение вольтамперометрических методов.
- Амперометрическое титрование. Сущность метода. Практическое применение амперометрического титрования.
- Классическая полярография. Основные понятия, использование в физико-химическом анализе.
- Теоретические основы и классификация спектроскопических методов анализа
- Законы поглощения электромагнитного излучения и способы их выражения. Закон Бугера-Ламберта-Бера, его математическое выражение. Величины, характеризующие поглощение. Молярный коэффициент поглощения. Оптическая плотность. Оптимальный интервал измеряемых значений оптической плотности.
- Отклонения от законов поглощения, их причины. Понятие об истинном и кажущемся (среднем) молярном коэффициенте поглощения. Выбор условий измерения поглощения (, раствор сравнения) и построения градуировочного графика.
- Колориметрические методы анализа, классификация и принцип методов
- Фотоколориметрия. Сущность метода, схема устройства приборов, проведение фотоколориметрических определений.
- Спектрофотометрический метод анализа (спектрофотометрия). Сущность метода. Схема устройства прибора. Построение калибровочного графика. Способы определения концентраций веществ.
- Инфракрасная спектроскопия и спектроскопия комбинационного рассеяния
- Люминесцентная спектроскопия
- Хроматография. Основные принципы метода. Классификация хроматографических методов. Способы получения хроматограмм.
- Хроматографические параметры.
- Концепция теоретических тарелок, ее недостатки. Кинетическая теория хроматографии. Селективность и разрешение.
- Блок-схема хроматографа. Основные узлы хроматографа. Методы расчёта хроматограмм.
- Плоскостная хроматография (бумажная и тонкослойная). Основные количественные характеристики. Получение и анализ плоскостных хроматограмм. Использование плоскостной хроматографии в качественном и количественном анализе.
- Газовая хроматография.
- Жидкостная колончатая хроматография
- Нефелометрия и турбидиметрия. Рефрактометрический метод анализа.
- Поляриметрический метод анализа.
- Кинетические методы анализа
- Методы оптического анализа. Поляриметрический, атомно-эмиссионный анализ.
- Атомно-эмиссионный анализ.
- Атомно-абсорбционный анализ.
- Рентгеновская спектроскопия.
- Общие представления о масс-спектрометрическом методе анализа
- Радиоспектроскопические методы
Темы рефератов
- История развития качественного анализа.
- История развития химических методов анализа.
- История развития электрохимических методов анализа.
- История развития спектроскопических методов анализа.
- Химический анализ в металлургии.
- Химический анализ в фармацевтической промышленности.
- Химический анализ в косметологии.
- Химический анализ в охране окружающей среды.
- Химический анализ in suti.
- Химический наноанализ.
- Химический анализ и информационные технологии.
- Отбор проб твёрдых веществ.
- Отбор жидких проб.
- Отбор газообразных проб.
- Пробоотбор в экологическом контроле окружающей среды.
- Методы подготовки пробы к анализу.
- Анализ металлов и сплавов.
- Анализ геологических объектов.
- Анализ объектов окружающей среды.
- Анализ органических и биологических объектов.
- Анализ токсичных и радиоактивных веществ.
Темы минипроектов
- Определение содержания меди (II) и никеля (II) при их совместном присутствии спектрофотометрическим методом.
- Фототурбидиметрическое определение Сa2+.
- Определение константы диссоциации метилового оранжевого.
- Определение железа (III) и меди (II) при их совместном присутствии титриметрическим методом.
- Определение дихромата калия и перманаганата калия при их совместном присутствии тириметрическим методом.
- Определение дихромата калия и перманаганата калия при их совместном присутствии спектрофотометрическим методом.
- Определение галогенидов методом тонкослойной хроматографии.
- Идентификация смеси катионов или анионов.
- Определение кальция и магния при их совместном присутствии титриметрическим методом.
- Разделение и идентификация катионов методом радиальной хроматографии.
