О. П. Чернушич Предмет, задачи и особенности современного естествознания Естествознание это комплекс наук, изучающих явления и закон
| Вид материала | Закон |
СодержаниеСкорость многих реакций при нагревании на 10 Биологические концепции |
- Концепция современного естествознания Глава 1: Предмет естествознания, 397.47kb.
- Семинар естествознание как элемент целостной человеческой культуры, 133.59kb.
- Лекция 1 Предмет и структура естествознания Естествознание, 74.75kb.
- Гончарова Оксана Владимировна Кандидат биологических наук, доцент Концепции современного, 1123.43kb.
- Концепция Современного Естествознания, 690.55kb.
- Учебно-методический комплекс дисциплины концепции современного естествознания Специальность, 187.08kb.
- Учебно-методический комплекс по дисциплине Концепции современного естествознания Направления, 781.33kb.
- Камчатский государственный технический университет, 33.59kb.
- Учебно-методический комплекс Для студентов всех специальностей, кроме специальности, 519.51kb.
- Учебно-методический комплекс дисциплины концепции современного естествознания для студентов, 331.69kb.
Химия - это наука о составе, свойствах и взаимодействии различных веществ. Химия изучает свойства вещества, отвечающие за его способность вступать в реакции с другими веществами. Примерами химических реакций могут служить следующие процессы: скисание молока, ржавление металла, горение топлива.
Сегодня в химии существует несколько разделов, каждый из которых имеет свой предмет исследования. Это – неорганическая, органическая, физическая и аналитическая химия, а также эволюционная химия.
По-видимому термин «химия» впервые употребил греческий философ - естествоиспытатель Зосима Пенополитанский во второй половине IV века. Этим термином он обозначал процессы «настаивания», «наливания».
Развитие химических знаний происходило с древних времён. Уже первобытные люди овладели процессами дубления кож, приготовления пищи., изготовления строительных материалов. В средние века получила развитие алхимия. Алхимия – это особый этап развития химии, да и всей науки в целом. Алхимики посвящали свои исследования поиску путей превращения неблагородных металлов в золото. Считалось, что осуществить желаемый процесс можно с помощью философского камня. Уже потом появились задачи создания «эликсира жизни» и «эликсира молодости».
Химера легкого обогащения увлекла многих. Искать философский камень и придумывать способы искусственного приготовления золота принимались люди, принадлежащие к разным классам и сословиям и часто не имеющие научной подготовки. «Священное тайное искусство» становилось сферой деятельности шарлатанов. Эта ситуация и повлияла на негативную оценку вклада алхимии в развитие науки. Причем именно алхимики выработали прочные навыки химического эксперимента. Они подробно описали свойства некоторых веществ и открыли много новых, в том числе серную, азотную и соляную кислоты, царскую водку (смесь концентрированных азотной и соляной кислот), едкие щелочи, соединения ртути и серы, сурьму и фосфор. Они первыми наблюдали реакцию нейтрализации, изобрели порох и предложили способ производства фарфора из каолина. Алхимики ввели в обиход различную лабораторную посуду, водяную и песчаную бани, фильтры из ткани и шерсти. Без этих приспособлений не могло начаться развитие искусства химического эксперимента. Конечно, реальные достижения алхимиков блекнут на фоне бесконечного, бесплодного труда, затраченного на поиски философского камня и бесчисленных попыток приготовить «дармовое золото». Но игнорировать алхимию, говоря о возникновении первоначальных химических представлений, невозможно. Алхимия хронологически предшествовала химии нового времени и в конечном итоге стала ею. Но путь этот был длиною в тысячелетие. Во второй половине XVII века алхимики практически исчерпали себя.
Формирование химии как науки связано с Робертом Бойлем. Он отделил химию от ремесленных и медицинских целей, развил атомистические представления, объясняя самими частицами, их формой, расположением и движениями превращения веществ и их свойства. М.В.Ломоносов сумел объединить корпускулярные представления о строении веществ и кинетическую теорию теплоты. Он сформулировал закон сохранения вещества и движения. А.Лавуазье создает теорию химического элемента. Он же предпринимает первую попытку систематизировать химические элементы. Классификация Лавуазье основана на соединениях кислорода (кислоты, основания, соли, органические вещества). Постепенно учение о составе веществ стало частью науки, но до XIX века оно составляло всю химию. Развитие промышленности требовало от химии расширения сырьевой базы, понимания происходящих в химических реакциях процессов.
В 1793 году И.Рихтер показал, что химические элементы взаимодействуют в строго ограниченных количествах, сохраняющихся в виде пропорциональных чисел при переходе от одного сложного вещества к другому. Эта упорядоченность была названа Рихтером стехиометрией, т. е мерой элементов, входящих в состав химического вида. Сам закон Рихтера стали называть законом эквивалентов.
Французский химик Ж.Пруст установил закон постоянства состава. По этому закону любое химическое соединение обладает строго неизменным составом. Атомы прочно притягиваются в соединении, и этим соединение отличается от смесей. Всякое чистое соединение имеет неизменный состав и при этом не зависит от способа получения этого вещества. Закон Пруста теоретически обосновал Дж.Дальтон. Он развил атомистические представления, показав, что все вещества состоят из молекул, а молекулы – из атомов. Дальтон ввел обозначения атомов – составных частей молекул и отметил возможность обмена атомами в процессе реакции.
Так Дальтон пришел к закону кратных соотношений, который завершал учение о стехиометрии. Согласно этому закону, ученый полагал, что все атомы каждого отдельного элемента одинаковы и обладают определенным атомным весом. Поэтому химическое взаимодействие элементов сводится к соединению неизменных атомов в «сложные цепи». Поскольку абсолютное значение атомного веса нельзя установить, можно использовать относительный вес. Выбрав за единицу вес атома водорода, Дальтон составил первую таблицу атомных весов. Шведский химик Й.Берцелиус более точно определил атомные веса элементов. Берцелиус ввел и обозначения элементов по первым буквам греческого или латинского названия, которые используются и сейчас.
Эти три закона стехиометрии: эквивалентности, постоянства состава и кратных отношений, - стали фундаментом химии. Утверждение дискретности химической организации вещества стало ведущим представлением вплоть до создания квантовой химии.
Развитие молекулярной физики позволило иначе взглянуть на свойства вещества в простейшем агрегатном состоянии – газе. Появились газовые законы, которые связали параметры газов. Это законы Бойля – Мариотта, Гей – Люссака и Шарля. Д.Бернулли и М.В.Ломоносову удалось вывести соответствующие этим законам соотношения между макроскопическими параметрами газа (давление, объем, температура), исходя из идеи молекулярного строения вещества. В 1811 году итальянский ученый А.Авагадро установил, что при одинаковых условиях равные объемы газов содержат одинаковое число молекул. Это значит, что при одинаковых условиях грамм – молекула любого газа занимает одинаковый объем. При нормальных условиях этот объем равен 22.4 л, и в нем содержится
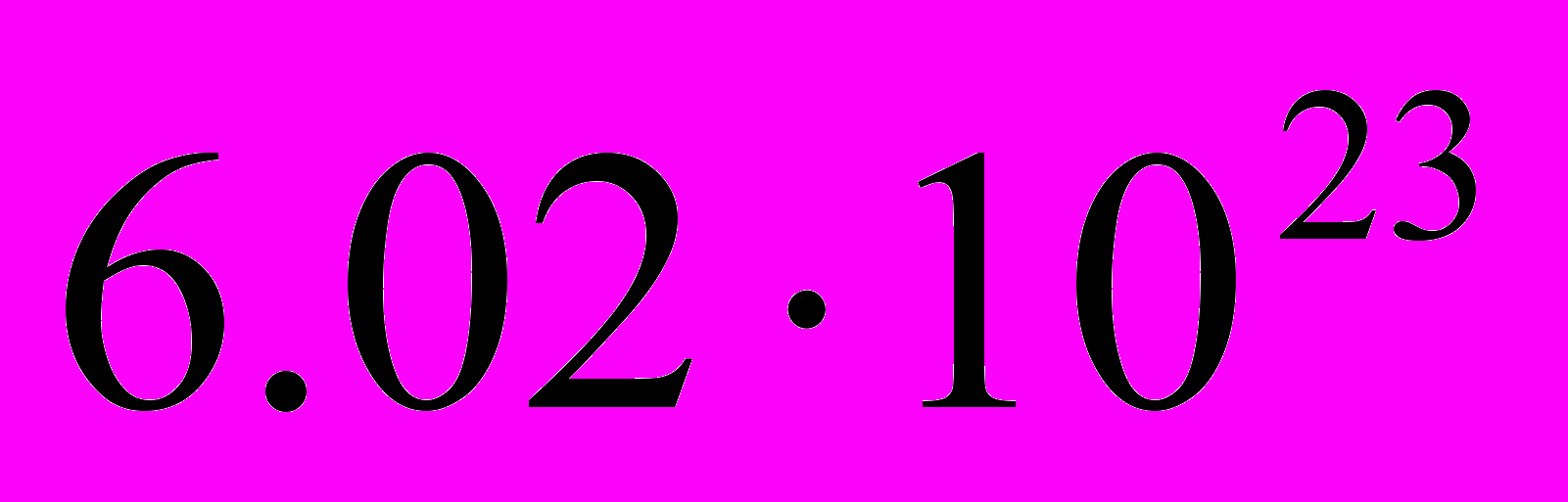 молекул газа. Это число получило название числа Авагадро. Молекулой называли наименьшую частичку вещества, сохраняющую его свойства. Но обнаруживались все более сложные молекулы, К ним стали относить полимеры, кристаллы, т.е. агрегаты. Поэтому проблема состава вещества оставалась актуальной.
молекул газа. Это число получило название числа Авагадро. Молекулой называли наименьшую частичку вещества, сохраняющую его свойства. Но обнаруживались все более сложные молекулы, К ним стали относить полимеры, кристаллы, т.е. агрегаты. Поэтому проблема состава вещества оставалась актуальной.В 1860 году в Карлсруэ (Германия) состоялся первый Международный конгресс химиков. На нем были установлены основные принципы, теории и законы химии, установлены единые понятия. Химия тесно связана с производством, поэтому ее основная задача – получение веществ с заданными свойствами. Реализация этой задачи требует осуществлять качественные превращения веществ, т.е. решать задачи происхождения свойств веществ. На первом этапе свойства веществ определялись элементным и молекулярным составом.
Учение о составе веществ сильно зависило от возможностей анализа. Поэтому понятие химического элемента изменялось с развитием методов исследования. Постепенно атомно-аналитическая концепция переросла в атомно-теоретическую. Если в XVII – XVIII веках в химии в основном господствовал случай, то на рубеже XIX – XX веков появились теории, которые включали в себя возможность прогнозирования. Сегодня химик обязан знать высшую математику. Современная химия опирается на мощный теоретический аппарат.
В середине XIX века из сопоставления периодичности химических свойств веществ и атомных весов элементов Д.И.Менделеев построил периодическую таблицу элементов. В то время было известно всего 62 химических элемента, но на основе установленной зависимости Менделееву удалось предсказать свойства еще не открытых элементов, и вскоре они были найдены. Уже в XIX веке периодический закон стал «фундаментом общей химии», упорядочил химические свойства, придал новое содержание проблеме соотношения состава и свойств.
После открытия атомного ядра стало понятно, что в периодической системе место элемента определяется не атомным весом, а зарядом ядра атомов. В 1897 году И.Ридберг заключил, что периодичность свойств элементов и их атомная масса определяются функцией порядковых номеров в таблице химических элементов. Поэтому понятие химического элемента связано с одинаковым зарядом ядра атомов. В эту совокупность включаются также изотопы. Изотопы – это разновидность атомов одного химического элемента, имеющие одинаковый заряд атомного ядра, но разную атомную массу. При химических превращениях любой атом сохраняет заряд атомного ядра, т.е. он остается атомом данного элемента. Сам же атом меняется, так как меняется его электронная оболочка, ответственная за химические свойства.
Только в 30-е годы XX была создана квантовая теория периодичности свойств элементов. В связи с пониманием природы химических связей как обменных взаимодействий валентных электронов четко было сформулировано понятие химического соединения. Химическое соединение – это качественно определенное вещество, состоящее из одного или нескольких химических элементов, атомы которых за счет химических связей объединены в частицы: молекулы, комплексы, агрегаты и др. Впоследствии были открыты макромолекулы полимеров, которые состоят из повторяющихся химически связанных структурных единиц и имеют большую молекулярную массу. Сложно организованной единицей являются молекулярные ассоциаты. Более крупная единица, состоящая из атомов и молекулярных блоков, называется молекулярным агрегатом. При образовании молекулярных агрегатов изменяется фазовое состояние вещества.
Из учения о составе развилась аналитическая химия.
Для описания свойств одного изолированного атома в химии было введено понятие валентности. Валентность постепенно стала отражать свойства связанного атома, т.е. атома, находящегося в молекуле и тем самым изменившего свои свойства под действием других атомов. В 1857 году немецкий химик Ф.Кекуле приходит к выводу, что некоторые элементы могут замещать в ряде соединений три атома водорода, а другие – только два или один. Кекуле вводит понятии химического сродства, означающее число атомов водорода, которое может заменить данный элемент. Число единиц сродства ученый и назвал валентностью. Ф.Кекуле и А.Купер создают теорию, согласно которой молекула представлялась целостным образованием, которое складывается из атомов за счет полного взаимного насыщения единиц сродства.
А.М.Бутлеров обращает внимание на энергетическую неравноценность разных химических связей. Он создает теорию химического строения вещества. В работах Бутлерова появляется новая характеристика - непрерывность изменения химической связи. Под химической связью стали понимать такой вид взаимодействия атомов, который обусловлен совместным использованием их электронов. Существуют разные виды химической связи – ковалентная (полярная и неполярная), ионная, металлическая, водородная.
Теория Бутлерова называется теорией химического строения потому, что выдвинула на первый план представления о химической связи и химической энергии, за счет которой происходит объединение атомов в молекулы. В конце XIX века поняли, что валентность – это число химических связей, осуществляемых атомом при образовании химических соединений. Валентность стала структурной характеристикой связанного атома.
Теория Бутлерова дала резкий толчок для развития органического синтеза. Были синтезированы многие лекарства, красители, взрывчатые вещества. Но в производстве по-прежнему использовалось дорогое органическое сырье, пути получения многих необходимых веществ не были понятны. Теория Бутлерова ввела в понятие структуры энергетическую прочность химических связей. В результате понятии свойств веществ расчленилось на два понятия: химических свойств макроскопического тела и реакционной способности отдельных структурных элементов, всей молекулы и всего вещества как совокупности молекул. Свойства вещества оказались зависящими не только от состава, но и от структуры молекул.
На основе учения о валентности была разработана теория строения молекул. Под молекулярной структурой понимают сочетание определенного числа атомов, расположенных в пространстве определенным образом и связанных друг с другом посредством химической связи. В середине 1870 –х годов стало возможным учесть сорасположение атомов в молекуле, поскольку были открыты изомеры. В 1874 году Я.Вант-Гофф и Ж.Ле Бель независимо друг от друга выдвинули стройную концепцию, получившую название стереохимия. Стереохимия – это синтез представлений о химическом строении и пространственном расположении атомов в молекулах.
Сразу же после открытия электрона стали предприниматься попытки связать его с природой химической связи. Немецкий физик Й.Штарк вводит понятие валентных электронов, связав валентность элемента с числом электронов на периферии атома.
В работах Ф.Лондона и В.Гайтлера были заложены основы квантовой химии. Они не считают электрон вращающимся по на определенной орбите, а говорят об электронном облаке, и вероятность нахождения электрона в какой-то области определяют как квадрат волновой функции. В 30-е годы американский физик и химик Л.Полинг усовершенствовал метод атомных орбиталей, применив его для расчета достаточно сложных молекул. Метод молекулярных орбиталей стал широко использоваться после появления быстродействующих ЭВМ.
В XX-XXI веках в химии был сделан существенный прорыв. Это прежде всего связано с появлением новых методов исследования (рентгеноструктурный анализ, спектральный анализ, дифракция медленных электронов и др.) и применением быстродействующих ЭВМ для обработки данных.
После создания учений о составе и структуре химических веществ, было создано учение о закономерностях химических процессов. Учение о закономерностях химических процессов представляет собой исследование внутренних механизмов и условий протекания химических процессов, таких, как температура, давление, скорость протекания реакций и некоторые другие. Все эти факторы оказывают существенное влияние на характер процессов и объем получаемых веществ, что имеет первостепенное значение для массового производства.
В 60-е годы XX века начинает развиваться эволюционная химия, которая формируется до сих пор. Эволюционный этап развития химии связан с синтезом новых, сложных, высокоорганизованных соединений без участия человека. Необходимость решать эволюционные задачи возникла у химиков по ряду причин. Во-первых, это мечта овладеть опытом «лаборатории живого организма», во-вторых, это попытки ввести в химию идею истории, чтобы объяснить самопроизвольное восхождение от низших химических материальных систем к высшим. И, в третьих, это появление работ, указывающих на установление экспериментальным путем фактов прогрессивной эволюции химических объектов через естественный отбор.
С появлением эволюционной химии тесно связана теория эволюционного катализа А.П.Руденко. Самосовершенствование катализаторов в реакциях было открыто в работах А.Гуотми и Р.Каннингема. Обычно катализаторы в ходе реакции стареют и их деятельность ослабевает, а здесь они перестраиваются в сторону повышения активности и селективности. По Руденко саморазвитие систем происходит за счет постоянного поглощения катализатором потока энергии, выделяющейся в ходе реакции. Таким образом, система является открытой, в ходе реакции происходит отбор каталитических центров с наибольшей активностью.
Наиболее ярким примером возникновения самоорганизации в химических системах является реакция Белоусова-Жаботинского – реакция образования структуры в жидкости.
Таким образом, при своем развитии химия прошла через четыре уровня. Это учение о составе, структурная химия, учение о закономерностях химических процессов и эволюционная химия.
К задачам химии относят не только получение веществ с заданными свойствами, но и возможности влиять на скорости получения этих веществ.
Скорости химических реакций изучает химическая кинетика. Более того, химическая кинетика дает ключ к управлению реакций. Одна из основных задач химической кинетики – управление скоростью химической реакции. Полезные реакции нужно заставить идти быстрее, а вредные – замедлить. Для этого нужно знать, какие факторы влияют на их скорость.
На скорость химических реакций существенное влияние оказывают концентрации реагирующих веществ, температура и наличие катализатора. Катализаторы изменяют скорость реакции, направляя ее по другому, энергетически более выгодному пути, но сами в процессе не расходуются.
Теория столкновений помогает понять, как влияет концентрация на скорость элементарных реакций. Для них эта зависимость выражается законом действующих масс: Скорость элементарной реакции пропорциональна произведению концентраций реагирующих молекул.
В зависимости от числа молекул, участвующих в элементарной реакции, закон действующих масс может иметь следующий вид:
V = k∙[X] – для мономолекулярных реакций;
V = k∙[X]∙[Y] – для бимолекулярных реакций;
V = k∙[X]∙[Y]∙[Z] - для тримолекулярных реакций.
Коэффициент пропорциональности k между скоростью и произведением концентраций называют константой скорости. Эта величина не зависит от концентраций, но на нее влияют температура и природа реагирующих веществ.
Сумму показателей степеней при концентрациях веществ называют общим порядком реакции. Показатели степеней при концентрациях в законе действующих масс равны единице только в случае элементарных реакций. Мономолекулярные реакции имеют первый порядок, бимолекулярные – второй, тримолекулярные – третий. Часто «докопаться» до элементарной стадии химических процессов очень непросто, и общий порядок реакции устанавливают экспериментально, определяя вид зависимости от концентрации реагента. Для порядок реакции, но это довольно сложная задача. процессов, механизм которых известен, можно математически рассчитать общий порядок, но это очень сложная задача.
В общем случае для сложных реакций тоже можно сформулировать закон действующих масс:
Скорость сложной реакции пропорциональна произведению концентраций реагирующих молекул, возведенных в некоторые степени.
Например, для реакции A + B → P V = k∙ [A]x∙[B]y. Показатели степени x и y, которые называют порядками по веществам А и В, в общем случае не связаны с коэффициентами в уравнении реакции. Эти числа могут быть положительными, отрицательными или дробными. Большое разнообразие порядков характерно для гетерогенных реакций.
Большинство химических и биохимических процессов с ростом температуры ускоряется. Так, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике. В странах с жарким тропическим климатом фрукты созревают раньше, а машины ржавеют быстрее, чем в северных широтах. Железо не реагирует с холодной концентрированной серной кислотой, но растворяется в горячей.
Этот эффект еще в XIX в. был описан с помощью эмпирического, т.е. выведенного опытным путем правила Вант-Гоффа:
Скорость многих реакций при нагревании на 10º увеличивается в 2-4 раза.
Так, при повышении температуры с 30º до 40ºС скорость гидролиза сахарозы в присутствии воды возрастает в 3.9 раза.
Математически правило Вант-Гоффа можно записать в виде степенной зависимости:
V(T2)/V(T1) = Υ(T2-T1)/10 ,
где Υ – температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при нагревании на 10ºС.
Однако правило Вант-Гоффа справедливо лишь при небольшом изменении температуры и далеко не для всех реакций. Гораздо более точно описывает температурные эффекты в химической кинетике уравнение Аррениуса для константы скорости:
K(T) = A∙ e-EA/RT,
Где A и EA – постоянные величины, которые не зависят от температуры и определяются только природой реагирующих веществ; R – универсальная газовая постоянная. Температура в уравнении Аррениуса измеряется по шкале Кельвина. Последний сомножитель e-EA/RT равен доле активных молекул, энергия которых больше некоторого порогового значения EA. Величину EA называют энергией активации. Доля молекул, имеющих энергию, большую, чем EA, быстро растет с увеличением температуры.
Энергию активации реакции можно определить экспериментальным путем, если измерить зависимость константы скорости (или самой скорости) от температуры.
В 1884 году французский физикохимик и металловед Анри Луи Ле Шатилье сформулировал общий принцип смещения химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Принцип Ле Шатилье прекрасно действует и в том случае, если в его формулировке опустить указание, что равновесная система должна быть химической.
Биологические концепции
Возникновение жизни на Земле и ее биосферы является одной из основных проблем современного естествознания. В настоящий момент наиболее детально рассматриваются три гипотезы:
