Л. А. Балыкова Официальные оппоненты
| Вид материала | Автореферат |
- Phodopus, 940.53kb.
- В педагогическом взаимодействии, 811.25kb.
- Прагматика языка туристической рекламы, 1403.92kb.
- А. В. Костров Официальные оппоненты, 251.97kb.
- Н. С. Русейкин Официальные оппоненты, 385.44kb.
- Модели регионализма и регионализации восточной азии, 1934.71kb.
- Влияние "кризиса трех лет" на познавательное развитие дошкольников, 773.28kb.
- Рецепция римского права: вопросы теории и истории, 249.57kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- М. Л. Макаров Официальные оппоненты: доктор филологических наук, профессор, 258.87kb.
На правах рукописи
ТУМАЕВА
Татьяна Станиславовна
ФАРМАКОЛОГИЧЕСКАЯ КОРРЕКЦИЯ ИШЕМИЧЕСКИ ОПОСРЕДОВАННЫХ ИЗМЕНЕНИЙ СЕРДЕЧНО-СОСУДИСТОЙ И ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМ У ДЕТЕЙ, РОЖДЕННЫХ ПУТЕМ КЕСАРЕВА СЕЧЕНИЯ
14.03.06.-Фармакология, клиническая фармакология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Саранск 2011
Работа выполнена на кафедре педиатрии Федерального Государственного
Бюджетного Образовательного учреждения высшего профессионального образования «Мордовский государственный университет им. Н. П. Огарёва»
| Научный руководитель: | доктор медицинских наук, профессор Л. А. Балыкова |
| Официальные оппоненты: | доктор медицинских наук, профессор А. В. Зорькина ФГБОУ ВПО «Мордовский государственный университет им. Н. П. Огарёва» (г. Саранск) академик Академии наук республики Татарстан, доктор медицинских наук, профессор Р. С. Гараев ГБОУ ВПО «Казанский государственный медицинский университет» (г. Казань) |
| Ведущая организация: | Учреждение Российской академии медицинских наук «НИИ фармакологии им. В.В. Закусова» РАМН (г. Москва) |
Защита состоится «16» декабря 2011 г. в 14.00 часов на заседании диссертационного совета Д 212.117.08 при ФГБОУ ВПО «МГУ им. Н. П. Огарёва» (430005, г. Саранск, ул. Большевистская, 68)
С диссертацией можно ознакомиться в научной библиотеке им. М. М. Бахтина ФГБОУ ВПО «МГУ им. Н. П. Огарёва» (430005, г. Саранск, ул. Большевистская, 68), с авторефератом – на сайте www.mrsu.ru МГУ им.
Н. П. Огарёва и направлен для размещения в сети интернет Министерства образования и науки РФ по адресу: referat_vak@mon.gov.ru.
Автореферат разослан «11» ноября 2011г.
Ученый секретарь ученого совета
кандидат медицинских наук, доцент А. Г. Голубев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. В рамках реализации приоритетного национального проекта «Здоровье» перинатальная охрана плода и новорожденного становится основой долговременной социальной политики государства, поскольку перинатальная патология во многом определяет структуру и уровень детской заболеваемости, инвалидности и смертности, формируя здоровье не только сегодняшнего, но и будущих поколений (Баранов А.А. и др., 2005; Володин Н.Н., 2006). Одним из способов быстрого и бережного окончания беременности и предупреждения последствий гипоксии традиционно является кесарево сечение (КС).
На протяжении последних 15-20 лет, как в зарубежных странах, так и в России частота кесарева сечения возросла в 3-4 раза (Суханова Л.П., 2006; Горбачева А.В., 2008; Ludwig H. et al., 2001). В последние годы значительно расширены показания к проведению КС не только со стороны плода, но и по желанию матери (Савельева Г.М. и др., 2005; Белокриницкая Т.Е., 2007; Caller P.W., 2000; Tully L. еt al., 2002). Однако, помимо несомненной пользы, оперативное родоразрешение может иметь и отрицательные последствия для матери и плода.
При абдоминальном родоразрешении на состояние новорожденного, кроме особенностей связанных с самим КС, оказывают влияние множество факторов, среди которых определяющее значение имеют тяжесть акушерской и экстрагенитальной патологии матери, степень доношенности и морфо-функциональной зрелости плода и условия его внутриутробного существования (Чернуха Е.А., 2007; Горбачева А.В., 2008; Холопова Е.А., 2009; Tully L. et al., 2002; Hillemanns P. еt al., 2003). Нефизиологично быстрый переход плода к внеутробной жизни, отсутствие воздействия на него необходимых механических и гуморальных факторов, токсическое действие анестетиков определяют особое состояние новорожденных после оперативного родоразрешения (Суханова Л.П., 2006; Georgeson G.D. et al., 2002).
Пристальное внимание неонатологов направлено на поддержание адекватного функционирования центральной нервной (ЦНС) и сердечно-сосудистой систем (ССС), как наиболее чувствительных к воздействию неблагоприятных факторов (в частности, гипоксии) и уязвимых в процессе адаптации (Кравченко В.П., 2009; Ипполитова Л.И. и др., 2010; Van den Berg A. et al., 2001). Поскольку выраженность функциональной дизадаптации во многом определяется тяжестью перинатальной гипоксии, несомненную перспективу представляет коррекция ее последствий с помощью препаратов антигипоксического, антиоксидантного типа действия (Карпов А.Л., 2006; Прахов А.В., 2008; Холопова Е.А., 2009; Шабалов Н.П., 2009; Digivesi V.et al., 2001).
Одним из наиболее эффективных препаратов антигипоксического, антиоксидантного действия является производное 3-оксипиридина – мексидол, нашедший широкое применение в кардиологии и неврологии (Голиков А.П. и др., 2004; Андреева Н.Н., Мухина И.В., 2005; Смирнов Л.Д., 2007; Petersen R.J., 2004). Кардиопротекторные свойства мексидола достаточно подробно изучены у детей с сахарным диабетом (Солдатов О.М. и др., 2008), с нарушениями ритма и проводимости (Балыкова Л.А. и др., 2001; Зайнутдинов Т.А., 2008), но до настоящего времени имеются лишь единичные работы по изучению эффективности данного лекарственного средства в неонатальной практике (Трегубова И.А., 2000; Petersen R.J., 2004). Антигипоксантом, имеющим богатый опыт использования в акушерстве и неонатологии, является актовегин (Громыко Г.Л., 2000; Макаров О.В. и др., 2003; Ажкамалов С.И. и др., 2003; Овчеренко Ю.А. и др., 2006; Коптырева Т.В., 2007). Однако, прямого сравнения кардио- и нейропротекторных свойств мексидола и актовегина у новорожденных с постгипоксической дизадаптацией, в частности рожденных оперативным путем, не проводилось.
Цель работы: Изучение эффективности антигипоксантов мексидола и актовегина в коррекции дизадаптационных расстройств центральной нервной и сердечно-сосудистой систем у детей, рожденных путем кесарева сечения, в раннем и отдаленном постнатальном периодах.
Задачи исследования: 1. Выявить особенности процессов ранней и отсроченной адаптации ЦНС и ССС у детей, рожденных путем кесарева сечения, в сравнении с детьми, рожденными естественным путем.
2. Оценить влияние мексидола в сравнении с актовегином и стандартной схемой лечения на динамику основных структурно-функциональных показателей сердечно-сосудистой системы у детей, рожденных путем кесарева сечения.
3. Оценить нейропротекторный эффект мексидола и актовегина у детей, рожденных оперативным путем.
Научная новизна. Впервые на большой группе новорожденных различного срока гестации проведено сравнительное исследование влияния оперативного родоразрешения на процессы ранней и поздней (в течение полугода) постнатальной адаптации ЦНС и ССС при стандартной терапии и дополнительном назначении антигипоксантов и цитопротекторов. Установлено, что кардиальные и неврологические изменения у детей, рожденных путем кесарева сечения, обусловлены, в основном, перенесенной перинатальной гипоксией, что подтверждается прямой зависимостью выявленных нарушений от степени церебральной ишемии. При этом спектр и тяжесть кардио-неврологической симптоматики у детей с церебральной ишемией, рожденных оперативным путем, более выражены по сравнению с новорожденными, перенесшими церебральную ишемию, но рожденными естественным путем, и регрессируют у большинства детей к полугоду. Однако, у 27-35% пациентов функциональные нарушения сердечно-сосудистой и центральной нервной систем сохраняются, несмотря на стандартную медикаментозную и немедикаментозную терапию.
Показано, что мексидол и актовегин способствуют более быстрому (в основном, к 3 месяцам) купированию клинико-инструментальных проявлений синдрома постгипоксической дизадаптации сердечно-сосудистой системы таких как признаки электрической нестабильности миокарда с развитием дизритмий, нарушение циркадной организации ритма сердца, систолической и диастолической дисфункции миокарда, длительного персистирования фетальных коммуникаций и транзиторной легочной гипертензии у детей, рожденных оперативным путем. Изученные препараты способствовали более динамичному регрессу проявлений перинатальной гипоксически-ишемической энцефалопатии в виде восстановления нарушенной гипоксией ауторегуляции церебральной гемодинамики с нормализацией резистентности сосудов, уменьшением выраженности ишемически-геморрагических расстройств, восстановлением темпов созревания биоэлектрической активности мозга и купированием судорожного синдрома. Мексидол в изученных дозах проявил большую по сравнению с актовегином эффективность в коррекции ишемически-опосредованных нарушений постнатальной адаптации у детей, рожденных оперативным путем.
Практическая значимость работы. Результаты проведенного клинико-инструментального исследования свидетельствуют о способности мексидола и актовегина корригировать ишемически-опосредованные расстройства функционирования ЦНС и ССС у детей, рожденных путем кесарева сечения. Применение препаратов способствовало сокращению сроков нормализации электрофизиологической активности головного мозга и церебрального кровотока, купированию судорожного синдрома, а также восстановлению автоматизма синусового узла, возбудимости, проводимости, сократимости миокарда, а также его релаксации, что имеет несомненную перспективу в предотвращении развития функциональных сердечно-сосудистых заболеваний в дальнейшем.
Основные положения, выносимые на защиту.
1. Ранний период адаптации детей, рожденных путем кесарева сечения, особенно недоношенных, характеризуется ишемически-гипоксическими расстройствами сердечно-сосудистой и центральной нервной систем, которые в отсутствии дополнительной терапии у большинства детей регрессируют к полугоду.
2. Дополнительное использование актовегина и мексидола у детей, рожденных путем кесарева сечения, способствует более быстрой (к 1-3 месяцам) нормализации объективного статуса, улучшению обменных процессов в миокарде, автоматизма синусового узла и внутрижелудочкового проведения, вегетативной регуляции сердечного ритма и его циркадной организации, а также уменьшению выраженности электрической нестабильности миокарда, восстановлению размеров полостей сердца и оптимизации его систолической и диастолической функции.
3. Мексидол и актовегин в изученных дозах в более ранние сроки стабилизируют показатели церебрального кровотока у детей, рожденных путем кесарева сечения, способствуют созреванию структур и нормализации биоэлектрической активности головного мозга, устраняют последствия его перинатального гипоксически-ишемического повреждения.
Апробация работы. Материалы, представленные в работе, докладывались и обсуждались на Всероссийской Конференции «Критические пороки сердца периода новорожденности» (Москва, 2005), на X, XI Конгрессах Российского Общества Холтеровского мониторирования и Неинвазивной электрофизиологии (Санкт-Петербург, 2009; В.Новгород, 2010), на VII,VIII, IX Всероссийских симпозиумах «Диагностика и лечение аритмий у детей» (Санкт-Петербург, 2006; 2008; 2010), на III, IV Конгрессах специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество» (Москва, 2008, 2009), на IV международном Европейском Конгрессе педиатров (Москва, 2009), на VIII Российском конгрессе «Современные технологии в педиатрии и детской хирургии» (Москва, 2009), на XIV межрегиональной научно-практической конференции «Актуальные вопросы диагностики, лечения и реабилитации больных» (Пенза, 2009), на VI Всероссийском Конгрессе «Детская кардиология» (Москва, 2010), на I Международном Конгрессе по перинатальной медицине (Москва, 2011), на VII Всероссийском семинаре «Детская кардиология в аспекте междисциплинарных связей» (Уфа, 2011г).
Публикации. По теме диссертации опубликовано 23 работы, в том числе 15 в рецензируемых изданиях, рекомендованных ВАК Минобрнауки РФ (из них 3 статьи).
Структура и объем работы. Диссертация изложена на 188 страницах компьютерного набора, документирована 33 таблицами и иллюстрирована 25 рисунками. Работа состоит из введения, обзора литературы (глава 1), описания материалов и методов исследования (глава 2), изложения собственных результатов (главы 3-4), заключения и библиографического указателя, включающего 290 источников, в том числе 181 отечественных и 109 иностранных.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клиническое исследование проведено с одобрения Локального этического комитета при Мордовском государственном университете им. Н.П. Огарева (протокол №53 от 30 июня 2011г.) на базе отделения функциональной и ультразвуковой диагностики ГУЗ ДРКБ №1 (г.Саранск) за период с 2007 по 2010гг. На первом этапе обследованы 100 детей, рожденных путем операции кесарева сечения и перенесших церебральную ишемию, в раннем неонатальном периоде. Из исследования исключались дети с органической патологией ССС (врожденные пороки сердца, кардиты, кардиомиопатии) и нервной системы (пороки развития, повреждения травматического, инфекционного генеза), а также дети с клинически значимой сопутствующей патологией (тяжелый респираторный дистресс-синдром; некротизирующий энтероколит, муковисцидоз, врожденный гипотиреоз, врожденный нефротический синдром; гастрошизис, атрезия пищевода, кишечная непроходимость и др.).
Группу сравнения составили 102 ребенка, рожденных естественным путем, сопоставимых по полу, массе, срокам гестации, спектру сопутствующей патологии. Критерием включения в группу сравнения являлось наличие перенесенной хронической внутриутробной гипоксии и/или острой асфиксии в родах, и/или выявление признаков церебральной ишемии. Контрольную группу составили 50 практически здоровых детей, рожденных от физиологичных беременности и родов.
После проведенного комплексного обследования, все дети, рожденные КС, были разделены на 3 группы, сопоставимые по степени недоношенности, половому составу, среднему весу при рождении и возрасту при поступлении в стационар. Различия касались степени перенесенной церебральной ишемии. Так в первой группе преобладали дети с легкой степенью ЦИ (количество детей с ЦИ I, II, и III степени составляло 50%, 34,4% и 15,6% соответственно), во второй - преобладали пациенты со среднетяжелой ЦИ (28%, 53,5 и 18,5% детей соответственно), а в третьей группе большинство составляли дети в тяжелом состоянии (24%, 36% и 40% соответственно). Пациенты первой группы получали общепринятую в неонатологии схему лечения ЦИ, включавшую пирацетам (Фармстандарт, Россия; ампулы по 5мл 20%р-ра, табл. по 200 мг). Тяжесть клинического состояния пациентов второй и третьей групп послужили основанием для дополнения стандартной схемы лечения препаратами актовегин (Nycomed, Австрия, ампулы по 2 мл, табл. по 200 мг) в дозе 0,2 мл/кг/сут в/в капельно в течение 10 дней с переходом на прием внутрь до месяца и мексидол (Фармасофт, Россия; ампулы по 2 мл 5% р-ра, табл. по 125 мг) в дозе 7,5 мг/кг/сут по аналогичной схеме.
Выбор мексидола обусловлен хорошо известными церебропротекторными и вазоактивными свойствами препарата, неоднократно доказанными у пациентов с ишемическим инсультом, вегето-сосудистой дистонией, черепно-мозговыми травмами, а также кардиоцитопротекторной активностью (Балыкова Л.А. и др., 2001; Голиков А.П. и др., 2004; Андреева Н.Н., Мухина И.В., 2005; Смирнов Л.Д., 2007; Аросланкина О.И., 2009; Petersen R.J., 2004). Актовегин выбран нами с учетом его известных антигипоксических свойств (Нордвик Б., 2002; Ажкамалов С.И. и др., 2003; Старчина Ю.А., 2010) и положительного опыта использования в акушерстве (Овчеренко Ю.А. и др., 2006; Коптырева Т.В., 2007). Эффективность исследуемых препаратов мы сравнивали с эффектом традиционного для неонатологии нейропротектора пирацетама (по 50-100мг/кг/сут в/в в течение 10 дней с переходом на прием внутрь до месяца).
В схему обследования входила оценка перинатального анамнеза, традиционное физикальное исследование, консультация кардиолога, невролога и инструментальное обследование ЦНС и ССС. Последнее включало оценку данных электрокардиограммы в 12 стандартных отведениях (электрокардиографы «Kens» (Япония) и «Schiller cardiovit» (Германия)). Структурные и гемодинамические особенности сердца и магистральных артерий изучались методом эхокардиографии (ЭХО-КГ) на ультразвуковых сканерах «Aloka-4000» и «TITAN» (Япония) мультичастотными датчиками в триплексном режиме. При интерпретации полученных данных учитывались нормативы для детского возраста (Белозеров Ю.М. и др., 1995). Систолическая функция сердца изучалась по конечно-систолическому и конечно-диастолическому диаметрам и объемам желудочков (по методу Teichgolz); фракции выброса (ФВ) левого желудочка. Диастолическая функция желудочков оценивалась по показателям максимальной скорости раннего диастолического наполнения желудочков (Е), скорости наполнения в фазу систолы предсердий (А), соотношению этих скоростей (Е/А). Выявлялось наличие функционирующих фетальных коммуникаций с оценкой их гемодинамической значимости, проводилось определение расчетного давления в легочной артерии.
Холтеровское мониторирование ЭКГ проводилось на аппаратно-программном комплексе «Миокард-12»(г.Саров, Россия) в течение суток с последующей оценкой средней ЧСС в период сна, бодрствования; минимальной, максимальной ЧСС, длительности пауз ритма, представленности и выраженности нарушений ритма и проводимости, ишемических изменений; определением циркадного индекса по рекомендациям Л.М.Макарова (2008).
Для оценки структур головного мозга проводилось динамическое комплексное УЗИ – нейросонография (НСГ) и допплерографическое исследование церебральных сосудов на приборах «Aloka-SSD-4000» и «TITAN» (Япония) мультичастотными датчиками в триплексном режиме по традиционной методике. При спектральной допплерографии оценивали индекс резистентности (RI), максимальную систолическую (Vs) и диастолическую (Vd) скорости кровотока по передней, средней и задней мозговым артериям, а также оценивалась полноценность оттока по вене Галена.
С целью оценки функционального состояния ЦНС проводилась электроэнцефалография (ЭЭГ) на компьютерном аппаратно-диагностическом комплексе «Нейрокартограф 4,52» (МБН, Москва). Использовали модифицированную международную схему с уменьшенным количеством электродов (Gibbs F., Gibbs E., 1950). Регистрацию осуществляли в монополярном отведении в состоянии естественного безмедикаментозного сна. Для оценки ЭЭГ-паттерна недоношенных детей в возрасте 24-40 недель от зачатия применялась классификация Эллингсона (1974); в возрасте 44-46 недель – классификация Строгановой Т.А. и соавторов (2005).
Статистическую обработку и исследование достоверности различия полученных результатов проводили методами «χ-квадрат», t- критерия и парного t-критерия Стьюдента при 5% уровне значимости с помощью пакета прикладных программ «Statistica». Корреляционный анализ проводился с использованием критерия Пирсона, в случае если обе выборки имели нормальное распределение и линейную зависимость. В противном случае использовался коэффициент ранговой корреляции Спирмена.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На предварительном этапе исследования при изучении перинатального анамнеза детей групп сравнения в среднем у каждого третьего пациента были выявлены отклонения. Спектр патологии был сопоставим с достоверным преобладанием у матерей детей основной группы хронической маточно-плацентарной недостаточности (ХМПН) и сочетанной экстрагенитальной патологии. Анализ показаний к КС выявил, что только в 19% проводились плановые оперативные роды у женщин с уже имевшимся рубцом на матке. В 20% показанием явилась начавшаяся острая асфиксия плода, в 49% - тяжелая хроническая внутриутробная гипоксия на фоне ХМПН, гестозов и т.д., и только 12% составили прочие причины (поперечное или тазовое положение плода, приступ почечной колики у матери и т.д.). Таким образом, у 2/3 детей основной группы констатировано наличие хронической внутриутробной гипоксии и/или острой асфиксии в родах, что позволило рассматривать их как угрожаемых по формированию перинатальной патологии.
Недоношенность I, II и III степеней выявлена у 10(10%), 28(28%) и 12(12%) детей основной группы и у 11(10,7%), 28(27,4%) и 13(12,7%) детей группы сравнения соответственно. Средний гестационный возраст детей составил 36,3±0,38 и 35,6±0,39 недель соответственно. Тяжесть состояния обследованных на этапе родильного дома и первых суток пребывания в стационаре была в первую очередь связана с перенесенной церебральной ишемией (ЦИ), диагноз и степень тяжести которой устанавливалась в соответствии с «Классификацией перинатальных поражений нервной системы у новорожденных» (2002), дыхательной недостаточностью различного генеза, а также гемо- и ликвородинамическими нарушениями. Комплексное обследование позволило диагностировать ЦИ Iст у 31%, IIст – у 44% и IIIст – у 25% детей, рожденных путем кесарева сечения. В группе сравнения выявляемость аналогичной патологии составила соответственно 33,5%, 43% и 23,5% случаев.
У детей, рожденных путем КС, достоверно чаще, чем в группе сравнения, выявлялось тахипноэ - у 53% против 36% соответственно (р≤0,05), синусовая тахи- или брадикардия - у 10% против 2% соответственно (р≤0,05), чаще выслушивался систолический шум - у 26% против 11,5% соответственно (р≤0,05). Спектр неврологической симптоматики в группах сравнения существенно не различался, но у детей, рожденных КС, синдром угнетения (как маркер более тяжелого поражения ЦНС) доминировал над синдромом гипервозбудимости - 59% против 33% (р≤0,05), тогда как в группе сравнения их представленность была сопоставима - 50% и 46%. Выраженность тахипноэ и синдрома угнетения у детей, рожденных КС, коррелировала со степенью перенесенной ЦИ (rs=0,894 р<0,001 и rs=0,964 р<0,001 соответственно).
Напряженное функционирование ЦНС и ССС у детей, рожденных КС, подтверждалось и результатами инструментальных методов обследования. По данным ЭКГ отмечалась высокая представленность в основной группе по отношению к двум другим группам ишемических ST-T нарушений (86% против 49% и 0% соответственно, р<0,01 и р<0,001), которые находились в прямой корреляционной зависимости от степени перенесенной ЦИ (r=0,908 р≤0,05). Показатель среднего суммарного значения отклонения амплитуды зубца Т (ПСО-Т) был достоверно выше в основной группе (3,3±0,61мм) по отношению к группе сравнения (2,2±0,68мм, p≤0,05). Представленность и выраженность более глубоких ишемических повреждений в виде отклонения сегмента ST от изолинии в сравниваемых группах достоверно не отличалась, но в обоих случаях была выше у детей с тяжелой церебральной ишемией относительно пациентов с легкой степенью церебральной ишемии (3,5±0,6мм и 3,1±0,9мм против 0,9±0,5мм и 0,5±0,3мм соответственно, р≤0,05).
Одинаково часто у детей групп сравнения относительно здоровых выявлялись ишемически опосредованные нарушения проводимости по правой ножке п.Гиса, выраженное отклонение электрической оси сердца вправо, замедление электрической систолы и нарушения ритма, которые тесно коррелировали со степенью перенесенной ЦИ (r=0,908, r=0,901, r=0,913, r=0,839 при р≤0,05 соответственно).
По данным суточного мониторирования ЭКГ у детей групп сравнения выявлено нарушение как базального уровня функционирования, так и адаптационных возможностей синусового узла. При этом у детей, рожденных путем КС, выявлен более низкий, относительно группы сравнения, уровень реактивности ритма сердца (максимальная ЧСС 204,4±3,91уд/мин в основной группе против 217,6±3,51уд/мин и 235,2±2,9уд/мин в двух других группах соответственно, р≤0,05) и более низкие значения циркадного индекса (1,13±0,01 в основной группе против 1,16±0,01 и 1,15±0,02 в двух других группах соответственно, р≤0,05) с ригидным циркадным профилем у 72% детей (из них 42(58%) составили дети с тяжелой и средне-тяжелой ЦИ), что свидетельствует о незрелости механизмов автономной регуляции ритма сердца. Дисфункция синусового узла и наджелудочковые аритмии чаще выявлялись у детей с ЦИ вне зависимости от способа родоразрешения (86% и 98%, из которых 40% и 44% составили новорожденные с тяжелой ЦИ соответственно) по сравнению со здоровыми (12%, p<0,01).
По результатам Эхо-КГ у детей групп сравнения, преимущественно перенесших церебральную ишемию II-III степени, с одинаковой частотой выявлены дилатация полостей сердца (33% и 27,4%) и снижение систолической функции ЛЖ (63% и 60% случаев соответственно), но нарушение диастолической функции желудочков, более чувствительной к гипоксии, чаще выявлялось в основной группе (60%) и в группе сравнения (44%) против здоровых детей (12%, р<0,01). Сочетанная диастолическая дисфункция обоих желудочков выявлена только у детей групп сравнения (26% и 14% соответственно), основную массу которых (76% и 70%) составили дети с тяжелой ЦИ.
Функционирование фетальных коммуникаций (Ефремов С.О. и др., 2005; Шарыкин А.С., 2009; Knight D.B., 2001; Wyllie J., 2003) выявлено у абсолютного большинства детей групп сравнения, но у детей, рожденных путем КС, отмечалась тенденция к более значительным размерам открытого артериального протока (ОАП) и межпредсердных сообщений (МПС) при сочетанном функционировании относительно двух других групп (2,5±0,11мм и 3,1±0,31мм в основной группе и 2,3±0,14мм, 2,6±0,26мм и 2,1±0,12мм, 2,3±0,13мм соответственно, р>0,05), поддерживаемые наличием неонатальной легочной гипертензии у 28% детей в основной группе, и только в 9% и 2% в двух других группах (р≤0,05).
По данным НСГ у детей групп сравнения, в отличие от здоровых, выявлялись без существенных различий изолированные ишемические и сочетанные ишемически-геморрагические нарушения, а также признаки незрелости структур мозга, которые преобладали среди недоношенных. При проведении допплерографии установлено существенное нарушение церебральной гемодинамики со снижением тонуса сосудов у 33,3-44% и развитием венозной дисфункции у 45-47% детей групп сравнения, преимущественно с церебральной ишемией II-III степени. Прогрессирование ЦИ на фоне истощения механизмов ауторегуляции мозгового кровотока способствовало развитию у 12-18% детей с тяжелой церебральной ишемией отека мозга, тогда как среди здоровых подобных нарушений не зарегистрировано.
Задержка формирования биоэлектрической активности головного мозга, патологические феномены и судорожный синдром по данным ЭЭГ были выявлены соответственно у 30-33%, 20-10% и 12-2% детей групп сравнения и не определялись у здоровых новорожденных. У детей, рожденных путем КС, выявлена прямая корреляция между развитием судорожного синдрома и тяжестью перенесенной ЦИ (r=0,841, р≤0,05).
Таким образом, оперативное родоразрешение не предупреждало в достаточной степени негативного действия на организм новорожденного перинатальной гипоксии и формирования структурно-функциональных повреждений ЦНС и ССС. Поскольку ишемически-опосредованные нарушения обусловлены не только изменениями в момент гипоксии, но и в постгипоксическом периоде (Макарова Е.А. и др., 2007; Шабалов Н.П., 2009; Blankenberg F.G. et al., 2000; Fenichel Gerald M., 2005), целесообразно использование антигипоксантов в коррекции функциональных дизадаптационных изменений у детей, рожденных оперативным путем. Поэтому на следующем этапе работы в наблюдательном исследовании нами изучена эффективность актовегина и мексидола в коррекции ишемически-опосредованных расстройств.
Регресс неврологической симптоматики на фоне проводимого лечения и естественных процессов созревания ЦНС наиболее эффективно происходил у детей, получавших антигипоксанты, особенно мексидол. Полная редукция синдрома угнетения и восстановление двигательной активности были достигнуты к 3 месяцам как при стандартной терапии, так и при лечении антигипоксантами, но наиболее динамично (с 80% до 0%, р≤0,05) этот процесс происходил у детей, принимавших дополнительно мексидол. К 3 месяцам судорожный синдром, отражающий тяжесть ишемического повреждения ЦНС, нивелировался при дополнении терапии актовегином и мексидолом, а вегетативно-висцеральные дисфункции исчезли только у детей, получавших мексидол, в то время как при стандартной терапии пирацетамом эти нарушения сохранялись на протяжении всего первого полугодия.
Параллельно оптимизации состояния ЦНС происходило и улучшение функционирования ССС. При исходно более тяжелом состоянии пациентов на фоне проводимой терапии актовегином и мексидолом уже к возрасту 1 месяц выявляемость приглушенности сердечных тонов и тахипноэ уменьшилась на 45,5-60,5% (р≤0,05). Представленность цианоза носогубного треугольника /акроцианоза уменьшилась до 18,5-20% к 1 месяцу при лечении актовегином и к 3 месяцам при лечении мексидолом (р≤0,05). В то же время, стандартное лечение к 1 месяцу приводило только к некоторому уменьшению регистрации цианоза носогубного треугольника/акроцианоза с 37,5% до 12,4% (р>0,05), несмотря на менее тяжелое исходное состояние. К 6 месяцам полный регресс всех кардиологических симптомов (за исключением систолического шума, обусловленного наличием фетальных коммуникаций) был достигнут только у пациентов, получавших актовегин и мексидол.
Процессы восстановления электрофизиологических параметров миокарда также более динамично происходили у детей, получавших терапию мексидолом (табл.1).
Таблица 1.
Динамика ишемических изменений у детей, рожденных оперативным путем, при различных вариантах фармакологической коррекции
| Показатель | до лечения | 1мес | 3мес | 6мес |
| ПСО-Т, мм: стандартная терапия + актовегин + мексидол ПСО-ST,мм: стандартная терапия + актовегин + мексидол | 2,64±0,25 2,82±0,43 3,7±0,69# 0,09±0,02 0,11±0,13 0,4±0,13 | 2,34±0,17 2,3±0,06 2,38±0,07* 0,06±0,03 0,08±0,4 0,2±0,3 | 2,09±0,3* 1,8±0,03* 1,76±0,08*# 0,04±0,01 0,05±0,07* 0,06±0,07* | 1,48±0,25* 1,1±0,17* 0,88±0,28*# 0,04±0,01 0,05±0,07* 0,06±0,07* |
В первую очередь это касалось ST-T нарушений, которые в третьей группе при максимально высокой исходной выявляемости (84%) полностью нивелировались к полугоду (рис. 1), в то время как при терапии пирацетамом и дополнительном использовании актовегина сохранялась и в 6 месяцев (р<0,01 и р<0,01). Амплитуда суммарного отклонения зубца Т (ПСО-Т) и сегмента ST (ПСО-ST) также более эффективно уменьшалась на фоне лечения мексидолом. Так существенные отличия ПСО-Т от исходного уровня были достигнуты уже к 1 месяцу, а к 3 и 6 месяцам динамика ПСО-Т на фоне лечения мексидолом значительно отличалась от двух других групп (p≤0,05).Выраженная динамика ПСО-ST отмечалась уже к 3 месяцам у детей, получавших актовегин и мексидол, в то время как на фоне терапии пирацетамом даже к полугоду значимых отличий от исхода не получено.
1 2 3 4 5 6
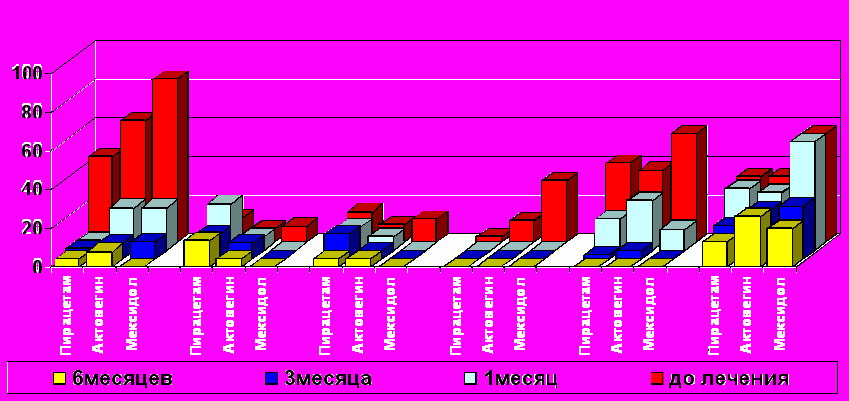
* *
* * *
#
#
* * *
* *
* * *
*
* * *
1 - ишемические нарушения; 2 - брадикардия; 3 - экстрасистолия; 4 - QTc>440мс; 5 - отклонение ЭОС>120°; 6 - нарушение в/желудочкового проведения
Р и с. 1. Динамика электрокардиографических показателей у детей, рожденных оперативным путем, при различных вариантах фармакотерапии.
Примечания: *- достоверность отличий от исходного уровня при р≤0,05; #- достоверность отличий от стандартной схемы при р≤0,05
Кардиопротекторный эффект мексидола уже к 1 месяцу проявлялся редукцией брадикардии, а также подавлением экстрасистолии (р≤0,05). В то же время, в двух других группах детей динамика этих сдвигов была замедлена и даже к полугоду существенных различий с исходом не имела.
Нормализация длительности интервала QTc во всех группах произошла к 1 месяцу, но наибольший эффект отмечен у детей, получавших дополнительное лечение мексидолом, где исходный уровень выявляемости замедления интервала QTc (>440мс) составил 36%, тогда как в двух других группах таких пациентов было лишь 9,4-21%. На фоне проводимой терапии во всех группах восстанавливалось положение электрической оси сердца, но у детей, получавших дополнительно мексидол, выраженное отклонение электрической оси вправо не регистрировалось к 3 месяцам, а в двух других группах – к полугоду. Улучшение проведения по правой ножке п.Гиса имело более медленную динамику и достоверные различия с исходным уровнем были достигнуты к 6 месяцам только у пациентов, получавших мексидол.
Суточное мониторирование ЭКГ позволило выявить нормализацию базового уровня функционирования синусового узла (по восстановлению уровня ЧСС во время сна, сокращению пауз ритма, эпизодов СА-блокады) и реактивности ритма (по восстановлению ЧСС в периоде бодрствования), что указывает на восстановление вегетативной регуляции ритма и цереброкардиальных взаимодействий к 6 месяцам у детей, получавших мексидол. При лечении мексидолом отмечалась нормализация циркадной регуляции ритма сердца и более значимое и динамичное уменьшение выраженности признаков электрической нестабильности миокарда. Так, продолжительность интервала QTc в полгода у детей, получавших мексидол, была заметно меньше соответствующего показателя детей на стандартном лечении (410,3±2,7мс против 431,1±2,8мс, р≤0,05). Данный эффект может быть обусловлен прямым вегетотропным действием мексидола и его антигипоксическим действием (Лукьянова Л.Д., 2000; Капелько В.И., 2003; Андреева Н.Н., Мухина И.В., 2005; Digivesi V. et al., 2001).
Продолжительность пауз ритма при лечении мексидолом уже к 1 месяцу уменьшилась по сравнению с исходом на 13% (798,1±51,1мс против 916,4±63,7мс, р≤0,05), а в других группах значимой динамики не отмечалось.
Некоторое увеличение продолжительности пауз ритма (происходящее у всех детей к 3 месяцам вследствие активного включения парасимпатического отдела нервной системы) в третьей группе не превышало исходного уровня, а к 6 месяцам длительность асистолии у детей, получавших мексидол, была минимальной, достоверно отличаясь от соответствующих показателей детей на стандартной терапии (779,1±62,9мс против 898,2±40,1мс, р≤0,05).
У детей, получавших дополнительно мексидол, в отличие от пациентов других групп, выявляемость СА-блокады, составившая исходно 30%, не нарастала в период транзиторного вегетативного дисбаланса (в 3-4 месяца) и полностью исчезала к полугоду. В тоже время в двух других группах представленность эпизодов СА-блокады в период транзиторного вегетативного дисбаланса достоверно нарастала, незначительно уменьшаясь к 6 месяцам. На фоне использования актовегина и мексидола уже к 3 месяцам происходила стабилизация циркадной организации ритма сердца и средние значения циркадного индекса (ЦИн) заметно превышали исходный уровень: 1,16±0,01 и 1,17±0,01 против 1,13±0,02 и 1,11±0,02 соответственно (р≤0,05). Однако полная нормализация данного показателя (1,2±0,04) достигнута к 6 месяцам только у детей, получавших мексидол.
Эхокардиография выявила более быстрые темпы восстановления гемодинамических показателей у детей, получавших дополнительно терапию антигипоксантами. Это касалось, прежде всего, регресса транзиторной легочной гипертензии. Средний градиент давления в легочной артерии снизился к полугоду при стандартной терапии лишь на 0,8±0,01мм.рт.ст, а при дополнительном лечении актовегином и мексидолом на 3,2±0,1мм.рт.ст и 6,3±0,01мм.рт.ст. соответственно (р≤0,05). Аналогично происходило восстановление систолической функции ЛЖ: к полугоду выявляемость систолической дисфункции у детей, получавших антигипоксанты, уменьшилась на 75% и 60% соответственно (р≤0,05), в то время как у детей, получавших только пирацетам, достоверной разницы с исходом получено не было. Стабилизация размеров сердца более динамично происходила при лечении мексидолом. Так, несмотря на исходно высокую выявляемость дилатации полостей сердца (68%) в этой группе пациентов, уже к 3 месяцам данная патология регистрировалась только у 20% больных (р≤0,05), а в двух других группах статистически значимые различия с исходом получены лишь к полугоду (рис.2). Восстановление же диастолической функции желудочков и закрытие фетальных коммуникаций у всех детей происходило без существенных различий к полугоду.
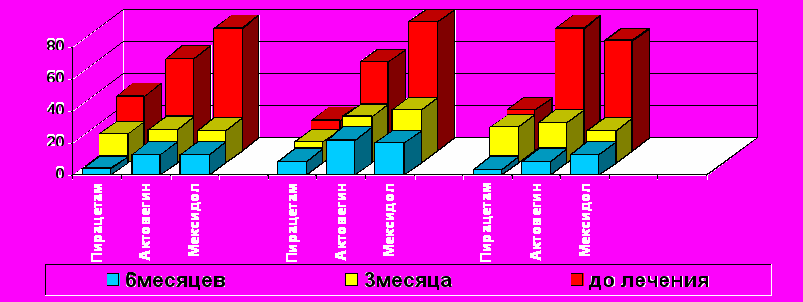 1 2 3
1 2 3* *
* *
* *
*
* * *
* * *
1 - транзиторная легочная гипертензия; 2 - систолическая дисфункция; 3 –
дилатация полостей сердца
Р и с. 2. Динамика эхокардиографических показателей у детей, рожденных путем кесарева сечения, при различных вариантах фармакологической коррекции.
Примечание: *-достоверность отличий от исходного уровня при р≤0,05
По результатам НСГ под влиянием мексидола у детей, рожденных путем КС, отмечалась значительная редукция патологических изменений: выявляемость ишемических нарушений достоверно уменьшилась уже к 3 месяцам, а резидуальные проявления (в виде единичных или множественных кист, расширения межполушарной щели) к 6 месяцам уменьшились наполовину, сохраняясь у 33% детей (р≤0,05). В тоже время в двух других группах к полугоду наметилась только тенденция к регрессу резидуальных ишемических нарушений, которые сохранялись у 43% и 52% детей. Применяемые терапевтические воздействия не оказали значимого эффекта на развитие вентрикуломегалии как осложнения сочетанных ишемически-геморрагических поражений мозга преимущественно у детей, перенесших в раннем неонатальном периоде церебральную ишемию II-III степени.
У детей, рожденных путем КС, в восстановительном периоде перинатальной энцефалопатии происходили фазовые изменения артериального кровотока (Ильенко Л.И. и др., 2003; Зубарева Е.А., 2006) и основные гемодинамические эффекты изучаемых антигипоксантов выявлены в «фазе восстановительных явлений» - к 6 месяцам жизни. На фоне дополнительного лечения актовегином и, особенно, мексидолом происходило приближение индекса резистентности артериальных сосудов (0,65±0,01 и 0,67±0,02 соответственно) к показателям здоровых детей (0,66±0,02), тогда как у детей, получавших стандартную терапию, этот показатель был значимо ниже (0,63±0,01, р≤0,05), что позволяет констатировать стойкое резидуальное изменение церебрального кровотока у пациентов этой группы.
Напротив скорость оттока по вене Галена с возрастом прогрессивно нарастала, что свидетельствовало о развитии венозной дисциркуляции, обусловленной микроструктурными нарушениями головного мозга и формированием вентрикуломегалии, вследствие перенесенной в раннем неонатальном периоде перинатальной церебральной ишемии II-III степени.
По данным ЭЭГ у детей, рожденных путем КС, отмечалось постепенное восстановление нарушенного гипоксией функционального состояния головного мозга, в частности, его биоэлектрической активности в цикле сна (Строганова Т.А. и др., 2005). На фоне дополнительного использования мексидола задержка созревания биоэлектрической активности мозга к 6 месяцам сохранялась лишь у 13% детей (против 40% исходно, р≤0,05). Судорожный синдром к 3 месяцам был купирован у всех детей, но только в группе детей, получавших дополнительное лечение мексидолом, эта динамика была статистически значима по сравнению с исходом (28% против 0%, р≤0,05). Вместе с тем вследствие пролонгированного влияния гипоксии на функциональное состояние головного мозга выявлялись нарушения регуляторного характера во всех трех исследуемых группах.
Результаты проведенного исследования свидетельствуют о том, что состояние детей, рожденных КС, характеризуется наличием выраженных гипоксически-опосредованных дизадаптационных нарушений, требующих в ряде случаев (при наличии средне-тяжелой и тяжелой ЦИ) дополнения стандартной схемы лечения антигипоксантами и антиоксидантами. Использование актовегина и, особенно, мексидола способствовало более быстрой коррекции структурных нарушений сердечно-сосудистой и центральной нервной систем и оптимизации их функционирования в более ранние сроки.
Выводы:
1. Ранний неонатальный период у детей, рожденных путем кесарева сечения, по сравнению с рожденными естественным путем характеризуется большей выраженностью гипоксически-опосредованной дизадаптации ССС, в виде более частого выявления признаков электрической нестабильности миокарда и аритмий, нарушения циркадной организации ритма и дисфункции синусового узла, систолической и диастолической дисфункций сердца, персистирования фетальных коммуникаций и транзиторной легочной гипертензии и наличием структурных и функциональных изменений головного мозга (признаков незрелости, нарушения биоэлектрической активности, церебральной дисциркуляции).
2. Мексидол (в дозе 7,5 мг/кг/сут) и актовегин (в дозе 0,2 мл/кг/сут) в составе стандартной схемы лечения способствуют более значимому улучшению клинического состояния детей, рожденных оперативным путем, быстрому и эффективному регрессу постгипоксических расстройств функционирования сердечно-сосудистой системы, в виде восстановления вегетативной регуляции сердечного ритма и его циркадной организации, регресса признаков электрической нестабильности миокарда, стабилизации размеров полостей сердца, оптимизации его систолической и диастолической функций.
3. Мексидол и актовегин улучшают структурно-функциональное состояние ЦНС у детей, рожденных путем КС, в более ранние сроки снижая выявляемость клинических и ультразвуковых признаков гипоксически-ишемического поражения головного мозга и их последствий, нормализуя биоэлектрическую активность мозга, стабилизируя показатели церебрального кровотока по сосудам артериального русла и способствуя более эффективному купированию судорожного синдрома.
4. Мексидол в изученных дозах более эффективно, по сравнению с актовегином, корригировал дизадаптационные кардиальные (транзиторную легочную гипертензию, миокардиальную дисфункцию, ишемические расстройства, дисфункцию синусового узла) и церебральные (неврологическую симптоматику, биоэлектрическую активность мозга, в том числе - судорожный синдром, явления церебральной дисциркуляции) нарушения у детей, рожденных путем кесарева сечения.
Практические рекомендации:
1. Полученные данные о состоянии здоровья детей, рожденных путем КС, позволяют отнести их в группу высокого риска по реализации перинатальной патологии. С целью раннего выявления постгипоксических дизадаптационных нарушений и предупреждения осложнений, таким детям показано углубленное обследование ЦНС и ССС с использованием холтеровского мониторирования ЭКГ, эхокардиографии, нейросонографии, допплерографии сосудов головного мозга и электроэнцефалографии уже в раннем неонатальном периоде.
2. Выявленные нарушения у детей, рожденных путем кесарева сечения и имеющих признаки ЦИ 2-3 степени, являются основанием для дополнения стандартной схемы лечения препаратами антигипоксантного и антиоксидантного типа действия.
3. При обнаружении признаков средне-тяжелого гипоксически/ишемического поражения головного мозга у детей, рожденных КС, целесообразно дополнительное использование антиоксиданта актовегина в дозе 0,2 мл/кг/сут в течение 10 дней в виде внутривенных инфузий уже в начале восстановительного периода с переходом на прием внутрь до месяца.
4. С целью устранения тяжелых последствий перенесенной перинатальной гипоксии, улучшения показателей мозговой и внутрисердечной гемодинамики, оптимизации электрофизиологических параметров миокарда, восстановления вегетативной регуляции ритма и цереброкардиальных взаимодействий у детей с ЦИ III степени, рожденных путем КС, рекомендуется назначение мексидола – 7,5мг/кг/сут в виде внутривенных инфузий в течение 10 дней с переходом на прием внутрь до 1 месяца.
Список работ, опубликованных по теме диссертации:
1. Науменко Е.И. Кардиоваскулярная патология у детей периода новорожденности / Е.И. Науменко, Т.С. Тумаева, Т.Н. Беззубова // Всероссийская Конференция «Критические пороки сердца периода новорожденности» с международным участием: Тезисы докладов - Москва, 2005. - С. 67.
2. Науменко Е.И. Нарушение проводимости сердца у новорожденных / Е.И. Науменко, Т.С. Тумаева, Н.В. Сацук, С.В. Слезкина // Вестник аритмологии. - 2006. - №40, приложение А. – С. 135.
3. Науменко Е.И. Структура аритмий у детей первого месяца жизни / Е.И. Науменко, Т.С. Тумаева // Вестник аритмологии. – 2008. - №45, приложение А. – С. 122.
4. Науменко Е.И. ЭКГ и ЭХОКГ у новорожденных с межпредсердными сообщениями / Е.И. Науменко, А.С. Сысуева, Т.С. Тумаева // Вестник аритмологии. – 2008. - №45, приложение А. - С. 126.
5. Гарина С.В. Фармакологическая коррекция функциональных нарушений сердечно-сосудистой системы у новорожденных, перенесших перинатальную гипоксию / С.В. Гарина, Л.А. Балыкова, А.В. Герасименко, Т.С. Тумаева, С.В. Князева // III Конгресс специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество» : Тезисы докладов - Москва, 29-30 сентября 2008г.- С. 10.
6. Гарина С.В. Фармакологическая коррекция функциональных нарушений сердечно-сосудистой системы у новорожденных, перенесших перинатальную гипоксию / С.В. Гарина, М.И. Киселева, А.В. Герасименко, Л.А. Балыкова, Т.С. Тумаева, Ю.В. Потанина, К.Т. Бикмаева // Детские болезни сердца и сосудов.- 2009.- № 2.- С. 73-78.
7.Тумаева Т.С. Суточное мониторирование сердечного ритма у недоношенных новорожденных детей / Т.С. Тумаева, Е.И. Науменко // Вестник аритмологии. – 2009. - №2, приложение А. - С. 77.
8. Tumaeva Т. Ultrasound neuroimaging in newborns, delivered by cesarean / T. Tumaeva, Е. Naumenko, Т. Dolmatova, Е. Samoshkina // 4th Europaediatrics- 2009.- Moscow, 3-6 Yuly 2009.- Abstract. - Р. 666.
9. Tumaeva Т. The cerebral hemodynamic condition in newborn, delivered by cesarean / T. Tumaeva, Т. Dolmatova, I. Ryazina, Е. Naumenko, Е. Samoshkina // 4th Europaediatrics- 2009.- Moscow, 3-6 Yuly 2009.- Abstract. - Р. 665.
10. Тумаева Т.С. Состояние мозгового кровотока у новорожденных с церебральной ишемией 2-3 степени, рожденных оперативным путем / Т.С. Тумаева, Е.И. Науменко// IV Ежегодный Конгресс специалистов перинатальной медицины «Современная перинатология: организация, технологии и качество»: Тезисы докладов - Москва, 28-29 сентября 2009г.- С.67-68.
11. Гарина С.В. Метаболическая терапия кардиоваскулярных нарушений у новорожденных с церебральной ишемией // С.В. Гарина, Л.А. Балыкова, Т.Н. Беззубова, Т.С. Тумаева, Л.В. Ледяйкина // VIII Российский конгресс «Современные технологии в педиатрии и детской хирургии»: Тезисы докладов - Москва, 20-22 октября 2009г.- С. 154-155.
12. Тумаева Т.С. Особенности ЭКГ у недоношенных детей, рожденных оперативным путем / Вестник аритмологии. - 2010. - №45, приложениеА-С.136.
13. Тумаева Т.С. Особенности ЭХО-КГ у недоношенных детей, рожденных оперативным путем / Т.С. Тумаева, Л.А. Балыкова, Е.И. Науменко, О.А. Пиксайкина // Вестник аритмологии. – 2010. - №45, приложение А - С. 147.
14. Тумаева Т.С. Состояние церебральной гемодинамики у новорожденных, рожденных путем операции кесарева сечения / Т.С. Тумаева, Е.И. Науменко, Т.В. Долматова // Вестник аритмологии. – 2010. - №45, приложение А - С. 147.
15. Тумаева Т.С. Данные электороэнцефалографии у детей, рожденных оперативным путем в раннем неонатальном периоде / Т.С. Тумаева, Е.И. Науменко // Вестник аритмологии. – 2010. - №45, приложение А - С. 147.
16. Науменко Е.И. Суточный ритм сердца у детей, рожденных оперативным путем / Е.И. Науменко, Т.С. Тумаева, О.Ю. Желудкова // Вестник аритмологии.- 2010. - №45, приложение Б. - С. 125.
17. Науменко Т.С. Экстрасистолия у новорожденных, рожденных оперативным путем / Е.И. Науменко, Т.С. Тумаева, О.Ю. Желудкова // Вестник аритмологии. – 2010. - №45, приложение Б. - С. 126.
18. Тумаева Т.С. Особенности становления сердечной гемодинамики у недоношенных детей, рожденных путем операции кесарева сечения / Т.С. Тумаева, Л.А. Балыкова, Е.И. Науменко, О.А. Пиксайкина // Всероссийский Конгресс «Детская кардиология- 2010» (Материалы Конгресса).- Москва, 1-3 июля 2010г.-С. 252-253.
19. Тумаева Т.С. Результаты ЭКГ–обследования недоношенных детей, рожденных оперативным путем / Т.С. Тумаева, Л.А. Балыкова, Е.И. Науменко, О.А. Пиксайкина // Всероссийский Конгресс «Детская кардиология- 2010» (Материалы Конгресса).- Москва, 1-3 июля 2010г.- С. 253-254.
20. Пиксайкина О.А. Случай рефрактерного трепетания предсердий у новорожденного / О.А. Пиксайкина, Л.А. Балыкова, Т.И. Корнилова, Е.И. Науменко, Т.С. Тумаева, Н.П. Костькина, Ю.В. Потанина // Вестник РУДН, серия Медицина.- М.: Изд. РУДН. -2010.- № 3.- С. 153-156.
21. Тумаева Т.С. Ишемически- опосредованные нарушения церебральной гемодинамики в раннем неонатальном периоде у детей, рожденных путем кесарева сечения / Т.С. Тумаева, Л.А. Балыкова, Е.И. Науменко, О.А. Пиксайкина // I Международный Конгресс по перинатальной медицине (Материалы Конгресса).- Москва, 16-18 июня 2011г.- С. 158-159.
22. Тумаева Т.С. Фармакологическая коррекция гипоксически-опосредованных нарушений сердечно-сосудистой системы у детей, рожденных путем кесарева сечения / Т.С. Тумаева, Л.А. Балыкова, Е.И. Науменко // VII Всероссийский семинар «Детская кардиология в аспекте междисциплинарных связей» : Тезисы докладов - Уфа, 19-20 сентября 2011г. - С. 87-88.
23. Тумаева Т.С. Клинико-инструментальная характеристика состояния центральной нервной системы у детей, рожденных путем кесарева сечения, в раннем неонатальном периоде / Т.С. Тумаева, Л.А. Балыкова, А.В. Герасименко, Л.В. Ледяйкина, О.А. Пиксайкина // Практическая медицина.-2011.- № 6(54). - С. 72-75.
