Н. С. Русейкин Официальные оппоненты
| Вид материала | Автореферат |
- Phodopus, 940.53kb.
- В педагогическом взаимодействии, 811.25kb.
- Прагматика языка туристической рекламы, 1403.92kb.
- А. В. Костров Официальные оппоненты, 251.97kb.
- Модели регионализма и регионализации восточной азии, 1934.71kb.
- Влияние "кризиса трех лет" на познавательное развитие дошкольников, 773.28kb.
- Синтез, свойства и биологическая активность производных 2-хлорникотинонитрилов, 264.36kb.
- Рецепция римского права: вопросы теории и истории, 249.57kb.
- М. Л. Макаров Официальные оппоненты: доктор филологических наук, профессор, 258.87kb.
- Историография роли иностранного капитала в экономике Урала в 1920-е годы, 365.49kb.
1 2
На правах рукописи
Свешников
Константин Анатольевич
ИЗМЕНЕНИЯ МИНЕРАЛЬНОЙ ПЛОТНОСТИ КОСТЕЙ НИЖНИХ КОНЕЧНОСТЕЙ ПОСЛЕ ПЕРЕЛОМОВ У БОЛЬНЫХ ОСТЕОПОРОЗОМ
(клинико-экспериментальные исследования)
14.00.16 – патологическая физиология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Саранск – 2009
Работа выполнена в медицинском институте Государственного образовательного учреждения высшего профессионального образования «Мордовский государственный университет им. Н.П.Огарева» Федерального агентства по образованию РФ.
Научный руководитель: заслуженный работник высшей школы РМ
кандидат медицинских наук, профессор, Н.С. Русейкин
Официальные оппоненты: доктор медицинских наук, профессор
С.П. Бякин
доктор медицинских наук, профессор
В.Г. Малышев
Ведущая организация: ГОУ ВПО «Саратовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию».
Защита состоится «29» июня 2009 г. в 12 часов на заседании диссертационного совета Д.212.117.08 при ГОУ ВПО «Мордовский государственный университет имени Н.П. Огарева» Медицинский институт: 430005 г. Саранск, ул. Большевистская, д. 68.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Мордовский государственный университет им. Н.П.Огарева»: 430005 г. Саранск, ул. Большевистская, д. 68.
Автореферат разослан « 18 » мая 2009 г.
Ученый секретарь диссертационного совета
кандидат медицинских наук, доцент А.Г. Голубев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Остеопороз – самая частая патология скелета у пожилых женщин, 80% из них страдают от происходящих возрастных изменений (Scottish Intercollegiate Guidelines Network 2003; Institute for Clinical Systems Improvement Health Care Guideline, 2004). Мужчины страдают от остеопороза в 6 раз реже, чем женщины, но в связи с увеличением продолжительности жизни, существенные изменения минеральной плотности костной ткани отмечены и у них (Родионова С.С. и соавт., 2003).
Несмотря на актуальность проблемы, остеопороз относится к числу малоизученных заболеваний. До сих пор окончательно не выяснены многие стороны этиологии и патогенеза, зависимость остеопороза от многочисленных факторов риска, особенности морфологических проявлений в тех или иных случаях (Шехтман А.Г., 2004).
Основным клиническим проявлением остеопороза являются переломы при минимальной травме (Institute for Clinical Systems Improvement Health Care Guideline, 2004). Подавляющее большинство переломов, возникших в возрасте после 50 лет при минимальной травме, относятся к остеопорозным (Тропцова Н.В., 2006). Они имеют ряд особенностей. Главная их черта – возникновение при низкой массе минералов. Переломы появляются при уменьшении минеральной плотности кости на 13,7 – 23% (Родионова С.С., 2002). В возрасте 60 – 80 лет снижение минеральной плотности костной ткани составляет 20 – 25 %. У лиц с переломами в анамнезе эта величина ниже ещё на 10 – 15%. Риск переломов при таком снижении минеральной плотности возрастает в 10 – 20 раз по сравнению с возрастным контролем (Михайлов Е.Е., 2003). Другой особенностью остеопорозных переломов является локализация, главным образом, в областях с преимущественно трабекулярной костью (Родионова С.С. с соавт., 2003).
В возрасте старше 45 лет ежегодно в России происходит около 1,3 млн. переломов костей на почве остеопороза (Беневоленская Л.И., 2003). Социальная значимость остеопороза определяется его последствиями – переломами позвонков и костей периферического скелета, обусловливающих значительный рост инвалидности и смертности среди лиц пожилого возраста (Шевцов В.И. и соавт., 2004; Глазырин Д.И., 2006). Среди городского населения России у 24% женщин и 13% мужчин в возрасте 50 лет и старше имеет место в анамнезе, по крайней мере, один случай перелома (Михайлов Е.Е., 2003).
Очень важно, что сочетание нескольких факторов риска остеопороза имеет кумулятивный эффект: при увеличении их числа – риск переломов возрастает (Михайлов Е.Е., 2003, Беневоленская Л.И., 2007). У людей с переломом любой локализации риск последующего перелома в 2,2 раза выше, чем без предшествующего перелома (Михайлов Е.Е., 2003).
Анализ результатов современного лечения переломов костей показывает, что осложнённое течение консолидации переломов достигает 70% (Омельченко Н.П., 1996). Неблагоприятные результаты лечения (рецидивы, ампутации, функциональная неполноценность конечностей) достигают 20 – 30% (Маder J.Т. c соавт., 2003), что может быть связано с недостаточным кровоснабжением зоны консолидации (Кавалерский Г.М., 2006), выраженным (более 1/3 диаметра кости) смещением отломков, нестабильной фиксацией отломков при консервативной терапии, необоснованной ранней нагрузке после перелома без учёта этапа регенерации кости (Калашников А.В., 2001).
Оптимальные условия для первичного сращения костных отломков после перелома создаёт остеосинтез, но сроки консолидации определяются также процессами эндокринной регуляции костеобразования (Шевцов В.И. и соавт., 2005, 2006). Выяснение взаимодействия гормонов с рецепторами клеток, изменения под их влиянием концентрации циклических нуклеотидов в клетках стало возможным благодаря внедрению метода радиоиммунологического анализа. Несмотря на это, остаётся большое количество нерешённых вопросов гормональной регуляции репаративного костеобразования (Ральникова С.В., 2002).
Существенное внимание должно уделяться выявлению начального уменьшения минеральной плотности кости и предсказанию риска возникновения перелома (Шевцов В.И. и соавт., 2004). Благодаря этому в 2 раза уменьшается число переломов (Короткова Т.А., 2004).
Из этого вытекает актуальность данной работы.
Цель работы: изучить изменения минеральной плотности костей нижних конечностей, гормональную регуляцию репаративного костеобразования при лечении переломов у больных остеопорозом.
Задачи исследования
1. Изучить изменения минеральной плотности большеберцовой кости и регенерата при репаративном костеобразовании после остеотомии в зависимости от точности репозиции отломков (экспериментальные исследования).
2. Исследовать зависимость между степенью смещения костных отломков и интенсивностью репаративного костеобразования при лечении переломов у больных остеопорозом.
3. Изучить влияние минеральной плотности костной ткани на её механические свойства.
4. Определить динамику изменения гормонов стресс-группы и регулирующих процесс костеобразования, а также циклических нуклеотидов в процессе лечения переломов у больных остеопорозом.
Научная новизна
В результате исследования в эксперименте определена зависимость степени изменения минеральной плотности кости и интенсивности репаративного костеобразования в процессе лечения.
Изучено влияние степени смещения костных отломков на минеральную плотность кости и репаративное костеобразование.
Получены сведения о минеральной плотности кости при наличии диастаза между отломками и нестабильной фиксации.
Показано, что в процессе репаративного костеобразования наблюдается волнообразное изменение концентрации АКТГ, альдостерона, кортизола, ангиотензина II и цАМФ, цГМФ, паратиреоидного гормона, соматотропина, кальцитонина и остеокальцина.
Выявлено, что при уменьшении минеральной плотности кости на 8% наибольшие изменения механических свойств кости возникали в поперечном направлении, что может явиться причиной переломов.
Практическая значимость
Впервые изучено состояние гормональной регуляции репаративного процесса после переломов у больных остеопорозом. В эксперименте и клинике изучено состояние минеральной плотности, как в поврежденном сегменте, так и во всём скелете. Изучены изменения механической прочности костной ткани в зависимости от её минеральной плотности. Эти данные важны для профилактики переломов у больных остеопенией и остеопорозом.
Основные положения, выносимые на защиту
1. Сниженная минеральная плотность костей скелета у больных остеопорозом приводит к существенным изменениям прочностных и деформационных свойств кости в поперечном направлении. Кость теряет способность противостоять действию нефункциональных нагрузок, что служит причиной спонтанных переломов.
2. Скорость репаративных процессов, степень деминерализации кости и минерализация формирующегося регенерата зависят от степени смещения костных отломков в момент травмы и устойчивости фиксации.
3. Увеличение концентрации соматотропина и кальцитонина стимулирует костеобразование. О его начале указывает уменьшение отношения цАМФ к цГМФ.
Реализация результатов исследования
Материалы работы внедрены в работу курса травматологии медицинского института Мордовского государственного университета, включены в план чтения лекций для студентов Курганского и Тюменского государственных университетов.
Апробация материалов работы
Результаты диссертационного исследования представлены в форме доклада на следующих конференциях российского и международного уровней: I Всеросс. симпозиум «Возрастные изменения минеральной плотности костей скелета», Курган, 2002; Всеросс. науч-практ. конф. «Актуальные проблемы экстренной медицинской помощи», Якутск, 2002; Междунар. научн.-практ. конф. «Оздоровительные технологии ХХI века», Челябинск, 2002; II науч-практ. конф. с междунар. участием «Проблема остеопороза в травматологии и ортопедии», Москва, 2003; Всеросс. науч.-практ. конф. с междунар. участием. «Новые биокибернетические и телемедицинские технологии XXI века», Петрозаводск, 2003; Всеросс. науч.-практ. конф. «Многопрофильная больница: проблемы и решения», Ленинск-Кузнецкий, 2003; I и II Российский конгресс по остеопорозу, Москва, 2003, 2005; Всероссийская науч.-практ. конф. «Актуальные вопросы лучевой диагностики в травматологии, ортопедии и смежных дисциплинах», Курган, 2003 г.; XIX съезде физиол. об-ва им. Павлова, 2004; Междунар. науч.-практ. конф. «Актуальные вопр. ортопед. и травматол. на соврем. этапе», Казахстан, г. Астана, 2007; Материалы Междунар. конгресса лучевых диагностов «Радиология 2007», Москва, 2007; Высокие технологии в медицине: материалы Всерос. науч.-практ. конф. «Высокие технологии в медицине», Ленинск-Кузнецкий, 2008; Материалы XXXVII научной конференции «Медицинские проблемы жизнедеятельности в норме, патологии и эксперименте», Саранск, 2008; Материалы IV Всероссийской науч.-практ. конф. с междунар. участием «Проблемы остеопороза в травматологии и ортопедии», Москва, 2009.
Работа доложена и обсуждена на совместном заседании кафедры патологической физиологии, госпитальной хирургии с курсом травматологии и ортопедии и нормальной физиологии медицинского института ГОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва» в 2009 г.
Публикации
По теме диссертации опубликовано 13 печатных работ, из них 1 в рецензируемом журнале, рекомендованном ВАК МОН; 1 – в электронном журнале, зарегистрированном в «Информрегистре».
Объём и структура диссертации
Диссертация изложена на 121 странице машинописного текста и состоит из введения, обзора литературы, раздела материалы и методы исследования, 3 глав результатов собственных исследований, заключения, выводов, практических рекомендаций и списка литературы, содержащего 243 источника (157 – отечественных, 86 – иностранных). Текст иллюстрирован 9 таблицами и 26 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
1. Материал и методы экспериментальных исследований.
Моделирование перелома и изучение репаративной регенерации. Цель исследования состояла в изучении минеральной плотности поврежденного сегмента и регенерата после остеотомии. На 21 беспородной собаке (масса тела 17 – 22 кг) под тиопенталовым наркозом открытым способом производили остеотомию большеберцовой кости правой голени с целью изучения минеральной плотности повреждённого сегмента, верхней и нижней трети большеберцовой кости и регенерата. В зависимости от точности репозиции и способа лечения животные были разделены на 3 группы по 7 в каждой. В 1-й группе сразу после остеотомии осуществляли точную репозицию костных фрагментов и их чрескостную фиксацию аппаратом Илизарова. Во 2-ой – создавался диастаз между отломками в 2 мм. В 3-й группе отломки фиксировали гипсовой повязкой.
Репаративное костеобразование. О его развитии судили по накоплению пирофосфата, меченного по 99mTc, который вводили внутривенно за 3 часа до обследования (активность 55,5 – 74,0·104 Бк). Сканирование и радиометрию костей голени выполняли на планисканере КЕ-32 фирмы «Radiax» (Италия).
Минеральная плотность. Минеральную плотность в различных участках большеберцовой кости исследовали на анализаторе минералов фирмы «Norland» (США). При прохождении над костью часть ионизирующего излучения от источника 125I поглощалась пропорционально количеству минеральных веществ. На экране прибора появлялись данные о ширине кости (в см) и МПК (в г/см2). Ошибка при измерении ±2%.
Исследование репаративного костеобразования и минеральной плотности кости проводили на 1, 3, 7, 14, 21, 28, 35, 45, 60, 90, 120 дни после остеотомии.
2. Материал и методы обследования, примененные в клинике.
Характеристика материала. Контрольные данные о минеральной плотности костей получены после обследования 410 человек (мужчин – 206, женщин – 204), в возрасте 21 – 80 лет, не имевших заболеваний костно-мышечной и эндокринной систем, методом рентгеновской двухэнергетической абсорбциометрии на костном денситометре фирмы «GE/Lunar» (США).
Задача исследования – определение минеральной плотности и процентного изменения массы минералов всего скелета и костей нижних конечностей в возрастном аспекте с целью выявления возрастной группы с достоверным снижением этих показателей для дальнейшего изучения процессов костеобразования при лечении переломов костей голени. Соблюдалось главное условие при выполнении таких исследований – приходившие на обследование были совершенно случайными людьми.
Результаты исследования оценивали с учетом методических рекомендаций Международного общества клинической денситометрии (ISCD 2003, 2005, 2007 гг.).
С целью изучения состояния минерализации костных отломков и репаративного костеобразования на костном денситометре фирмы «GE/Lunar» (США) обследовали 200 больных в возрасте 66 – 75 лет с поперечными, косыми и винтообразными переломами. Лечение переломов проводили методом чрескостного остеосинтеза по Илизарову. Исследование проводили ежедневно в течение 1-ой недели после перелома, а затем 1 раз в неделю до полной минерализации регенерата. Время сращения перелома определяли на основании результатов рентгенологических, радионуклидных исследований и клинической пробы.
С закрытыми поперечными переломами костей голени обследовали 84 человека. Все пациенты были разделены на 6 групп по 14 больных в каждой: с переломами без смещения и со смещением в верхней, средней и нижней трети.
С косыми закрытыми переломами большеберцовой кости под наблюдением находилось 56 пациентов. Все больные были разделены на 4 группы по 14 больных в каждой: с переломами в средней и нижней трети со смещением отломков после травмы и без смещения. Больные обследовались в те же сроки, что и при поперечных переломах.
С винтообразными переломами большеберцовой кости было 60 больных. Из них у 11 переломы были в средней трети, у 49 – в нижней трети. В зависимости от смещения костных отломков после травмы все больные были разделены на 6 групп по 10 человек в каждой: без смещения отломков, смещение на кортикальный слой, на 1/3, 1/2, 2/3 и полное смещение после травмы.
Концентрацию гормонов (АКТГ, кортизола, альдостерона, паратиреоидного гормона, соматотропина, кальцитонина) определяли у 50 больных с закрытыми поперечными переломами большеберцовой кости в возрасте 66 –75 лет, не имевших заболеваний эндокринной системы, методом радиоиммунологического анализа с использованием наборов фирмы «CIS» (Франция), а циклических нуклеотидов (цАМФ, цГМФ) – радиоконкурентным методом с наборами фирмы «Amersham» (Англия). Исследование проводили ежедневно в течение 1-ой недели после перелома, а затем 1 раз в неделю до снятия аппарата Илизарова. Подсчет активности и распечатка результатов осуществлялись на ß- и γ-счетчиках фирмы «Tracor Europa» (Голландия).
Концентрацию остеокальцина и ангиотензина II определяли для суждения о механизмах костеобразования с помощью радиоиммунологических наборов «Elsa osteo» и «Ren-СТ2» (Франция) в те же сроки.
Состояние механических свойств костей изучали на образцах костной ткани 80 мужчин, погибших в ДТП, в 2-х возрастных группах 40 – 50 и 70 – 80 лет. С этой целью образцы костной ткани испытывали на сжатие (образцы взяты в соответствии с действующими законодательными актами). Образцы выпиливали вручную из кортикального слоя проксимального метафиза бедренной кости (метафиз имеет небольшую кривизну и достаточно толстый кортикальный слой) и тщательно освобождали от периоста. Образцы представляли собой прямоугольные призмы длиной 31 мм, шириной 4 мм, и глубиной 3 мм, точность измерения определялась микрометром. До исследования механических свойств образцы держали замороженными в 0,9% растворе натрия хлорида при температуре – 15оС. МП образцов определяли на анализаторе минералов фирмы «Norland» (США).
И

спытание 80 образцов (по 40 образцов в каждой возрастной группе, из них 20 образцов испытывали в поперечном и 20 – в продольном направлении) на сжатие проводилось в реверсоре (Утенькин А.А., 1967; рис. 1), установленном на стандартной испытательной машине РМП-500.
Рис. 1. Схема реверсора для испытания образцов на сжатие.
Обозначения: 1 – верхняя плита; 2 – нижняя плита; 3 – испытуемый образец кости; 4 – стрелочный индикатор.
Образцы нагружали вручную (это облегчало процесс снятия показаний силомера и индикаторов). Показания индикаторов снимали каждые 25 кг нагрузки. Испытание продолжалось несколько секунд. Деформацию (укорочение) костных образцов замеряли двумя стрелочными индикаторами (цена деления 0,002 мм). На основании полученных данных для каждого испытуемого образца строили диаграмму в координатах «сжимающая сила – укорочение образца», которая использовалась в дальнейшем для определения показателей механических свойств: модуль упругости, предел пропорциональности, относительная упругая деформация, предел прочности и относительная деформация разрушения. Показатели механических параметров костной ткани вычисляли по формулам, используемым при испытании материалов (Грязнов И.Н. и соавт., 1991).
3. В качестве инструмента вычислений использован пакет статистического анализа и встроенные формулы расчетов данных компьютерной программы Microsoft® Excel (2003).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В
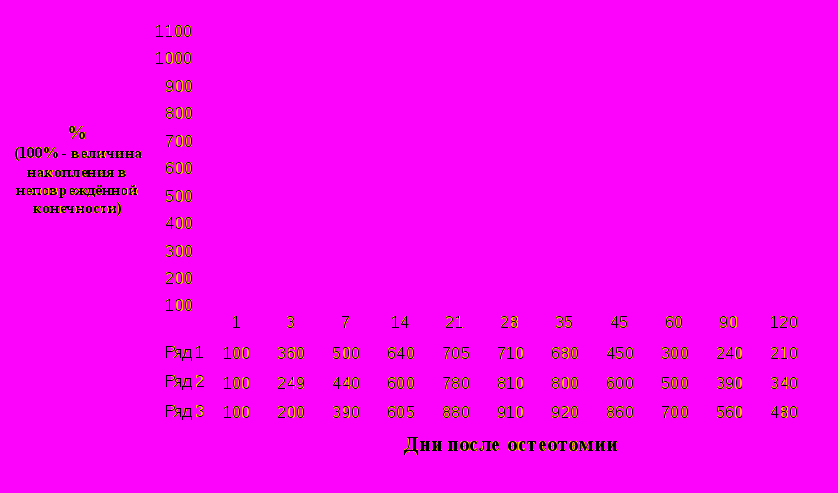
эксперименте при изучении минеральной плотности кости в повреждённом сегменте и регенерате результат зависел от точности репозиции отломков и способа лечения. В первые дни единственными критериями, свидетельствовавшими о состоянии репаративного костеобразования были результаты радионуклидных исследований. Динамика накопления меченого пирофосфата, отражающая активность репаративного процесса в зависимости от способа лечения, представлена на рис. 2.
Рис. 2. Динамика накопления меченого пирофосфата при репаративном костеобразовании после переломов у собак. Примечание: 1 – стабильная фиксация без диастаза; 2 – диастаз 2 мм; 3 – фиксация гипсовой повязкой.
При анализе МПК на 3-и сутки при стабильной фиксации (1 группа) в месте остеотомии изменений не обнаружено. К 7-му дню наблюдалась тенденция к снижению МПК. На 14-й день МПК уменьшалась на 29±1,9% (р<0,05). Рентгенологически в этот период отмечалась выраженная резорбция костной ткани концов отломков. В прилежащих к перелому участках кости минеральная плотность была снижена на 16±1,0 % (р<0,05). Аналогичная закономерность отмечалась в верхней и нижней третях голени. В дальнейшем МПК в месте перелома непрерывно увеличивалась. Через 6 недель МПК была в пределах нормы.
В диастазе (2 группа) минеральные вещества в регенерате обнаружены лишь на 7-й день и составляли всего 0,05±0,003% от величины в симметричном участке неповреждённой кости. Накопление их непрерывно увеличивалась до 28-го дня. В дальнейшем увеличение происходило более медленно. Нормализация отмечена на 90-й день после остеотомии.
При фиксации гипсовой повязкой (3-я группа) минеральные вещества в регенерате впервые определены на 14-й день после перелома и составляли 0,08±0,005% от величины в симметричном участке неповреждённой кости. Быстрая фаза минерализации продолжалась до 28-го дня. Медленная фаза завершалась полной минерализацией на 120-й день. У собак этой группы деминерализация была выражена как у концов костных отломков (23,0±1,8 %, р<0,05), так и в верхней и нижней третях кости (18,0±1,5 %, р<0,05).
Таким образом, регенерация происходила более быстрыми темпами при стабильной фиксации костных отломков без диастаза. При сопоставлении результатов радионуклидных и денситометрических исследований отмечено, что продолжительность сращения варьирует и протекает тем дольше, чем хуже сопоставлены концы отломков, чем ниже устойчивость их фиксации. При наличии диастаза или нестабильной фиксации восстановление структуры кости происходит в более поздние сроки. Для минерализации регенерата минеральные вещества в большей степени мобилизуются из концов костных отломков и в несколько меньшей мере из более удалённых отделов кости.
Изменение минеральной плотности костей у «здоровых» людей в возрастном аспекте. Максимальная МП костей всего скелета у женщин выявлена в возрастной группе 21 – 25 лет и оставалась практически неизменной до 45 лет. После этого наблюдалась тенденция более быстрого уменьшения и, начиная с 66 лет, существенно отличалась от величин в возрасте 21 – 25 лет: в 66 – 70 лет – на 11,2% (р<0,05), 71 – 75 лет – на 15,4% (р<0,01). У мужчин МП костей всего скелета достигала максимальных значений в 26 – 30 лет и сохранялась на постоянных значениях до 45 лет, после этого уменьшалась: в 66 – 70 лет – была снижена на 6% (р<0,05), в 71 – 75 лет – на 8% (р<0,05). Снижение минеральной плотности костей нижних конечностей в возрасте 66 – 70 лет у женщин составляло 14,4% (р<0,05), у мужчин – 8,5% (р<0,05), в возрасте 71 – 75 лет у женщин 17,5% (р<0,01), у мужчин – 8,8% (р<0,05). Результаты исследования представлены в табл. 1; 2. Для дальнейшего исследования были выбраны больные в возрастной группе 66 – 75 лет.
Таблица 1
Возрастные изменения минеральной плотности костей всего скелета и обеих нижних конечностей у мужчин и женщин (г/см2, М ± m)
| Возраст (годы) | МУЖЧИНЫ | ЖЕНЩИНЫ | ||||
| n | весь скелет | обе нижние конечности | n | весь скелет | обе нижние конечности | |
| 21 – 25 | 19 | 1,269±0,084 | 1,363±0,091 | 17 | 1,177±0,038 | 1,221±0,062 |
| 26 – 30 | 20 | 1,277±0,082 | 1,357±0,087 | 19 | 1,172±0,035 | 1,213±0,051 |
| 31 – 35 | 22 | 1,246±0,087 | 1,356±0,089 | 20 | 1,170±0,039 | 1,205±0,046 |
| 36 – 40 | 19 | 1,255±0,086 | 1,349±0,077 | 20 | 1,169±0,047 | 1,201±0,058 |
| 41 – 45 | 19 | 1,251±0,081 | 1,351±0,082 | 20 | 1,168±0,043 | 1,202±0,041 |
| 46 – 50 | 18 | 1,218±0,079 | 1,329±0,081 | 17 | 1,153±0,038 | 1,195±0,046 |
| 51 – 55 | 18 | 1,210±0,073 | 1,296±0,078 | 17 | 1,143±0,043 | 1,184±0,054 |
| 56 – 60 | 17 | 1,204±0,077 | 1,298±0,084 | 22 | 1,107±0,047 | 1,144±0,044 |
| 61 – 65 | 15 | 1,203±0,074 | 1,295±0,082 | 15 | 1,076±0,045 | 1,082±0,038 |
| 66 – 70 | 17 | 1,191±0,072* | 1,249±0,077* | 16 | 1,045±0,049* | 1,045±0,051* |
| 71 – 75 | 12 | 1,180±0,075* | 1,243±0,078* | 11 | 1,016±0,054* | 1,007±0,048* |
| 76 – 80 | 10 | 1,121±0,069* | 1,220±0,074* | 10 | 1,014±0,052* | 1,005±0,039* |
Примечание: "*"– статистически достоверные значения по сравнению с данными у женщин в возрасте 21–25 лет, у мужчин – в возрасте 26–30 лет.
Таблица 2
Возрастное процентное изменение массы минералов костей всего скелета и обеих нижних конечностей у мужчин и женщин (М ± m)
| Возраст (годы) | МУЖЧИНЫ | ЖЕНЩИНЫ | ||||
| n | весь скелет | обе нижние конечности | n | весь скелет | обе нижние конечности | |
| 21 – 25 | 19 | 100,0±3,6 | 100,0±3,1 | 17 | 100,0±3,8 | 100,0±3,7 |
| 26 – 30 | 20 | 101,0±3,4 | 99,9±3,0 | 19 | 99,8±4,0 | 99,8±3,9 |
| 31 – 35 | 22 | 99,4±3,4 | 99,9±3,0 | 20 | 99,6±3,5 | 99,7±3,8 |
| 36 – 40 | 19 | 99,6±3,4 | 99,6±3,0 | 20 | 99,2±3,5 | 99,7±3,8 |
| 41 – 45 | 19 | 99,7±3,4 | 99,8±3,1 | 20 | 99,1±3,6 | 99,6±3,9 |
| 46 – 50 | 18 | 99,6±3,4 | 99,1±3,1 | 17 | 97,9±3,7 | 99,2±4,0 |
| 51 – 55 | 18 | 98,8±3,6 | 98,7±3,3 | 17 | 95,2±3,6 | 98,2±4,0 |
| 56 – 60 | 17 | 95,8±3,6 | 97,8±3,5 | 22 | 90,7±3,5* | 95,1±3,8 |
| 61 – 65 | 15 | 90,5±3,7* | 97,5±3,7 | 15 | 84,5±3,4* | 91,7±3,8* |
| 66 – 70 | 17 | 85,6±3,6* | 92,1±3,6* | 16 | 81,7±3,4* | 88,2±3,7* |
| 71 – 75 | 12 | 79,2±3,6* | 85,3±3,6* | 11 | 75,7±3,4* | 82,1±3,7* |
| 76 – 80 | 10 | 74,0±3,5* | 81,5±3,5* | 10 | 68,7±3,5* | 74,1±3,7* |
Примечание: проценты рассчитаны к массе минералов в возрасте 21 – 25 лет;
знаком "*" обозначены значения, статистически достоверно отличающиеся от величин в возрасте 21 – 25 лет.
Минеральная плотность костной ткани после переломов у больных остеопорозом. Закономерности, обнаруженные в эксперименте в накоплении меченого пирофосфата и минеральных веществ, нашли свое подтверждение при изучении процесса деминерализации костных отломков и репаративного костеобразования при лечении больных с переломами. Установлено, что накопление меченого пирофосфата, указывающее на усиление обменных процессов в костной ткани во время лечения поперечных переломов большеберцовой кости отличается в зависимости от места перелома и при наличии смещения. В большей степени накопление меченого пирофосфата в первые 3 недели лечения наблюдалось у больных с переломами без смещения в верхней трети большеберцовой кости, что обусловлено разной степенью васкуляризации отломков. В течение 1-ой недели 2-го месяца накопление меченого пирофосфата при поперечных переломах со смещением становилось близкой по интенсивности к данным без смещения, а в конце 2-го месяца, в силу формирования большей по размеру костной мозоли, превышало их.
Параллельно динамике накопления меченого пирофосфата изменяется минеральная плотность костной ткани. В табл. 3 представлены результаты исследования минеральной плотности костной ткани у больных с поперечными переломами при плотном контакте отломков и при наличии диастаза.
На 3-й день у концов костных отломков при плотном контакте начинается снижение МП, которое становится статистически достоверным на 7-й день, максимальное снижение МП отмечено на 28-й день, нормализация отмечена на 105-й день после перелома.
В промежутке между отломками образуется органическая основа и происходит ее минерализация, что доказывается измерением минеральных компонентов кости (табл. 3). Впервые минеральная плотность в промежутке между отломками определена на 7-й день после перелома, в последующем происходило непрерывное увеличение минерализации, которое достигало нормальных значений на 135-й день после перелома.
Таблица 3
Минеральная плотность костной ткани при лечении поперечных переломов большеберцовой кости (%, М±m)
| Место перелома | Дни после перелома | |||||||||
| 1 | 3 | 7 | 14 | 28 | 45 | 75 | 105 | 120 | 135 | |
| Линия перелома при плотном контакте отломков | 100±3,9 | 95±3,8 | 88±3,4* | 75±3,0* | 72±2,9* | 80±3,6* | 92±3,6* | 96±3,7 | 100±4,0 | 100±4,0 |
| В промежутке между отломками | 0 | 0 | 6,6±0,05* | 15±0,6* | 35±1,3* | 43±1,7* | 67±2,6* | 83±3,3* | 92±3,68* | 100±4,0 |
Примечание: знаком «*» обозначены величины, статистически достоверно отличающиеся от данных в противоположной неповреждённой конечности.
При косых переломах точное сопоставление отломков не всегда удается, а несоблюдение этого условия неизбежно ведет к нарушению функции конечности и васкуляризации отломков. При отсутствии смещения после перелома наблюдалось усиление обменных процессов уже с 1-го дня. Деминерализация концов отломков обнаружена на 2-й неделе. Величина накопления меченого пирофосфата за каждую последующую неделю увеличивалась на 150 – 190% и локализовался он преимущественно у концов отломков. При переломах со смещением в течение 1-го месяца выявлено меньшее накопление активности (на 60%).
Минеральная плотность большеберцовой кости при косых переломах изменялась однонаправлено с поперечными переломами, но несколько большая площадь соприкосновения отломков приводила к меньшей деминерализации, быстрее наступала полная минерализация места сращения. При наличии диастаза минерализация регенерата при косых переломах происходила быстрее, чем при поперечных переломах (табл. 4).
Таблица 4
Минеральная плотность костной ткани при лечении косых переломов
большеберцовой кости (%, М ± m)
| Место перелома | Время (дни) после перелома | ||||||||
| 1 | 3 | 7 | 14 | 28 | 45 | 75 | 105 | 120 | |
| Линия перелома при плотном контакте отломков | 100±1,6 | 96±2,0 | 91±1,8* | 80±1,9* | 76±2,1* | 83±1,8* | 95±1,5 | 98±1,6 | 100±1,2 |
| В промежутке между отломками | 0 | 0 | 7,2±2,1* | 18,1±1,9* | 38±2,0* | 46±1,8* | 70±1,6* | 89±1,8* | 100±1,7 |
Примечание: «*» — статистически достоверные значения по сравнению с данными в симметричном участке противоположной неповреждённой кости.
При косых переломах со смещением только к 35-му дню активность РФП в месте травмы становилась такой же, как при переломах без смещения. В последующие дни 2-го месяца ввиду образования большей по объему костной мозоли активность значительно превосходила величину при переломах без смещения.
Максимальное усиление обменных процессов при переломах без смещения наблюдалось на 7 – 8-й неделе. При смещении эта величина отмечалась на 9 – 10-й неделе. После этого начинался процесс ослабления обменных процессов. Это было основанием считать, что процесс сращения отломков завершен.

Рис. 3. Динамика накопления меченого пирофосфата при лечении винтообразных переломов большеберцовой кости: 1 – без смещения отломков; 2 – смещение на 1/3; 3 – смещение на 2/3; 4 – смещение на поперечник.
При винтообразных переломах без смещения происходило, как правило, повреждение только большеберцовой кости. Репаративное костеобразование в этой группе больных развивалось наиболее интенсивно: накопление меченого пирофосфата увеличивалось с первых же дней и достигало максимальных значений на 42-й день, затем начинало уменьшаться (рис. 3).
При смещении отломков на 1/3 поперечника кости репаративное костеобразование вначале развивалось в месте соприкосновения отломков. Затем активное течение обменных процессов отмечалось в проксимальном и дистальном фрагментах, включая прилежащий метафиз. После этого РФП локализовался непосредственно в месте перелома, достигая максимальных значений на 42-й день (рис. 3). В дальнейшем наблюдалось постепенное ослабление накопления РФП, особенно заметное на 9-й неделе.
При смещении отломков установлена общая закономерность в развитии репаративного процесса: чем больше смещение, тем слабее развивалось костеобразование в течение 1-го месяца, на 2-ом месяце, наоборот, оно выражено в большей мере. Максимальное содержание РФП отмечалось несколько позднее, чем без смещения: при смещении на 1/2 поперечника регистрировалось на 47-й день; на 2/3 – на 50-й и на поперечник – на 60-й день.
Таблица 5
Минеральная плотность костных отломков в месте винтообразного перелома большеберцовой кости в зависимости от величины смещения костных фрагментов (г/см2, М ± m)
| Дни после перелома | Величина смещения отломков | |||||
| нет смещения | кортикальный слой | 1/3 | 1/2 | 2/3 | полное смещение | |
| 3 | 1,337±0,052 | 1,320±0,052 | 1,333±0.053 | 1,329±0,052 | 1,323±0,052 | 1,376±0,054 |
| 7 | 1,239±0,050 | 1,202±0,048 | 1,146±0,046* | 1,168±0,046 | 1,039±0,040* | 1,018±0,038* |
| 14 | 1,105±0,043* | 1,056±0,039* | 0,986±0,038* | 0,957±0.037* | 0,932±0,036* | 0,894±0,034* |
| 28 | 0,997±0,040* | 0,924±0,037* | 0,857±0,032* | 0,837±0,034* | 0,785±0,031* | 0,770±0,030* |
| 35 | 1,051±0,041* | 0,964±0,037* | 0,933±0,036* | 0,877±0,034* | 0,813±0,032* | 0,812±0,031* |
| 42 | 1,145±0,046* | 1,030±0,040* | 0,986±0,038* | 0,930±0,036* | 0,855±0,033* | 0,853±0,033* |
| 60 | 1,199±0,048* | 1,122±0,045* | 1,037±0,040* | 0,997±0,040* | 0,974±0,039* | 0,949±0,038* |
Примечание: "*" обозначены величины, статистически достоверно отличающиеся от соответствующих данных в неповреждённой конечности.
Динамика изменения минеральной плотности костных отломков в месте винтообразного перелома большеберцовой кости в зависимости от величины смещения переломов представлена в табл. 5.
Деминерализация отломков, независимо от величины их смещения, продолжалась 28 дней. К этому времени содержание минеральных веществ понижалось на 34%. После этого начинался процесс их постепенного увеличения, за каждую последующую неделю минерализация возрастала на 8,5%. К моменту снятия аппарата количество минеральных веществ в месте сращения отломков составляло 70%, что указывало на способность костей в месте бывшего перелома выдерживать физиологические нагрузки.
Таким образом, исследования минеральной плотности в месте винтообразного перелома доказывают обоснованность заключений, полученных с меченым пирофосфатом. Нами установлено, что чем больше смещение отломков в момент травмы, тем сильнее деминерализация кости и тем длительнее последующая минерализация.
Механические свойства костной ткани. Коэффициент корреляции между минеральной плотностью и механическими свойствами кости очень высокий (0,88 – 0,90), чем выше минеральная плотность, тем прочнее кость и наоборот (Родионова С.С., 2002).
Перед испытанием мы определили минеральную плотность исследуемых образцов костной ткани, которая в группе 40 – 50 лет составляла 1,71±0,09 г/см2, в 70 – 80 лет – 1,58±0,09 г/см2 (р<0,05). Таким образом, снижение минеральной плотность составило 8±0,2% (р<0,05). Анализ исследования механических свойств показал, что такое снижение минеральной плотности приводит к серьезным изменениям как прочностных, так и деформационных свойств кости. В наибольшей мере изменялись модуль упругости (на 20 и 30% соответственно для 0о и 90о) и относительная деформация разрушения (36% и 45% соответственно для 0◦ и 90◦). Предел прочности снижался на 15% и 18,6% (для 0о и 90о), а относительная упругая деформация – на 10% и 16% (для 0◦ и 90◦).
Таким образом, снижение минеральной плотности кости после 70 лет приводит к значительному снижению жёсткости и прочности костной ткани. Наибольшие изменения механических свойств возникали в поперечном направлении. Они указывали на то, что кость теряет способность выдерживать нефункциональные нагрузки.
Изменение концентрации гормонов. В ответ на травму происходил незамедлительный ответ эндокринной системы, что приводило к увеличению (в 10 раз) концентрации АКТГ, стимулирующего продукцию гормонов надпочечников. Вследствие этого существенно увеличивалось содержание альдостерона и кортизола. К концу 1-х суток концентрация АКТГ несколько уменьшалась (до 9,5 раза), затем продолжала снижаться, но более интенсивно, к 14-м суткам была выше нормы в 4,6 раза, а к концу 1-ого месяца – в 2 раза. В последующие недели концентрация АКТГ была изменена очень незначительно.
В ближайшие часы после травмы концентрация кортизола возрастала в 2,9 раза. К концу 1-х суток эта величина составляла 2,6 раза, на 7-й день – 1,9 раза. На 2 – 3-й неделях снижение концентрации происходило более медленными темпами. Величины, близкие к норме, были в конце 1-го месяца. Полная нормализация отмечена на 45-й день.
В течение 2–х суток после перелома концентрация паратиреоидного гормона возрастала в 6,5 раз. Увеличение происходило вплоть до 14-го дня и составило 14,3 раза. На 3-й неделе наблюдалось довольно существенное снижение её (на 51% за каждый день). В течение 4-й недели уменьшение концентрации происходило более быстрыми темпами (140% за каждые сутки) и поэтому на 28-й день она была близка к норме. Под влиянием паратиреоидного гормона происходит активация остеокластов и усиливается резорбция костной ткани, поэтому в первые 2 – 3 недели в регенерате мало минералов и происходит деминерализация костных отломков. В результате этого мы наблюдали повышение накопления меченого пирофосфата в повреждённом сегменте.
Концентрация соматотропина возрастала довольно медленно (в 1-е сутки – увеличение в 1,3 раза). В дальнейшем (до 21-го дня) концентрация увеличивалась за сутки на 36% от значений в норме. В конце 1-го месяца (21 – 27-й дни) прирост несколько ослабевал. Максимальные значения (увеличение в 9,1 раза) отмечены на 28 – 45-й дни. Затем очень медленно (по 6% за сутки) концентрация уменьшалась. Полная нормализация установлена на 105-й день после перелома.
Содержание кальцитонина изменялось однонаправлено с соматотропином, однако увеличение происходило более медленно: в 1-й день концентрация увеличена на 10% (р<0,05), на 3-й день – на 25% (р<0,01). Прирост в 2 раза отмечен только на 15-й день. Максимальные величины (увеличение в 2,6 раза) наблюдались на 28 – 45-й день после перелома. Полная нормализация установлена на 105-й день после перелома.
Таким образом, под влиянием одновременного действия соматотропина и кальцитонина активизируется пролиферация костномозговых элементов, усиливается их биосинтетическая активность для образования и минерализации костной ткани. Об этом свидетельствует нарастание количества минеральных веществ в формирующемся регенерате и увеличение минерализации костных отломков.
О повышении активности костномозговых элементов, в частности о повышении активности остеобластов, свидетельствуют и сроки изменения концентрации в крови остеокальцина. Его содержание после переломов увеличивалось, достигая максимальных значений на 28-й день, что совпадает с началом минерализации костных отломков. В дальнейшем концентрация остеокальцина постепенно снижалась и через 4 недели после снятия аппарата существенно не отличалась от нормальных показателей.
При исследовании концентрации циклических нуклеотидов установлено, что через 4 – 5 часов после травмы концентрация цАМФ увеличивается, достигая 28,6±3,1 пмоль/мл. В последующие дни содержание цАМФ постепенно уменьшается и на 21-й день наблюдения наблюдается нормализация.
Содержание цГМФ, в отличие от цАМФ, при лечении переломов большеберцовой кости в первые 3 дня после травмы практически не менялось. К концу 3-х суток отмечалась тенденция к увеличению. В дальнейшем, особенно с 7-го дня, концентрация цГМФ стремительно увеличивалась и на 14-й день более чем в 2 раза превышала нормальные показатели, затем она довольно медленно снижалась и на 45-й день существенно не отличалась от нормы.
Отношение нуклеотидов цАМФ/цГМФ через 4 – 5 часов после травмы составляло 2,9, а к концу суток уже начинало уменьшаться. На 14 – 21-е сутки отношение было ниже нормы. К 28-м суткам – восстанавливалось до нормы.
Таким образом, увеличение концентрации цАМФ в первые часы после травмы отражает напряжение адренергических механизмов и является одной из первых ответных реакций организма на травму. Постепенное уменьшение концентрации цАМФ и одновременное повышение содержания цГМФ свидетельствует о подключении холинергических механизмов, что указывает на повышение устойчивости организма к такому острейшему воздействию, как травма. В итоге, отношение концентраций этих нуклеотидов становится ниже нормы и именно в это время начинается интенсивная клеточная пролиферация. Индукторы пролиферации стволовых клеток, взаимодействуя с рецепторами мембран, усиливают транспорт ионов кальция внутрь клетки. Количество цГМФ прямо зависит от концентрации кальция, поэтому и происходит повышение его уровня. Таким образом, определение концентрации циклических нуклеотидов, их соотношение может лежать в основе диагностических и прогностических критериев степени тяжести травмы, выраженности компенсаторных реакций и эффективности лечения (Патраков В.В., 2008).
Концентрация ангиотензина II на 7-й день возрастала в 5 раз, на 14-й день выявлена тенденция к снижению. С 21-го дня уменьшение содержания происходило более быстрыми темпами. На 28-й день после перелома она была еще в 2 раз выше нормы. После снятия аппарата продолжалась тенденция к нормализации. Восстановление происходило на 45-й день после снятия аппарата.
Таким образом, проведённые исследования показали, что повышение в первые дни и последующее снижение концентрации гормонов стресс-группы, ангиотензина II и цАМФ происходит одновременно. Под влиянием гормонов стресс-группы активные резорбтивные процессы приводят к уменьшению минеральной плотности кости после перелома. В результате этого мы наблюдали повышенное накопление меченого пирофосфата в повреждённом сегменте.
Одновременно, но более медленно, начинала нарастать концентрация паратиреоидного гормона, цГМФ, а позднее гормонов костеобразования – соматотропина и кальцитонина. При этом соотношение нуклеотидов (цАМФ/цГМФ) становилось ниже нормы. У концов костных фрагментов уменьшалась деминерализация. Нормализация концентрации соматотропина и кальцитонина свидетельствовала о завершении процессов консолидации перелома. Это подтверждается при исследованиях с помощью меченого пирофосфата и определении МПК на костном денситометре.
Динамические изменения изученных нами показателей ещё раз подтверждают существование системного регуляторного механизма репаративного костеобразования и согласуются с данными других авторов (Барабаш А.А., 2002; Аминова Г.Г., 2003; Алекберов Д.А., 2005; Белая Ж.Е., 2006; Бердюгина О.В., 2006).
