Характеристика биологической активности экзополисахаридов бактерий рода Lactobacillus и перспективы их использования 03. 02. 03 микробиология
| Вид материала | Автореферат |
- Программа вступительного экзамена в аспирантуру по специальной дисциплине 06. 02., 270.79kb.
- Программа кандидатского экзамена по специальности 03. 00. 07 Микробиология (биологические, 146.66kb.
- Контрольная работа по дисциплине Микробиология По теме Общая и специальная микробиология, 208.97kb.
- Особенности распределения и молекулярная детекция бактерий рода caulobacter озера байкал, 232.61kb.
- Взаимодействие ассоциативных бактерий и растений в зависимости от биотических и абиотических, 576.81kb.
- Каталазная активность углеводородокисляющих бактерий 03. 02. 03 «Микробиология», 250.08kb.
- Тесты по микробиологии, 156.97kb.
- Исследование возрастных особенностей моторики показывает исключительное значение двигательной, 36.84kb.
- Разнообразие аэробных и факультативно-анаэробных органотрофных бактерий содово-соленых, 515.52kb.
- Нп «сибирская ассоциация консультантов», 66.07kb.
Влияние лаксаранов in vitro на активность и завершённость процесса
фагоцитоза бактерий
При изучении влияния лаксаранов 1596, 1936, Z на процесс фагоцитоза бактерий S. aureus 209-P in vitro было показано, что в контрольной группе животных (которым не вводили лаксараны) при определении числа активных АМФ максимальное увеличение наблюдали к 6 часам процесса фагоцитоза S. aureus 209-Р. ИЗФ был равен - 0,26, фагоцитарный процесс был не завершён. В то время как, наибольшая активность ПМФ у контрольной группы мышей была отмечена через 1 час фагоцитоза S. aureus 209-Р, к 6 часам количество активных ПМФ снижалось. ИЗФ был равен 0,64, что позволило говорить о частичном переваривании микробных клеток.
В группе животных, которым вводили лаксаран 1596, было обнаружено, что активность АМФ была максимальной через 1 час фагоцитоза S. aureus 209-Р на 1 и 3 сутки эксперимента, на 5 и 7 сутки активность АМФ отмечена через 30 минут фагоцитоза S. aureus 209-Р, что было достоверно выше контроля. На 1 и 3 сутки ИАК был равен 0,85 и 0,52, соответственно, скорость фагоцитоза АМФ была выше, чем в контроле; на 5 и 7 сутки – ниже (ИАК равен - 0,11 и - 0,09). Число активных ПМФ при определении фагоцитарного индекса в опытной группе животных в течение всего процесса фагоцитоза S. aureus 209-Р составляло около 45%. На 3 сутки после введения лаксарана 1596 наибольшая активность ПМФ отмечена через 6 часов процесса фагоцитоза S. aureus 209-Р, ИЗФ составил 35 % (табл. 6).
Таблица 6 – Влияние лаксарана 1596 на завершённость процесса фагоцитоза S. aureus 209-Р
| Сроки исследований | Макрофаги | Фагоцитарный индекс, (М±m), % | ||
| с S. aureus 209- P | ||||
| 30 минут | 1ч | 6ч | ||
| контроль (без ЭПС) | АМФ | 8,00±0,15 | 19,00±1,22 | 24,13±2,13 |
| ПМФ | 6,00±0,18 | 25,13±2,00 | 9,51±1,00 | |
| 1 сутки | АМФ | 63,11±4,25* | 72,32±5,82* | 29,23±2,21 |
| ПМФ | 43,23±4,12* | 47,51±3,53 | 46,31±3,01* | |
| 3 сутки | АМФ | 72,31±5,14* | 81,13±6,01* | 60,24±5,02* |
| ПМФ | 13,32±1,00* | 8,00±0,43* | 35,41±3,13* | |
| 5 сутки | АМФ | 43,25±4,32* | 27,60±2,21 | 37,32±3,41 |
| ПМФ | 52,11±4,15* | 78,13±5,22* | 46,22±4,22* | |
| 7 сутки | АМФ | 46,22±4,23* | 20,11±2,21 | 27,41±2,31 |
| ПМФ | 43,13±4,15* | 13,23±1,23 | 5,31±0,53* |
Примечание: * - достоверные различия по сравнению с контролем при p<0,05.
Активность ПМФ на 5 сутки эксперимента у мышей была на всех этапах процесса фагоцитоза достоверно выше контрольных значений. Максимальная активность зафиксирована через 1 час процесса фагоцитоза. Наибольшая активность отмечена для ПМФ, выделенных на 7 сутки процесса фагоцитоза, через 30 минут от начала фагоцитоза бактериальных клеток, фагоцитоз был не завершен. Скорость фагоцитоза во все сроки исследования была ниже, чем у контрольных макрофагов, ИАК имел отрицательные значения.
При изучении активности макрофагов из организма животных, которым вводили лаксаран 1936, показано, что для АМФ, выделенных на 1 сутки эксперимента, к 6 часам фагоцитоза in vitro активность АМФ сохранялась на уровне 40%, процесс фагоцитоза был не завершён (табл. 7). Наибольшая активность АМФ, выделенных на 3, 5 и 7 сутки, наблюдалась через 30 минут фагоцитоза S. aureus 209-Р. ИЗФ на 3 и 5 сутки иммуногенеза был равен 0,3, что свидетельствует о частичном переваривании микробных клеток, на 7 сутки ИЗФ имел отрицательные значения, процесс фагоцитоза был незавершённым. ИАК для АМФ у мышей, которым вводили лаксаран 1936, на 1 и 7 сутки имел отрицательные значения - 0,16 и - 0,24, соответственно, скорость фагоцитоза S. aureus 209-Р была ниже, чем в контрольных значениях, в отличие от 3 и 5 суток эксперимента, когда ИАК был равен 0,62 и 0,56, соответственно (табл. 7).
Таблица 7 – Влияние лаксарана 1936 на завершённость процесса фагоцитоза S. aureus 209-Р
| Сроки исследований | Макрофаги | Фагоцитарный индекс, (М±m), % | ||
| с S. aureus 209- P | ||||
| 30 минут | 1ч | 6ч | ||
| контроль (без ЭПС) | АМФ | 8,00±0,15 | 19,00±1,22 | 24,13±2,13 |
| ПМФ | 6,00±0,18 | 25,13±2,00 | 9,51±1,00 | |
| 1 сутки | АМФ | 24,21±2,51* | 28,32±3,52 | 40,32±4,51* |
| ПМФ | 48,32±3,54* | 32,41±4,00* | 34,41±4,00* | |
| 3 сутки | АМФ | 72,14±5,00* | 58,42±3,21* | 37,26±1,01* |
| ПМФ | 50,31±4,52* | 32,34±2,13* | 30,41±2,00* | |
| 5 сутки | АМФ | 39,14±2,00* | 10,11±1,00 | 7,21±0,41* |
| ПМФ | 11,22±1,51 | 42,61±3,21* | 6,00±0,34 | |
| 7 сутки | АМФ | 25,31±2,52* | 12,43±0,14 | 18,12±1,25 |
| ПМФ | 11,24±1,04 | 28,91±2,41 | 15,21±1,22 |
Примечание: * - достоверные различия по сравнению с контролем при p<0,05.
Активность ПМФ у данной группы животных, выделенных на 1 и 3 сутки, достигла максимума через 30 минут процесса фагоцитоза S. aureus 209-Р; на 5 и 7 сутки через 1 час – составляла 42% и 28%, соответственно. По полученным данным можно говорить, что на 5 и 7 сутки исследования макрофаги были способны к частичному перевариванию микробных клеток, как и клетки контрольной группы, ИЗФ был равен 0,85 и 0,46. На 1 и 3 сутки процесс фагоцитоза был не завершённым (-0,06 и 0,06) (табл. 7). ИАК имел отрицательные значения на 1, 3 и 7 сутки. На 5 сутки скорость фагоцитоза была выше, чем в контроле (ИАК равен 0,21).
Во все сроки исследований после введения животным лаксарана Z максимальное число активных АМФ наблюдалось через 30 минут фагоцитоза S. aureus 209-Р, к 6 часам фагоцитоза S. aureus 209-Р количество активных АМФ снижалось, что говорило о частичном переваривании микробных клеток (табл. 8). Активность ПМФ у мышей этой группы была максимальной через 30 минут фагоцитоза S. aureus 209-Р во все сроки исследований. ИЗФ на 1 сутки эксперимента имел отрицательные значения, фагоцитоз был не завершён. На 3, 5 и 7 сутки наблюдали частичное переваривание микробных клеток. По оценке активации киллинга показано, что скорость фагоцитоза АМФ была выше, чем ПМФ.
Таблица 8 – Влияние лаксарана Z на завершённость процесса фагоцитоза S. aureus 209-Р
| Сроки исследований | Макрофаги | Фагоцитарный индекс, (М±m) в % | ||
| с S. aureus 209- P | ||||
| 30 минут | 1ч | 6ч | ||
| контроль (без ЭПС) | АМФ | 8,00±0,15 | 19,00±1,22 | 24,13±2,13 |
| ПМФ | 6,00±0,18 | 25,13±2,00 | 9,51±1,00 | |
| 1 сутки | АМФ | 47,12±4,42* | 19,31±2,44 | 13,15±2,36 |
| ПМФ | 41,21±4,21* | 15,42±1,26 | 17,23±2,34 | |
| 3 сутки | АМФ | 41,33±4,23* | 18,14±1,30 | 12,41±2,00 |
| ПМФ | 81,34±6,01* | 62,41±5,01* | 30,22±2,13* | |
| 5 сутки | АМФ | 80,43±6,00* | 31,46±2,31 | 19,16±2,41 |
| ПМФ | 70,21±5,32* | 42,31±3,00 | 41,32±3,42* | |
| 7 сутки | АМФ | 22,43±2,11* | 10,42±0,14 | 5,21±0,21* |
| ПМФ | 31,47±3,25* | 28,34±2,17 | 18,44±1,18* |
Примечание: * – достоверные различия по сравнению с контролем при p<0,05.
Изучение влияния лаксаранов на синтез
провоспалительных цитокинов при фагоцитозе бактерий
При изучении влияния лаксаранов на синтез провоспалительных цитокинов при фагоцитозе S. aureus 209-P in vitro было установлено, что продукция ИЛ-1α АМФ в контрольной группе была равна 18 пг/мл через 0,5 и 1 час, а к завершению процесса фагоцитоза – 16 пг/мл. Синтез ИЛ-1α ПМФ контрольной группы животных в процессе фагоцитоза S. aureus 209-P равнялась 14, 16,17 пг/мл, соответственно.
После внутрибрюшинного введения лаксарана 1596 мышам было показано, что синтез ИЛ-1α при фагоцитозе S.aureus 209-P достоверно превышал контрольные значения через 6 часов в АМФ на 1, 3, 7 сутки после введения лаксарана 1596, и в течение всего процесса фагоцитоза – в АМФ на 5 сутки (рис.1а). Синтез ИЛ-1α ПМФ 1, 3 и 5 сутки после введения мышам лаксарана 1596, в течение всего процесса фагоцитоза S. aureus 209-P был выше контрольных значений. Продукция ИЛ-1α в ПМФ через 7 суток была достоверно выше контроля в 1,6 раза через 30 минут процесса фагоцитоза S.aureus 209-P (рис. 1б). Наряду с ИЛ-1α определяли продукцию ФНО-α. Синтез ФНО-α АМФ контрольной группы животных в динамике процесса фагоцитоза равнялся 135, 127, 120 пг/мл для 30 минут, 1 и 6 часов, а ПМФ – 105, 96 и 92 пг/мл, соответственно. На 1 и 7 сутки после введения мышам лаксарана 1596 продукция ФНО-α АМФ была на уровне контрольных значений, а на 3, 5 сутки синтез ФНО-α был достоверно ниже контрольных значений во все время процесса фагоцитоза S.aureus 209-P (рис. 1в). Продукция ФНО-α ПМФ после внутрибрюшинного введения лаксарана 1596 на 1, 3 и 5 сутки была достоверно ниже контрольных значений. Тогда как на 7 сутки эксперимента количество ФНО-α составляло 180 пг/мл, что в 1,7 раз выше контрольных значений (рис. 1г).
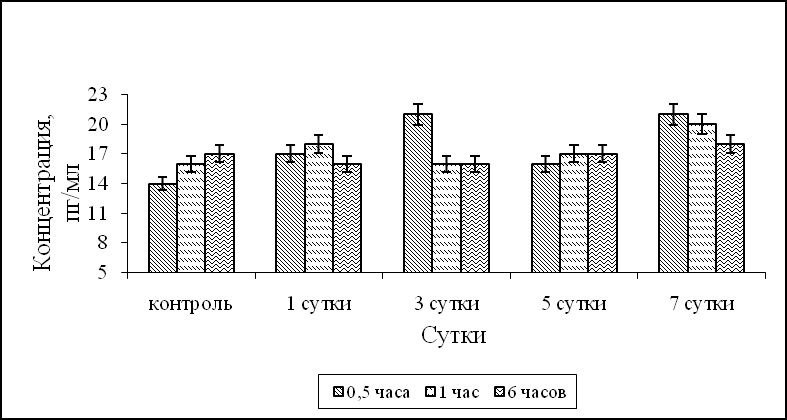
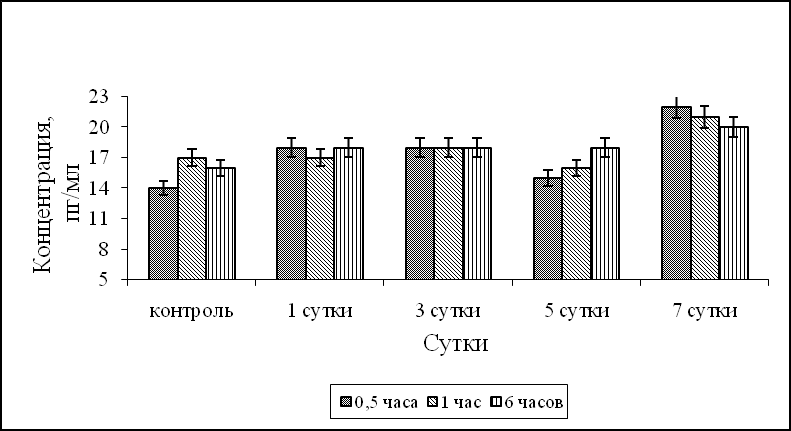
а б
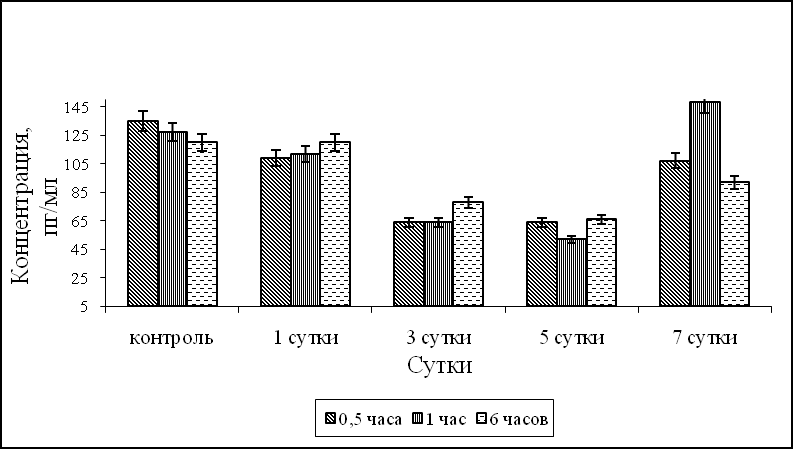
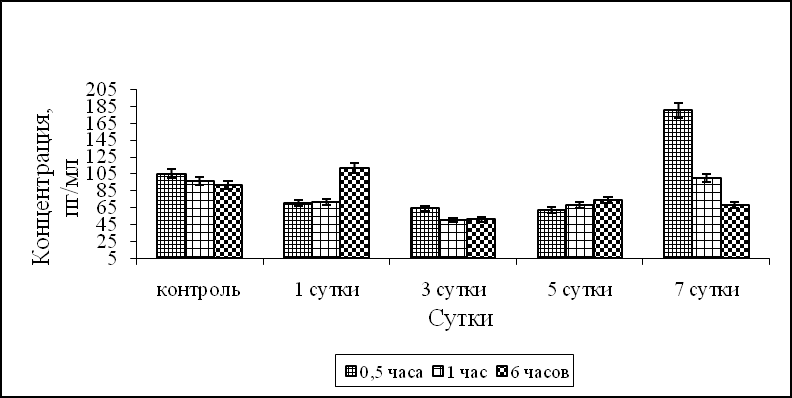
в г
Рис. 1. Влияние лаксарана 1596 на продукцию ИЛ-1α АМФ (а), ПМФ (б) и ФНО-α АМФ (в), ПМФ (г), при фагоцитозе бактерий S. aureus 209-P
Такое позднее воздействие лаксарана 1596 на фагоциты (7 сутки после введения) можно объяснить, очевидно, тем, что именно на этом этапе биологический эффект лаксарана 1596 в отношении продукции макрофагами ФНО-α начинает проявляться.
Аналогичные результаты были получены и при введении мышам лаксарана 1936.
После введения мышам лаксарана Z содержание ИЛ-1α, продуцируемого АМФ и ПМФ, в процессе фагоцитоза S. aureus 209-P незначительно отличалось от контрольных значений. Количество ФНО-α, продуцируемого АМФ было достоверно ниже контроля во время всего процесса фагоцитоза S. aureus 209-P. Продукция ФНО-α ПМФ выделенные из организма животных на 3, 5 и 7 сутки процесса фагоцитоза S. aureus 209-P in vitro была ниже контрольных значений, в отличие от 1 суток, где количество ФНО-α через 30 минут, 1 час и 6 часов было в 1,3 раза; 1,4 раза и 1,4 раза, соответственно, выше контрольных значений.
Исследование ранозаживляющих свойств лаксаранов и пленок, созданных на основе лаксаранов
При изучении ранозаживляющих свойств лаксаранов и пленок, созданных на их основе, в контрольной группе в течение первых суток после нанесения раны отмечали образование сгустка крови, края раны были широкие и цвет раны красно-коричневый. На третьи сутки опыта эпидермис плотно прилегал к стенке раневого канала и по краям раны под струпом начинал загибаться. При этом края раны были широкими по сравнению с первым днем эксперимента. К четвертым суткам начиналось восстановление эпителия и формирование на месте дефекта грануляционной ткани. На пятые сутки грануляционная ткань не полностью заполняла раневой канал, наблюдали рост эпителия под струпом по боковой поверхности раневого канала. К шестым суткам эпидермис не полностью перекрывал рану, она была заполнена первичной грануляционной тканью, т.е. отмечалось частичное заживление раны с помощью рубца. По истечении семи дней эксперимента рубец на кожи животных был четко виден.
При нанесении на рану лаксарана 1596 было замечено, что на поверхности раны в первые сутки образовывалась новая бледно-розовая грануляционная ткань на основе пролиферации эндотелия капилляров и фибробластов, которые стимулируют рост ткани через продукцию коллагена (Аничков, 1951). На третьи сутки пролиферирующий эпителий покрывал грануляционную ткань не полностью. На четвертые сутки эпидермис полностью закрывал раневую щель, формировался рубец с помощью рубцевой ткани. По истечении семи суток эксперимента рубца на коже животных было почти не заметно.
При нанесении на рану крыс лаксарана 1936 (0,06 г/кг) через сутки наблюдали, что края раны были узкими и на поверхности образовывался свежий сгусток крови, что свидетельствовало о дальнейшем заживлении раны. На третьи сутки эксперимента наблюдался процесс фиброплазии (заживление раны), на поверхности ранения проходил синтез коллагена, образовалась корочка. Отпадение корочки, наблюдали на четвертые сутки края раны, сблизились до полного контакта друг с другом, что обеспечило рубцевание раны. На седьмые сутки рубец слегка был заметен.
При нанесении на поверхность раны лаксарана Z в концентрации (0,06 г/кг) процесс ранозаживления значительно ускорялся, по сравнению с другими лаксаранами 1596 и 1936. Образование корочки на ране происходило уже на вторые сутки. К третьим суткам у крыс этой группы восстановление эпителия происходит интенсивнее, чем у крыс, раны которых обрабатывали лаксаранами 1596, 1936. Образование рубца происходило уже на третьи сутки, а к шестым суткам эксперимента рубец становился слегка заметным и не был заметен на 7 сутки.
При исследовании ранозаживляющих свойств пленки, содержащей лаксаран 1596 было показано, что образование корочки происходило на четвертые сутки эксперимента, при этом рубец образовывался на шестые и был заметен на седьмые сутки эксперимента. У животных, которым на поверхность ранения наносили плёнку, образованную на основе лаксарана 1936, морфологические изменения в области раны в ходе всего времени эксперимента были аналогичны таковым, как и у животных контрольной группы. При нанесении животным на область ранения плёнки, приготовленной на основании лаксарана Z, образование корочки происходило на третьи сутки, которая отпадала на пятые сутки; рубец был слегка заметен на седьмые сутки эксперимента.
Таким образом, представленные результаты свидетельствуют о том, что нанесение на раны крыс лаксаранов способствует более быстрому их заживлению, по сравнению с контролем и пленками, в состав которых они входили.
Исследование антимикробной активности лаксаранов и плёнок, созданных на их основе
Антимикробную активность лаксаранов 1596, 1936, Z и пленок, созданных на основе данных лаксаранов с добавлением связующего агента и пластификатора (Бухарова, 2004), определяли методом диффузии в агар (Лабинская, 1978). Было показано, что лаксараны 1596, 1936 и Z обладают антимикробной активностью в отношении E. coli 01, S. aureus 209-P, P. aeruginosa АТСС 27533, C. albicans 130, которые, как известно из литературных источников (Шляпников, Рыбкин, 1999; Блатун, 2007), наиболее часто встречаются в ранах с первичным загрязнением. При исследовании антимикробной активности пленок, созданных на основе данных лаксаранов, было показано, что плёнки с лаксараном 1596 и лаксараном 1936 ингибировали рост всех взятых в опыт тест-культур. Пленка, в состав которой входил лаксаран Z, не обладала антимикробной активностью по отношению к изучаемым бактериям.
Влияние лаксаранов на выход готового продукта и
структурно-механические, физико-химические, микробиологические,
органолептические свойства сыровяленых колбас
Изучали влияние лаксаранов 1596, 1936, Z на качество сыровяленых колбас на примере сыровяленой колбасы «Русич». Было показано, что при определении выхода готового продукта в контрольном образце к 21 суткам созревания масса батона снижалась на 40 %, в то время как в образцах, содержащих лаксараны 1596, 1936, Z, потеря массы батонов уменьшилась на 52 %, 47 %, 57 %, соответственно. Снижение массы батона в сыровяленой колбасе свидетельствует о хорошем качестве продукта (Фатьянов, 2008). Содержание влаги и ВСС в контрольном образце были равны 31 % и 52 %, соответственно. Наименьшее содержание влаги и наибольшее содержание влагосвязывающей способности были в образце с лаксараном Z. В контрольном образце количество рН и активности воды было равно 5,58 и 0,85. В образцах содержащих либо лаксаран 1596, либо 1936, либо Z, рН равнялся 4,19; 4,18 и 4,00; активность воды – 0,75; 0,74 и 0,71, соответственно. Следует отметить, что значения показателя активности воды в сыровяленых колбасах ниже 0,86 в совокупности со значениями показателя рН ниже 5,2 гарантирует микробиологическую безопасность продукта при употреблении и хранении (Фатьянов, 2008). В процессе исследований было показано, что в контрольном образце к концу периода созревания количество молочнокислых микроорганизмов было больше, чем в начале созревания в 41 раз. В образце, содержащим лаксаран Z, к концу периода созревания количество молочнокислых микроорганизмов увеличилось в 397 раз, в отличие от образцов, содержащих лаксаран 1596 и лаксаран 1936, где количество молочнокислых бактерий к концу срока созревания возросло в 40 раз и 197 раз, соответственно. В процессе дальнейших исследований было показано, что в контрольном образце к концу созревания (21 сутки) количество E.coli, стафилококков, микроскопических грибов обнаружено не было. Добавление лаксаранов 1596, 1936 и Z в сыровяленые колбасы приводило к полному исчезновению E. coli, стафилококков уже на 14 сутки, микроскопических грибов на 7 сутки созревания, что говорит о более раннем подавлении санитарно-показательной микрофлоры. Наименьшее количество E. coli, стафилококков, микроскопических грибов наблюдали в сыровяленых колбасах, приготовленных с добавлением лаксарана Z в течение всего периода созревания (21 сутки). Возможно, это объясняется тем, что лаксаран Z в отличие от лаксаранов 1596 и 1936, способствует в большей степени снижению рН и активности воды в опытных образцах. Сальмонелл и протей во всех образцах и в контроле в течение всего процесса созревания (сушки) не обнаружено.
Лаксараны 1596, 1936 и Z улучшают и органолептические свойства сыровяленых колбас (аромат, текстуру, нежность, консистенцию, вкус).
Таким образом, лаксараны 1596, 1936, Z, как показали экспериментальные исследования, способствуют улучшению качества сыровяленых колбас, что открывает перспективы их использования в пищевой промышленности.
