Инфекционный фактор и показатели липидного спектра у детей с системными заболеваниями соединительной ткани
| Вид материала | Документы |
- Инфекционный фактор и показатели липидного спектра у детей с системными заболеваниями, 143.29kb.
- Заболеваниями соединительной ткани в условиях стационара, 173.94kb.
- 1. Общая характеристика системы соединительной ткани, 474.44kb.
- А мышечной ткани, б соединительной ткани, в эпителиальной ткани, 45.82kb.
- Экспериментально-клиническое обоснование применения импульсного низкочастотного электромагнитного, 438.35kb.
- Автореферат диссертации на соискание ученой степени, 379.98kb.
- Показатели липидного состава кожного барьера у новорожденных детей, 150.09kb.
- Маслова Ирина Сергеевна Нарушения обмена соединительной ткани как фактор прогноза формирования, 338.47kb.
- Компьютерная программа «Методика диагностики и алгоритмированного выбора терапии Дисплазии, 1454.14kb.
- Юра у детей и подростков (этиология, патогенез, классификация, клиника, диагностика), 161.31kb.
Опубликовано в журнале «Кардиология в Беларуси» №5, 2009
Инфекционный фактор и показатели липидного спектра у детей с системными заболеваниями соединительной ткани
Беляева Л.М., Хрусталева Е.К., Колупаева Е.А., Чижевская И.Д.,
Довнар-Запольская О.Н.
Белорусская медицинская академия последипломного образования, кафедра педиатрии
К числу актуальных и сложных проблем медицины относят системные заболевания соединительной ткани (СЗСТ), основными представителями которых являются ювенильный ревматоидный артрит (ЮРА), системная красная волчанка (СКВ), ювенильная склеродермия (ЮС) и ювенильный дерматомиозит (ЮДМ) [3]. В настоящее время отмечен рост их распространенности, частоты неблагоприятных исходов и осложнений, высоко инвалидизирующий характер. С 2002 по 2007 г. г. официально зарегистрированная общая «ревматическая» заболеваемость среди российских детей увеличилась на 30% процентов, а среди подростков – почти на 48% 7. В Республике Беларусь отмечается такая же тенденция, о чем свидетельствуют данные годовых отчетов кардиоревматологической службы в Республике Беларусь за период с 1998 по 2005 годы.
Системные заболевания соединительной ткани – это мультифакторные заболевания с полигенным предрасположением. Установлено, что важная роль в их реализации принадлежит инфекционным «триггерам»: РНК - и ДНК – содержащим вирусам (ретровирусам, вирусу Эпштейна – Барра, цитомегаловирусу, вирусу простого герпеса, парвовирусам и др.) и бактериальной инфекции (стрептококковой, стафилококковой, туберкулезной, боррелиозной, кишечной и др.) 4, 6, 18, 19, 20, 21, 22.
Несмотря на достигнутые за последние годы успехи в изучении иммунных, микроциркуляторных расстройств, молекулярных основ фиброзообразования при этих болезнях, многие вопросы биохимических механизмов патологических нарушений остаются неизученными. Нарушение липидного спектра является одной из наиболее изучаемых проблем у взрослых больных с СЗСТ в мировой ревматологии в связи с доказанной дислипидемией у этой категории больных и возникающими вопросами о генезе атеросклероза на фоне аутоиммунной патологии [1, 15]. При изучении структуры смертности этих больных было выявлено, что основной причиной преждевременной смерти у половины из них являются заболевания сердечно-сосудистой системы, связанные с атеросклеротическим поражением сосудов [15]. Имеются единичные работы по изучению состояния липидного обмена при ревматоидном артрите, системной склеродермии, системной красной волчанке у взрослых пациентов [12, 14].
Цель исследования – на основании комплексного клинико- лабораторного, иммунологического и бактериологического методов исследования установить значимость инфекционного фактора, а также изучить состояние липидного обмена у детей и подростков с СЗСТ (ЮРА, СКВ, ЮС).
Материалы и методы исследования. Обследовано 111 пациентов в возрасте от 2 до 18 лет жизни, страдающих системными заболеваниями соединительной ткани. В структуре заболеваний 13% составили пациенты с системной красной волчанкой и ювенильным дерматомиозитом, 24% с ювенильной склеродермией, 64% с ювенильным ревматоидным артритом (суставная форма- 69% и системная форма – 31%). Распределение по полу было следующим: мальчики составили 37% (n=41) и девочки 63%(n=70), распределение по возрасту было следующим: дети в возрасте от 1 года до 6 лет составили 19% (n=22), от 6 до 11 лет-22% (n=24), от 12 до 18 лет-59% (n=65).
Изучен генеалогический анамнез, анамнез жизни и заболевания, проведено клинико – лабораторное обследование: клиническая оценка состояния ребенка, определение частоты, характера и продолжительности рецидивов, биохимические показатели: С-реактивный белок (СРБ), антистрептолизин О (АСЛ–О), общий белок; общий анализ периферической крови; иммунологическое исследование, включавшее: Т - и В- лимфоциты, иммуноглобулины М, G и А, уровень комплемента, уровни альфа - фактора некроза опухоли (α-ФНО) и гамма-интерферона (γ-ИНФ); проведено исследование на наличие вирусных (вируса простого герпеса, цитомегаловируса) и бактериальных (Borrelia Burgdorferi, Chlamydia pneumonii, psittazii) инфекций в сыворотке крови, мазков со слизистых зева и носа, биоптата слизистой оболочки желудка.
В качестве статистического контроля дополнительно обследовано 30 практически здоровых детей в возрасте 9 – 17 лет. Здоровыми считали детей I–II групп здоровья, не болевших в течение месяца перед обследованием. Группы пациентов были сопоставимы с группой сравнения по полу и возрасту.
Диагностику ЮС, оценку стадии развития, степени активности процесса, характера течения заболевания проводили с учетом классификации, разработанной Н.Г. Гусевой, а также использовали диагностический алгоритм, разработанный Американской ревматологической ассоциацией и модифицированный НИИ ревматологии РАМН [5, 10, 16].
Диагноз ЮРА, СКВ и ЮДМ устанавливали на основании критериев МКБ-10 и Американской Коллегии Ревматологов [13, 17]. При включении в исследование фиксировали выраженность лихорадки, лимфаденопатии, утренней скованности, биохимические и иммунологические параметры периферической крови, показатели клинического анализа крови и мочи.
Определяли основные показатели липидного обмена: содержание общих липидов (ОЛ), общего холестерина (ОХС), α-холестерина (α-ХС), триглицеридов (ТГ), общих фосфолипидов (ОФЛ), липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности (ЛПОНП), липопротеидов высокой плотности (ЛПВП), рассчитывали коэффициент атерогенности (КА) по формуле: КА= (ОХС – α-ХС)/α-ХС [11]. Исследования проводили в биохимической лаборатории ЦНИЛ БелМАПО.
Содержание общих липидов в сыворотке крови определяли по цветной реакции с сульфофосфованилиновым реактивом. Для определения концентрации общего холестерина в сыворотке крови использовался энзиматический метод Триндера. Концентрацию триглицеридов в сыворотке крови определяли энзиматическим колориметрическим методом, разработанным Буколо и Дэвидом. Уровень фосфолипидов в сыворотке крови определяли по содержанию в них липидного фосфора [11].
Статистическую обработку данных, полученных в результате исследований, проводили традиционными методами вариационной статистики на персональном компьютере с использованием программ Statsoft Statistica 6.0, «Primer of Biostatistics» (Version 4.03 by Stanton A. Glantz) [8, 9].
Оценивали нормальность распределения вариант в выборках, после чего принимали решение о применении непараметрических или параметрических методов статистической обработки. Описание распределений количественных признаков в выборках представлено в виде медиан и границ интерквартильного отрезка с применением процентилей, качественных номинальных признаков – в виде абсолютных частот и процентов.
Для оценки степени взаимного влияния и связи между изучаемыми показателями использовался корреляционный анализ, для чего рассчитывали непараметрический коэффициент ранговой корреляции Спирмена – rs. Достоверными считались различия и корреляция при значениях P<0,05.
Результаты и обсуждение. В результате проведенного исследования установлено, что возраст дебюта у 51% пациентов приходился на возрастной промежуток от 1 до 6 лет жизни, у 24% – от 7 до 11 лет, у 25% – от 12 до 18 лет. У 15% детей с СЗСТ продолжительность заболевания составляла менее года, 21% болели до двух лет и у 64% пациентов заболевание длилось более двух лет.
На момент обследования у наблюдавшихся пациентов преобладало хроническое течение болезни во всех группах – у 76,9% пациентов с СКВ и ЮДМ, у 77,8% пациентов с ЮС и у всех больных с ЮРА. Подострое течение отмечалось у 14,8% больных с ЮС и у 23,1% больных с СКВ и ЮДМ, острое течение наблюдалось только у 7,4% детей с ЮС. Минимальная активность болезни (I степень) диагностирована у 19,7% детей с ЮРА, у 40,7% пациентов с ЮС, у 38,4% пациентов с СКВ и ЮДМ; II (умеренная) степень активности заболевания отмечена у 59,3% детей с ЮС, у 80,3% детей с ЮРА, 61,6% с СКВ и ЮДМ.
Общеклинические симптомы: субфебрилитет, слабость, повышенная утомляемость, потеря веса – наблюдались в дебюте ЮС у 18,5% больных, у 50,7% детей с ЮРА, у 38,4% детей с СКВ и ЮДМ. Задержка физического развития отмечена у 14,8% пациентов с ЮС, у 23,1% пациентов с СКВ и у 29,5% больных с ЮРА. Лимфаденопатия была выражена незначительно - увеличенные лимфоузлы отдельных групп определялись у 18,5% пациентов с ЮС, у 38,4% пациентов с СКВ и у 22,5% детей с ЮРА.
Среди поражений опорно-двигательного аппарата на первый план выходит суставной синдром, характеризующийся многообразием проявлений (от преходящих артралгий до тяжелых деформаций) [3]. Наиболее частым проявлением суставного синдрома были полиартралгии у 59,2% больных ЮС, у 53,8% больных СКВ. Артриты с умеренно выраженной воспалительной реакцией выявлены у 40,7% человек с ЮС, у 46,2% человек с СКВ и у всех детей с ЮРА. Поражение периартикулярных тканей с формированием контрактур отмечено у 18,5% пациентов с ЮС, у 23,1% пациентов с СКВ и у 50,7% с ЮРА. Поражения костной ткани рентгенологически (дистальный остеопороз, сужение суставных щелей, сглаженность фаланг, деформации и подвывихи межфаланговых суставов) диагностированы в 25,9% случаев ЮС, у 53,8% детей с СКВ и у 78,8% детей с ЮРА.
При исследовании показателей анализа крови, проводимых в состоянии неполной клинико-лабораторной ремиссии, выявлены: лейкоцитоз- 9,39±1,35х109/л, увеличение СОЭ - 19±4,6 мм/ч, повышение уровня АСЛ-О: - 268±39,5 усл. ед., СР-Б- 18,6±1,3 мкмоль/л.
У детей с СЗСТ выявлялась сопутствующая патология: у 37% хронический тонзиллит и аденоидные вегетации; частые респираторные заболевания (более 4 раз в году) у 30%; хроническая патология ЖКТ (гастрит, дуоденит, ЯБ 12 п. к. и др.) более чем у трети детей (36%), причем у 30% из них выявлялась обсемененность слизистых оболочек H. pylori средней и высокой степени.
Вирусологически обследовано 50 детей с СЗСТ, у половины из них выявлено наличие хронического носительства цитомегаловирусной инфекции и вируса простого герпеса, у 3% пациентов выявлена хроническая парвовирусная и аденовирусные инфекции. По результатам исследования мазков со слизистой носоглотки на патогенную флору у 55% пациентов обнаружены: золотистый стафилококк (47%), бета – гемолитический стрептококк (35%), альфа – гемолитический стрептококк (11%) и кадидоз слизистых оболочек (7%).
По результатам бактериологического исследования крови у каждого четвертого пациента с СЗСТ обнаружены антитела к Borrelia Burgdorferi, а в 10% случаев - к Clamidia pneumonii в титрах выше 1:64.
По данным иммунологического обследования детей с СЗСТ выявлены достоверно низкие уровни гамма интерферона – 0,1-1,1 пг/мл (норма – 1,5 -2,6 пг/мл), снижение популяции Т-супрессоров – 15-22% (контроль – 28,8-33,6%), повышение показателя иммунорегуляторного индекса – 2,07-3,2 (контроль – 1,43), а так же повышение уровня фактора некроза опухоли альфа – 124,7-128,6 пг/мл (норма – 0-3 пг/мл) и иммуноглобулинов G и M, циркулирующих иммунных комплексов (сравнение с контрольной группой детей).
Исследование показателей липидного спектра проведено у 60 пациентов с СЗСТ (30 детей с ЮРА, 20 детей с ЮС и 10 детей с СКВ). Результаты исследования показателей липидного спектра сыворотки крови у детей с СЗСТ представлены в виде средней (М), стандартного отклонения (SD) и медианы (Мe), значимость различий определена непараметрическим методом с помощью Т-критерия Манна-Уитни (таблица 1).
Таблица 1 - Показатели липидного спектра крови у обследованных детей
| Параметры | Пациенты с СКВ n = 10 | Пациенты с ЮРА n = 30 | Пациенты с ЮС n = 20 | Контроль n = 30 | ||||
| M±SD | Me | M±SD | Me | M±SD | Me | M±SD | Me | |
| ОЛ, г/л | 9,02±0,13*** | 8,5 | 7,01±2,2** | 6,7 | 6,65±2,7* | 7,15 | 5,31±0,66 | 5,2 |
| ОФЛ, ммоль/л | 3,5±0,14*** | 3,2 | 2,84±1,5 | 3,02 | 3,21±1,7** | 3,25 | 2,29±0,54 | 2,1 |
| ОХС, ммоль/л | 4,56±0,36*** | 4,45 | 3,99±0,85 | 3,71 | 3,6±1,01 | 3,78 | 3,71±0,69 | 4,1 |
| ТГ, ммоль/л | 1,95±0,22*** | 1,99 | 1,03±0,72*** | 0,87 | 0,94±0,55 | 0,82 | 0,83±0,39 | 0,8 |
| ЛПВП, ммоль/л | 1,54±0,59 | 1,52 | 1,26±0,63 | 1,11 | 1,09±0,31* | 1,13 | 1,29±0,33 | 1,2 |
| ЛПНП, ммоль/л | 2,79±0,57 | 2,61 | 2,45±0,66 | 2,35 | 2,49±0,49 | 2,63 | 2,52±0,6 | 2,6 |
| КА | 2,27±1,3 | 2,26 | 2,6±1,29 | 2,42 | 2,4±0,91 | 2,15 | 2,39±0,88 | 2,3 |
| Примечание – Достоверность различий в сравнении с контролем: * – Р<0,05; ** – Р<0,01; *** – Р<0,001. | ||||||||
У детей и подростков с СКВ установлено достоверное повышение содержания ОЛ, ОФЛ, ОХС и ТГ при сравнении с контрольной группой (Р < 0,001). У детей и подростков, страдающих ЮРА, выявлено достоверное повышение ОЛ (Р < 0,01) и ТГ (Р < 0,001) при сравнении с контрольной группой. У детей и подростков с ЮС установлено достоверное повышение в сыворотке крови ОЛ (Р < 0,05), ОФЛ (Р<0,01), а также снижение содержания ЛПВП (Р<0,05) при сравнении с контрольной группой.
Повышение уровней ОЛ в сыворотке крови >7,0 г/л установлены у 60% детей с СКВ, у 43,3% пациентов с ЮРА и у 65% больных ЮС. Повышение содержания ТГ >1,4 ммоль/л выявлено у 50% детей и подростков с СКВ, у 20% больных ЮРА и у 25% пациентов с ЮС. Повышенные уровни ОФЛ > 3,25 ммоль/л отмечены у 70% больных СКВ, у 46,7% детей и подростков с ЮРА и у 60% пациентов с ЮС. Повышение содержания ОХС >5,2 ммоль/л установлено у 16,7% детей с ЮРА, а снижение уровней ЛПВП <0,96 ммоль/л выявлено у 30% пациентов с ЮРА и у 25% детей с ЮС.
При проведении корреляционного анализа установлена прямая корреляционная связь между уровнем ОЛ в сыворотке крови и длительностью болезни (rs = 0,71; Р<0,01), а также между степенью активности болезни и содержанием ОЛ (rs = 0,63; Р<0,01) (рисунок 1).
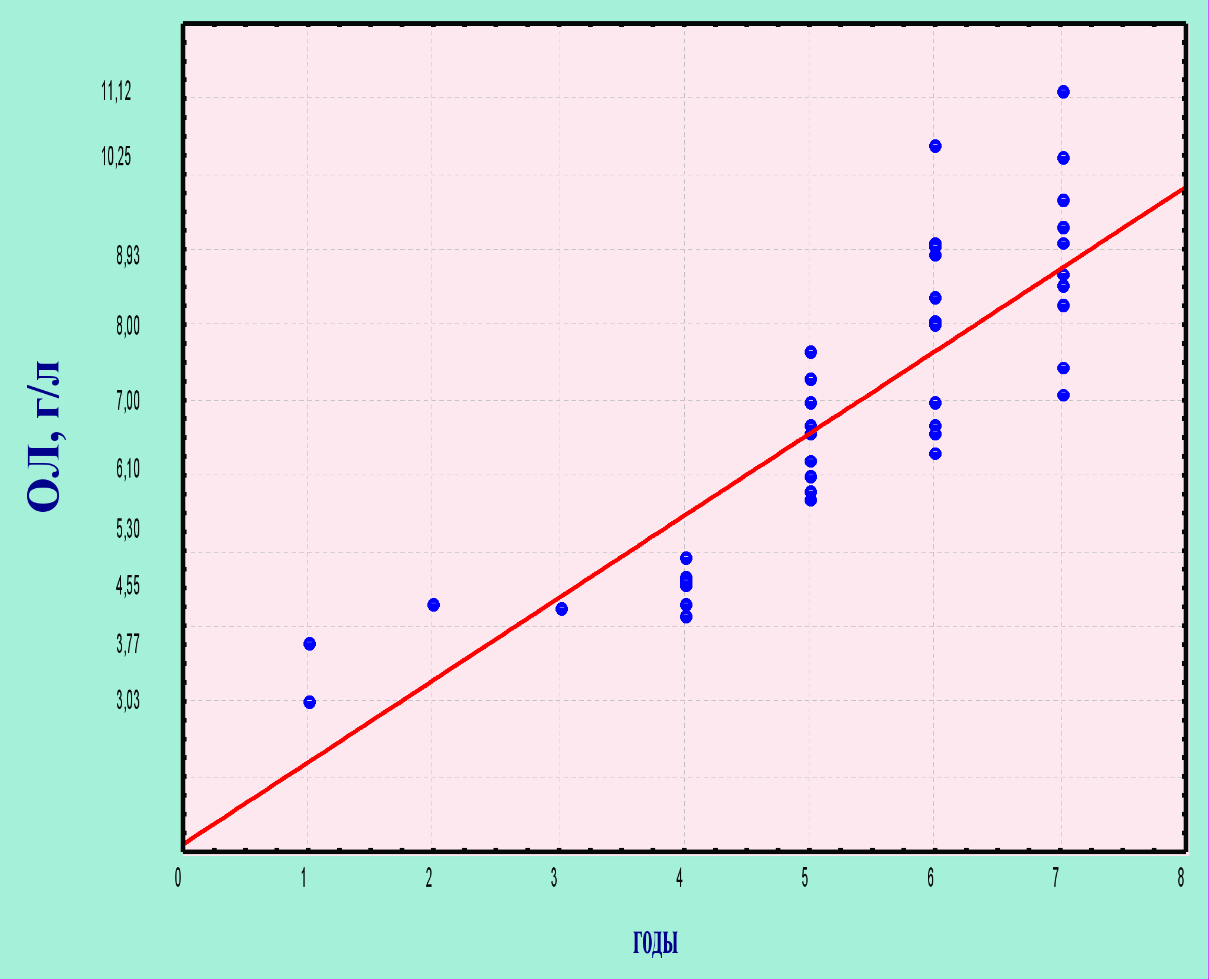
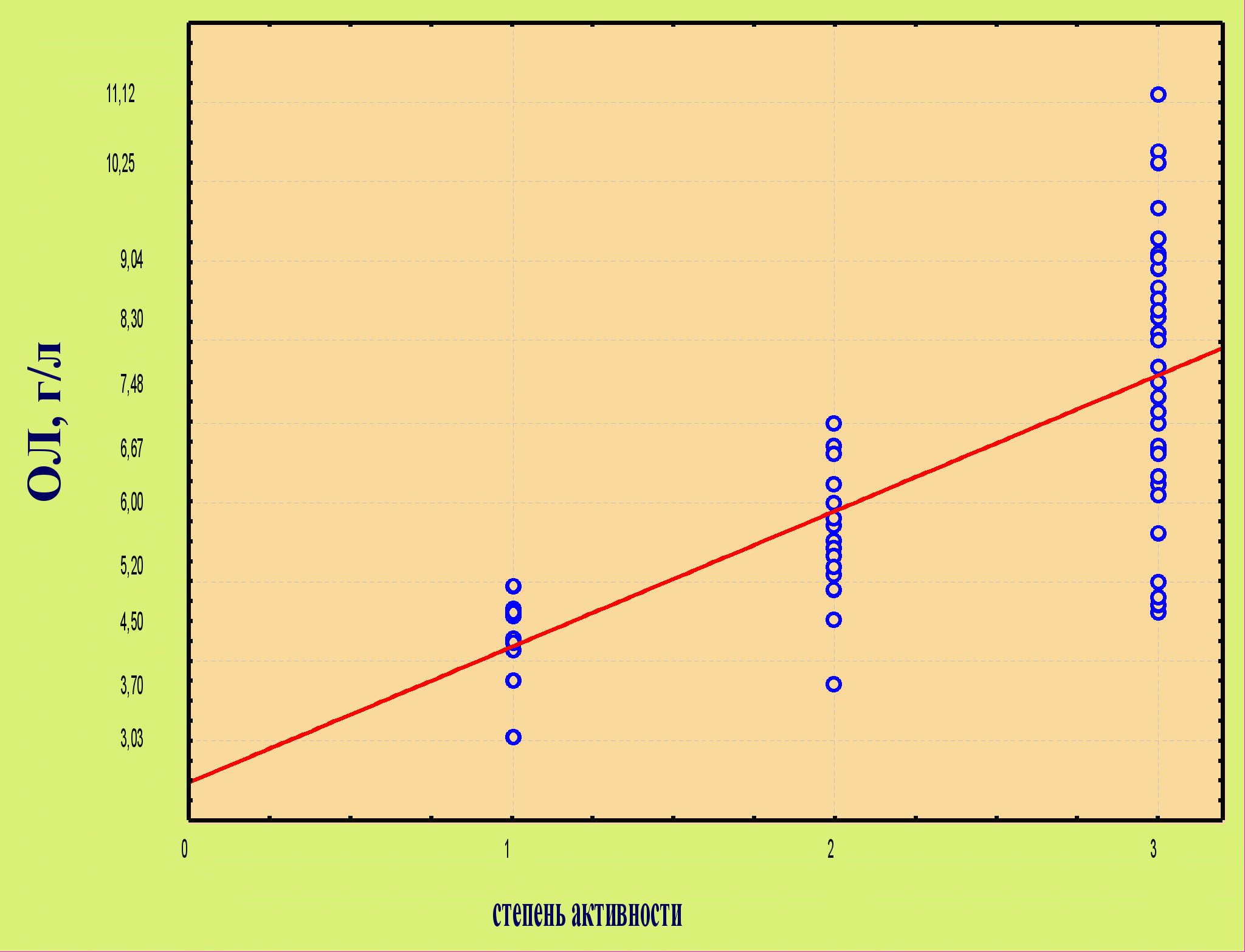
Рисунок 1 – Зависимость уровней общих липидов от продолжительности болезни
Установлена положительная корреляционная связь между уровнем общего холестерина и продолжительностью заболевания (rs=0,69; P<0,01) (рисунок 2).

Рисунок 2 – Зависимость уровней общего холестерина от продолжительности заболевания
Выявлена положительная корреляционная связь между стадией заболевания и содержанием ОФЛ в сыворотке крови (rs = 0,36; Р<0,05) и концентрацией ЛПНП (rs = 0,38; Р<0,05), а также прямая корреляционная связь между степенью активности болезни и содержанием ОФЛ (rs = 0,72; Р<0,01), α-ХС (rs = 0,61; Р<0,01) и ЛПНП (rs = 0,45; Р<0,05), прямая корреляционная связь между характером течения заболевания и концентрацией ЛПНП (rs = 0,52; Р<0,01).
По результатам проведенного исследования получен ряд выводов:
- Для половины детей с СЗСТ оказалась характерной склонность к частым респираторным заболеваниям; у трети – установлено наличие хронической носоглоточной инфекции, при этом в структуре микрофлоры зева преобладал золотистый стафилококк (в 46,2% случаев) и бета- гемолитический стрептококк группы А (в 32% случаев).
- У детей с СЗСТ на фоне отсутствия клинических проявлений болезни, выявлялись лабораторные признаки активности иммунного воспаления: лейкоцитоз, повышение уровня СРБ, АСЛ-О, увеличение СОЭ, содержания α-ФНО и снижение уровня γ-ИНФ.
- У 90% пациентов с СЗСТ и с продолжительностью болезни более 2 лет - установлено хроническое носительство бактериальной и вирусной инфекции. Для 40% пациентов с СЗСТ оказалось характерным наличие носительства вирусных инфекций (ВПГ, ЦМВ).
- На основании полученных иммунологических данных (снижение уровня ИФН-γ в сыворотке крови и наличие персистирующей вирусной и бактериальной инфекции) целесообразно в период ремиссии заболевания проводить курсы иммунокоррегирующей терапии.
- Установлена положительная корреляционная связь между уровнем общих липидов в сыворотке крови и длительностью болезни (rs=0,71; P<0,01), уровнем общего холестерина и продолжительностью заболевания (rs=0,69; P<0,01). Выявлена положительная корреляционная связь между степенью активности заболевания и уровнями общих липидов (rs=0,63; P<0,01) и общих фосфолипидов (rs=0,72; P<0,01).
- Для детей и подростков, страдающих системными заболеваниями соединительной ткани, характерны нарушения липидного обмена атерогенной направленности, что обосновывает включение коррекции этих нарушений в комплексную терапию этой категории пациентов.
Литература
- Алекберова З.С. Дислипидемии и аутоиммунные заболевания / З.С. Алекберова, В.А. Насонова // Вестн. Рос. АМН. – 1998. – № 12. – С.43-45.
- Алексеева Е. И. Ревматические болезни и их влияние на качество жизни детей и их семей // Качество жизни. Медицина. – 2008. - №1. – Р. 20-21.
- Беляева Л.М. Сердечно-сосудистые заболевания у детей и подростков / Л.М. Беляева, Е.К. Хрусталева. – 2-е изд., перераб. и доп. – Минск: "Вышэйшая школа", 2003. – С.151-169.
- Беляева Л.М. Болезни суставов у детей и подростков / Л.М. Беляева / Изд. 2-е доп. и перераб. – Минск, 2006. – 51 с.
- Беляева Л.М. Системный склероз и ограниченная склеродермия у детей и подростков: диагностика, клинические проявления / Л.М. Беляева, И.Д. Чижевская // Медицинская панорама – №5, 2007. – С.73-76
- Баранов А. А. Ювенильный ревматоидный артрит. Клинические рекомендации. Москва. 2005.- С. 2-11.
- Баранов А. А. Состояние специализированной ревматологической помощи детям и взрослым в Российской Федерации. Проект Федеральной целевой программы «Ревматические болезни 2008-212 г.г.» Баранов А. А., Насонов Е. Л., Алексеева Е. И., Эрдес Ш. Ф., Ильин А. Г. // Заседание Президиума РАМН, материалы заседания. Москва. 2007. – С. 23-26.
- Боровиков В. STATISTICA: искусство анализа данных на компьютере / Боровиков В. – 2003. – 160 с.
- Гланц С. Медико-биологическая статистика: пер. с англ. / С. Гланц. – М., 1999. – 459 с.
- Гусева Н.Г. Системная склеродермия и склеродермическая группа болезней / Н.Г. Гусева // Рус. мед. журн. – 2000. – Т.8, №9. – С.383-387.
- Камышников В.С. Справочник по клинико-биохимической лабораторной диагностике: в 2 т. / В.С. Камышников. – 2-е изд. – Мн.: Беларусь, 2002. – Т.2. – 463 с.
- Козлова Л.К. Функциональная оценка состояния сердца по данным эхокардиографии и состояния липидного обмена у больных системной склеродермией и системной красной волчанкой / Л.К. Козлова // Терапевт. арх. – 2001. – Т.73, №5. – С.33 -36.
- Международная статистическая классификация болезней и проблем, связанных со здоровьем: МКБ-10: в 3-х т. / Мн.: "ИнтерДайджест", 2000. – Т.1. Ч.1. – С.611-665.
- Митьковская Н.П. Методы экстракорпоральной коррекции гомеостаза и интенсивная медикаментозная терапия системных заболеваний соединительной ткани / Изд. 2-у, доп. и перераб. / Монография / Н.П. Митьковская. – Мн.: БГМУ, 2004. – С.13-26.
- Насонов Е.Л. Проблема атеротромбоза в ревматологии / Е.Л. Насонов // Вестник РАМН. – 2003. – №7. – С.6-10.
- Подчерняева Н.С. Системная склеродермия / Н.С. Подчерняева // Кардиология и ревматология детского возраста / Е.И. Алексеева [и др.]; под ред. Г.А. Самсыгиной и проф. М.Ю. Щербаковой. – М.: ИД Медпрактика. – М., 2004. – С.721-735.
- Arnet F.C., Edworthy S.M., Bloch D.A. et al. The American Rheumatism Association 1987 revised criteria for classification of rheumatoid arthritis // Arthr. Rheum. – 1988. – V.31. – P.315-324.
- Bombardieri M, Alessandri C, Labbardia G et al. Role of anti-cyclic citrullinated peptide antibodies in discriminating patients with rheumatoid arthritis from patients with chronic hepatitis C infection-associated polyarticular involvement. // Res Ther, 2004,6:137-41.
- Butrimiene, S. Jarmalaite, J. Ranceva, A. Venalis, L. Jasiuleviciute, and A. Zvirbliene.Different cytokine profiles in patients with chronic and acute reactive arthritis. Rheumatology, October 1, 2004; 43(10): 1300 - 1304.
- Davidson A., Diamond B. Autoimmune diseases. // N Engl J Med, 2001, 345(5): 340-50.
- D’Cruz D. Testing for autoimmunity in humans. // Toxicol Lett, 2002, 14(3): 93-100.
- Goronzy J.J., Weyand C.M. Rheumatoid arthritis – epidemiology, pathology and pathogenesis. // In: Klippel JH, Crofford LH, Stone JH, Weyand CM eds. Primer of the rheumatic diseases. Atlanta: Georgia Arthritis Foundation, 2001: 209-18.
